修回日期: 2015-11-26
接受日期: 2015-11-30
在线出版日期: 2016-01-18
目的: 探讨双歧杆菌三联活菌对葡聚糖硫酸钠(dextran sulfate sodium, DSS)诱导的结肠炎小鼠肠道炎症及紧密连接蛋白连接黏附分子1(junctional adhesion molecule-1, JAM-1)表达与分布的影响.
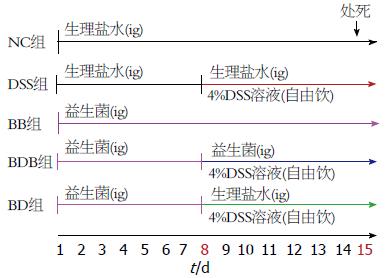
方法: 将SPF级♀Balb/c小鼠(8-10周龄)随机分为5组: 正常对照NC组、益生菌BB组(正常小鼠予益生菌灌胃14 d)、急性DSS模型组(生理盐水灌胃14 d+第8天起4%DSS溶液自由饮用7 d)、BD组(益生菌灌胃7 d +第8天起4%DSS溶液自由饮用7 d)、BDB组(益生菌灌胃14 d+第8天起4%DSS溶液自由饮用7 d). 记录小鼠每日体质量变化. 第15天处死小鼠、分离结肠, 观察各组肠道损伤情况, 以组织病理学积分评估结肠炎的严重程度. 采用Western blot法、免疫组织化学法(IHC)检测结肠组织中JAM-1的表达及分布.
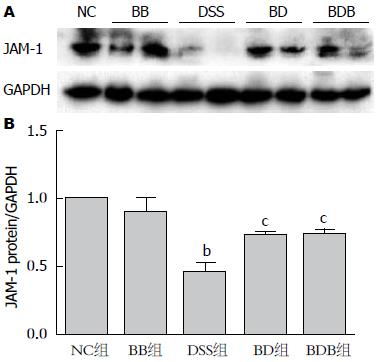
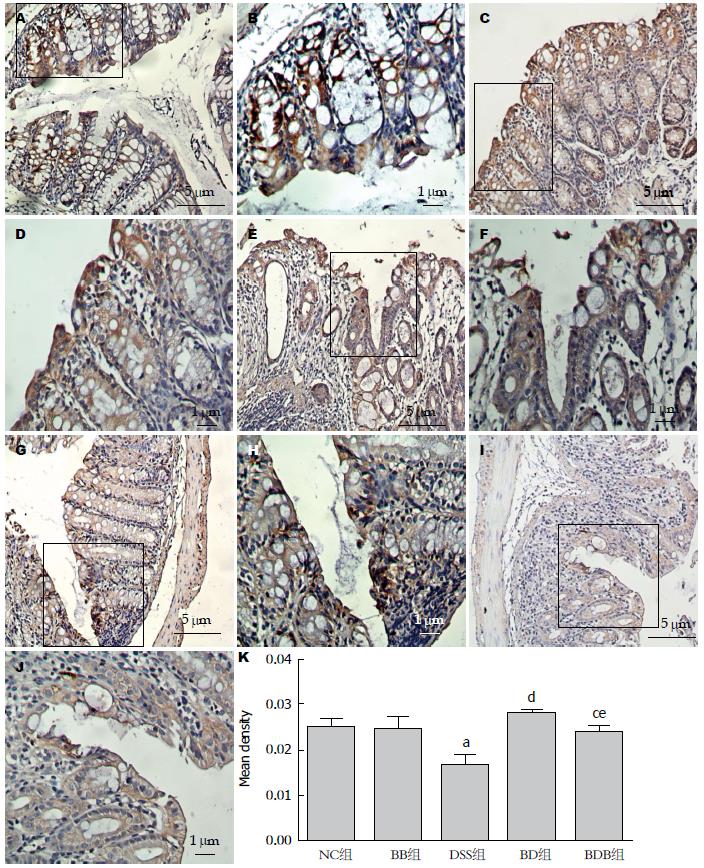
结果: 与DSS模型组相比, 益生菌干预组(BD、BDB组)小鼠减轻的体质量得到不同程度恢复(95.17%±3.34%、87.17%±1.83% vs 81.49%±2.16%, P1<0.01, P2 = 0.08), 病变结肠缩短程度、肠黏膜水肿, 上皮细胞破坏程度及肠道炎症细胞浸润减轻, 且BD组小鼠的改善程度优于BDB组. Western blot结果显示给予益生菌干预, BD、BDB组肠黏膜组织JAM-1蛋白的表达水平较DSS组显著增加(0.725±0.027、0.739±0.033 vs 0.454±0.073, 均P<0.05). 免疫组织化学结果显示DSS模型组小鼠结肠黏膜JAM-1染色强度明显减弱, 染色细胞数减少, 分布散乱、中断, 益生菌处理后JAM-1染色强度及阳性细胞数减少程度显著改善. 仅给予益生菌灌胃的小鼠, 体质量、结肠大体、镜下表现以及结肠组织中JAM-1蛋白表达水平及分布, 与正常小鼠无显著差异(P>0.05).
结论: 双歧杆菌三联活菌可能通过影响JAM-1蛋白的表达与分布, 改善肠黏膜的屏障功能, 从而减轻小鼠急性期肠道炎症反应.
核心提示: 本研究应用双歧杆菌三联活菌作用于葡聚糖硫酸钠(dextran sulfate sodium)诱导的结肠炎小鼠, 结果表明双歧杆菌三联活菌能减轻小鼠急性期肠道炎症反应, 可能与影响连接黏附分子1(junctional adhesion molecule-1)蛋白的表达与分布, 进而改善黏膜的屏障功能有关.
引文著录: 张迎娣, 余婷婷, 朱云娟, 赵小静, 程秀琴, 张红杰. 双歧杆菌三联活菌对DSS诱导结肠炎鼠肠紧密连接蛋白JAM-1的影响. 世界华人消化杂志 2016; 24(2): 187-195
Revised: November 26, 2015
Accepted: November 30, 2015
Published online: January 18, 2016
AIM: To investigate whether supplementation with a probiotic mixture (bifidobacterium, lactobacillus and enterococcus) could ameliorate dextran sulfate sodium (DSS)-induced murine colitis and affect the expression and distribution of the tight junction protein junctional adhesion molecule-1 (JAM-1) in colonic tissue.
METHODS: Female Balb/c mice (8-10 wk old) of specific pathogen free grade were randomly divided into five groups: an NC group (normal controls), a BB group (mice administered with the probiotic mixture by intragastric gavage for 14 d), a DSS group (14-day intragastric saline administration + 7-day 4% DSS exposure from day 8), a BD group (7-day intragastric administration of probiotic mixture +7-day 4% DSS exposure from day 8) and a BDB group (14-day intragastric administration of probiotic mixture +7-day 4% DSS exposure from day 8). Body weight was monitored daily. All mice were sacrificed on day 15 and colonic tissue samples were obtained. Colon inflammatory injury in each group was observed and histopathological scores were evaluated. The expression and distribution of JAM-1 in colonic tissues were detected by Western blot and immunohistochemistry, respectively.
RESULTS: Compared with the DSS group, body weight significantly improved in mice administrated with the probiotic mixture by intragastric gavage (95.17% ± 3.34%, 87.17% ± 1.83% vs 81.49 % ± 2.16%, P1 < 0.01, P2 = 0.08, for the BD and BDB groups, respectively). Moreover, the probiotic mixture could ameliorate inflamed colon shortening and mucosal edema, as well as alleviate destruction of epithelial cells and the infiltration of inflammatory cells. In addition, the efficacy of the probiotic mixture in the BD group was superior to that in the BDB group. Western blot analysis showed that the level of JAM-1 increased significantly in the colons of mice in the BD and BDB groups compared with that in DSS mice (0.725 ± 0.027, 0.739 ± 0.033 vs 0.454 ± 0.073, P < 0.05 for both). Data from immunohistochemical analysis showed that the positive staining intensity and the number of positively stained cell in the colon of the DSS group were markedly downregulated, and the distribution of JAM-1 was disordered and discontinuous. This phenomenon was improved after administration of the probiotic mixture in mice with DSS-induced colitis. Compared with the normal group, mice administrated with the probiotic mixture alone showed no significant changes in body weight, macroscopic and microscopic manifestation, or the level of JAM-1 in their colonic tissue (P > 0.05).
CONCLUSION: Triple viable probiotic mix containing Bifidobacteria can ameliorate DSS-induced colitis. This may result from improved mucosal barrier function by influencing the expression and distribution of JAM-1.
- Citation: Zhang YD, Yu TT, Zhu YJ, Zhao XJ, Cheng XQ, Zhang HJ. Effect of probiotic mixture containing bifidobacteria on dextran sulfate sodium-induced colitis and expression of tight junction protein junctional adhesion molecule-1 in mice. Shijie Huaren Xiaohua Zazhi 2016; 24(2): 187-195
- URL: https://www.wjgnet.com/1009-3079/full/v24/i2/187.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i2.187
炎症性肠病(inflammatory bowel disease, IBD)主要包括溃疡性结肠炎(ulcerative colitis, UC)和克罗恩病(Crohn's disease, CD), 是一种慢性、非特异性肠道炎症性疾病, 可累及整个消化道, 具有易复发、难治愈等特点, 其发病机制尚不完全清楚, 与菌群失调、免疫异常、遗传易感和环境因素等有关. 近年来肠道菌群失调与IBD的发生、发展之间的关系, 尤其是肠道菌群对肠黏膜屏障的影响已成为研究热点[1]. 肠黏膜屏障结构破坏、功能紊乱是IBD患者肠道炎性病变加重的主要因素[2], 可能与肠腔内抗原物质及病原菌透过破坏的屏障移位至肠黏膜固有层, 激活免疫、炎症反应, 进一步加重黏膜屏障的破坏有关[3,4]. 因此, 肠道屏障功能的维持与重塑有利于减轻肠道炎症损伤. 研究[5-7]表明多种益生菌(如鼠李糖乳杆菌株GG、婴儿双歧杆菌、尼氏大肠杆菌1917等)可以增强紧密连接的完整性, 进而预防化学物质或有害病原菌对紧密连接的破坏, 但是目前益生菌对IBD患者疗效的临床研究结果尚存争议, 这可能与益生菌种类、剂量、疾病状态等密切相关. 肠上皮细胞间紧密连接是肠黏膜屏障的重要组成之一, 其中决定紧密连接(tight junction, TJ)结构和功能的蛋白主要包括连接黏附分子1(junctional adhension molecule-1, JAM-1)、Claudins家族蛋白、Occludin蛋白、Zo(zona occludens)家族蛋白. JAM-1是上皮细胞间的单次跨膜蛋白, 也是细胞连接形成过程中较早出现并具有招募其他TJ功能的蛋白[8,9]. 我们利用葡聚糖硫酸钠(dextran sulfate sodium, DSS)诱导的急性结肠炎模型, 观察双歧杆菌三联活菌是否通过影响肠道紧密连接蛋白JAM-1的表达和分布, 从而恢复肠道屏障完整性, 进而减低炎症、改善肠道炎性损伤, 目前国内外尚无关于这一方面的研究.
SPF级♀Balb/c小鼠(8-10周龄, 22 g±2 g, 购自南京医科大学动物实验中心). DSS, 36-50 kDa(MP Biomedicals); 双歧杆菌三联活菌, 主要含有长型双歧杆菌、嗜酸乳杆菌和粪肠球菌(上海信谊药厂, 批号04720140922); 兔抗JAM-1多克隆抗体(Abcam, ab180821); HRP-山羊抗兔二抗(immunology consultants laboratory, GGHL-15P); 免疫组织化学试剂盒(北京中杉金桥, SP-9000); DAB(武汉博士德, AR1022).
1.2.1 急性DSS结肠炎模型建立以及益生菌给药处理: 按Chen等[10]、Okayasu等[11]的方法将其随机分为5组(图1): 正常对照NC组、益生菌BB组(正常小鼠予益生菌灌胃14 d)、急性DSS模型组(生理盐水灌胃14 d+第8天起4%DSS溶液自由饮用7 d)、BD组(益生菌灌胃7 d+第8天起4%DSS溶液自由饮用7 d)、BDB组(益生菌灌胃14 d+第8天起4%DSS溶液自由饮用7 d). 实验第1天开始, 给予BB组及BDB组小鼠, 每日双歧杆菌三联活菌灌胃[3×107 cfu/(0.5 mL•只)][12]至实验结束, 而BD组仅在实验的前7 d给予双歧杆菌三联活菌灌胃. 除正常对照NC组及BB组, 各模型组均从第8天起自由饮用含有4%DSS自来水7 d, 第15天处死小鼠.
1.2.2 分离肠组织及结肠大体病变观察: 处死小鼠后分离回盲部至肛门的肠段, 观察肠腔内容物、肠壁水肿等情况并测量每只小鼠结肠长度及质量.
1.2.3 组织病理学检查(HE染色)与评分: 预冷无菌PBS冲洗肠管后, 切取距肛门1-2 cm, 长约0.5 cm的肠管[10], 浸入40 g/L甲醛, 石蜡包埋及苏木素-伊红(HE)染色, 参照Dieleman等[13]的标准进行组织病理评分(表1).
| 评分参数 | 描述 | 得分(分) |
| 炎症 | 无 | 0 |
| 轻度 | 1 | |
| 中度 | 2 | |
| 重度 | 3 | |
| 深度 | 无 | 0 |
| 累及黏膜 | 1 | |
| 累及黏膜及黏膜下层 | 2 | |
| 穿透黏膜全层 | 3 | |
| 隐窝损伤 | 无 | 0 |
| 靠近基底膜1/3隐窝破坏 | 1 | |
| 靠近基底膜2/3隐窝破坏 | 2 | |
| 仅有完整上皮 | 3 | |
| 全部隐窝、上皮破坏 | 4 | |
| 病变范围(%) | 1-25 | 1 |
| 26-50 | 2 | |
| 51-75 | 3 | |
| 76-100 | 4 |
1.2.4 Western blot检测结肠组织中JAM-1蛋白的表达: 取一定质量的结肠组织, 经强效蛋白裂解液裂解后, 制备蛋白样品. 兔抗JAM-1多克隆抗体稀释度为1:1000, 4 ℃过夜, HRP-抗兔二抗1:8000, 室温1 h. 经ECL发光法曝光, Image Lab软件对条带灰度值进行分析.
1.2.5 免疫组织化学法检测JAM-1在结肠组织中的分布与表达情况: 取结肠组织, 经甲醛浸泡后, 石蜡包埋、切片厚度0.4 μm. 组织切片经二甲苯脱蜡, 梯度乙醇水化, 微波修复抗原, 3%H2O2消除内源性过氧化物酶活性. 滴加JAM-1抗体(1:100), 4 ℃孵育过夜; 滴加生物素标记的二抗(B液), 室温或37 ℃孵10-15 min; 滴加辣根酶标记链霉卵白素工作液(C液), 室温或37 ℃孵育10-15 min; DAB显色, 苏木素复染, 脱水, 透明, 中性树胶封片, 镜检. Image-Pro Plus软件进行免疫组织化学半定量分析.
统计学处理 数据以mean±SE表示, 所有数据采用SPSS20.0统计软件进行分析处理, 组间比较采用t检验. 相关性分析采用Spearman相关性检验. P<0.05为差异有统计学意义.
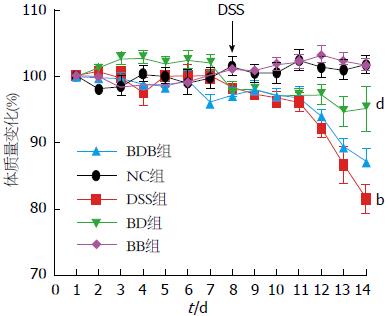
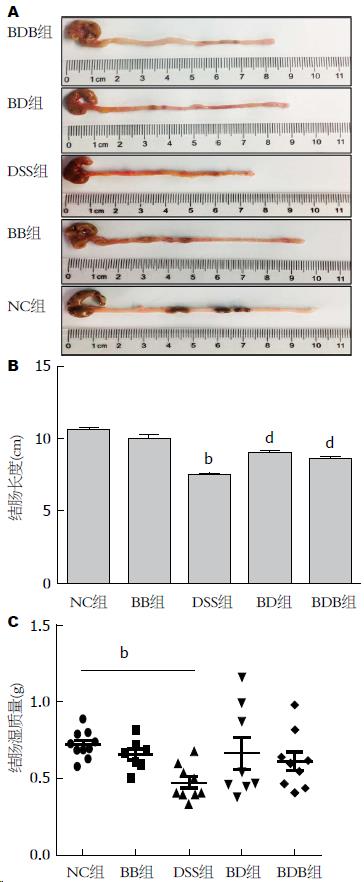
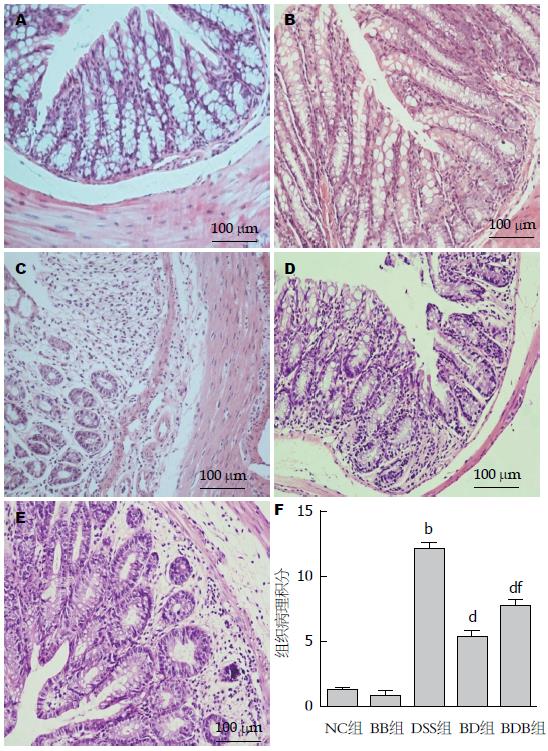
第8天起DSS组小鼠暴露于4%DSS溶液, 平均4-5 d后出现毛发粗糙、体质量下降, 稀便表面附着鲜血甚至完全血便, 活动、饮食饮水减少, 反应迟钝. 与正常对照组相比, 实验结束时DSS模型鼠的体质量显著减轻(81.49%±2.16% vs 101.73%±1.29%, P<0.01), 肠腔内可见暗红色血迹、病变局部黏膜充血水肿, 结肠长度缩短(7.49 cm±0.20 cm vs 10.51 cm±0.20 cm, P<0.01)、结肠湿质量减轻(0.476 g±0.037 g vs 0.724 g±0.028 g, P<0.01), 镜下炎症细胞浸润几乎累及黏膜全层, 上皮结构破坏、隐窝消失(P<0.01)(图2).
2.2.1 各组小鼠结肠大体表现: 给予益生菌干预的BD、BDB组小鼠肠壁充血、水肿程度减轻, 结肠长度缩短程度较DSS组明显改善(均P<0.01), BD组小鼠结肠长度缩短改善程度似乎优于BDB组, 但无显著差异(P>0.05); 仅益生菌灌胃的BB组小鼠结肠长度与正常对照小鼠无显著差异(P>0.05)(图3A, B). 另外, 益生菌干预后结肠湿质量较DSS模型组有增加趋势, 但尚无显著差别(BD、BDB分别为: 0.665 g±0.105 g、0.614 g±0.062 g vs 0.476 g±0.037 g, 均P>0.05)(图3C). 结肠质量减轻与长度缩短均可间接反映肠道炎症情况.
2.2.2 各组结肠组织HE染色后镜下表现: DSS结肠炎模型组肠组织结构受到破坏(图4A). 益生菌干预后BD、BDB组病理评分分别为: 5.28分±0.55分、7.69分±1.23分, 均显著低于DSS组(均P<0.01), 并且BD组结肠损伤轻于BDB组(P<0.01). 与正常对照小鼠相比, 仅予双歧杆菌三联活菌灌胃(BB组)不会造成小鼠结肠组织病理性损伤(P>0.05)(图4B).
Western blot检测结果显示, 与正常对照小鼠相比, DSS模型组小鼠肠组织中紧密连接蛋白JAM-1显著减少(P<0.01), 给予益生菌干预的BD、BDB组小鼠肠组织JAM-1的表达水平较DSS模型组显著增加(BD, BDB分别为: 0.725±0.027、0.739±0.033 vs 0.454±0.073, P1 = 0.03, P2 = 0.02), 且BD组小鼠肠道JAM-1表达水平与BDB组相当. 益生菌灌胃14 d(BB组)的小鼠肠道紧密连接蛋白JAM-1表达量与正常对照小鼠无显著差别(P>0.05)(图5).
免疫组织化学染色结果显示, 正常对照组、BB组小鼠结肠组织中蛋白染色阳性呈棕黄色或棕褐色、表达量多, 定位于细胞膜, 呈线性分布且阳性染色细胞范围广. DSS模型组JAM-1阳性染色强度和细胞数明显低于正常组, 分布稀疏、散乱, 有中断或缺失, 而双歧杆菌三联活菌处理后, 肠组织中JAM-1表达量及分布范围较DSS组显著改善(BD、BDB分别为: P1<0.01, P2<0.05)(图6).
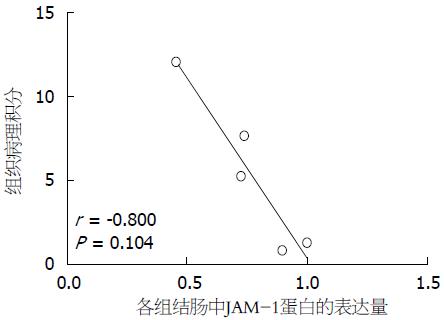
小鼠结肠组织病理评分是反映小鼠肠道炎症严重程度的重要指标, 为了分析JAM-1表达水平与肠道炎症是否相关, 我们检测并分析结肠组织中JAM-1蛋白与组织损伤程度间关系, 结果显示: 当JAM-1蛋白处于较高水平时, 肠道炎症亦相应轻(r = -0.80, P = 0.104), 提示双歧杆菌三联活菌可能通过使JAM-1蛋白重新分布、表达量增加, 缓解肠道炎症(图7).
DSS诱导结肠炎模型重现性好、组织学改变与人类的UC极为相似[11], 故本研究采用自由饮用4%DSS溶液7 d, 建立小鼠急性结肠炎性损伤模型, 并于不同时期进行益生菌灌胃干预, 观察在肠道出现急性损伤前后, 双歧杆菌三联活菌对肠道黏膜损伤程度及紧密连接蛋白JAM-1表达的影响. 结果显示小鼠暴露于DSS溶液7 d后, 结肠大体改变、组织病理变化与以往研究[14-16]利用DSS建立急性结肠炎模型的表现相似. 给予益生菌干预的BD、BDB组, 结肠缩短程度、组织病理损伤程度较DSS模型组有不同程度改善, 研究结果表明预先给予双歧杆菌三联活菌, 可减轻DSS小鼠的肠道炎症, 提示双歧杆菌三联活菌对急性肠道炎症具有保护作用. 另外, 我们观察到DSS造模前及造模同时继续给予益生菌处理的BDB组小鼠结肠炎性损伤重于仅在DSS造模前给予益生菌处理的BD组, 这是否提示结肠炎急性期, 益生菌通过损伤的肠黏膜进入黏膜内, 进而激活免疫, 使得进入肠道内的长型双歧杆菌、嗜酸乳杆菌和粪肠球菌有可能变成条件致病菌, 促使炎症加重.
目前关于JAM-1在IBD中的作用尚未得到充分阐明. 活动期IBD患者病变肠道的显著特点是上皮大量受损, 细胞间紧密连接结构广泛改变, 基底部渗透性增加[17], 手术切除的肠组织标本上皮阻抗明显降低[18,19], 肠道大分子抗原(主要为肠道内的微生物)通过增宽的细胞间隙进入固有层, 进而加重慢性活动性炎症反应[17,20], 提示屏障功能的完整性对IBD的重要性, 因此本研究重点研究了紧密连接结构重要组成蛋白JAM-1的表达水平, 尤其是双歧杆菌三联活菌对DSS小鼠肠道JAM-1的影响.
本研究[21,22]显示给予益生菌干预的DSS小鼠肠组织中JAM-1表达量、阳性染色细胞数及染色强度均增加. 近年来研究表明实验性结肠炎小鼠在益生元或微生物代谢产物处理后, 疾病活动性及炎症反应得以改善. 因此推测, 小鼠肠道炎症的改善与双歧杆菌三联活菌对JAM-1蛋白上调作用有关. JAM-1蛋白主要表达于内皮细胞和上皮细胞间紧密连接结构TJ中, 是较早出现在细胞间接触点的分子[23,24]. 他是TJ结构中的关键分子之一, 并对TJ结构的组装具有重要作用, 通过招募其他连接蛋白[25], 参与调节紧密连接的形成与连接结构的完整性[26,27]. JAM-/-基因敲除小鼠极易发生急性损伤引起的结肠炎, 主要表现为上皮渗透性增加, 炎症因子水平增高, 细菌发生易位, 结肠淋巴细胞增加[28,29]. 应用JAM-1单克隆抗体显著降低T84细胞的跨上皮电阻, 导致Occludin蛋白丢失, 干扰TJ结构的组装[30].
相关性分析结果也表明小鼠给予益生菌处理后, JAM-1蛋白表达水平与肠道病理损伤程度呈反比趋势, 提示双歧杆菌三联活菌可通过影响JAM-1蛋白量, 改善肠道炎症. 但是, 我们也发现BDB组小鼠肠道病理损伤程度重于BD组, 两组JAM-1的表达量却相当, 一方面可能由于DSS导致肠黏膜屏障受损, 益生菌作为外源性细菌透过屏障进入固有层, 激活免疫应答, 导致肠黏膜炎症细胞浸润增多; 另一方面提示可能JAM-1蛋白的变化并不是双歧杆菌三联活菌影响小鼠肠道炎症程度的唯一因素. 此外, JAM-1也属于免疫球蛋白家族成员[8,31,32], 能够调节多种白细胞迁移至病变组织中[28], 有研究[33]发现在实验性脑出血模型中早期血管上JAM-1表达减少, 与血脑屏障的通透性增加密切相关; 后期JAM-1表达阳性的白细胞数显著增加, 提示JAM-1可能参与炎症反应. 本实验主要研究了急性结肠炎模型肠组织JAM-1蛋白的变化, 但在慢性结肠炎模型中, JAM-1蛋白如何变化以及是否可能也参与介导炎症反应, 尚有待进一步研究.
总之, 本实验表明双歧杆菌三联活菌对DSS诱导的急性结肠炎具有保护作用, 可能通过影响肠道紧密连接蛋白JAM-1表达与分布, 进而减低DSS诱导的急性结肠炎性损伤.
炎症性肠病(inflammatory bowel disease, IBD)目前的病因及发病机制尚不完全清楚, 主要与肠道菌群失调、免疫、遗传、环境等因素有关, 其中易感个体对异常的肠道菌群产生过度免疫反应, 导致肠黏膜免疫功能紊乱是目前公认的假说, 天然免疫是宿主的第一道防线, 由组织屏障、免疫细胞及免疫分子组成, 其中组织屏障损伤已成为近年来研究的热点. 已有研究表明益生菌可减低肠道的炎性损伤, 可能与黏膜屏障受损有关, 机制尚不完全清楚, 因而开展相关研究有着重要临床意义.
宋武, 教授, 主任医师, 中山大学附属第一医院胃肠外科
近年来肠道菌群与IBD间的关系日益成为研究热点, 益生菌制剂种类繁多且对IBD患者的临床疗效尚存在争议, 其具体的作用机制仍不明确.
Khounlotham和Vetrano等研究发现JAM-/-基因敲除小鼠极易发生急性损伤引起的结肠炎, 主要表现为上皮渗透性增加, 炎症因子水平增高, 细菌发生易位, 结肠淋巴细胞增加.
本文首次报道了双歧杆菌三联活菌通过影响急性葡聚糖硫酸钠(dextran sulfate sodium, DSS)模型鼠肠道紧密连接蛋白连接黏附分子连接黏附分子1(junctional adhension mole-cules, JAM-1)的表达水平, 进而改善疾病活动性及肠道炎症, 为IBD的治疗提供理论依据.
本研究显示益生菌制剂可通过影响肠上皮细胞间JAM-1表达, 从而对DSS结肠炎产生保护作用, 提示维持肠道微生态平衡及保护肠上皮紧密连接蛋白JAM-1有助于IBD的缓解.
本文立题具有一定创新性, 研究方法科学可靠, 结论可信.
编辑: 郭鹏 电编:闫晋利
| 1. | Ramakrishna BS. Probiotic-induced changes in the intestinal epithelium: implications in gastrointestinal disease. Trop Gastroenterol. 2009;30:76-85. [PubMed] |
| 2. | Cichon C, Sabharwal H, Rüter C, Schmidt MA. MicroRNAs regulate tight junction proteins and modulate epithelial/endothelial barrier functions. Tissue Barriers. 2014;2:e944446. [PubMed] [DOI] |
| 3. | Becker C, Neurath MF, Wirtz S. The Intestinal Microbiota in Inflammatory Bowel Disease. ILAR J. 2015;56:192-204. [PubMed] [DOI] |
| 5. | Johnson-Henry KC, Donato KA, Shen-Tu G, Gordanpour M, Sherman PM. Lactobacillus rhamnosus strain GG prevents enterohemorrhagic Escherichia coli O157: H7-induced changes in epithelial barrier function. Infect Immun. 2008;76:1340-1348. [PubMed] [DOI] |
| 6. | Ewaschuk JB, Diaz H, Meddings L, Diederichs B, Dmytrash A, Backer J, Looijer-van Langen M, Madsen KL. Secreted bioactive factors from Bifidobacterium infantis enhance epithelial cell barrier function. Am J Physiol Gastrointest Liver Physiol. 2008;295:G1025-G1034. [PubMed] [DOI] |
| 7. | Zyrek AA, Cichon C, Helms S, Enders C, Sonnenborn U, Schmidt MA. Molecular mechanisms underlying the probiotic effects of Escherichia coli Nissle 1917 involve ZO-2 and PKCzeta redistribution resulting in tight junction and epithelial barrier repair. Cell Microbiol. 2007;9:804-816. [PubMed] [DOI] |
| 8. | Hamazaki Y, Itoh M, Sasaki H, Furuse M, Tsukita S. Multi-PDZ domain protein 1 (MUPP1) is concentrated at tight junctions through its possible interaction with claudin-1 and junctional adhesion molecule. J Biol Chem. 2002;277:455-461. [PubMed] [DOI] |
| 9. | Bazzoni G, Martinez-Estrada OM, Orsenigo F, Cordenonsi M, Citi S, Dejana E. Interaction of junctional adhesion molecule with the tight junction components ZO-1, cingulin, and occludin. J Biol Chem. 2000;275:20520-20526. [PubMed] [DOI] |
| 10. | Chen YP, Hsiao PJ, Hong WS, Dai TY, Chen MJ. Lactobacillus kefiranofaciens M1 isolated from milk kefir grains ameliorates experimental colitis in vitro and in vivo. J Dairy Sci. 2012;95:63-74. [PubMed] [DOI] |
| 11. | Okayasu I, Hatakeyama S, Yamada M, Ohkusa T, Inagaki Y, Nakaya R. A novel method in the induction of reliable experimental acute and chronic ulcerative colitis in mice. Gastroenterology. 1990;98:694-702. [PubMed] |
| 12. | Chen LL, Zou YY, Lu FG, Li FJ, Lian GH. Efficacy profiles for different concentrations of Lactobacillus acidophilus in experimental colitis. World J Gastroenterol. 2013;19:5347-5356. [PubMed] [DOI] |
| 13. | Dieleman LA, Palmen MJ, Akol H, Bloemena E, Peña AS, Meuwissen SG, Van Rees EP. Chronic experimental colitis induced by dextran sulphate sodium (DSS) is characterized by Th1 and Th2 cytokines. Clin Exp Immunol. 1998;114:385-391. [PubMed] [DOI] |
| 14. | Azuma T, Shigeshiro M, Kodama M, Tanabe S, Suzuki T. Supplemental naringenin prevents intestinal barrier defects and inflammation in colitic mice. J Nutr. 2013;143:827-834. [PubMed] [DOI] |
| 15. | Dai C, Zhao DH, Jiang M. VSL#3 probiotics regulate the intestinal epithelial barrier in vivo and in vitro via the p38 and ERK signaling pathways. Int J Mol Med. 2012;29:202-208. [PubMed] [DOI] |
| 16. | Yan F, Cao H, Cover TL, Washington MK, Shi Y, Liu L, Chaturvedi R, Peek RM, Wilson KT, Polk DB. Colon-specific delivery of a probiotic-derived soluble protein ameliorates intestinal inflammation in mice through an EGFR-dependent mechanism. J Clin Invest. 2011;121:2242-2253. [PubMed] [DOI] |
| 17. | Festen EA, Szperl AM, Weersma RK, Wijmenga C, Wapenaar MC. Inflammatory bowel disease and celiac disease: overlaps in the pathology and genetics, and their potential drug targets. Endocr Metab Immune Disord Drug Targets. 2009;9:199-218. [PubMed] [DOI] |
| 18. | Schmitz H, Barmeyer C, Fromm M, Runkel N, Foss HD, Bentzel CJ, Riecken EO, Schulzke JD. Altered tight junction structure contributes to the impaired epithelial barrier function in ulcerative colitis. Gastroenterology. 1999;116:301-309. [PubMed] [DOI] |
| 19. | Zeissig S, Bürgel N, Günzel D, Richter J, Mankertz J, Wahnschaffe U, Kroesen AJ, Zeitz M, Fromm M, Schulzke JD. Changes in expression and distribution of claudin 2, 5 and 8 lead to discontinuous tight junctions and barrier dysfunction in active Crohn's disease. Gut. 2007;56:61-72. [PubMed] [DOI] |
| 20. | Barmeyer C, Schulzke JD, Fromm M. Claudin-related intestinal diseases. Semin Cell Dev Biol. 2015;42:30-38. [PubMed] [DOI] |
| 21. | Simeoli R, Mattace Raso G, Lama A, Pirozzi C, Santoro A, Di Guida F, Sanges M, Aksoy E, Calignano A, D'Arienzo A. Preventive and therapeutic effects of Lactobacillus paracasei B21060-based synbiotic treatment on gut inflammation and barrier integrity in colitic mice. J Nutr. 2015;145:1202-1210. [PubMed] [DOI] |
| 22. | Miyamoto J, Mizukure T, Park SB, Kishino S, Kimura I, Hirano K, Bergamo P, Rossi M, Suzuki T, Arita M. A gut microbial metabolite of linoleic acid, 10-hydroxy-cis-12-octadecenoic acid, ameliorates intestinal epithelial barrier impairment partially via GPR40-MEK-ERK pathway. J Biol Chem. 2015;290:2902-2918. [PubMed] [DOI] |
| 23. | 周 华容. 变应性鼻炎鼻黏膜紧密连接的观察及claudin-4、JAM-1的表达与意义. 太原: 山西医科大学 2014; . |
| 24. | Nourshargh S, Krombach F, Dejana E. The role of JAM-A and PECAM-1 in modulating leukocyte infiltration in inflamed and ischemic tissues. J Leukoc Biol. 2006;80:714-718. [PubMed] [DOI] |
| 25. | Itoh M, Sasaki H, Furuse M, Ozaki H, Kita T, Tsukita S. Junctional adhesion molecule (JAM) binds to PAR-3: a possible mechanism for the recruitment of PAR-3 to tight junctions. J Cell Biol. 2001;154:491-497. [PubMed] [DOI] |
| 26. | Nasdala I, Wolburg-Buchholz K, Wolburg H, Kuhn A, Ebnet K, Brachtendorf G, Samulowitz U, Kuster B, Engelhardt B, Vestweber D. A transmembrane tight junction protein selectively expressed on endothelial cells and platelets. J Biol Chem. 2002;277:16294-16303. [PubMed] [DOI] |
| 27. | Naik UP, Eckfeld K. Junctional adhesion molecule 1 (JAM-1). J Biol Regul Homeost Agents. 2003;17:341-347. [PubMed] |
| 28. | Vetrano S, Rescigno M, Cera MR, Correale C, Rumio C, Doni A, Fantini M, Sturm A, Borroni E, Repici A. Unique role of junctional adhesion molecule-a in maintaining mucosal homeostasis in inflammatory bowel disease. Gastroenterology. 2008;135:173-184. [PubMed] [DOI] |
| 29. | Khounlotham M, Kim W, Peatman E, Nava P, Medina-Contreras O, Addis C, Koch S, Fournier B, Nusrat A, Denning TL. Compromised intestinal epithelial barrier induces adaptive immune compensation that protects from colitis. Immunity. 2012;37:563-573. [PubMed] [DOI] |
| 30. | Liu Y, Nusrat A, Schnell FJ, Reaves TA, Walsh S, Pochet M, Parkos CA. Human junction adhesion molecule regulates tight junction resealing in epithelia. J Cell Sci. 2000;113:2363-2374. [PubMed] |
| 31. | Sobocka MB, Sobocki T, Babinska A, Hartwig JH, Li M, Ehrlich YH, Kornecki E. Signaling pathways of the F11 receptor (F11R; a.k.a. JAM-1, JAM-A) in human platelets: F11R dimerization, phosphorylation and complex formation with the integrin GPIIIa. J Recept Signal Transduct Res. 2004;24:85-105. [PubMed] [DOI] |
| 32. | Martìn-Padura I, Lostaglio S, Schneemann M, Williams L, Romano M, Fruscella P, Panzeri C, Stoppacciaro A, Ruco L, Villa A. Junctional adhesion molecule, a novel member of the immunoglobulin superfamily that distributes at intercellular junctions and modulates monocyte transmigration. J Cell Biol. 1998;142:117-127. [PubMed] [DOI] |