修回日期: 2015-11-13
接受日期: 2015-11-25
在线出版日期: 2016-01-18
目的: 观察荔枝核总黄酮(total flavone from Litchi chinensis Sonn, TFL)对二甲基亚硝胺(dimethylnitrosamine, DMN)诱导的肝纤维化大鼠肝脏组Smads信号通路中关键信号传导分子Smad3、Smad4及基质金属蛋白酶抑制剂-1(tissue inhibitor of metalloproteinase-1 TIMP-1)表达水平的变化, 探讨TFL抗肝纤维化的作用机制.
方法: 90只SD大鼠随机平均分成正常对照组、模型组、秋水仙碱组不同浓度的TFL[200、100、50 mg/(kg•d)]. 用DMN腹腔注射诱导大鼠肝纤维化模型, 造模同时灌胃给药. 1次/d, 共给6 wk, 于实验第6周后处死大鼠, 取血清测定谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate transaminase, AST)的含量. 取留取肝脏同一部位行Masson染色观察大鼠病理改变及肝纤维化程度; 免疫组织化学法检测Smad3、Smad4、TIMP-1表达量, 实时荧光定量PCR检测(real-time quantitative PCR, qRT-PCR)检测Smad3、Smad4、TIMP-1 mRNA表达量.
结果: 与模型组比较, TFL能降低血清ALT、AST含量, Masson染色病理显示TFL能显著减轻大鼠肝纤维化程度; 与空白对照组比较, 模型组大鼠的肝纤维化程度明显增加, 肝组织Smad3、Smad4及TIMP-1的表达明显增强(P<0.05); 与模型组比较, TFL各剂量组和秋水仙碱组肝组织Smad3、Smad4、TIMP-1的表达不同程度的降低(P<0.05).
结论: TFL可减轻实验性大鼠肝损伤及改善肝纤维化程度, 其机制与降低Smad3、Smad4及TIMP-1的表达有密切关系, 可能与改善肝功能、抑制肝细胞变性坏死, 从而抑制胶原蛋白的合成和沉积减少细胞外基质有关.
核心提示: 观察荔枝核总黄酮(total flavone from Litchi chinensis Sonn, TFL)对二甲基亚硝胺(dimethylnitrosamine)诱导的肝纤维化大鼠肝脏组Smads信号通路中关键信号传导分子Smad3, Smad4及基质金属蛋白酶抑制剂-1(tissue inhibitor of metalloproteinase-1)表达水平的变化, 探讨TFL抗肝纤维化的作用机制.
引文著录: 黄红, 康毅, 黄旭平, 王晨晓, 罗伟生. 荔枝核总黄酮对大鼠肝纤维化Smad3、Smad4及TIMP-1信号表达的影响. 世界华人消化杂志 2016; 24(2): 176-186
Revised: November 13, 2015
Accepted: November 25, 2015
Published online: January 18, 2016
AIM: To observe the effect of total flavone from Litchi chinensis Sonn (TFL) on dimethylnitrosamine (DMN) induced hepatic fibrosis and the expression of Smad3, Smad4 and TIMP-1 in rat liver tissue, to explore the antifibrotic mechanism of TFL.
METHODS: Ninety male SD rats were randomly divided into a normal control group, a fibrosis model group, a colchicine positive control group, and high-, medium-, and low-dose TFL groups [200, 100, and 50 mg/(kg•d), respectively]. Liver fibrosis was induced in rats by intraperitoneal injection of 0.5% DMN solution. Colchicine or TFL was given during modelling by gavage, once a day, for 6 wk. Rats were killed after 6 wk, and the levels of alanine aminotransferase (ALT) and aspartate transaminase (AST) were tested using an automatic biochemical analyzer. Liver tissue samples were taken for Masson staining to observe the pathological changes and the degree of liver fibrosis in rats. The protein and mRNA expression of Smad3, Smad4, and TIMP-1 was detected by immunohistochemistry and real-time quantitative PCR (RT-PCR), respectively.
RESULTS: Compared with the model group, the levels of ALT and AST were significantly decreased in the TFL groups. Compared with the normal control group, the extent of fibrosis in the model group increased significantly, and the expression of Smad3, Smad4 and TIMP-1 in liver tissue was significantly enhanced (P < 0.05). Compared with the model group, the expression of Smad3, Smad4 and TIMP-1 showed varying degrees of down-regulation in the TFL groups and colchicine groups.
CONCLUSION: TFL can reduce liver injury and improve liver fibrosis in rats with liver fibrosis, and the underlying mechanism may be closely related with decreasing the expression of Smad3, Smad4 and TIMP-1.
- Citation: Huang H, Kang Y, Huang XP, Wang CX, Luo WS. Effect of total flavone from Litchi chinensis Sonn on Smad3, Smad4 and TIMP-1 expression in a rat model of liver fibrosis. Shijie Huaren Xiaohua Zazhi 2016; 24(2): 176-186
- URL: https://www.wjgnet.com/1009-3079/full/v24/i2/176.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i2.176
肝纤维化是由多种病因所导致的慢性肝病肝损伤的修复, 主要是细胞外基质(extracellularmatrix, ECM)的合成和降解平衡遭到破坏, 导致ECM过度沉积的病理过程, 对肝纤维化早期进行早诊断、早治疗, 就能有效挽救更多慢性肝病患者. 因此研究肝纤维化的病理机制对肝纤维化早诊断、早治疗, 甚至逆转肝纤维化的发生发展具有重要的意义[1]. 荔枝核盛产与于岭南地区, 味甘、微苦, 归属肝、肾经. 具有行气散结、散寒止痛的功效. 荔枝核总黄酮(total flavone from Litchi chinensis Sonn, TFL)为荔枝核中具有药理活性的主要成分之一, 不少研究[2-7]已证TFL具有抗病毒及抗肝纤维化的作用. 本课题通过动物大鼠实验, 从血清水平、病理形态学等角度验证TFL抗肝纤维化的效应, 并运用免疫组织化学及实时定量PCR检测(real-time quantitative PCR, qRT-PCR)检测Smad3、Smad4、基质金属蛋白酶抑制剂-1(tissue inhibitor of metalloproteinase-1 TIMP-1)的表达, 探讨TFL抗肝纤维化的分子机制. 现将实验结果报告如下.
SPF级♂SD大鼠90只, 体质量150 g±20 g, 鼠龄5 wk, 由广西医科大学动物中心提供, 合格证: SCXK桂2009-0002. 按常规饲养条件(23 ℃±2 ℃; 湿度55%±10%; 光照随昼夜变化), 普通大鼠饲料喂养, 自由进水. 实验大鼠于实验室适应性饲养1 wk后开始正式实验. TFL原材料TFL购自南京泽朗公司, TFL纯度为82.1%(广西中医药大学药理实验室复测纯度一致); 秋水仙碱片购自西双版纳版纳公司; 二甲基亚硝胺(dimethylnitrosamine, DMN)购自德国Sigma Aldrich公司; Smad3、Smad4、TIMP-1抗体(Protein Group公司); 免疫组织化学二抗试剂、DAB显色试剂盒购自福建迈新公司; 全自动生化分析仪(日本HITACHI公司, 7600-020); 倒置照相显微镜(日本Olympus公司, CK2). 根据GenBank登录的Smad3、Smad4、TIMP-1核苷酸序列设计引物, 由上海生工生物工程技术服务有限公司合成, qRT-PCR仪(美国Biorad公司).
1.2.1 动物分组及处理: 将90只大鼠随机分为正常对照组, 模型组, TFL高、中、低剂量组、秋水仙碱组, 每组15只. 模型组, TFL高、中、低剂量组、秋水仙碱组按照腹腔注射0.5%DMN(2 mL/kg)每周连续3 d, 共4 wk作肝纤维化模型[8]. 造模同时, 模型组用5 mL/kg生理盐水灌胃, 荔枝核高、中、低剂量组分别按生药计算为200、100、50 mg/(kg•d)灌胃, 秋水仙碱组生理盐水配置的0.1 mg/(kg•d)的秋水仙碱混悬液灌胃, 1次/d, 共6 wk. 正常对照组以等体积的生理盐水灌胃[7]. 6 wk后, 腹主动脉采血, 离心分离血清, -20 ℃冰箱保存; 剖开大鼠腹腔暴露肝脏, 观察肝脏外形改变, 取新鲜肝脏右叶中部组织. 一部分以40 g/L多聚甲醛溶液固定, 3 d内石蜡包埋准备病理组织切片和免疫组织化学检测. 另一部分切取肝组织, 滤纸吸干, 称质量后置于液氮中速冻, -80 ℃冰箱冻存, 为组织待测标本.
1.2.2 肝功能检测: 血液常规离心分离出血清后, 用全自动生化分析仪测定血清谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate transaminase, AST)水平.
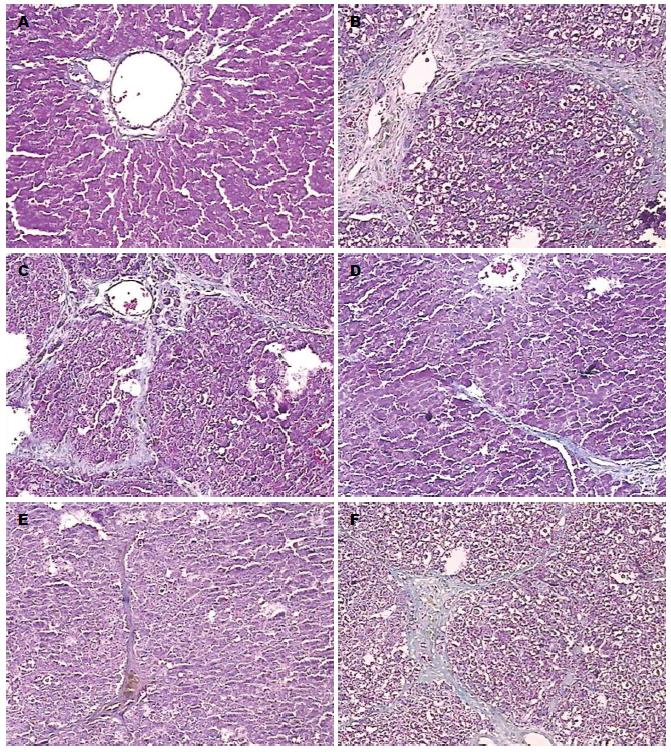
1.2.3 Masson胶原染色: 取肝组织右叶中部进行Masson胶原染色: 10%三氯乙酸和10%重铬酸钾混合液15 min, 蒸馏水清洗6次; 5%天青石蓝6 min, 蒸馏水洗6次; 1%冰醋酸中冲洗1遍, 滴上酸性品红与丽春红混合液比例2:1; 滴1%亮绿待1 min; 在冰醋酸中冲洗3遍; 脱水透明封片[9]. 肝纤维化分期和半定量评分参照2007年中华肝脏病学会发布的《肝纤维化诊断及疗效评估共识》[10], 最低0分, 最高29分; 得分越高, 表示纤维化程度越重.
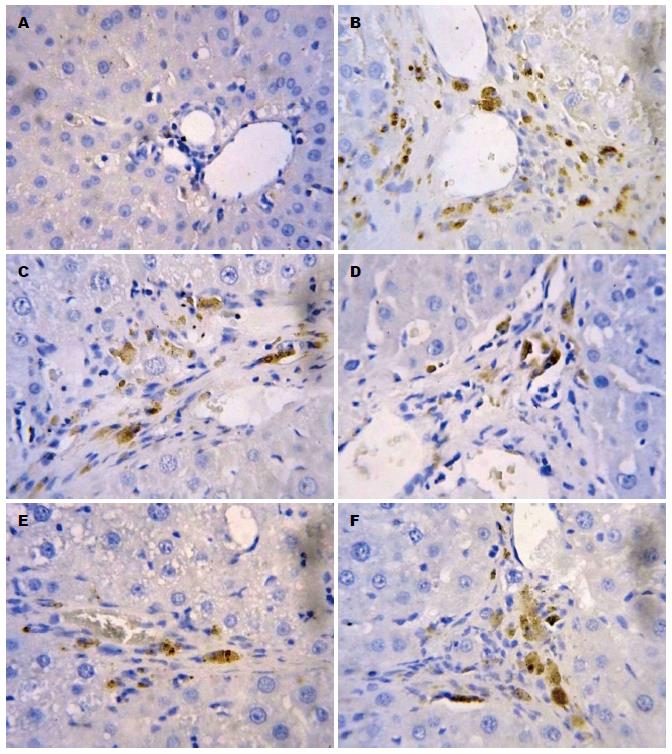
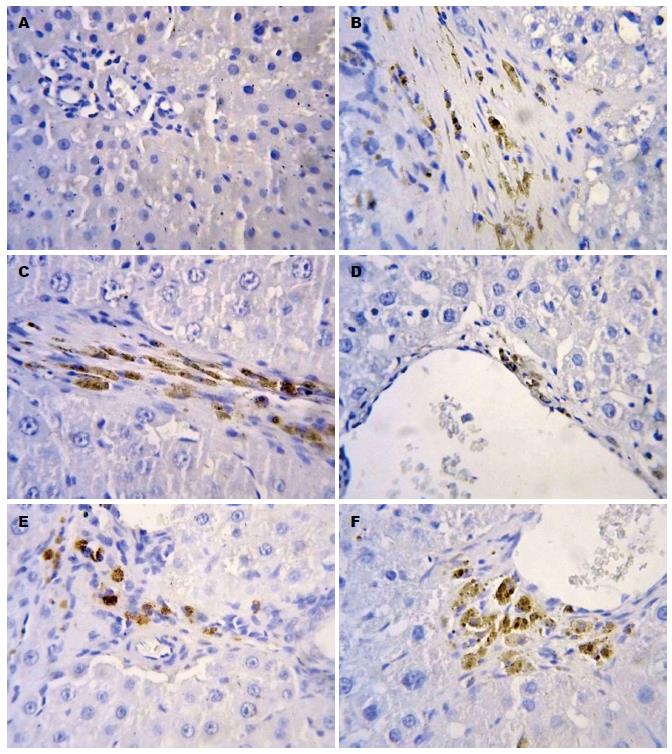
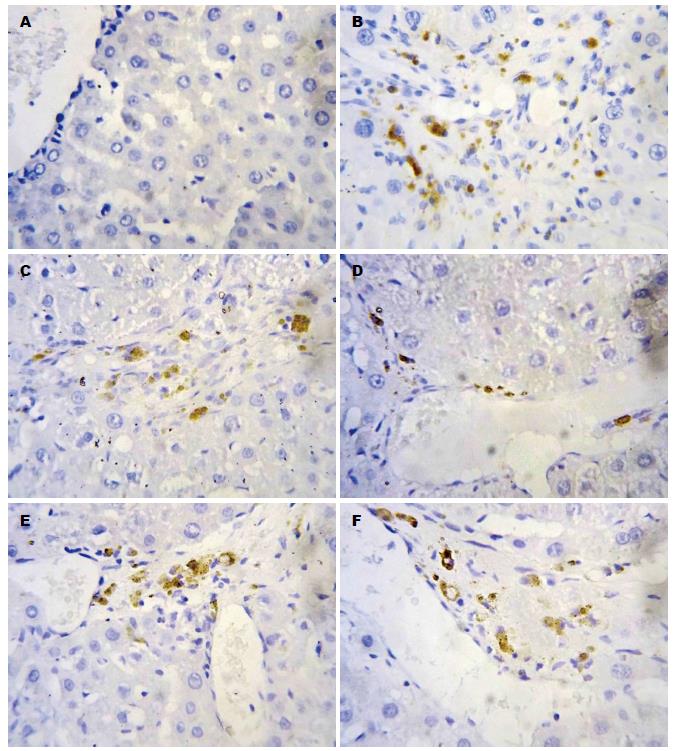
1.2.4 采用免疫组织化学法检测肝组织Smad3、Smad4、TIMP-1蛋白的表达: 肝组织经10%甲醛溶液固定, 石蜡包埋、切片, 脱蜡脱水, 2%EDTA高温修复20 min冷却后PBS冲洗; 3%H2O2阻断10 min, PBS冲洗; 0.1 mol/L枸椽酸盐缓冲液微波处理, 滴加Smad3、Smad4、TIMP-1多克隆抗体(1:200); 4 ℃过夜; PBS冲洗, 5 min×3次; 滴加二抗, 15 min后PBS冲洗, 5 min×3次; DAB显色; 苏木精复染, 常规脱水, 透明, 中性树胶封固、光镜下观察. 阳性片细胞胞质中出现棕黄色阴性片无着色. 免疫组织化学结果半定量判断参照略修改, 用已知阳性切片作为阳性对照, 用PBS代替一抗作为阴性对照. 采用半定量计分方法, 参照免疫组织化学显色标准[9]. 按显色程度分弱、中、强3种, 分别记以1、2、3分. 每个指标的每个标本, 选择阳性细胞较多的区域进行采集, 取10个较好的高倍视野, 按显色范围分为4度: (+)为显色范围占高倍视野<1/4, (++)为显色占高倍视野1/4-2/4, (+++)为显色占高倍视野2/4-3/4, (++++)为显色占高倍视野>3/4. 将每个高倍视野显色程度和范围换算成显色指数, 显色指数 = 显色程度×显色范围, (+)为1分, (++)为2分, (+++)为3分, (++++)为4分, 取均数作为每一种类蛋白表达的最终显色指数.
1.2.5 qRT-PCR检测Smad3、Smad4、TIMP-1 mRNA表达: 按说明书进行逆转录聚合酶链式反应, 各组总RNA样品均取2 μg进行逆转录为cDNA, 总反应体积为20 μL. 将反转录所得cDNA原液稀释10倍后用qRT-PCR仪检测, 反应条件设置为95 ℃预变性10 s; 扩增均设定为45个循环, 其中每一循环95 ℃变性15 s, 58 ℃ 30 s, 72 ℃ 30 s. 反应结束, 由电脑自动分析各样本的Ct值, 即可得到一定荧光阈值的循环数. 考虑到每个样本总RNA浓度的差异, 本实验用内参18S进行校正, 最终计算结果按下列公式换算: 目的基因的相对表达量 = 目的基因的相对表达量 = 2-△△Ct(△Ct = 目的基因Ct-内参Ct; △△Ct = 待测样品中目的基因△Ct-参照样品中目的基因△Ct). 引物序列如表1.
| 名称 | 引物序列 | 扩增长度(bp) |
| Smad3 | 上游: 5'-CGTCCATCCTGCCCTTCAC-3' | 123 |
| 下游: 5'-CCAAGCTCTTGACCGCCTTC-3' | ||
| Smad4 | 上游: 5'-CCTGGACTGGAAGTAGGACTG-3' | 146 |
| 下游: 5'-GGAAATGGGAGGCTGGAATGC-3' | ||
| TIMP-1 | 上游: 5'-CCACAGATATCCGGTTGGCCTACA-3' | 218 |
| 下游: 5'-GCACCCCACAGCCAGCACTAT-3' | ||
| 18S | 上游: 5'-GAATTCCCAGTAAGTGCGGGTCATA-3' | 105 |
| 下游: 5'-CGAGGGCCTCACTAAACCATC-3' |
统计学处理 采用SPSS17.0软件进行统计分析. 计量资料以mean±SD表示, 两样本均数间的比较采用t检验; 多个样本间的比较采用单因素方差分析(one way ANOVA), 以P<0.05为差异具有统计学意义. 符合组间比较应用最小显著差数法LSD检验, 以P<0.05为差异具有统计学意义.
实验空白组大鼠体格健壮, 喜动好斗, 毛发光滑亮泽, 饮食、二便正常, 体质量增长正常, 无死亡. 实验期间死亡3只大鼠(模型组2只, 秋水仙碱组1只. 秋水仙碱组大鼠死亡的原因为灌胃时大鼠挣扎导致灌胃针穿破食管和胸腔主动脉致大出血而死; 模型组2只死亡大鼠), 经尸检及肝脏Masson染色检查, 系死于急性肝衰竭, 故死亡动物不计入数据统计.
6 wk末时, 模型组大鼠消瘦, 反映迟钝, 食欲差, 少动, 毛发稀疏, 无光泽, 解剖后, 观察肝脏色泽晦暗, 表面不光滑, 质地较硬, 肝组织病理切片有较多纤维生成, 按2007年中华肝脏病学会发布的《肝纤维化诊断及疗效评估共识》[6]. 证实实验大鼠肝纤维化已形成, 造模成功.
空白对照组大鼠血清ALT为38.96 U/L±3.72 U/L, 模型组大鼠为200.97 U/L±10.53 U/L, 较空白对照组增高(P<0.05). TFL高、中、低剂量组和秋水仙碱组血清ALT分别为61.48 U/L±8.08 U/L、84.90 U/L±12.83 U/L、94.30 U/L±14.33 U/L、98.65 U/L±6.63 U/L, 各治疗组均明显低于模型组(P<0.05), 且TFL高、中剂量组血清ALT较秋水仙碱组低(P<0.05), TFL低剂量组血清ALT较秋水仙碱组稍低, 无统计学意义. 空白对照组大鼠血清AST为73.34 U/L±7.82 U/L, 模型组大鼠为382.65 U/L±19.39 U/L, 较空白对照组增高(P<0.05). TFL高、中、低剂量组和秋水仙碱组血清AST分别为111.29 U/L±11.55 U/L、147.83 U/L±12.91 U/L、154.56 U/L±10.36 U/L、154.56 U/L±12.68 U/L, 各治疗组均明显低于模型组(P<0.05), 且TFL高、中剂量组血清AST较秋水仙碱组低(P<0.05), TFL低剂量组血清AST与秋水仙碱组无统计学差异(表2).
Masson染色显示, 正常对照组无纤维组织增生, 仅在肝板间和中央静脉等管壁周围有少许纤细的网状纤维包绕; 模型组见汇管区大量胶原纤维增生, 在中央静脉之间、汇管区之间、汇管区与中央静脉之间形成纤维间隔, 破坏肝小叶结构, 分割、包绕肝小叶; 秋水仙碱组可见胶原纤维轻度增生, 汇管区纤维间隔轻度阔大, 局限于窦周和小叶内纤维化; 肝小叶间未见纤维组织增生, 无假小叶形成(表3, 图1).
在正常肝组织Smad3、Smad4、TIMP-1均呈弱阳性, 散在分布于肝窦、肝细胞、汇管区血管壁及间质细胞, 颜色较淡, 在DMN诱导的模型组大鼠肝组织中, Smad3、Smad4、TIMP-1呈强阳性表达, 广泛且特点相似(图2-4), 在纤维间隔、肝窦、汇管区和中央静脉等均可见表达, 显著高于正常对照组(P<0.01); 与模型组相比, TFL高剂量组Smad3、Smad4、TIMP-1蛋白表达明显下降(P<0.01); 仅在肝窦周围少部分着色, 呈小片状, 汇管区及肝细胞见少许淡黄色着色细胞, 中剂量组及低剂量组Smad3、Smad4、TIMP-1在肝小叶呈片状着色, 肝窦周围颜色较深, 个别单个肝细胞内可见强着色的细胞核, 与模型组相比较, 高、中剂量及低剂量组Smad3、Smad4、TIMP-1表达下降(P<0.01), 与秋水仙碱组比较, TFL高、中剂量组Smad3、Smad4、TIMP-1表达较低(P<0.05); TFL低剂量组Smad3、Smad4、TIMP-1表达较秋水仙碱稍低, 差异无统计学意义(表4).
| 分组 | n | Smad3显色指数 | Smad4显色指数 | TIMP-1显色指数 |
| 正常对照组 | 15 | 0.73±0.32b | 0.76±0.19b | 0.52±0.25b |
| 模型组 | 13 | 7.95±1.45 | 7.69±2.76 | 7.85±1.88 |
| 秋水仙碱组 | 14 | 4.99±0.77b | 5.76±1.42b | 4.85±1.38b |
| TFL高剂量组 | 15 | 2.93±0.98bc | 2.80±1.06bc | 2.41±0.80bc |
| TFL中剂量组 | 15 | 3.80±0.83bc | 3.76±1.44bc | 3.56±1.16bc |
| TFL低剂量组 | 15 | 4.39±1.29b | 4.71±1.73b | 4.19±1.30b |
| F值 | 79.113 | 32.044 | 57.173 | |
| P值 | 0.000 | 0.000 | 0.000 |
qRT-PCR检测结果显示: 模型组中Smad3、Smad4、TIMP-1 mRNA表达较正常组比较明显升高(P<0.01), 差异具有统计学意义, 与模型组相比, TFL高、中、低组及秋水仙碱组Smad3、Smad4、TIMP-1 mRNA表达降低(P<0.01), 差异具有统计学意义, TFL高、中剂量组与秋水仙碱组对比(P<0.05), TFL低剂量组Smad3、Smad4、TIMP-1 mRNA表达较秋水仙碱稍低, 差异无统计学意义(表5).
| 分组 | n | Smad3/18S | Smad4/18S | TIMP-1/18S |
| 正常对照组 | 15 | 1.71±0.46b | 1.53±0.41b | 1.36±0.29b |
| 模型组 | 13 | 8.44±1.14 | 8.04±1.41 | 7.64±1.27 |
| 秋水仙碱组 | 14 | 5.88±1.19b | 6.57±1.23b | 5.32±1.23b |
| TFL高剂量组 | 15 | 2.44±0.95bc | 2.02±0.63bc | 2.05±0.58bc |
| TFL中剂量组 | 15 | 3.95±1.19bc | 4.52±1.27bc | 4.34±1.46bc |
| TFL低剂量组 | 15 | 4.32±1.2b | 4.71±1.42b | 4.46±1.11b |
| F值 | 76.299 | 71.019 | 63.680 | |
| P值 | 0.000 | 0.000 | 0.000 |
大量实验表明荔枝核及其活性成分具有抗肝纤维化[5,6,9,11]、抗氧化[12]、抗肿瘤[13]、降糖[14]等多种作用. 本文通过Smad3、Smad4、TIMP-1的表达来了解TFL对实验性大鼠肝纤维化的作用机制.
肝纤维化的形成是一个复杂的过程, 是受多种细胞因子的调控, 主要指通过肝细胞的凋亡、肝脏内弥漫性细胞外基质的过度沉积, 而细胞外基质的沉积打破了肝脏内正常组织结构, 是导致肝硬化的必经病理过程, 而肝星状细胞的活化是肝纤维化过程的中心环节, 肝窦旁细胞发生一系列病理改变, 包括正常肝细胞外基质的降解、瘢痕分子的积聚、血管和器官的收缩以及细胞因子的释放. 所以, 如何逆转和防治肝纤维化是现今阶段国内外研究的热点[15]. 周学东等[16]通过实验表明TFL对肝纤维化模型大鼠肝细胞的损伤有改善作用. 黄大健等[17]通过实验表明TFL可改善肝纤维化的作用可能与抑制转化生长因子β(transforming growth factor-β, TGF-β)1、骨桥蛋白高表达从而减少细胞外基质ECM的分泌有关. TFL通过抑制TGF-β1、Smad3高表达上调Smad7表达有关[5,6].
吴晓玲等[18]通过实验证实Smads分子在实验性大鼠肝纤维化存在表达水平的失衡, 表明TGF-Smad信号通路可能与肝纤维化的形成有密切关系. Smads是TGF-β受体复合物下游一类非常重要的信号转导分子, 他具有独特的结构特点. 根据各个因子在TGF-β信号转导中所起的不同作用分为3个亚族: 受体激活型Smad(R-Smads), 通用型Smad(Co-Smads)和抑制型Smad(I-Smads). 在肝纤维化过程中, TGF-β1通过与细胞膜上特殊的丝氨酸/苏氨酸受体结合促使下游的Smad2/Smad3(R-Smads)磷酸化, 后者与Smad4(Co-Smads)形成复合体, 然后发生核转位, 调控靶基因的转录. 因此, 对Smads信号分子的调控是一种有效的抗肝纤维化治疗的策略[19-23].
通过细胞内Smad信号通道蛋白发挥促纤维化作用Smad蛋白是TGF-Smad号通路中的重要组成部分是胞内的信号分子是目前所知的最重要的TGF受体TR胞内激酶的底物. Smads是目前已知的最重要的TGF-β的下游信号传导分子, 其家族成员的功能与与其所处疾病的病理阶段和环境密切相关[19]. Smad3蛋白是转化生长因子TGF-β1信号通路在炎症和纤维化的中心作用的一个重要介质, 而肝纤维化的形成与Smads有着密切关联, 要产生最大效应胶原的活化肝星状细胞(hepatic stellate cell, HSC), 必定需要Smad3参与[24]. 而肝损伤的不同阶段, Smads有不同的作用. 在Smad蛋白家族中, Smad2主要介导TGF-β1的生理功能, 而Smad3在介导TGF-β1诱发肝纤维化中起着关键作用[25]. Smad4是通用型信号传导分子, Smad3必须与其结合后, 才能转入核内诱导靶基因转录. Smad3作为肝纤维化时细胞内主要信号传导介质, 将信号由胞质传递到胞核内调控目的基因的表达具有活化HSC促进胶原合成等效应是肝纤维化发生发展的必然过程. 活化后的HSC在Smad3的参与下才能发挥最大效应的胶原合成, Smad3蛋白主要表达于肝组织HSC中随着肝纤维化程度的增加其表达强度也呈递增趋势, 这表明了TGF-β1/Smad信号通路的激活在大鼠肝纤维化中可能起重要的作用与肝纤维化的发生发展密切相关Smad3蛋白的活化可能促进HSC分泌ECM, 说明Smad3蛋白的活化可能与HSC的活化密切相关. TGF-β1-Smad3在大鼠肝纤维化组织内的表达不断升高同时与肝纤维化程度表现呈正相关TGF-β1-Smad3-ILK信号转导通路可能在肝纤维化中发挥着重要的作用[26].
有学者认为, Smad3介导TGF-β促肝纤维化效应, 转基因大鼠肝脏内源性因子Smad4的表达降低, 大鼠肝脏Ⅰ型胶原降低, 显示抑制Smad3、Smad4的表达具有潜在的抗纤维化的价值. 而本实验显示, 肝纤维化大鼠肝组织Smad3、Smad4 mRNA表达同对照组相比, 均存在明显的增加. 证实实验性大鼠肝纤维化的形成过程中, Smad3、Smad4表达水平明显升高. 同时有学者认为敲除Smad4基因可延缓肝纤维化和肝癌的进展[27]. TIMP是ECM合成和降解调节中的重要的因素[28]. TIMP-1主要通过抑制MMPs活性, 从而导致ECM降解减少; 抑制HSC凋亡, 活化的HSC是导致肝纤维化的主要效应细胞, 其合成的TIMP-1又可阻碍HSC凋亡, 以致ECM增多; TIMP-1可促进HSC增殖[29]. 肝星状细胞的活化是肝纤维化的起始, TIMP-1不是肝纤维化中起主要的因素, 却能在肝纤维化的发展过程中起促进作用, 肝脏受损后, 经过一系列的细胞因子的作用来激活肝星状细胞, TIMP-1表达可与酶原活化阶段与MMPs形成较稳定的复合体, 使MMPs酶原激活受阻, 从而抑制其活性[30].
本实验结果表明: 肝纤维化模型组血清AST、ALT水平及肝纤维化半定量评分显著高于空白对照组(P<0.05); TFL高、中、低各组和秋水仙碱组血清AST、ALT水平、肝纤维化半定量评分均有所减少(P<0.05), 其中TFL高剂量组、TFL中剂量组组均优于秋水仙碱组(P<0.05), 表明TFL有较好的护肝和抗肝纤维化作用. 与正常对照组对比, 模型组大鼠肝组织纤维化程度显著增加, Smad3、Smad4、TIMP-1表达显著增加. TFL干预组与秋水仙碱组肝组织内Smad3、Smad4、TIMP-1表达的高低与肝纤维化程度呈正相关, 显示随着肝纤维化的程度加重, Smad3、Smad4、TIMP-1表达显著增加, TFL低剂量组与秋水仙碱组无显著性差异.
总之, TFL能调低实验肝纤维化大鼠血清ALT、AST水平, 具有保护肝功能, 改善肝细胞损伤作用; TFL能够改善实验性肝纤维化大鼠肝纤维化程度, 具有良好的抗肝纤维化作用; TFL抗肝纤维化的作用机制可能是抑制Smad3、Smad4、TIMP-1高表达, 抑制肝星状细胞活化, 进而抑制肝纤维化的发生和发展. 但肝纤维化涉及到的细胞分子生物学机制极其复杂, 单独研究TFL对某类细胞或某几个信号分子的干预存在局限, 今后应从细胞信号通路交联角度继续完善TFL抗肝纤维化的具体机制研究, 为开发抗肝纤维化新药提供更多科学依据. 传统药物是有效预防肝纤维化和其他原因引起的慢性肝损伤, 这提供了更多的希望为今后的防治肝纤维化和肝硬化. 这些药物都是廉价的优势, 安全和容易获得, 但他们中的大多数是在动物实验和临床观察的局限, 并在分子水平上研究系统的缺乏.
肝纤维化是由多种病因所导致的慢性肝病肝损伤的修复, 主要是细胞外基质(extracellularmatrix, ECM)的合成和降解平衡遭到破坏, 导致ECM过度沉积的病理过程, 对肝纤维化早期进行早诊断、早治疗, 就能有效挽救更多慢性肝病患者. 因此研究肝纤维化的病理机制对肝纤维化早诊断、早治疗, 甚至逆转肝纤维化的发生发展具有重要的意义.
刘旭东, 副主任医师, 广西中医学院附属瑞康医院肝病科; 顾生旺, 主任医师, 江苏省淮安市解放军第八二医院感染内科; 潘明新, 主任医师, 南方医科大学珠江医院肝胆外科
目前肝纤维化的发病机制是研究纤维化分子治疗领域的重点, 热点; 前期文献报道荔枝核总黄酮(total flavone from Litchi chinensis Sonn, TFL)具有防治大鼠肝纤维化并且促进肝星状细胞凋亡, 抑制肿瘤坏死因子相关诱导凋亡配体的作用, 但仍需进一步研究TFL在肝纤维化基础上对凋亡调控蛋白表达变化.
黄大建等通过体内试验TFL能抑制大鼠转化生长因子β(transforming growth factor-β, TGF-β)1、骨桥蛋白高表达, 从而减少细胞外基质ECM的分泌, 减轻肝细胞的损伤作用, 改善肝纤维化.
荔枝核能否通过抑制肝细胞变性坏死、促进肝细胞再生以及抑制胶原合成与沉积, 减少ECM沉积和促进ECM的降解目前未见报道, 而本文通过二甲基亚硝胺(dimethylnitrosamine, DMN)诱导大鼠建立肝纤维化模型, 观察TFL对肝纤维化大鼠肝细胞Smad3、Smad4、基质金属蛋白酶抑制剂-1(tissue inhibitor of metalloproteinase-1, TIMP-1)蛋白表达的变化. 结果表明, TFL可能通过下调Smad3、Smad4、TIMP-1的表达抑制肝细胞的凋亡从而达到抗肝纤维化的作用.
本实验旨在探讨TFL抗纤维化的作用机制, 初步证明TFL可改善肝功能, 并为开发抗肝纤维化中药提供了较好的理论依据, 但是TFL抗肝纤维化的其他作用机制, 与其他抗肝纤维化药物的疗效比较还需进一步研究.
细胞外基质(ECM): 是由动物细胞合成并分泌到胞外分布在细胞表面或细胞之间的大分子, 主要是一些多糖和蛋白、或蛋白聚糖.
本文研究立意新, 设计合理, 方法正确可靠, 结果可信, 具有一定的创新性和学术价值, 为治疗肝纤维化做出理论和实验依据.
编辑: 于明茜 电编:闫晋利
| 1. | Giannone FA, Baldassarre M, Domenicali M, Zaccherini G, Trevisani F, Bernardi M, Caraceni P. Reversal of liver fibrosis by the antagonism of endocannabinoid CB1 receptor in a rat model of CCl(4)-induced advanced cirrhosis. Lab Invest. 2012;92:384-395. [PubMed] [DOI] |
| 3. | 杨 艳, 彭 璇, 朱 薿, 陈 清宙, 陈 文, 罗 凡, 冯 勇, 侯 炜. 荔枝核黄酮类化合物的体外抗腺病毒作用. 武汉大学学报(医学版). 2014;35:41-45. |
| 8. | Xu L, Zheng N, He Q, Li R, Zhang K, Liang T. Puerarin, isolated from Pueraria lobata (Willd.), protects against hepatotoxicity via specific inhibition of the TGF-β1/Smad signaling pathway, thereby leading to anti-fibrotic effect. Phytomedicine. 2013;20:1172-1179. [PubMed] [DOI] |
| 17. | 黄 大健, 赵 永忠, 卢 青, 周 英琼, 肖 绪华, 成 秋宸, 董 勇, 何 志国. 转化生长因子-β1和骨桥蛋白在肝纤维化大鼠肝组织的表达及荔枝核总黄酮的干预. 实用医学杂志. 2013;29:3646-3649. |
| 19. | Cohen MM. TGF beta/Smad signaling system and its pathologic correlates. Am J Med Genet A. 2003;116A:1-10. [PubMed] [DOI] |
| 20. | Yan C, Wang L, Li B, Zhang BB, Zhang B, Wang YH, Li XY, Chen JX, Tang RX, Zheng KY. The expression dynamics of transforming growth factor-β/Smad signaling in the liver fibrosis experimentally caused by Clonorchis sinensis. Parasit Vectors. 2015;8:70. [PubMed] [DOI] |
| 21. | Dooley S, ten Dijke P. TGF-β in progression of liver disease. Cell Tissue Res. 2012;347:245-256. [PubMed] [DOI] |
| 22. | Zhang BB, Cai WM, Tao J, Zheng M, Liu RH. [Expression of Smad proteins in the process of liver fibrosis in mice infected with Schistosoma japonicum]. Zhongguo Jishengchongxue Yu Jishengchongbing Zazhi. 2013;31:89-94. [PubMed] |
| 23. | Prosser CC, Yen RD, Wu J. Molecular therapy for hepatic injury and fibrosis: where are we? World J Gastroenterol. 2006;12:509-515. [PubMed] |
| 24. | Jeong DH, Hwang M, Park JK, Goo MJ, Hong IH, Ki MR, Ishigami A, Kim AY, Lee EM, Lee EJ. Smad3 deficiency ameliorates hepatic fibrogenesis through the expression of senescence marker protein-30, an antioxidant-related protein. Int J Mol Sci. 2013;14:23700-23710. [PubMed] [DOI] |
| 25. | Uemura M, Swenson ES, Gaça MD, Giordano FJ, Reiss M, Wells RG. Smad2 and Smad3 play different roles in rat hepatic stellate cell function and alpha-smooth muscle actin organization. Mol Biol Cell. 2005;16:4214-4224. [PubMed] [DOI] |
| 27. | Xu XB, He ZP, Leng XS, Liang ZQ, Peng JR, Zhang HY, Zhang HY, Xiao M, Zhang H, Liu CL. [Effects of Smad4 on liver fibrosis and hepatocarcinogenesis in mice treated with CCl4/ethanol]. Zhonghua Ganzangbing Zazhi. 2010;18:119-123. [PubMed] |
| 28. | Zhu Y, Miao Z, Gong L, Chen W. Transplantation of mesenchymal stem cells expressing TIMP-1-shRNA improves hepatic fibrosis in CCl4-treated rats. Int J Clin Exp Pathol. 2015;8:8912-8920. [PubMed] |