修回日期: 2016-03-20
接受日期: 2016-04-06
在线出版日期: 2016-05-18
目的: 研究酒精诱导的小鼠肝损伤过程中肝脏增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)的表达变化.
方法: 将100只健康清洁♂小鼠随机分为对照组(n = 40)和模型组(n = 60), 模型组小鼠每日给予56%的红星二锅头(10 mL/kg)灌胃, 对照组每日给予等体积的蒸馏水灌胃.分别于第1、2、3、4周将两组小鼠全部处死, 并在各时间点取小鼠肝脏做苏木精-伊红(HE)染色并测定血清中ALT酶活力, 以检测小鼠酒精性肝损伤程度. 剩余肝脏通过蛋白印迹法用以检测小鼠肝脏增殖细胞核抗原的表达情况. 应用SSPS16.0对实验数据进行ANOVA显著性分析和Duncan's test.
结果: 酒精灌胃第1周, 病理HE染色显示肝细胞轻度损伤, ALT酶活力显著上升, 小鼠肝脏中的PCNA的表达量相比正常小鼠显著下降(P<0.05); 第2周, 病理HE染色显示肝细胞出现明显的水肿和大量的炎细胞浸润, ALT酶活力高于正常, PCNA的表达量达到了最低值(P<0.01); 第3周, 病理HE染色显示中央静脉周围的肝细胞脂肪变性, 门管区周围肝细胞水样变, ALT酶活力下降, PCNA的表达量显著上升, 但仍低于正常小鼠肝脏PCNA的表达量(P<0.05).
结论: 在酒精诱导的肝损伤过程中, PCNA在小鼠肝脏中的表达先下降后上升, 提示酒精诱导的肝损伤及损伤后的修复与PCNA的表达变化有关.
核心提示: 本实验通过酒精灌胃法成功建立小鼠酒精性肝损伤模型, 并发现在酒精诱导肝损伤的过程中PCNA在小鼠肝脏中的表达先下降后上升, 经过讨论和分析认为这种变化规律与酒精性肝损伤及损伤后的修复密切相关.
引文著录: 马秀青, 李三强, 卢华杰, 王莲丽, 乔新杰, 霍续磊, 白淼水, 姚致远. 增殖细胞核抗原在小鼠酒精性肝损伤中的表达及意义. 世界华人消化杂志 2016; 24(14): 2219-2224
Revised: March 20, 2016
Accepted: April 6, 2016
Published online: May 18, 2016
AIM: To detect the expression of proliferating cell nuclear antigen (PCNA) in alcohol-induced liver injury in mice and to analyze its significance.
METHODS: One hundred male mice were randomly divided into two groups: a model group (n = 60) and a control group (n = 40). Mice were intragastrically given 56% Red Star Erguotou (model group) or equal volume of distilled water (control group) each day. Mice in each group were sacrificed at the 1st, 2nd, 3rd and 4th wk. The extent of alcoholic hepatic injury at each point was assessed by hematoxylin-eosin (HE) staining and determination of serum ALT. PCNA expression was detected by Western blot.
RESULTS: At the first week, hepatic cells were injured mildly. The activity of ALT was increased. The expression of PCNA was decreased dramatically (P < 0.05) compared with normal mice. At the second week, liver cell swelling, inflammatory cell infiltration and other pathological changes were visible. The level of ALT was above normal. The expression of PCNA reached the minimum (P < 0.01). At the third week, liver steatosis and hydropic degeneration were observed around the central vein and interlobular veins by optical microscopy and the activity of ALT was decreased. The expression of PCNA was increased dramatically but was lower than that in normal mice (P < 0.05).
CONCLUSION: The expression of PCNA increases in early period and then decreases during the process of hepatic injury induced by alcohol, which implies that hepatocellular injury and repair may be associated with the expression change of PCNA.
- Citation: Ma XQ, Li SQ, Lu HJ, Wang LL, Qiao XJ, Huo XL, Bai MS, Yao ZY. Significance of expression of proliferating cell nuclear antigen in alcohol-induced liver injury in mice. Shijie Huaren Xiaohua Zazhi 2016; 24(14): 2219-2224
- URL: https://www.wjgnet.com/1009-3079/full/v24/i14/2219.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i14.2219
酒精性肝病(alcoholic liver diseases, ALD)是指由于长期摄入大量酒精而引起的一系列呈阶段性发展的疾病总称, 包括肝脂肪变性、酒精性肝炎、慢性肝炎、肝纤维化和肝硬化. ALD是慢性酒精中毒的主要表现之一, 主要由于酒精过度饮用及其他因素如环境、生活方式、遗传因素等所致[1]. 据2010年的调查, 全球每一百万人约有7人死于酒精过度饮用所致的肝硬化[2]. 而近年来, 随着我国经济的发展, 居民的生活水平逐渐提高, 所面临的精神压力同时增加, 导致酒精消费量日益增长, ALD的发病率也呈逐年增高趋势[3]. 然而目前对其发病机制仍不十分明确. 本文旨在通过研究小鼠酒精性肝损伤模型中PCNA的表达为ALD发病机制的进一步研究提供理论基础.
健康清洁昆明种♂小鼠, 体质量20 g±2 g, 由河南科技大学医学院动物实验中心提供; 56%的红星二锅头, 北京红星股份有限公司生产; 丙氨酸转氨酶(alanine aminotransferase, ALT)试剂盒购自南京建成公司; PCNA鼠源性单克隆抗体购自美国Santa Cruz公司; 辣根过氧化物酶标记的兔抗小鼠二抗, 购自北京中杉金桥生物技术有限公司; 其余化学试剂均为市售分析纯. JY300C电泳仪, 北京君意东方电泳设备有限公司产品; H1850R离心机, 日本Tome公司产品; 隔水式恒温箱, 上海新苗医疗器械制造有限公司; CX31RBSF光学显微镜, 奥林巴斯(中国)有限公司产品.
1.2.1 小鼠酒精性肝损伤模型的建立: 将100只健康清洁的昆明种♂小鼠分为对照组(n = 40)和酒精肝模型组(n = 60), 饲养1 wk使小鼠适应环境后开始建模. 模型组小鼠每天按10 mL/kg给予56%的红星二锅头灌胃, 对照组小鼠每天给予同等体积的蒸馏水灌胃. 各组小鼠实验期间均予全价营养饲料喂养, 自由进食进水, 每隔3 d更换垫料. 连续造模4 wk, 分别于0、1、2、3和4 wk采用颈髓脱臼法处死小鼠, 取肝脏.
1.2.2 HE染色检测肝脏病理变化: 取相同部位的肝脏组织冲洗24 h后用40 g/L甲醛固定12 h, 梯度乙醇脱水, 石蜡包埋, 取石蜡组织块切片, 切片厚度为4 μm, 做常规HE染色, 光镜下观察肝脏病理变化.
1.2.3 血清ALT含量: 眼球取血后静置30 min, 离心3000 r/min×10 min, 常规分离血清, 按试剂盒说明书操作测定血清中ALT的含量.
1.2.4 蛋白印迹检测小鼠酒精性肝损伤过程中PCNA的表达情况: 小鼠肝脏用PBS溶液按照1∶10的比例进行匀浆, 以4 ℃、12000 r/min离心2 min, 分离上清, 上清为蛋白样品, 进行蛋白电泳检测. 考马斯亮蓝G250蛋白定量后, 取蛋白样品70 μg, 经SDS-PAGE电泳后, 将蛋白转移到硝酸纤维素膜上, 用5%的脱脂奶粉/0.1%的Tween20/PBS(PBST)室温封闭膜30 min, 用PCNA鼠源性单克隆抗体(1∶800)37 ℃孵育1 h, 用TBST冲洗3次, 每次5 min; 加入辣根过氧化物酶标记的兔抗小鼠抗体(1∶800), 于37 ℃孵育1 h, 用TBST冲洗3次, 每次5 min. 用3,3'-二氨基联苯胺(diaminobenzidine, DAB)显色, 检测阳性信号. 在扫描仪扫描后, 用Gel Pro 4.0软件计算蛋白相对表达值. 被检测的目的蛋白相对表达值 = 目的蛋白条带灰度值/β-actin蛋白条带灰度值.
统计学处理 实验数据用SSPS16.0处理, 以mean±SD表示. 用ANOVA进行显著性分析, 组间比较采用Duncan's test. 以P<0.05为差异有统计学意义.
实验期间酒精灌胃组中有7只小鼠死亡, 死亡原因考虑可能有酒精误入气管、灌胃后胃急剧扩张、食管气管瘘等. 正常对照组有2只小鼠死亡, 可能与蒸馏水灌胃时操作不当或小鼠对外界环境适应不佳有关. 实验4 wk后观察到模型组小鼠精神萎靡, 体态呆板, 活动较少, 而正常小鼠(即0 wk取材未做任何处理的小鼠)和对照组小鼠均精神状态良好, 行动灵敏, 活动较多.
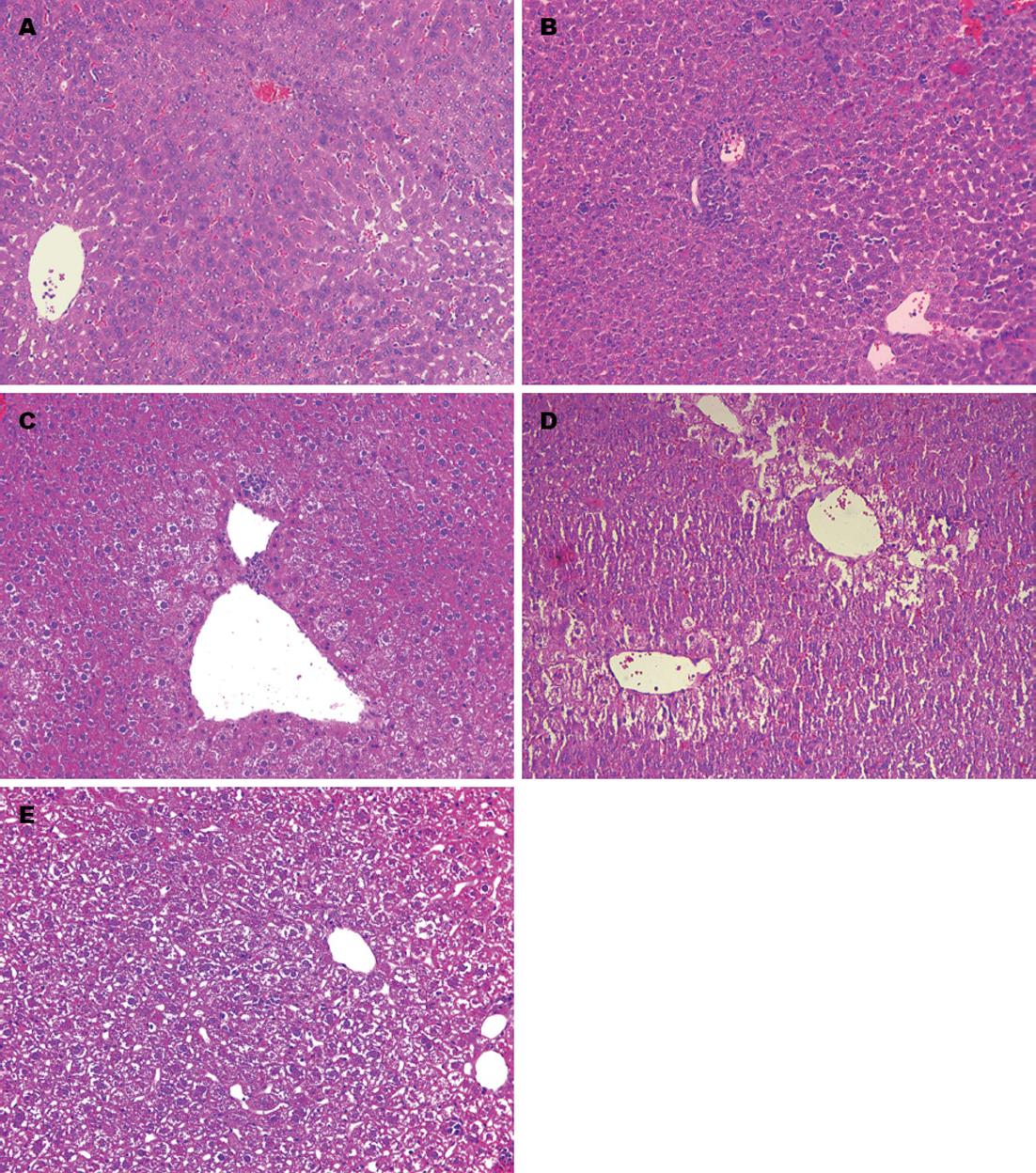
光镜下观察切片, 对照组小鼠与正常小鼠肝脏表现无明显差异(防止灌胃操作及饲养过程中可能造成的肝损伤干扰实验结果), 均表现为肝细胞形态结构正常, 肝窦和肝细胞排列整齐, 正常肝小叶极性存在. 模型组小鼠第1周肝组织表现为肝细胞的轻度水肿和炎细胞的浸润; 第2周肝细胞明显水肿, 大量的炎细胞浸润; 第3周表现为中央静脉周围的肝细胞脂肪变性, 门管区周围肝细胞水样变; 第4周表现为肝细胞排列紊乱并出现不同程度的肿胀, 弥漫性脂肪变性, 局部有肝细胞坏死(图1). 提示小鼠酒精性肝损伤模型建立成功.
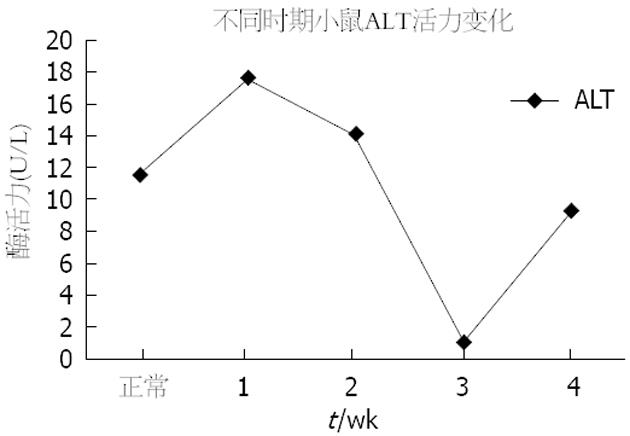
酒精连续灌胃1 wk后, 小鼠血清ALT活力较正常组明显升高; 酒精灌胃第2周, 小鼠血清ALT活力较第1周有所下降但仍高于正常; 第3周, 小鼠血清ALT活力降至最低, 第4周, 小鼠血清ALT活力接近于正常(图2).
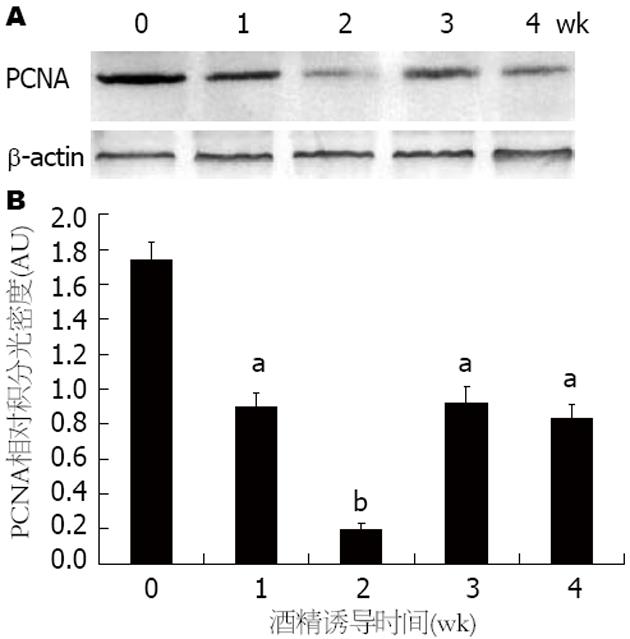
酒精性肝损伤模型组小鼠在连续酒精灌胃1 wk后, 小鼠肝脏中的PCNA的表达量相比正常组显著下降(P<0.05), 之后随时间的延长PCNA的表达量逐渐下降, 在连续酒精灌胃2 wk后, 小鼠肝脏中PCNA的表达量达到了最低值(P<0.01). 在酒精灌胃3 wk后, PCNA的表达量显著增加但仍低于正常小鼠肝脏PCNA的表达量(P<0.05). 酒精灌胃4 wk后, PCNA的表达量与第3周无差异性(图3).
PCNA是一种存在于增殖细胞内分子量为36 kDa的多肽. 他是DNA多聚酶的辅助蛋白, 在DNA复制过程中起重要作用, 其表达合成与细胞的增殖状态密切相关[4]. 此外, PCNA是一种在生物进化上非常保守的蛋白质, 几乎被发现于所有真核生物及古生菌中[5]. 因此, PCNA是一个较为理想的细胞增殖标志, 可以通过研究PCNA在酒精性肝损伤模型中的表达变化来了解肝细胞的增殖变化. 目前国内外关于酒精性肝损伤模型的造模方法主要有两种, 一种是灌胃法, 一种是腹腔注射法. 其中灌胃法更加符合人类的饮酒习惯[6]且简单、快速、易于操作而被本实验采用.
本研究结果显示, 在连续酒精灌胃1 wk后, 病理HE染色显示肝细胞轻度损伤, ALT酶活力显著上升; 连续酒精灌胃第2周病理结果显示肝细胞出现明显的水肿和大量的炎细胞浸润, ALT酶活力高于正常. 表明酒精灌胃初期肝脏损伤明显. 酒精在肝脏经乙醇脱氢酶、P4502E1和过氧化氢酶三个酶系统代谢为乙醛和乙酸[7]. 乙醛转化为乙酸的速度很慢, 导致乙醛在体内蓄积.乙醛可以使肝脏微管系统微粒蛋白分泌减少[8], 影响蛋白质转运和分泌, 蛋白性物质储留在细胞内并吸收水分, 造成肝细胞水肿、大量的炎性细胞浸润; 而小鼠肝脏中PCNA的表达量在酒精灌胃1 wk后明显下降(P<0.05), 酒精灌胃2 wk后PCNA的表达量下降至最低值(P<0.01). 提示在酒精灌胃初期, 酒精所致的肝损伤与PCNA表达量下降密切相关. 孙梦雯等[9]的研究发现酒精性肝损伤模型组小鼠肝脏中MDA水平明显高于对照组小鼠, 而SOD、GSH-Px的活性远低于正常组小鼠. 表明酒精可以诱发脂质过氧化反应并降低肝脏清除氧自由基的能力. 而当过多的活性氧簇产生超过细胞的抗氧化防御能力就会引起氧化应激[10], 导致: (1)脂质过氧化, 损害生物膜及其功能; (2)氧自由基与线粒体蛋白反应形成复合物, 抑制呼吸链中电子传递, 使线粒体呼吸链复合物活性降低, 加剧线粒体功能障碍; (3)内质网内出现未折叠或错误折叠蛋白的聚集和钙平衡紊乱, 诱发内质网应激; (4)大量的活性氧分子引起DNA链断裂、DNA位点突变、DNA双链畸变等形式的DNA损伤[11-13]. 这些都可能造成PCNA表达量的下降.
在酒精灌胃第3周, 病理HE染色显示中央静脉周围的肝细胞脂肪变性, 至第4周出现弥漫性脂肪变性, 局部有肝细胞坏死(图1). 这是因为酒精的持续刺激使SREBP1-c过表达, 启动下游固醇调节蛋白反应原件, 促使大量TG合成, 导致受损肝细胞脂肪变性[14]. 而此时ALT酶活力急剧下降, 提示肝功能有所恢复. 而且小鼠肝脏PCNA表达量与酒精灌胃第2周相比明显增加, 甚至超过酒精灌胃第1周PCNA的表达量. 表明残存的正常肝细胞开始分裂增殖. 张文娟等[15]认为轻度的肝损伤主要依靠周围成熟肝细胞分裂增殖进行修复. 表明PCNA的表达量的增加在一定程度上可以反映受损肝脏的修复. 大量研究表明, PCNA主要参与DNA损伤的修复, 在古生菌和真核生物的多种DNA修复途径中, PCNA滑动夹作为一个募集其他蛋白因子的稳定平台起重要作用[16]. 除直接修复以外, 他几乎参与了所有的DNA修复过程[17], 包括核苷酸切除修复、碱基切除修复、错配修复、双链断裂修复等[18]. 这有助于肝细胞耐受损伤而继续生存.
总之, PCNA在酒精诱导的肝损伤模型中的表达量先上升后下降, 该变化与酒精所致的肝损伤及损伤后的修复有关, 但PCNA是否通过其他途径参与酒精性肝损伤及其修复目前不太清楚, 有待深入研究.
据2010年的调查, 全球每一百万人约有7个人死于酒精过度饮用所致的肝硬化.而近年来, 居民的生活水平逐渐提高, 所面临的精神压力同时增加, 导致酒精消费量日益增长, 酒精性肝病(alcoholic liver diseases, ALD)的发病率也呈逐年增高趋势. 然而目前关于ALD的发病机制仍不十分明确.
程明亮, 教授, 博士生导师, 贵州医科大学附属医院感染科; 李树德, 副教授, 昆明医科大学基础医学院生物化学与分子生物学系; 谭宁, 副研究员, 桂林医学院科学实验中心, 广西肝损伤及修复分子医学重点实验室
ALD有效的治疗方法及预防措施是目前的研究热点, 但由于其发病机制不明确, 在一定程度上限制了该方面的研究. 所以ALD的发病机制仍是目前亟需研究的问题.
赵琼等的研究阐明增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)在药物性肝损伤中有重要作用. 在肝损伤早期, 对乙酰氨基酚主要通过抑制细胞增殖造成肝脏损害. 而在损伤后期, 肝细胞通过增殖来补偿修复损伤的肝组织.
目前大量研究表明PCNA在癌组织中的表达与癌症的恶性程度、预后密切相关, 而关于PCNA与组织损伤的研究甚少. 本文首次详细地阐述PCNA在酒精性肝损伤中的表达变化及其意义.
本研究小鼠慢性酒精性肝损伤模型建立成功, 对后续的模型复制具有指导意义. 此外, 本文通过探讨小鼠酒精性肝损伤模型中PCNA的表达意义, 为ALD发病机制的进一步研究提供了理论基础.
氧化应激: 正常情况下, 体内的氧化与抗氧化作用是保持相对平衡的. 氧化应激是指当细胞衰老或者损伤时, 这种平衡被打破而倾向氧化, 导致中性粒细胞炎性浸润, 蛋白酶分泌增加, 产生大量氧化中间产物.
本文的研究具有一定的科学意义, 讨论应该围绕结果进行, 并突出论文的创新性.
编辑: 郭鹏 电编:闫晋利
| 1. | Williams JA, Ding WX. A Mechanistic Review of Mitophagy and Its Role in Protection against Alcoholic Liver Disease. Biomolecules. 2015;5:2619-2642. [PubMed] [DOI] |
| 2. | Rehm J, Samokhvalov AV, Shield KD. Global burden of alcoholic liver diseases. J Hepatol. 2013;59:160-168. [PubMed] [DOI] |
| 5. | Strzalka W, Ziemienowicz A. Proliferating cell nuclear antigen (PCNA): a key factor in DNA replication and cell cycle regulation. Ann Bot. 2011;107:1127-1140. [PubMed] [DOI] |
| 7. | Zhu H, Jia Z, Misra H, Li YR. Oxidative stress and redox signaling mechanisms of alcoholic liver disease: updated experimental and clinical evidence. J Dig Dis. 2012;13:133-142. [PubMed] [DOI] |
| 8. | 贾 艳, 付 怡静, 刘 晓阳, 杨 国庆. 我国酒精性脂肪肝病的研究进展. 胃肠病学和肝病学杂志. 2014;23:376-379. |
| 10. | Nassir F, Ibdah JA. Role of mitochondria in alcoholic liver disease. World J Gastroenterol. 2014;20:2136-2142. [PubMed] [DOI] |
| 14. | 陈 潇迪, 王 军, 熊 吉, 牟 歌, 陶 林, 王 斌, 陈 东风. 内质网应激介导的凋亡途径在大鼠酒精性脂肪性肝病中的变化及意义. 胃肠病学和肝病学杂志. 2013;22:215-218. |
| 16. | Giroux X, MacNeill SA. A novel archaeal DNA repair factor that acts with the UvrABC system to repair mitomycin C-induced DNA damage in a PCNA-dependent manner. Mol Microbiol. 2016;99:1-14. [PubMed] [DOI] |
| 18. | Maga G, Hubscher U. Proliferating cell nuclear antigen (PCNA): a dancer with many partners. J Cell Sci. 2003;116:3051-3060. [PubMed] [DOI] |