修回日期: 2016-03-15
接受日期: 2016-03-23
在线出版日期: 2016-04-28
目的: 检测肿瘤坏死因子-α(tumor necrosis factor alpha, TNF-α)对体外培养的原代大鼠肝内胆管上皮细胞Jagged-1表达的影响以及诱导其间质-上皮转化的作用.
方法: 原代胆管上皮细胞分为对照组, TNF-α处理组(10 ng/mL), TNF-α加核转录因子-κB(nuclear factor kappa B, NF-κB)抑制剂PDTC(pyrrolidine dithiocarbamate)(50 μmol/L)处理组及PDTC单独处理组, 72 h后Western blot法检测各组细胞Jagged-1蛋白、间质细胞标记成纤维细胞特异性蛋白-1(fibroblast specific protein 1, FSP-1)、波形蛋白(Vimentin)、α-平滑肌肌动蛋白(α smooth muscle actin, α-SMA)和胆管细胞特异性标记角蛋白19片段(cytokeratin 19, CK19)的蛋白的表达, 凝胶迁移或电泳迁移率实验(EMSA)检测NF-κB蛋白结合活性. 倒置显微镜观察各组胆管细胞的形态变化, Transwell小室法检测细胞的迁移能力.
结果: TNF-α处理组胆管上皮细胞NF-κB的活性增强, Jagged-1、FSP-1、Vimentin和α-SMA蛋白的表达水平上调, CK19的表达下调, 细胞迁移能力增强, 细胞形态由鹅卵石样向梭形样转化. TNF-α+PDTC与TNF-α组相比其NF-κB活性明显减弱, Jagged-1, FSP-1, Vimentin和α-SMA蛋白水平降低, CK19表达升高, 细胞迁移能力减弱, 细胞形态向鹅卵石样转化.
结论: TNF-α可通过激活NF-κB信号上调Jagged-1蛋白表达的同时诱导大鼠胆管上皮细胞向间质细胞转化.
核心提示: 本文检测肿瘤坏死因子-α(tumor necrosis factor alpha, TNF-α)对体外培养的原代大鼠肝内胆管上皮细胞Jagged-1表达及诱导其间质-上皮转化作用的影响, 结果证实, TNF-α可能通过激活Notch通路而促进胆管上皮细胞发生上皮-间质转化.
引文著录: 李潼, 郭兵, 高杨, 于奇宏, 李锦锦, 鲜文静, 蒋帅, 郑启昌, 张勇. TNF-α激活大鼠胆管上皮细胞Jagged-1的表达并诱导其上皮-间质转化. 世界华人消化杂志 2016; 24(12): 1806-1811
Revised: March 15, 2016
Accepted: March 23, 2016
Published online: April 28, 2016
AIM: To investigate the role of tumor necrosis factor-alpha (TNF-α) in the epithelial-mesenchymal transition (EMT) process in rat cholangiocytes in vitro.
METHODS: Primary rat cholangiocytes were treated with TNF-α (10 ng/mL) alone, TNF-α plus nuclear factor kappa B (NF-κB) inhibitor PDTC (50 µmol/L), or PDTC alone for 72 h. The expression of Jagged-1, mesenchymal markers [fibroblast-specific protein-1 (FSP-1), Vimentin and α-SMA] as well as epithelial marker CK19 was detected by Western blot. NF-κB binding activity was measured by EMSA. Migration ability and morphological changes of cholangiocytes were also examined.
RESULTS: In the TNF-α alone group, the protein levels of Jagged-1, FSP-1, Vimentin and α-SMA were up-regulated compared to control cells, whereas the expression of CK19 was down-regulated. The migration ability of cholangiocytes was increased and their shape changed from stone-like to fiber-like. For the TNF-α plus PTCD group and the PTCD alone group, no significant changes in EMT markers as well as migration ability were observed compared to control cells.
CONCLUSION: TNF-α is able to increase the expression of Jagged-1 and induce EMT in rat cholangiocytes in vitro possibly through activation of NF-κB signaling.
- Citation: Li T, Guo B, Gao Y, Yu QH, Li JJ, Xian WJ, Jiang S, Zheng QC, Zhang Y. Tumor necrosis factor-alpha up-regulates expression of Jagged-1 and induces epithelial-mesenchymal transition in rat cholangiocytes in vitro. Shijie Huaren Xiaohua Zazhi 2016; 24(12): 1806-1811
- URL: https://www.wjgnet.com/1009-3079/full/v24/i12/1806.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i12.1806
上皮-间质转变(epithelial-mesenchymal transition, EMT)是指上皮细胞在特定情况下逐渐获得间质细胞生物学特点的现象[1,2], 目前认为Notch通路是调控EMT的关键信号分子之一[3-5]. 我们前期实验发现高表达Notch信号通路配体Jagged-1能诱导大鼠胆管上皮细胞发生EMT, 并参与了大鼠肝移植术后的胆管损伤过程[6]. 有研究证实肿瘤坏死因子-α(tumor necrosis factor alpha, TNF-α)能诱导肿瘤细胞发生EMT[7-9], 最新研究[10-12]发现, TNF-α可能通过上调Notch信号通路发挥其促炎作用, TNF-α是否可以通过上调Notch通路而促进细胞发生EMT还有待进一步探讨. 本实验的目的是研究TNF-α对大鼠胆管上皮细胞Jagged-1表达的影响, 观察TNF-α能否诱导胆管上皮细胞发生EMT并探讨其机制.
重组大鼠TNF-α购自美国R&D公司, PDTC购自美Sigma公司, 抗大鼠Jagged-1、FSP-1、Vimentin、CK19和α-SMA一抗购自美国Abcam公司. 辣根过氧化酶-生物素标记的二抗购自德国Merck公司. Transwell小室购自美国Corning Costar公司. DAB显色试剂盒购自武汉博士德生物技术有限公司. ECL发光试剂盒购自碧云天生物科技有限公司.
1.2.1 原代大鼠胆管上皮细胞的分离培养及分组: 原代大鼠胆管上皮细胞采用Espinoza等[5]报道的胶原酶-胰蛋白酶两步分离法并加以改进. 将分离的肝内胆管上皮细胞接种于细胞培养皿中, 并以含15%胎牛血清的α-MEM培养液进行传代培养, 第3-10代细胞用于实验. 细胞实验随机分为空白对照组、TNF-α(10 ng/mL)处理组、TNF-α(10 ng/mL)+PDTC(50 μmol/L)处理组、PDTC(50 μmol/L)处理组[13].
1.2.2 免疫细胞化学SABC法检测CK19表达: 将原代大鼠胆管上皮细胞接种于盖玻片上, 4%多聚甲醛固定后以0.3%Tritonx-100对细胞膜打孔15 min, 30%H2O2与甲醇混合浸泡60 min以灭活内源性过氧化物酶, 洗涤后以5%牛血清白蛋白封闭60 min, 加入CK19一抗(1:500), 以IgG作为对照, 4 ℃湿盒内孵育过夜, 再滴加生物素化二抗室温孵育20 min后加入SABC反应液室温孵育20 min, 洗涤后加入DAB显色及苏木素复染, 脱水, 透明, 封片.
1.2.3 凝胶迁移率实验(EMSA)检测NF-κB蛋白结合活性: 将各组细胞培养皿中加入核蛋白提取液A 200 μL, 用组织匀浆器碾磨, 冰浴振荡30 min; 加入10% NP-40 12.5 μL, 轻度振摇30 s, 4 ℃条件下2000 g离心10 min; 弃上清, 取沉淀, 加入核蛋白提取液B 100 μL, 混匀后冰浴振荡60 min; 4℃下1200 g离心10 min; 取上清液, 测定核蛋白浓度. 采用[γ-32P]ATP标记下列DNA寡核苷酸5'-AGTTGAGGGGACTTTCCCAGGC-3', 3'-TCAACTCCCCTGAAAGGGTCCG-5'(碧云天生物科技有限公司合成), 即为NF-κB测定探针. 将细胞核提取物(10 μg)与同位素标记的探针1 μL在10 μL缓冲液体系中充分结合后行7%非变性SDS-PAGE电泳. 取凝胶60 ℃烘干后放入X线片暗盒中, -80 ℃条件下曝光, 洗片后进行灰度测定, 以蛋白区带灰度值表示NF-κB活性的值.
1.2.4 Western blot检测: 细胞按上述分组经孵育72 h后, 洗涤加入蛋白裂解液提取总蛋白. 煮沸变性后按30 μg/孔上样, 经10%SDS-PAGE凝胶电泳后转移至PVDF膜, 以5%脱脂奶粉封闭60 min, 分别加入Jagged-1、FSP-1、CK19、Vimentin、α-SMA及GAPDH一抗4 ℃孵育过夜, 二抗室温孵育1 h后, ECL曝光显影.
1.2.5 细胞迁移分析: 采用Transwell小室法, 按上述分组上室内接种5×104个细胞, 下室分别加入600 μL上述分组处理液孵育72 h后, 苏木素复染, 显微镜下计数穿膜细胞.
统计学处理 应用SPSS11.0统计软件行方差分析, 数据以mean±SD表示, P<0.05认为差异有统计学意义.
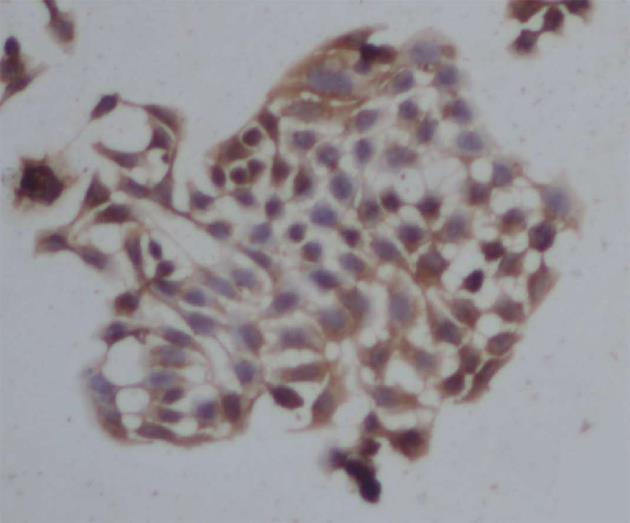
经上述方法分离所得细胞经免疫细胞化学SABC法检测CK19发现, 肝内胆管细胞呈鹅卵石样, 大小不一、胞浆较少, 胞核颜色明显加深. 细胞聚集呈群落生长. CK19检测细胞呈棕黄色样深染, 证实为胆管上皮细胞(图1).
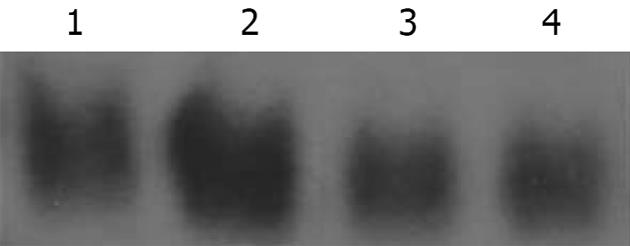
TNF-α处理组较对照组胆管上皮细胞NF-κB活性显著增高(P<0.05). TNF-α+PDTC组较TNF-α组NF-κB活性显著降低, 与对照组及PDTC组相比无明显改变(图2).
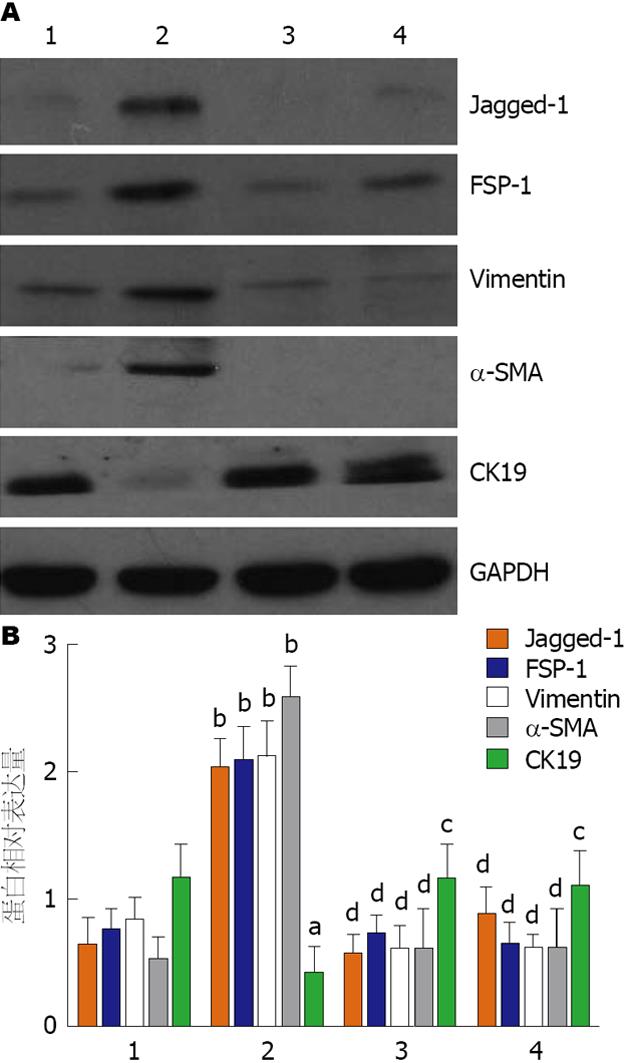
TNF-α处理组胆管上皮细胞FSP-1蛋白、Vimentin蛋白和α-SMA蛋白均显著增加(P<0.001), 而CK19蛋白则显著下降(P<0.05). TNF-α+PDTC处理组与TNF-α组相比上述蛋白的表达均无显著改变. 此外, TFN-α处理组Jagged-1蛋白表达明显增加, TNF-α+PDTC组Jagged-1表达较TNF-α组明显降低, 提示TNF-α可能通过激活NF-κB信号通路上调Jagged-1的表达(图3).
采用Transwell小室对4组细胞的检测发现, 与空白对照组(1899.26±609)、TNF-α+PDTC组(1725.70±529)及PDTC处理组(1646.44±319)比较, TNF-α处理组(18365.68±744)的肝内胆管上皮细胞其迁移运动性明显增强(P<0.01), 而前3组的组间差异无显著统计学意义.
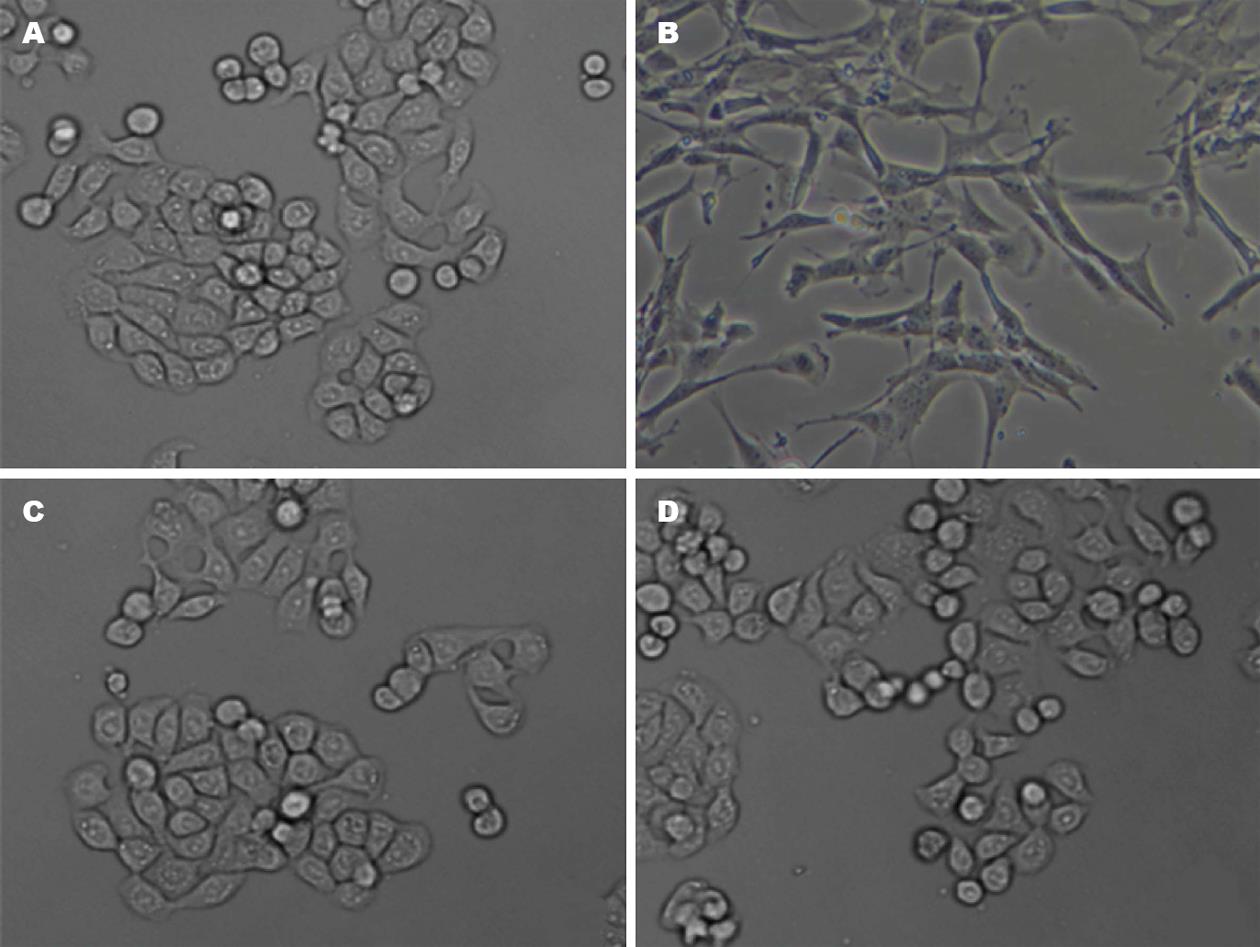
原代大鼠胆管上皮细胞细胞均呈现细胞形态呈圆形或椭圆形的"鹅卵石"形态, TNF-α处理组细胞则变为长条的梭形, 加入PDTC能逆转TNF-α诱导的上皮细胞形态向间质细胞形态转化(图4).
Notch通路对细胞的分化、增殖和细胞命运决定具有重要的作用, Notch信号的激活能够扩大并固化相邻细胞之间的分子差异, 最终决定细胞的命运[14-17]. Notch通路的配体Jagged-1不但是胚胎肝细胞向胚胎胆道细胞分化和胆管形成的关键因素, 还参与了Alagille综合征、原发性胆汁性肝硬化和原发性硬化性胆管炎等疾病的胆管病变过程[18-21]. 我们的前期研究发现, Jagged-1介导的Notch信号通路的激活与大鼠肝移植术后胆管细胞表达间质细胞标记增高密切相关, 而且转染Jagged-1能诱导体外培养的胆管细胞发生EMT. 但对调节Jagged-1表达的相关因素尚不清楚.
目前认为许多生长因子或炎症因子均可诱导EMT的发生. TNF-α是单核-巨噬细胞分泌的重要炎症因子, TNF-α在多种肝脏损伤性疾病中处于中心地位[22-24]. 研究[25,26]已证实TNF-α能导致多种肿瘤细胞发生上皮间质转化. 本实验发现TNF-α能显著上调Jagged-1在胆管上皮细胞中的表达, 同时TNF-α处理组细胞间质标记蛋白FSP-1、Vimentin和α-SMA的表达被大量激活, 而胆管细胞的上皮标记蛋白CK19则被显著抑制, 胆管细胞由圆形或椭圆转变为长条的梭形, 并获得了很强的迁移能力. 以上结果显示TNF-α能够在体外诱导胆管上皮细胞向间质细胞转化, 其机制可能是通过激活Jagged-1的表达.
NF-κB是炎症反应中重要的转录因子, 可被TNF-α等细胞因子激活, 将炎症信号转录到细胞核, 刺激下游蛋白表达增强[27-29]. 研究[30]证实NF-κB可诱导B淋巴细胞Jagged-1的表达. 本实验结果发现TNF-α处理组NF-κB的转录活性显著增强. NF-κB活化抑制剂PDTC不但抑制了TNF-α对胆管上皮细胞NF-κB的激活作用, 还抑制了其对Jagged-1及EMT相关蛋白的影响. 此外PDTC也阻止了TNF-α诱导的胆管细胞形态及侵袭能力的改变. 本结果提示NF-κB/Jagged-1通路在TNF-α诱导胆管细胞EMT发生的过程中可能发挥了重要的作用.
EMT在胚胎发育、恶性肿瘤的侵袭和转移及慢性纤维化疾病中的作用被越来越多的研究者所重视. 本研究发现TNF-α可在体外通过激活NF-κB上调胆管上皮细胞Jagged-1的表达并诱导EMT的发生. 对胆管上皮细胞间质转化的深入研究不但有利于进一步了解以胆管细胞损伤为靶点的疾病如先天性胆道闭锁、胆汁积以及肝移植小胆管消失等的发病机制, 还可以为治疗提供新的思路.
既往研究表明, 肿瘤坏死因子-α(tumor necrosis factor alpha, TNF-α)可能促进细胞发生间质-上皮化; 亦有研究表明激活Notch通路可能促进细胞发生上皮-间质转化; 最新研究认为, TNF-α可能激活Notch通路. TNF-α能否通过激活Notch通路促进细胞发生间质-上皮转化有待进一步研究.
王晓鹏, 副主任医师, 甘肃省人民医院普外科
TNF-α促进细胞发生上皮-间质转化已有大量报道, 但其机制仍未完全阐明. 本研究发现, TNF-α可通过激活Notch通路促进细胞发生上皮-间质转化.
有研究报道TNF-α可能促进细胞发生上皮-间质转化, 作者的前期研究发现上调Notch通路相关蛋白可促进细胞发生上皮-间质转化.
本次研究将TNF-α与Notch通路结合起来, 证明了TNF-α可能通过激活Notch通路促进细胞发生上皮-间质转化.
通过阐明TNF-α促进胆管上皮细胞发生上皮-间质转化的机制, 为胆管损伤相关疾病提供治疗的突破口及理论依据.
本研究通过检查TNF-α对原代大鼠肝内胆管上皮细胞Jagged-1表达的影响及其对间质-上皮转化相关蛋白的影响, 观察到TNF-α可以激活原代大鼠肝内胆管上皮细胞Jagged-1的表达并诱导其间质-上皮转化. 为TNF-α对大鼠肝内胆管上皮细胞向间质细胞转化的作用及其机制研究提供了有意义的实验依据.
编辑: 郭鹏 电编:闫晋利
| 1. | Thiery JP, Acloque H, Huang RY, Nieto MA. Epithelial-mesenchymal transitions in development and disease. Cell. 2009;139:871-890. [PubMed] [DOI] |
| 2. | Kiesslich T, Pichler M, Neureiter D. Epigenetic control of epithelial-mesenchymal-transition in human cancer. Mol Clin Oncol. 2013;1:3-11. [PubMed] [DOI] |
| 3. | Wang Z, Li Y, Kong D, Sarkar FH. The role of Notch signaling pathway in epithelial-mesenchymal transition (EMT) during development and tumor aggressiveness. Curr Drug Targets. 2010;11:745-751. [PubMed] |
| 4. | Espinoza I, Miele L. Deadly crosstalk: Notch signaling at the intersection of EMT and cancer stem cells. Cancer Lett. 2013;341:41-45. [PubMed] [DOI] |
| 5. | Espinoza I, Pochampally R, Xing F, Watabe K, Miele L. Notch signaling: targeting cancer stem cells and epithelial-to-mesenchymal transition. Onco Targets Ther. 2013;6:1249-1259. [PubMed] [DOI] |
| 6. | 刘 小卫, 郑 启昌, 李 俊, 熊 俊, 李 民, 张 勇. 大鼠肝移植术后Jagged1基因在胆管中的表达变化及意义. 华中科技大学学报(医学版). 2011;40:521-524. |
| 7. | Techasen A, Namwat N, Loilome W, Bungkanjana P, Khuntikeo N, Puapairoj A, Jearanaikoon P, Saya H, Yongvanit P. Tumor necrosis factor-α (TNF-α) stimulates the epithelial-mesenchymal transition regulator Snail in cholangiocarcinoma. Med Oncol. 2012;29:3083-3091. [PubMed] [DOI] |
| 8. | Wang H, Wang HS, Zhou BH, Li CL, Zhang F, Wang XF, Zhang G, Bu XZ, Cai SH, Du J. Epithelial-mesenchymal transition (EMT) induced by TNF-α requires AKT/GSK-3β-mediated stabilization of snail in colorectal cancer. PLoS One. 2013;8:e56664. [PubMed] [DOI] |
| 9. | Asiedu MK, Ingle JN, Behrens MD, Radisky DC, Knutson KL. TGFbeta/TNF(alpha)-mediated epithelial-mesenchymal transition generates breast cancer stem cells with a claudin-low phenotype. Cancer Res. 2011;71:4707-4719. [PubMed] [DOI] |
| 10. | Wang H, Tian Y, Wang J, Phillips KL, Binch AL, Dunn S, Cross A, Chiverton N, Zheng Z, Shapiro IM. Inflammatory cytokines induce NOTCH signaling in nucleus pulposus cells: implications in intervertebral disc degeneration. J Biol Chem. 2013;288:16761-16774. [PubMed] [DOI] |
| 11. | Fernandez L, Rodriguez S, Huang H, Chora A, Fernandes J, Mumaw C, Cruz E, Pollok K, Cristina F, Price JE. Tumor necrosis factor-alpha and endothelial cells modulate Notch signaling in the bone marrow microenvironment during inflammation. Exp Hematol. 2008;36:545-558. [PubMed] [DOI] |
| 12. | Yoshida R, Nagata M, Nakayama H, Niimori-Kita K, Hassan W, Tanaka T, Shinohara M, Ito T. The pathological significance of Notch1 in oral squamous cell carcinoma. Lab Invest. 2013;93:1068-1081. [PubMed] [DOI] |
| 13. | Hattori Y, Kasai K, Gross SS. NO suppresses while peroxynitrite sustains NF-kappaB: a paradigm to rationalize cytoprotective and cytotoxic actions attributed to NO. Cardiovasc Res. 2004;63:31-40. [PubMed] [DOI] |
| 14. | Bigas A, Espinosa L. Hematopoietic stem cells: to be or Notch to be. Blood. 2012;119:3226-3235. [PubMed] [DOI] |
| 15. | Liu J, Sato C, Cerletti M, Wagers A. Notch signaling in the regulation of stem cell self-renewal and differentiation. Curr Top Dev Biol. 2010;92:367-409. [PubMed] [DOI] |
| 16. | Xie J, Wang W, Si JW, Miao XY, Li JC, Wang YC, Wang ZR, Ma J, Zhao XC, Li Z. Notch signaling regulates CXCR4 expression and the migration of mesenchymal stem cells. Cell Immunol. 2013;281:68-75. [PubMed] [DOI] |
| 17. | Ben-Shushan E, Feldman E, Reubinoff BE. Notch signaling regulates motor neuron differentiation of human embryonic stem cells. Stem Cells. 2015;33:403-415. [PubMed] [DOI] |
| 18. | Boulter L, Govaere O, Bird TG, Radulescu S, Ramachandran P, Pellicoro A, Ridgway RA, Seo SS, Spee B, Van Rooijen N. Macrophage-derived Wnt opposes Notch signaling to specify hepatic progenitor cell fate in chronic liver disease. Nat Med. 2012;18:572-579. [PubMed] [DOI] |
| 19. | Kamath BM, Spinner NB, Rosenblum ND. Renal involvement and the role of Notch signalling in Alagille syndrome. Nat Rev Nephrol. 2013;9:409-418. [PubMed] [DOI] |
| 20. | Morell CM, Strazzabosco M. Notch signaling and new therapeutic options in liver disease. J Hepatol. 2014;60:885-890. [PubMed] [DOI] |
| 21. | Mazur PK, Riener MO, Jochum W, Kristiansen G, Weber A, Schmid RM, Siveke JT. Expression and clinicopathological significance of notch signaling and cell-fate genes in biliary tract cancer. Am J Gastroenterol. 2012;107:126-135. [PubMed] [DOI] |
| 22. | Schwabe RF, Brenner DA. Mechanisms of Liver Injury. I. TNF-alpha-induced liver injury: role of IKK, JNK, and ROS pathways. Am J Physiol Gastrointest Liver Physiol. 2006;290:G583-G589. [PubMed] [DOI] |
| 23. | Yang Y, Qiu XQ, Yu HP, Zeng XY, Bei CH. TNF-α -863 polymorphisms and the risk of hepatocellular carcinoma. Exp Ther Med. 2012;3:513-518. [PubMed] [DOI] |
| 24. | Spencer NY, Zhou W, Li Q, Zhang Y, Luo M, Yan Z, Lynch TJ, Abbott D, Banfi B, Engelhardt JF. Hepatocytes produce TNF-α following hypoxia-reoxygenation and liver ischemia-reperfusion in a NADPH oxidase- and c-Src-dependent manner. Am J Physiol Gastrointest Liver Physiol. 2013;305:G84-G94. [PubMed] [DOI] |
| 25. | Ho MY, Tang SJ, Chuang MJ, Cha TL, Li JY, Sun GH, Sun KH. TNF-α induces epithelial-mesenchymal transition of renal cell carcinoma cells via a GSK3β-dependent mechanism. Mol Cancer Res. 2012;10:1109-1119. [PubMed] [DOI] |
| 26. | Shiozaki A, Bai XH, Shen-Tu G, Moodley S, Takeshita H, Fung SY, Wang Y, Keshavjee S, Liu M. Claudin 1 mediates TNFα-induced gene expression and cell migration in human lung carcinoma cells. PLoS One. 2012;7:e38049. [PubMed] [DOI] |
| 27. | Hayden MS, Ghosh S. NF-κB, the first quarter-century: remarkable progress and outstanding questions. Genes Dev. 2012;26:203-234. [PubMed] [DOI] |
| 28. | Hoesel B, Schmid JA. The complexity of NF-κB signaling in inflammation and cancer. Mol Cancer. 2013;12:86. [PubMed] [DOI] |
| 29. | Ben-Neriah Y, Karin M. Inflammation meets cancer, with NF-κB as the matchmaker. Nat Immunol. 2011;12:715-723. [PubMed] [DOI] |