修回日期: 2016-03-28
接受日期: 2016-04-06
在线出版日期: 2016-04-28
目的: 通过观察肝再生磷酸酶3(phosphatase of regenerating liver 3, PRL-3)对胃癌SGC7901细胞迁移侵袭及RhoC表达的影响,探讨胃癌SGC7901细胞迁移侵袭的机制中PRL-3和RhoC是否位于同一信号通路.
方法: 体外培养人胃癌SGC7901细胞, 经不同浓度PRL-3抗体(1:600, 1:400, 1:200)作用后, 采用细胞划痕实验观察不同时间段(0、12、24、48 h)SGC7901细胞的迁移距离; 通过Transwell迁移侵袭实验检测不同浓度PRL-3抗体(1:600, 1:400, 1:200)作用48 h后SGC7901细胞迁移侵袭的穿膜细胞数, 并采用Real-time PCR和ELISA检测SGC7901细胞中RhoC mRNA及蛋白表达量的变化, 比较不同浓度PRL-3抗体处理后SGC7901细胞迁移侵袭的细胞数和RhoC mRNA及蛋白的表达量.
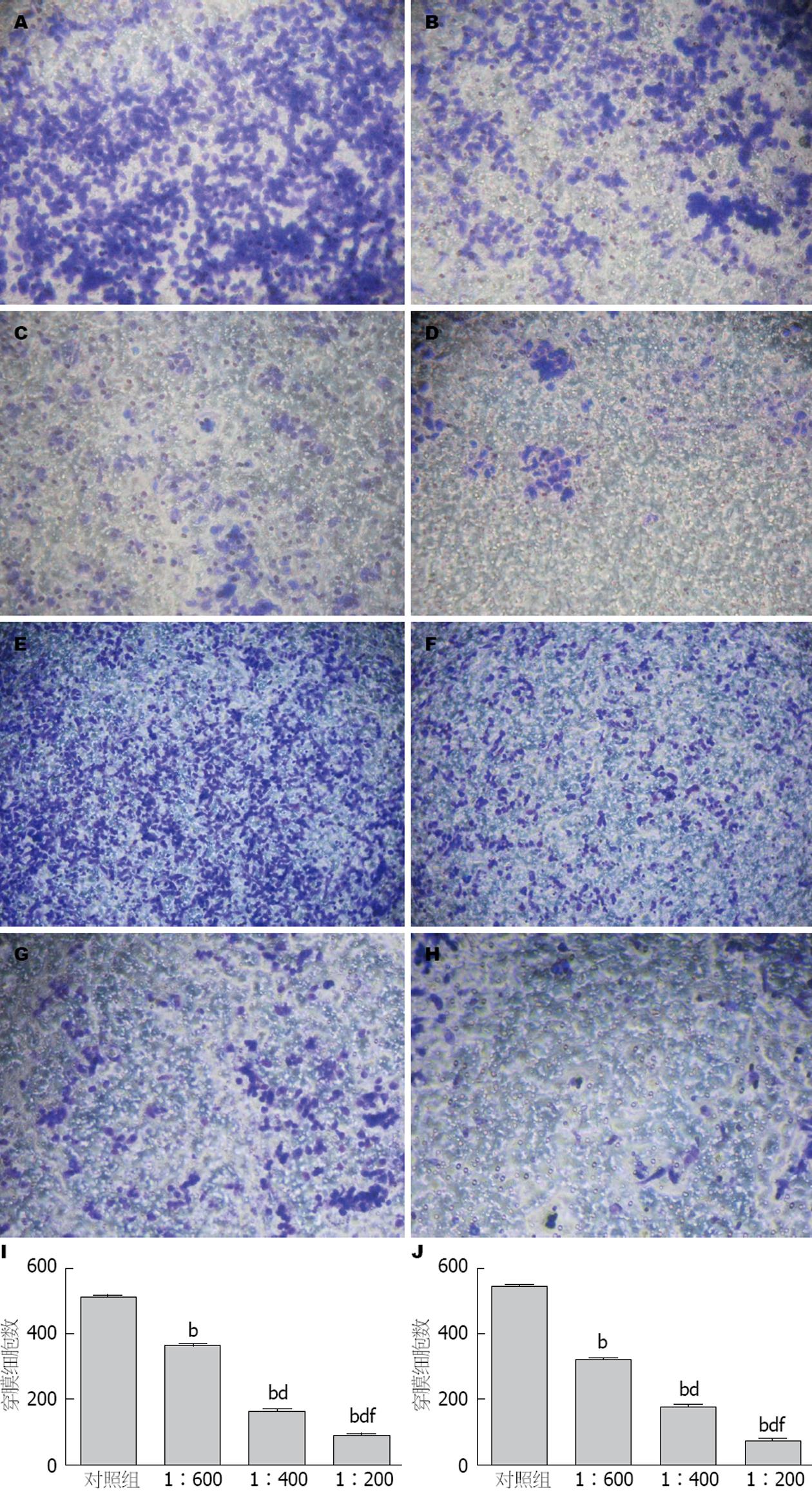
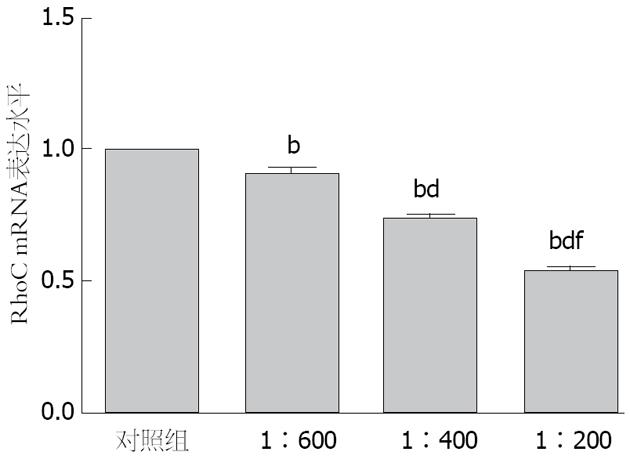
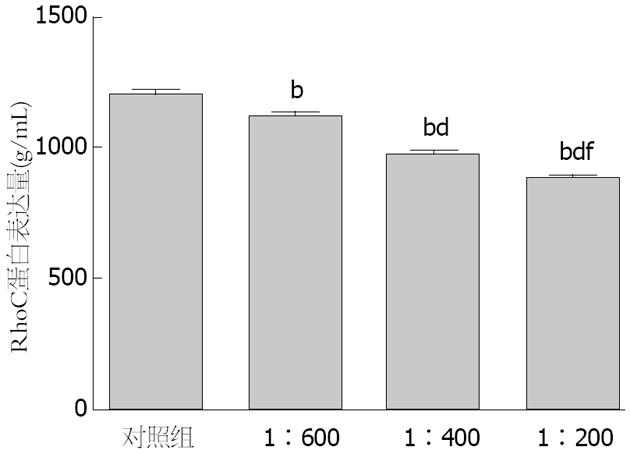
结果: 与对照组比较, 随着PRL-3抗体浓度的升高和作用时间的延长, SGC7901细胞的迁移距离逐渐减小, 在48 h, 经不同浓度PRL-3抗体(1:600, 1:400, 1:200)处理SGC7901细胞后, 其迁移和侵袭的细胞数, RhoC mRNA相对表达量和蛋白表达水平与对照组相比均明显降低(迁移SGC7901细胞数: 365.0±5.0, 165.3±5.0, 90.3±5.5 vs 512.3±4.9; 侵袭SGC7901细胞数: 321.3±6.1, 179.0±6.1, 75.7±4.0 vs 545.3±5.0; RhoC mRNA的相对表达量: 0.910±0.022, 0.742±0.018, 0.539±0.015 vs 1.000±0.000; RhoC蛋白表达量: 1130.77 g/mL±15.32 g/mL, 981.52 g/mL±14.44 g/mL, 893.03 g/mL±11.10 g/mL vs 1212.42 g/mL±18.37g/mL)(均P<0.01), 不同PRL-3抗体浓度组两两比较均有统计学意义(均P<0.01).
结论: PRL-3在体外能显著促进SGC7901细胞的迁移侵袭, 并能增强RhoC基因和蛋白的表达, 提示在SGC7901细胞迁移侵袭的机制中PRL-3和RhoC可能位于同一信号通路.
核心提示: 肝再生磷酸酶3(phosphatase of regenerating liver 3, PRL-3)不仅能促进SGC7901细胞迁移侵袭, 也具有降低其细胞内RhoC基因和蛋白的作用, 但以上两种作用并非具有直接的因果关系, PRL-3可能通过某种信号通路影响RhoC基因和蛋白的表达, 间接说明PRL-3和RhoC可能位于同一条信号通路.
引文著录: 覃宗帅, 何守搞. 肝再生磷酸酶3对SGC7901细胞迁移侵袭及RhoC表达的影响. 世界华人消化杂志 2016; 24(12): 1797-1805
Revised: March 28, 2016
Accepted: April 6, 2016
Published online: April 28, 2016
AIM: To explore whether phosphatase of regenerating liver 3 (PRL-3) and RhoC belong to the same signal pathway in the mechanism of SGC7901 cell migration and invasion by observing the influence of PRL-3 on cell migration, invasion and the expression of RhoC in SGC7901 cells.
METHODS: Human gastric cancer SGC7901 cells were cultured in vitro and treated with different concentrations of PRL-3Ab (1:600, 1:400 and 1:200), then the migration distance of SGC7901 cells was assessed at different time points (0, 12, 24, 48 h) by wound healing assay, and the migration and invasion of SGC7901 cells were examined by Transwell assay at 48 h. The expression of RhoC mRNA and protein was detected by real-time PCR and ELISA.
RESULTS: Compared with the control group, the migration distance of SGC7901 cells at 12, 24 and 48 h decreased with the increase in PRL-3Ab concentration. At 48 h, the migration and invasion of SGC7901 cells and the expression of RhoC mRNA and protein in SGC7901 cells treated with different concentrations of PRL-3Ab (1:600, 1:400 and 1:200) were significantly lower than those in the control group (migration: 365.0 ± 5.0, 165.3 ± 5.0, 90.3 ± 5.5 vs 512.3 ± 4.9; invasion: 321.3 ± 6.1, 179.0 ± 6.1, 75.7 ± 4.0 vs 545.3 ± 5.0; expression of RhoC mRNA: 0.910 ± 0.022, 0.742 ± 0.018, 0.539 ± 0.015 vs 1.000 ± 0.000; expression of RhoC protein: 1130.77 g/mL ± 15.32 g/mL, 981.52 g/mL ± 14.44 g/mL, 893.03 g/mL ± 11.10 g/mL vs 1212.42 g/mL ± 18.37 g/mL; P < 0.01 for all).
CONCLUSION: PRL-3 can promote SGC7901 cell migration and invasion and raise the expression of RhoC, which suggests that PRL-3 and RhoC may belong to the same signal pathway in the mechanism of SGC7901 cell migration and invasion.
- Citation: Qin ZS, He SG. Influence of phosphatase of regenerating liver 3 on cell migration, invasion and expression of RhoC in SGC7901 cells. Shijie Huaren Xiaohua Zazhi 2016; 24(12): 1797-1805
- URL: https://www.wjgnet.com/1009-3079/full/v24/i12/1797.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i12.1797
胃癌是全世界癌症死亡的第三大原因, 仅次于肺癌和肝癌[1], 其发病率随着年龄的增加而显著升高, 并且已逐年呈现年轻化趋势, 目前对胃癌迁移侵袭的作用机制尚不完全清楚, 因此需要对此进行深入研究. 近年研究[2,3]发现, 肝再生磷酸酶3(phosphatase of regenerating liver 3, PRL-3)和RhoC在胃癌细胞迁移侵袭的部位高表达, 而且均能促进胃癌细胞的迁移侵袭. 在PRL-3促进胃癌细胞迁移侵袭的作用机制中PRL-3和RhoC是否位于同一信号通路, 目前鲜有报道, 本研究采用不同浓度的PRL-3抗体作用于人胃癌细胞株SGC-7901, 通过细胞划痕实验和Transwell观察PRL-3抗体对肿瘤细胞迁移侵袭的抑制作用, 并检测其对RhoC基因和蛋白的影响, 为进一步揭示PRL-3促进胃癌细胞迁移侵袭的作用机制提供理论依据.
SGC7901细胞购自中国科学院上海细胞库; 改良型RPMI 1640培养基购自武汉博士德生物工程有限公司; 标准胎牛血清为海克隆生物化学制品(北京)有限公司产品; 鼠抗人PRL-3多克隆抗体为上海生工生物工程有限公司产品; RNAiso Plus、反转录试剂盒、PCR试剂盒均为TaKaRa产品; ELISA试剂盒为武汉华美生物工程有限公司产品.
1.2.1 细胞培养: 将SGC7901培养于含10%胎牛血清的RPMI 1640培养液, 37 ℃、50 mL/L CO2饱和湿度细胞培养箱内培养.
1.2.2 细胞划痕实验: 在6孔板背面用Marker通过孔的直径画标记线, 将生长状态良好的SGC7901细胞接种于6孔板, 待细胞贴壁率达100%时, 用10 µL Tip头垂直于标记线划痕, PBS液冲洗3次; 第1孔加入含1:600抗人PRL-3抗体的2%血清培养液, 第2孔加入含1:400抗人PRL-3抗体的2%血清培养液, 第3孔加入含1:200抗人PRL-3抗体的2%血清培养液, 第4孔加入不含抗体的2%血清培养液作对照. 分别于0、12、24、48 h照相.
1.2.3 细胞迁移和侵袭能力检测: Transwell小室细胞迁移检测, 上室中分别加入200 µL含1:200、1:400、1:600抗人PRL-3抗体的无血清RPMI 1640培养基和不含抗体的无血清RPMI 1640培养基, 分别接种细胞, 细胞数为2.5×105个, 下室加入750 µL含20%胎牛血清RPMI 1640培养基, 37 ℃、50 mL/L CO2孵箱中培养48 h后吸尽培养基, PBS清洗后, 甲醇室温固定15 min, 用棉签轻擦掉微孔膜上表面的细胞, 结晶紫染色30 min, 干燥, 取下微孔膜, 置载玻片上, 镜下观察. 细胞侵袭能力的测定用预冷的无血清培养基以1:8稀释Matrigel加入上室100 µL, 在室温下放置2 h. 使用前用培养基重新水化并吸净, 其他与迁移实验相同, 培养48 h后观察结果.
1.2.4 Real-time PCR检测RhoC mRNA的表达: 将生长状态良好的SGC7901细胞接种于6孔板中, 加入不同浓度(同前)人PRL-3抗体的无血清RPMI 1640培养基和不含抗体的无血清RPMI 1640培养基, 培养48 h后用RNAiso Plus提取总RNA, 使用RT- PCR试剂盒逆录得到cDNA, 随后使用SYBR Premix Ex Taq Ⅱ(Tli RNaseH Plus)(2×)试剂盒扩增RhoC和GAPDF基因, 定量分析RhoC表达水平. RhoC引物如下: 上游引物5' -CTGCAGCCTGGGAACTTCA-3', 下游引物5'-GTCCGCAATATAGTTCTCAAAGACA-3'.GAPDH引物如下: 上游引物5'-GCACCGTCAAGGCTGAGAAC-3', 下游引物5'-TGGTGAAGACGCCAGTGGA-3'. 反应条件: 95 ℃ 30 s预变性后, 95 ℃ 5 s, 59 ℃ 34 s, 40个循环, 最后55 ℃ 30 s, 81个循环; 结果分析处理采用相对定量法, mRNA的相对表达量 = 2-△△Ct[△△Ct = △Ct(检测样品)-△Ct(对照样品)].
1.2.5 ELISA检测RhoC蛋白的表达: 加入不同浓度(同前)人PRL-3抗体的无血清RPMI 1640培养基和不含抗体的无血清RPMI 1640培养基进行培养, 将细胞反复冻融破坏细胞膜, 稀释浓度为106/mL, 离心取上清液, 准备试剂, 加入准备好的样品和标准品, 37 ℃反应30 min, 洗涤5次, 加入酶标试剂, 37 ℃反应30 min, 洗板5次, 加入显色液A、B, 37 ℃显色10 min, 加入终止液, 15 min之内用酶标仪在450 nm波长测量各孔的光密度(A)值, 使用Curve Expert 1.4软件绘制标准曲线, 将样本的A值代入方程式, 计算出样本浓度.
统计学处理 实验数据的收集、整理按照完全随机对照设计的原则, 所有数据均以mean±SD表示, 同一处理因素多组间的比较采用单因素方差分析, 采用SPSS16.0软件进行处理, P<0.05为差异有统计学意义.
结果显示在各个时间点, 随着PRL-3抗体浓度逐渐增加, 伤口愈合速度逐渐降低, 提示细胞的迁移能力逐渐降低(图1).
迁移实验阴性对照组, 浓度为1:600、1:400、1:200的PRL-3抗体穿膜细胞数的具体数目见图2I, J. 单因素方差分析结果提示, 细胞迁移实验中不同浓度PRL-3抗体组与阴性对照组比较, 差异均有统计学意义(均P<0.01), 不同浓度PRL-3抗体组的穿膜细胞数差异有统计学意义(F = 4201.273, P<0.001); 细胞侵袭实验中不同浓度PRL-3抗体组与阴性对照组比较, 差异均有统计学意义(均P<0.01), 不同浓度PRL-3抗体组之间穿膜细胞数差异有统计学意义(F = 4278.031, P<0.001)(图2).
RhoC mRNA的相对表达量随着PRL-3抗体浓度的升高而逐渐降低, 单因素方差分析提示, 不同PRL-3抗体浓度组与阴性对照组相比, 差异均具有统计学意义(均P<0.01), 不同抗体浓度组之间RhoC mRNA的相对表达量差异有统计学意义(F = 295.589, P<0.001)(图3).
RhoC的蛋白表达量随着PRL-3抗体浓度的升高而逐渐降低,单因素方差分析提示, 不同浓度PRL-3抗体组与阴性对照组相比, 差异均具有统计学意义(均P<0.01), 不同抗体浓度组之间RhoC蛋白表达量的差异有统计学意义(F = 275.075, P<0.001)(图4).
PRL-3属于蛋白酪氨酸磷酸酶(protein tyrosine phoshatases, PTPs)家族, 该家族可以通过酪氨酸的去磷酸化和磷酸化调节细胞的生长、分化、细胞周期、细胞间信息传递和其他活动[4]. PRL-3由173个氨基酸组成, 以单体形式存在, 结构复杂[5], 其活性中心由Cysl04、Arg110和他们之间的几个疏水性氨基酸组成的P-环构成. 72位的Asp所在的噜噗环结构独立于蛋白的其他结构域, 在PRL-3和底物结合时可以发生空间结构变化, 对于PRL-3磷酸酶活性的发挥具有重要作用[6].
自从Saha等[7]第一次发现PRL-3与结肠癌的迁移侵袭具有相关性以后, Miskad等[8]用免疫组织化学法研究发现, 胃癌组织中有68%表达PRL-3, 其中有转移的胃癌组织PRL-3的表达为81.5%, 明显高于未转移的胃癌组织. 在转移的淋巴结中表达阳性率为92.6%. 有腹膜转移的在原发灶和转移灶阳性率分别为68.7%和92.1%, 统计学分析显示, PRL-3的表达与肿瘤是否有淋巴管浸润、淋巴结转移及肿瘤分期有关, 而与组织学类型、肿瘤大小、浸润程度无关. 以上研究说明胃癌中PRL-3呈现高表达, 在有转移的胃癌中呈现更高表达, 在转移的淋巴结、腹膜和远端转移灶中表达最高. Cai等[9]在SGC7901胃癌细胞的研究中发现, PRL-3能促进SGC7901细胞增殖、迁移和侵袭, 推测PRL-3在胃癌的发生发展中起到关键作用. 随后宋倩等[10]发现PRL-3表达增高, 能上调ABCBl和ABCG2的表达, 并促进胃癌细胞BGC823的增殖. Li等[11]通过甲基化沉默miR-425后, 胃癌细胞的迁移侵袭能力明显增强, miR-425已被证实能抑制PRL-3的表达, 采用Real-PCR和Western blot检测, 发现PRL-3 mRNA和蛋白表达水平也明显升高, 说明PRL-3可以促进胃癌细胞的迁移侵袭下. Matsukawa等[12]发现通过特异性siRNA干扰PRL-3的表达后, 稳定转染13株胃癌细胞系, 选取PRL-3 mRNA表达最高的胃癌SH101-P4细胞, 发现其迁移侵袭的能力明显下降, 并将胃癌SH101-P4细胞种植到体外的脾脏中, 发现其肝脏转移以及脾脏原位肿瘤的体积明显下降, 这些研究说明PRL-3在胃癌的发生发展和转移侵袭中有重要意义,研究陆续发现PRL-3的表达与卵巢癌[13]、乳腺癌[14]和黑素瘤[15]等恶性肿瘤的发生发展具有相关性.
蒋蒙蒙等[16]通过构建miR495和miR551a的真核表达载体, 稳定转染胃癌SGC7901细胞后, 发现PRL-3mRNA和蛋白表达明显降低, 随后许牧等[17]通过建立胃癌裸鼠模型, 接种稳定转染miR495和miR551a的SGC7901细胞, 结果提示胃癌细胞体内迁移侵袭能力明显下降. Guo等[18]通过建立动物模型, 发现表达PRL-3的卵巢癌细胞的迁移侵袭能被PRL-3特异性抗体抑制, 张平等[19]研究提示肺癌A549细胞中PRL-3的功能能被特异性PRL-3抗体阻断, 进而减弱PRL-3促进肺癌细胞迁移侵袭的能力. 本实验从PRL-3的蛋白水平研究, 通过PRL-3抗体阻断PRL-3的功能后, SGC7901细胞的迁移侵袭能力随着PRL-3抗体浓度增加而逐渐降低, 提示PRL-3具有促进胃癌细胞迁移侵袭的能力, 这与前人研究基本一致.
同时, 相关研究提示PRL-3在细胞中所在位置与异戊二烯化有关, 当酶的C-末端被异戊二烯化时, 他位于胞质膜, 反之则处于核内. 同时, PRL-3在大多数正常细胞中定位于细胞核内, 但在癌细胞中, PRL-3则迁移至细胞质内或细胞膜上异戊二烯化, 从而激活下游信号通路造成细胞突出、皱缩乃至出现沫空泡样的延伸, 最终促进细胞的迁移和侵袭[20].
因此, 为揭示PRL-3促进癌细胞迁移侵袭的信号通路及作用机制, 前人做了大量的研究, 目前的研究表明PRL-3促进细胞迁移侵袭主要有5条途径: (1)通过调控Rho GTPase家族的重要成员RhoA和RhoC的活性促进细胞的迁移侵袭[21]; (2)通过下调Csk促进Src活化促进细胞的侵袭[22]; (3)通过PTEN-PI3K通路促进细胞的迁移侵袭[23,24]; (4)通过负调节肿瘤抑制基因p53[25]促进细胞的迁移侵袭; (5)通过上调pERK的表达和活性促进肿瘤细胞的迁移侵袭[26].
Pryczynicz等[27]研究发现表明PRL-3和E-cadherin与胃癌细胞的迁移侵袭具有相关性,间接表明PRL-3有可能通过PTEN-PI3K通路促进胃癌细胞的迁移侵袭. Fiordalisi等[28]研究结果提示PRL-3可能通过调控RhoC活性促进人结肠癌SW480细胞的迁移侵袭, 然后建立PRL-3、Src和RhoC信号通路模型, 发现PRL-3需要Src家族的激活才能促进SW480细胞的迁移侵袭以及调控RhoC的活性. Ming等[29]研究发现, 在肺癌中PRL-3通过激活RhoC活性促进肺癌细胞的远处转移.
RhoC是Rho基因家族的重要成员, 是Ras的同源类似物. 研究表明Rho GTPase的活性增强促进肿瘤细胞的增殖、迁移和侵袭[30], RhoC的最重要的功能是通过调节与细胞骨架生成相关蛋白的磷酸化, 使肌动蛋白丝和肌球蛋白相互作用, 引发收缩性, 最终促进肿瘤细胞的运动和迁移[31].
近几年关于RhoC促进胃癌迁移侵袭作用机制的研究相继增多. Zhou等[32]在体内、体外实验通过miR-493抑制胃癌细胞的迁移侵袭能力, 同时使用qRT-PCR和Western blot方法检测RhoC mRNA和蛋白, 发现RhoC的表达随着胃癌细胞的迁移侵袭能力降低而降低, 说明RhoC具有促进胃癌细胞迁移侵袭的能力. Wu等[33]通过病毒性特异性质粒和DNA编码干扰胃癌细胞RhoC和IQGAP1的表达, MTT法和溴-脱氧尿嘧啶掺入法分析RhoC表达和IQGAP1结构改变对胃癌细胞增殖的影响, 使用Western blot法检测IQGAP1和RhoC蛋白, 免疫荧光和免疫共沉检测RhoC和IQGAP1之间的关系和在细胞中的定位. 结果表明, RhoC、IQGAP1、IQGAP1的C-末端能明显促进胃癌细胞的迁移侵袭, 并增强细胞周期蛋白E和细胞周期蛋白D1的表达, 相比之下, 被病毒性特异性质粒和DNA编码干扰IQGAP1或RhoC表达的胃癌细胞, 其增殖能力明显下降, IQGAP1表达降低阻断了RhoC的表达, 而沉默RhoC的表达, IQGAP1表达和胃癌细胞增殖无明显变化. 免疫荧光和免疫共沉分析提示RhoC和IQGAP1可能处于同一信号通路.
以上研究表明, PRL-3和RhoC均参与胃癌细胞的迁移侵袭, 但二者在胃癌细胞迁移侵袭的过程中是否具有关联性, 本研究通过不同浓度的PRL-3抗体作用于胃癌SGC7901细胞后, 发现RhoC mRNA和蛋白表达量随着PRL-3抗体浓度的增加呈逐渐下降趋势, 说明PRL-3和RhoC在胃癌SGC7901细胞中可能具有相关性.
总之, PRL-3不仅能促进SGC7901细胞迁移侵袭, 也具有降低其细胞内RhoC基因和蛋白的作用, 但以上两种作用并非具有直接的因果关系, PRL-3可能通过某种信号通路影响RhoC基因和蛋白的表达, 间接说明PRL-3和RhoC可能位于同一条信号通路, 而且PRL-3与RhoC都具有促进胃癌细胞迁移侵袭的能力, 但PRL-3是否通过调控RhoC活性促进胃癌细胞迁移侵袭还有待研究. 目前对PRL-3促进胃癌迁移侵袭的作用机制及其对RhoC的影响途径尚不十分清楚, 但可以预测, 随着研究的不断深入, PRL-3与RhoC在胃癌细胞迁移侵袭中的相互关系及作用机制将逐步被证实, 并为研制抗胃癌辅助药物提供分子机制的支持.
胃癌是全世界癌症死亡的第三大原因, 仅次于肺癌和肝癌, 肝再生磷酸酶3(phosphatase of regenerating liver 3, PRL-3)和RhoC在胃癌的发生、发展中均起到重要作用, 深入探究二者之间的关系将为进一步揭示PRL-3促进胃癌迁移侵袭的具体作用机制提供理论依据.
赵春玲, 副教授, 潍坊医学院细胞生物学教研室
Fiordalisi等研究结果提示PRL-3可能通过调控RhoC活性促进结肠癌SW480细胞的迁移侵袭, Ming等研究发现, 在肺癌中PRL-3通过激活RhoC活性促进肺癌细胞的远处转移.
PRL-3促进胃癌细胞迁移侵袭的作用机制中PRL-3和RhoC是否位于同一信号通路,目前鲜有报道, 本研究为进一步揭示PRL-3促进胃癌细胞迁移侵袭的作用机制提供理论依据.
本研究显示在胃癌细胞中PRL-3具有调控RhoC表达的作用, 为研制抗胃癌辅助药物提供分子机制的支持.
IQGAP1: 是一种Ras鸟苷三磷酸酶活化蛋白, 因其含有类似于Ras GAPs催化域的广泛序列和位于N端的4个可与钙调蛋白相互作用的IQ模体而被命名. 研究表明, IQGAP1通过多种转导通路在肝癌、胃癌、结肠癌等多种肿瘤的发生及转移中发挥了显著的促进作用, 被认为是一种致癌基因.
本文选题较新颖, 研究结果对后续的深入研究有重要指导意义.
编辑: 郭鹏 电编:闫晋利
| 1. | Ferlay J, Soerjomataram I, Dikshit R, Eser S, Mathers C, Rebelo M, Parkin DM, Forman D, Bray F. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. Int J Cancer. 2015;136:E359-E386. [PubMed] [DOI] |
| 2. | Xing X, Lian S, Hu Y, Li Z, Zhang L, Wen X, Du H, Jia Y, Zheng Z, Meng L. Phosphatase of regenerating liver-3 (PRL-3) is associated with metastasis and poor prognosis in gastric carcinoma. J Transl Med. 2013;11:309. [PubMed] [DOI] |
| 3. | Liu N, Zhang G, Bi F, Pan Y, Xue Y, Shi Y, Yao L, Zhao L, Zheng Y, Fan D. RhoC is essential for the metastasis of gastric cancer. J Mol Med (Berl). 2007;85:1149-1156. [PubMed] |
| 4. | Zhang ZY, Dodd GT, Tiganis T. Protein Tyrosine Phosphatases in Hypothalamic Insulin and Leptin Signaling. Trends Pharmacol Sci. 2015;36:661-674. [PubMed] [DOI] |
| 5. | Guzińska-Ustymowicz K, Pryczynicz A. PRL-3, an emerging marker of carcinogenesis, is strongly associated with poor prognosis. Anticancer Agents Med Chem. 2011;11:99-108. [PubMed] |
| 6. | Jeong KW, Kang DI, Lee E, Shin A, Jin B, Park YG, Lee CK, Kim EH, Jeon YH, Kim EE. Structure and backbone dynamics of vanadate-bound PRL-3: comparison of 15N nuclear magnetic resonance relaxation profiles of free and vanadate-bound PRL-3. Biochemistry. 2014;53:4814-4825. [PubMed] [DOI] |
| 7. | Saha S, Bardelli A, Buckhaults P, Velculescu VE, Rago C, St Croix B, Romans KE, Choti MA, Lengauer C, Kinzler KW. A phosphatase associated with metastasis of colorectal cancer. Science. 2001;294:1343-1346. [PubMed] |
| 8. | Miskad UA, Semba S, Kato H, Yokozaki H. Expression of PRL-3 phosphatase in human gastric carcinomas: close correlation with invasion and metastasis. Pathobiology. 2004;71:176-184. [PubMed] |
| 9. | Cai SR, Wang Z, Chen CQ, Wu WH, He YL, Zhan WH, Zhang CH, Cui J, Wu H. Role of silencing phosphatase of regenerationg liver-3 expression by microRNA interference in the growth of gastric cancer. Chin Med J (Engl). 2008;121:2534-2538. [PubMed] |
| 10. | 宋 倩, 孟 麟, 曲 立科, 廉 沈沂, 寿 成超. 酪氨酸磷酸酶PRL-3增加人胃癌细胞BGC823的SP细胞比例并提高其对化疗药物的耐受性. 中国生物化学与分子生物学报. 2013;29:257-263. |
| 11. | Li Z, Zhang G, Li D, Jie Z, Chen H, Xiong J, Liu Y, Cao Y, Jiang M, Le Z. Methylation-associated silencing of miR-495 inhibit the migration and invasion of human gastric cancer cells by directly targeting PRL-3. Biochem Biophys Res Commun. 2015;456:344-350. [PubMed] [DOI] |
| 12. | Matsukawa Y, Semba S, Kato H, Koma Y, Yanagihara K, Yokozaki H. Constitutive suppression of PRL-3 inhibits invasion and proliferation of gastric cancer cell in vitro and in vivo. Pathobiology. 2010;77:155-162. [PubMed] [DOI] |
| 13. | Liu H, Al-aidaroos AQ, Wang H, Guo K, Li J, Zhang HF, Zeng Q. PRL-3 suppresses c-Fos and integrin α2 expression in ovarian cancer cells. BMC Cancer. 2013;13:80. [PubMed] [DOI] |
| 14. | Lv J, Liu C, Huang H, Meng L, Jiang B, Cao Y, Zhou Z, She T, Qu L, Wei Song S. Suppression of breast tumor growth by DNA vaccination against phosphatase of regenerating liver 3. Gene Ther. 2013;20:834-845. [PubMed] [DOI] |
| 15. | Fang XY, Song R, Chen W, Yang YY, Gu YH, Shu YQ, Wu XD, Wu XF, Sun Y, Shen Y. PRL-3 Promotes the Malignant Progression of Melanoma via Triggering Dephosphorylation and Cytoplasmic Localization of NHERF1. J Invest Dermatol. 2015;135:2273-2282. [PubMed] [DOI] |
| 16. | 蒋 蒙蒙, 曹 毅, 李 正荣, 揭 志刚. miR495、miR551a靶向干扰SGC7901细胞PRL-3基因的表达. 世界华人消化杂志. 2012;20:3361-3365. [DOI] |
| 17. | 许 牧, 曹 毅, 蒋 蒙蒙, 李 正荣, 揭 志刚. miR495、miR551a靶向干扰PRL-3表达抑制胃癌腹膜转移. 世界华人消化杂志. 2013;21:1693-1700. [DOI] |
| 18. | Guo K, Tang JP, Tan CP, Wang H, Zeng Q. Monoclonal antibodies target intracellular PRL phosphatases to inhibit cancer metastases in mice. Cancer Biol Ther. 2008;7:750-757. [PubMed] |
| 20. | Al-Aidaroos AQ, Zeng Q. PRL-3 phosphatase and cancer metastasis. J Cell Biochem. 2010;111:1087-1098. [PubMed] [DOI] |
| 21. | Fiordalisi JJ, Keller PJ, Cox AD. PRL tyrosine phosphatases regulate rho family GTPases to promote invasion and motility. Cancer Res. 2006;66:3153-3161. [PubMed] |
| 22. | Liang F, Liang J, Wang WQ, Sun JP, Udho E, Zhang ZY. PRL3 promotes cell invasion and proliferation by down-regulation of Csk leading to Src activation. J Biol Chem. 2007;282:5413-5419. [PubMed] |
| 23. | Wang H, Quah SY, Dong JM, Manser E, Tang JP, Zeng Q. PRL-3 down-regulates PTEN expression and signals through PI3K to promote epithelial-mesenchymal transition. Cancer Res. 2007;67:2922-2926. [PubMed] |
| 25. | Min SH, Kim DM, Heo YS, Kim HM, Kim IC, Yoo OJ. Downregulation of p53 by phosphatase of regenerating liver 3 is mediated by MDM2 and PIRH2. Life Sci. 2010;86:66-72. [PubMed] [DOI] |
| 26. | Ming J, Jiang Y, Jiang G, Zheng H. Phosphatase of regenerating liver-3 induces angiogenesis by increasing extracellular signal-regulated kinase phosphorylation in endometrial adenocarcinoma. Pathobiology. 2014;81:1-7. [PubMed] [DOI] |
| 27. | Pryczynicz A, Guzińska-Ustymowicz K, Niewiarowska K, Cepowicz D, Kemona A. PRL-3 and E-cadherin show mutual interactions and participate in lymph node metastasis formation in gastric cancer. Tumour Biol. 2014;35:6587-6592. [PubMed] [DOI] |
| 28. | Fiordalisi JJ, Dewar BJ, Graves LM, Madigan JP, Cox AD. Src-mediated phosphorylation of the tyrosine phosphatase PRL-3 is required for PRL-3 promotion of Rho activation, motility and invasion. PLoS One. 2013;8:e64309. [PubMed] [DOI] |
| 29. | Ming J, Liu N, Gu Y, Qiu X, Wang EH. PRL-3 facilitates angiogenesis and metastasis by increasing ERK phosphorylation and up-regulating the levels and activities of Rho-A/C in lung cancer. Pathology. 2009;41:118-126. [PubMed] [DOI] |
| 30. | Tumur Z, Katebzadeh S, Guerra C, Bhushan L, Alkam T, Henson BS. RhoC mediates epidermal growth factor-stimulated migration and invasion in head and neck squamous cell carcinoma. Neoplasia. 2015;17:141-151. [PubMed] [DOI] |
| 31. | Kawata H, Kamiakito T, Omoto Y, Miyazaki C, Hozumi Y, Tanaka A. RhoC upregulation is correlated with reduced E-cadherin in human breast cancer specimens after chemotherapy and in human breast cancer MCF-7 cells. Horm Cancer. 2014;5:414-423. [PubMed] [DOI] |
| 32. | Zhou W, Zhang C, Jiang H, Zhang Z, Xie L, He X. MiR-493 suppresses the proliferation and invasion of gastric cancer cells by targeting RhoC. Iran J Basic Med Sci. 2015;18:1027-1033. [PubMed] |