修回日期: 2016-02-28
接受日期: 2016-03-08
在线出版日期: 2016-04-18
目的: 探讨胰高血糖素样肽-1(glucagon-like peptide-1, GLP-1)受体激动剂艾塞那肽(exenatide, EXE)对肝细胞脂肪沉积作用及机制.
方法: 采用棕榈酸(palmitic acid, PA)诱导HepG2细胞沉积模型, 将不同剂量的EXE(25-100 nmoL/L)与PA(500 μmoL/L)共同孵育24 h. 采用油红O染色及细胞内甘油三酯(triglyceride, TG)含量检测观察脂肪沉积程度; 实时定量PCR检测(real-time quantitative PCR, qRT-PCR)脂肪酸合酶(fatty acid synthase, FAS)以及肿瘤坏死因子-α(tumor necrosis factor α, TNF-α)、白介素-6(interleukin-6, IL-6)的表达; Western blot检测p-腺苷酸激活的蛋白激酶(AMP-activated protein kinase, AMPK)及AMPK表达. 我们还采用AMPK抑制剂对调控AMPK在EXE抑制脂肪沉积及炎症反应中的作用进一步的验证.
结果: PA显著升高HepG2细胞中的TG及油红O含量, 增加FAS的表达, 与对照组比较有统计学差异(均P<0.05). EXE能剂量依赖性抑制PA诱导的TG及油红O含量升高及FAS基因激活, 与PA组比较有统计学差异(均P<0.05). PA处理组TNF-α、IL-6的表达较对照组显著升高, 与对照组比较有统计学差异(均P<0.05). EXE能剂量依赖性抑制PA诱导TNF-α、IL-6的表达升高, 与PA组比较有统计学差异(均P<0.05). AMPK抑制剂能显著降低EXE对AMPK的激活作用, 还显著降低了EXE对PA诱导脂肪沉积及FAS激动的抑制作用, 与EXE单独作用组比较有统计学差异(均P<0.05). 此外, AMPK抑制剂能显著降低EXE对PA诱导TNF-α、IL-6激活的抑制作用, 与EXE单独作用组比较差异有统计学意义(均P<0.05).
结论: EXE可能通过激活AMPK减少脂肪酸诱导肝细胞脂肪沉积及炎症反应.
核心提示: 本文探索了胰高血糖素样肽-1(glucagon-like peptide-1, GLP-1)激动剂治疗非酒精性脂肪性肝病的机制, 结果显示GLP-1激动剂艾塞那肽(exenatide, EXE)通过激活腺苷酸激活的蛋白激酶(AMP-activated protein kinase)抑制脂肪酸诱导的肝细胞脂肪沉积及炎症反应, 为EXE治疗非酒精性脂肪肝病的临床应用提供了实验依据.
引文著录: 郭南京, 李津, 朱雨霏, 郭丽蓉, 陈庆福, 黄滨. 艾塞那肽通过激活AMPK抑制脂肪酸诱导肝细胞脂肪沉积及炎症反应. 世界华人消化杂志 2016; 24(11): 1649-1657
Revised: February 28, 2016
Accepted: March 8, 2016
Published online: April 18, 2016
AIM: To detect the effect of glucagon-like peptide-1 (GLP-1) agonist exenatide (EXE) on fat deposition in liver cells and explore the underlying mechanism.
METHODS: A HepG2 cell deposition model was induced with palmitic acid (PA). After cells were incubated with different doses of EXE (25-100 nmoL/L) and PA (500 μmoL/L) for 24 h, fatty deposition was assessed by oil red O staining and the level of intracellular triglyceride (TG). Real-time quantitative PCR (qRT-PCR) was used to detect the expression of lipid metabolism related genes, including fatty acid synthase (FAS), tumor necrosis factor α (TNF-α), and interleukin 6 (IL-6). The expression of p-AMPK and AMPK protein was tested by Western blot. An AMPK inhibitor was used to explore the role of AMPK in fat deposition and inflammation.
RESULTS: Compared with the control group, PA significantly elevated TG and oil red O content, as well as the expression of FAS in HepG2 cells (P < 0.05). EXE significantly inhibited PA induced elevation of TG and oil red O content, as well as FAS gene expression in a dose dependent manner (P < 0.05). The expression of TNF-α and IL-6 significantly increased in the PA treated group (P < 0.05). EXE significantly inhibited the expression of TNF-α and IL-6 in PA treated HepG2 cells (P < 0.05). Co-treatment with AMPK inhibitor significantly reduced the effect of EXE on AMPK, and reduced the inhibitory effect of EXE on fatty deposition and PA induced FAS activation (P < 0.05). AMPK inhibitor significantly diminished the inhibitory effect of EXE on TNF-α and IL-6 activation induced by PA (P < 0.05).
CONCLUSION: EXE reduces fatty acid induced fatty deposition and inflammatory response in liver cells through activation of AMPK.
- Citation: Guo NJ, Li J, Zhu YF, Guo LR, Chen QF, Huang B. Exenatide inhibits fatty acid induced hepatocyte steatosis and inflammation through activating AMPK. Shijie Huaren Xiaohua Zazhi 2016; 24(11): 1649-1657
- URL: https://www.wjgnet.com/1009-3079/full/v24/i11/1649.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i11.1649
近年来, 随着生活水平的提高, 脂质代谢紊乱疾病的发病率快速提高, 如非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)在我国已经发展为第二大肝脏疾病, 仅次于病毒性肝炎[1]. NAFLD发生的主要病理改变是肝脏细胞的脂质沉积, 但目前国内外还没有对于肝脏细胞脂肪沉积特效的治疗药物. 胰高血糖素样肽-1(glucagon-like peptide-1, GLP-1)受体激动剂是一类具有与GLP-1相似结构, 能激活GLP-1受体的多肽[2]. GLP-1受体激动剂能促进血糖依赖性的胰岛素分泌, 抑制餐后胰高血糖素释放, 延缓胃排空, 减轻体质量[3]. 近年来有临床及实验研究[4]均证实GLP-1受体激动剂具有抗脂质沉积的作用, 然而机制尚不明确. 腺苷酸激活的蛋白激酶(AMP-activated protein kinase, AMPK)被发现与各种代谢综合征相关疾病的发病关系密切. AMPK对于脂质稳态的调控是由于提高了线粒体功能增加脂肪的代谢, 并通过抑制脂肪酶活性降低脂肪的合成[5]; 除了显著的调节脂质稳态作用外, AMPK还有显著的抗炎症效应使得AMPK成为了目前脂质沉积的研究热点[6]. 本文将探讨AMPK在艾塞那肽(exenatide, EXE)防治肝细胞脂肪沉积及炎症反应中的作用.
艾塞那肽购自美国礼来公司, 胎牛血清、DMEM培养基购自GIBICO公司; 棕榈酸(palmitic acid, PA)、油红O购自美国Sigma公司; BML-275购自Santa公司; p-AMPK、AMPK抗体购自CST公司; 脂肪酸合酶(fatty acid synthase, FAS)抗体购自Bioworld公司; GAPDH抗体购自Santa公司; BCA蛋白定量试剂盒购自上海碧云天生物技术公司; 甘油三酯(triglyceride, TG)检测试剂盒购自南京建成生物科技有限公司. 实时定量PCR检测(real-time quantitative PCR, qRT-PCR)引物购自Lifetechnologies公司; 逆转录试剂盒及qRT-PCR试剂盒购自Takara公司. HepG2细胞株, 购自中国科学院细胞所(上海)细胞库并保存于本实验室. HepG2细胞用含有10%胎牛血清的DEME培养液, 在37 ℃、50 mL/L CO2培养, 2-3 d后1:3传代, 对数生长期细胞用于实验.
1.2.1 分组: 为了探索EXE对脂肪沉积、炎症反应及AMPK激活的影响, 我们将细胞分成以下各组: 对照组(Control, 等体积DMSO)、PA组(PA, 500 μmoL/L)、EXE低剂量组(EXE-L, 500 μmoL/L PA+50 nmoL/L EXE)、EXE高剂量组(EXE-H, 500 μmoL/L PA+100 nmoL/L EXE). 为了探索AMPK在EXE抑制脂肪沉积、炎症反应中的作用, 我们将细胞分为以下各组: 对照组(Control, 等体积DMSO)、PA组(PA, 500 μmoL/L PA)、EXE高剂量组(EXE-H, 500 μmoL/L PA+100 nmoL/L EXE)、EXE高剂量+AMPK抑制剂BML-275组(EXE-H+BML-275, 500 μmoL/L PA+100 nmoL/L EXE+10 μmoL/L BML-275).
1.2.2 油红O染色: HepG2细胞在不同处理作用下培养48 h后, 弃去原细胞培养液, PBS漂洗3次, 用4%多聚甲醛固定细胞15 min, PBS漂洗3次, 新鲜配置的油红O染色液室温孵育30 min, PBS洗2次, 显微镜下拍摄图片. 为了量化细胞内的油红O含量, 新鲜配置的油红O染色液室温孵育30 min, PBS洗2次, 加入异丙醇室温下孵育5 min溶解油红O, 在510 nm处测定OD值.
1.2.3 细胞内甘油三酯含量检测: HepG2细胞在不同处理作用下培养48 h后, 弃去原细胞培养液, PBS洗2-3次, 加入细胞裂解液, 氯仿/甲醇混合溶液(2:1, v/v)提取细胞内脂质, 采用TG检测试剂盒检测TG含量.
1.2.4 qRT-PCR: 采用qRT-PCR检测mRNA表达水平. HepG2细胞加入1 mL/孔TRIzol, 室温裂解10 min, 加入0.2 mL三氯甲烷, 剧烈颠倒混匀15 s. 静置10 min后4 ℃ 12000 r/min, 离心15 min, 吸取上层水样层加入0.5 mL异丙醇, 颠倒混匀后, 25 ℃放置10 min, 4 ℃ 12000 r/min离心15 min, 移去上清. 750 mL/L乙醇1 mL沉淀RNA, 4 ℃ 7500 r/min离心5 min, 在防止丢失RNA沉淀的前提下吸尽上清, 静置以挥发乙醇. DEPC水30 μL溶解RNA, 参照Takara逆转录试剂盒说明书进行逆转录. 以GAPDH作为内参, 按SYBR Premix Ex Taq试剂盒说明书进行qRT-PCR检测. 实验所用引物序列如表1.
| 基因 | 引物 | 扩增长度(bp) |
| FAS | 上游: 5'-CTA GGT TTG ATG CCT CCT TCT T-3' | 98 |
| 下游: 5'-GAT GGC TTC ATA GGT GAC TTC C-3' | ||
| TNF-α | 上游: 5'-CCA GGG ACC TCT CTC TAA TCA-3' | 106 |
| 下游: 5'-TCA GCT TGA GGG TTT GCT AC-3' | ||
| IL-6 | 上游: 5'-GGA GAC TTG CCT GGT GAA A-3' | 99 |
| 下游: 5'-CTG GCT TGT TCC TCA CTA CTC-3' | ||
| GAPDH | 上游: 5'- GGT GTG AAC CAT GAG AAG TAT GA-3' | 123 |
| 下游: 5'-GAG TCC TTC CAC GAT ACC AAA G-3' |
1.2.5 Western blot检测: PBS洗涤HepG2细胞3次, 加入RIPA细胞裂解液充分裂解细胞, 4 ℃超速离心(12000 r/min, 5 min)收集各组上清液, 用BCA法测定蛋白浓度. 收集的蛋白提取物加入5×SDS-PAGE蛋白上样缓冲液, 100 ℃加热5 min使蛋白变性. 取15 μg总蛋白加入SDS-PAGE凝胶加样孔内电泳分离. 将凝胶分离的蛋白转移至PVDF膜, 转移膜置于含5%脱脂奶粉的TBST缓冲液(含0.05% Tween-20)中封闭2 h, 加入一抗p-AMPK(1:1000)、AMPK(1:1000)、FAS(1:1000)、GAPDH(1:1000) 4 ℃孵育过夜, TBST缓冲液洗涤3次, 加入辣根过氧化物酶标记的二抗(1:5000) 37 ℃孵育2-3 h, 蛋白条带通过ECL液荧光显色, X线曝光拍照, 用Image J软件分析结果.
统计学处理 采用SPSS13.0软件进行统计分析, 实验数据采用mean±SD表示, 组间差异比较采用单因素方差分析法, 方差齐性采用LSD进行两两比较, 方差不齐则采用Dunnetts T3进行两两比较, P<0.05认为差异具有统计学意义.
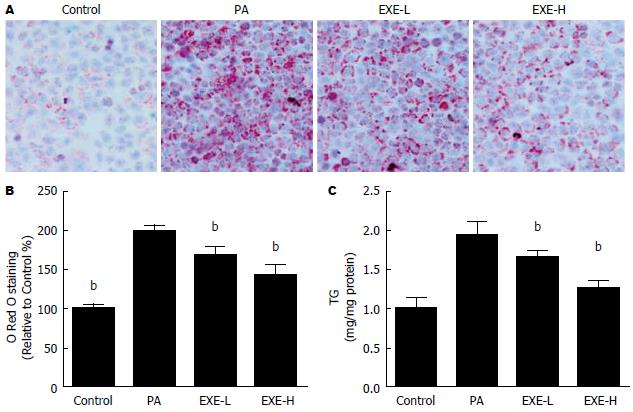
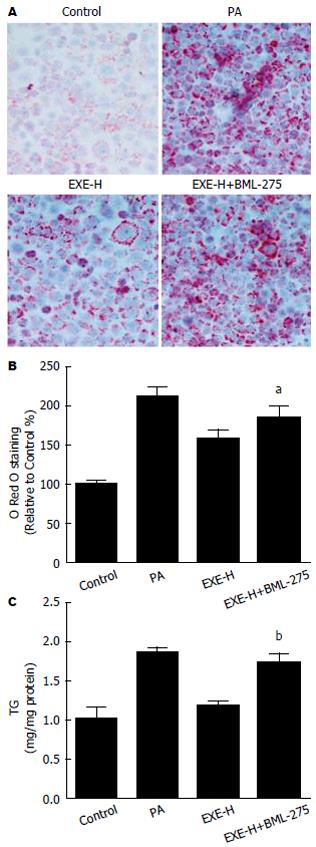
油红O染色结果如图1A, B所示, 空白对照组中HepG2细胞呈近卵球形生长, 边缘清晰, 胞浆丰富, 细胞边缘未见红色油滴沉积. PA处理组中, 细胞内可见明显的红色脂滴环绕于胞核周围, 油红O染色含量显著高于对照组, 与对照组比较差异有统计学意义(P<0.01). 不同浓度EXE处理组的红色脂滴较PA组显著降低, 油红O染色含量显著低于PA, 与PA组比较差异均有统计学意义(P<0.01). 细胞内TG含量结果如图1C所示, PA处理组的TG含量较对照组显著升高(P<0.01). 与PA组相比, EXE-H、EXE-L组中的TG均下降(P<0.01), 差异有统计学意义.
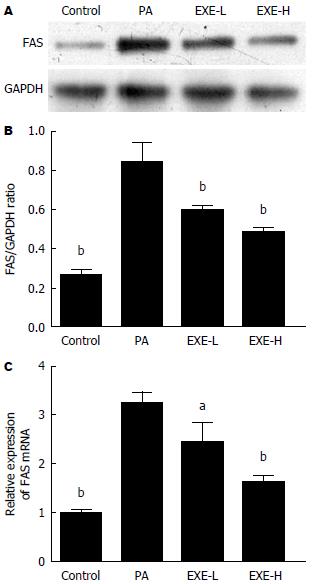
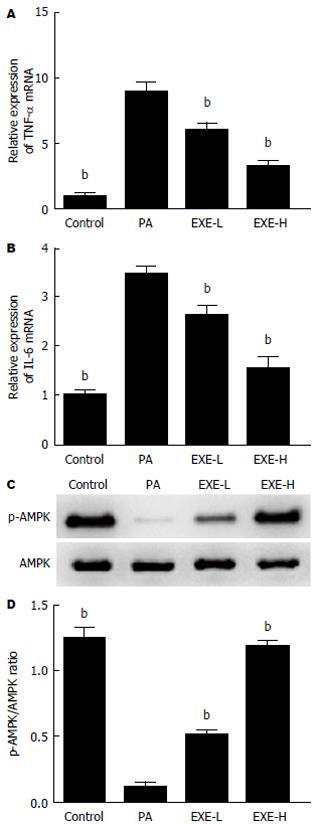
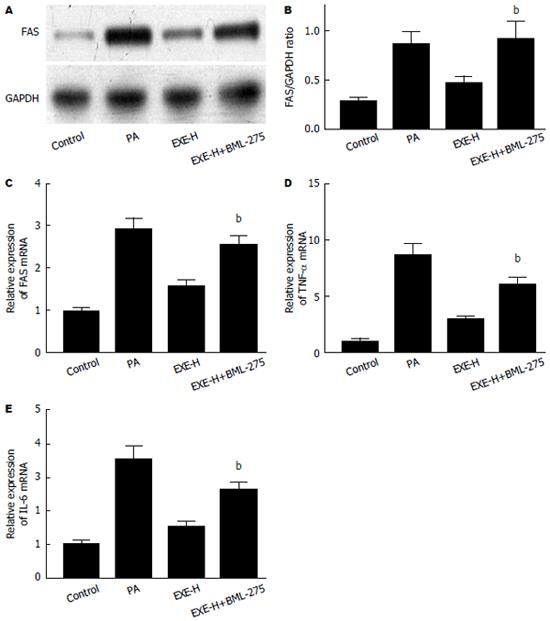
与对照组相比, PA组的FAS的蛋白表达水平、mRNA表达水平显著升高(P<0.01)(图2); PA组的肿瘤坏死因子-α(tumor necrosis factor alpha, TNF-α)、IL-6表达水平显著升高(P<0.01); PA组的p-AMPK表达水平显著降低(P<0.01); 与PA组比较, EXE-H、EXE-L组中的FAS蛋白表达水平、mRNA表达水平均下降(P<0.05, P<0.01). qRT-PCR显示出于Western blot相同的趋势. 与PA组比较, EXE-H、EXE-L组中的TNF-α水平、IL-6水平均下降(P<0.01)(图3A, B). EXE-H、EXE-L组中的p-AMPK水平均显著升高(P<0.01)(图3C, D).
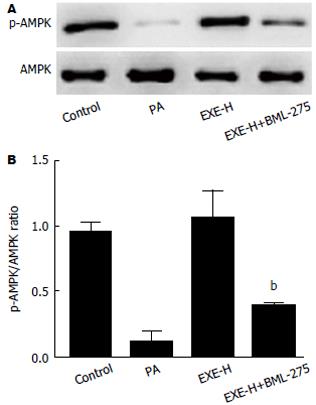
与BML-275、EXE(100 nmoL/L)共同孵育预处理48 h后, EXE及BML-275共处理组的p-AMPK表达显著低于EXE单独处理组, 与单独预处理组比较差异有统计学意义(P<0.01)(图4). 油红O定量及TG含量均显著高于EXE单独处理组, 与单独预处理组比较差异有统计学意义(油红O: P<0.05; TG: P<0.01)(图5). EXE、BML-275共处理组的FAS的蛋白及mRNA表达显著高于EXE单独处理组, 与单独预处理组比较差异有统计学意义(P<0.01)(图6A-C). EXE、BML-275共处理组的TNF-α、IL-6表达均显著高于EXE单独处理组, 与单独预处理组比较差异有统计学意义(P<0.01)(图6D, E).
随着社会的进步, 脂质代谢性疾病成为了影响人类健康的主要原因, 如NAFLD已经取代了乙型肝炎成为了中国人最主要的慢性肝病[7,8]. NAFLD突出表现是弥漫性的肝细胞脂肪性病变, 包括脂肪肝、脂肪性肝炎以及肝硬化等[9]. 肝脏脂质沉积是NAFLD的主要原因, 而造成肝脏脂质沉积的发病机制目前尚未完全清楚, 目前占主流的观点是由脂肪代谢紊乱、炎症反应等原因.
目前对于肝脏脂肪沉积并没有非常特效的药物, 实验研究证明二甲双胍[10,11]、罗格列酮[12]等有减少胰岛素抵抗效果的降糖药物, 以及抗氧化药物如维生素E[13], 降脂药如吉非贝齐[14], 有一定的治疗作用, 但效果并不理想. GLP-1受体激动剂EXE于2005年上市, 是一种肠促胰岛素系统的新型降糖药物, 主要通过GLP-1结合后发挥作用, 在治疗糖尿病的同时可以减轻患者的体质量和胰岛素抵抗状态[15]. 近年来有临床研究[16,17]发现EXE能降低2型糖尿病合并NAFLD患者的肝酶水平. 实验研究[18,19]发现, EXE可以减少ob/ob肥胖大鼠的肝脏脂肪含量, 提示可能对于NAFLD有一定的治疗效果. 还有研究[20]发现, EXE能抑制NAFLD小鼠模型的肝脏脂质沉积. 本研究用PA诱导HepG2脂肪沉积模型, 同时以不同剂量的EXE处理该细胞, 发现细胞內的TG水平显著下降降低, 表明GLP-1受体激动剂EXE具有改善脂质沉积和脂质代谢紊乱状态的作用.
AMPK具有显著的调节脂质稳态作用及抗炎症效应[21]. AMPK复合物由α、β、γ三个亚单位构成, 其中α亚单位的磷酸化对AMPK活性起重要调节作用, 当α中172位苏氨酸磷酸化后, AMPK变为有活动的p-AMPK形式, AMPK激活后可以增加葡萄糖的摄取, 脂肪酸的氧化等, 在肝脏脂质稳态的调节及炎症反应发挥重要作用[21,22]. AMPK对于脂质代谢的影响是通过抑制乙酰辅酶A羧化酶(ACC)、FAS等脂肪酶的活性抑制脂肪合成, 同时增加脂肪酸的氧化等方式[5,23]. 本次实验中PA显著抑制HepG2细胞中p-AMPK表达, 增加FAS的表达, 提示PA能抑制AMPK通路的激活. 我们还发现EXE能剂量依赖性抑制PA对AMPK的抑制及对FAS基因激活作用. 为了进一步研究其作用机制, 我们使用了AMPK的抑制剂BML-275研究EXE对于脂肪沉积的作用. BML-275能显著降低EXE对AMPK的激活作用, 还显著降低了EXE对PA诱导脂肪沉积及FAS激动的抑制作用, 与EXE单独作用组比较有统计学差异. 我们结果提示EXE可能通过激活AMPK抑制游离脂肪酸诱导的肝脏脂肪沉积.
既往研究[24]表明炎症反应在NAFLD的发展过程中起了关键的作用. NAFLD患者外周血TNF-α、IL-6等炎症因子水平升高[25,26]. 采用TNF-α抗体能抑制NAFLD的炎症反应, 减少了肝细胞坏死和脂质沉积[27,28]. 本项目研究发现, EXE能剂量依赖性的降低PA诱导的TNF-α、IL-6表达升高. 这提示, EXE具有抗炎作用. 研究[29]证实AMPK除了在脂代谢的调节作用外, 在体内炎症过程也发挥重要角色, 有研究[30]表明在游离脂肪酸刺激的小鼠巨噬细胞中, AMPK可以显著抑制NF-kB的活性及TNF-α的表达; 在大鼠巨噬细胞和小胶质细胞中, 转染AMPK可减少LPS导致的TNF-α、IL-1β及IL-6的表达[31]. 本次实验中, PA处理组TNF-α、IL-6的表达较对照组显著升高, 而EXE能剂量依赖性抑制PA诱导TNF-α、IL-6的表达升高. 为了进步一验证AMPK在EXE抗炎中的作用, 实验中使用AMPK抑制剂BML-275进行实验, AMPK抑制剂能显著降低EXE对PA诱导TNF-α、IL-6激活的抑制作用, 表明EXE可能通过激活AMPK减少脂肪酸诱导肝细胞炎症反应.
总之, GLP-1受体激动剂EXE可能有缓解脂质沉积的效应, 该作用可能与激活AMPK有关. 因此, GLP-1受体激动剂EXE有可能成为治疗脂质代谢紊乱疾病(如NAFLD)的有效药物.
目前, 国内外还没有对于肝脏细胞脂肪沉积特效的治疗药物. 胰高血糖素样肽-1(glucagon-like peptide-1, GLP-1)受体激动剂是一类具有与GLP-1相似结构, 能激活GLP-1受体的多肽, 是治疗2型糖尿病的上市药物. 临床及实验研究已证实GLP-1受体激动剂具有抗脂质沉积及抗炎的作用, 然而机制尚不明确. 腺苷酸激活的蛋白激酶(AMP-activated protein kinase, AMPK)是一种调控糖脂代谢的关键酶, 其激活还具有抗炎作用. 本文探索AMPK在GLP-1调控肝细胞脂质沉积及炎症反应中的作用.
李树德, 副教授, 昆明医科大学基础医学院生物化学与分子生物学系
非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)发病治疗药物研究一直是该领域的热点、难点. 研究表明, 抗氧化剂剂、胰岛素增敏剂、降脂药物具有治疗NAFLD的作用, 然而这些药物治疗NAFLD的疗效并不显著, 缺乏针对性的药物.
近年来有临床研究发现艾塞那肽(exenatide, EXE)能降低2型糖尿病合并NAFLD患者的肝酶水平. 实验研究发现, EXE可以减少ob/ob肥胖大鼠的肝脏脂肪含量, 提示可能对于NAFLD有一定的治疗效果. 还有研究发现, EXE能抑制NAFLD小鼠模型的肝脏脂质沉积.
国内未见有EXE调控AMPK治疗NAFLD的报道. 在国外, 2014年Diabetes杂志报道EXE能调控AMPK上游激酶SirT1抑制NAFLD的发展, 但是该研究没有对AMPK在EXE调控NAFLD中的作用进行验证, 也未探索AMPK在EXE抑制脂肪酸诱导炎症中的作用.
GLP-1受体激动剂: 是一类具有与GLP-1相似结构, 能激活GLP-1受体的多肽, 能促进血糖依赖性的胰岛素分泌, 抑制餐后胰高血糖素释放, 延缓胃排空; 非酒精性脂肪性肝病: 指除外酒精和其他明确的损肝因素所致的, 以弥漫性肝细胞大泡性脂肪变为主要特征的临床病理综合征.
本文研究内容具有重要的意义, 研究具有一定的创新性.
编辑: 于明茜 电编:都珍珍
| 1. | Fan JG, Farrell GC. Epidemiology of non-alcoholic fatty liver disease in China. J Hepatol. 2009;50:204-210. [PubMed] [DOI] |
| 2. | Prasad-Reddy L, Isaacs D. A clinical review of GLP-1 receptor agonists: efficacy and safety in diabetes and beyond. Drugs Context. 2015;4:212283. [PubMed] [DOI] |
| 3. | Ryan D, Acosta A. GLP-1 receptor agonists: Nonglycemic clinical effects in weight loss and beyond. Obesity (Silver Spring). 2015;23:1119-1129. [PubMed] [DOI] |
| 4. | Ruderman NB, Carling D, Prentki M, Cacicedo JM. AMPK, insulin resistance, and the metabolic syndrome. J Clin Invest. 2013;123:2764-2772. [PubMed] [DOI] |
| 5. | Lee JW, Choe SS, Jang H, Kim J, Jeong HW, Jo H, Jeong KH, Tadi S, Park MG, Kwak TH. AMPK activation with glabridin ameliorates adiposity and lipid dysregulation in obesity. J Lipid Res. 2012;53:1277-1286. [PubMed] [DOI] |
| 6. | Kumase F, Takeuchi K, Morizane Y, Suzuki J, Matsumoto H, Kataoka K, Al-Moujahed A, Maidana DE, Miller JW, Vavvas DG. AMPK-Activated Protein Kinase Suppresses Ccr2 Expression by Inhibiting the NF-κB Pathway in RAW264.7 Macrophages. PLoS One. 2016;11:e0147279. [PubMed] [DOI] |
| 8. | Baršić N, Lerotić I, Smirčić-Duvnjak L, Tomašić V, Duvnjak M. Overview and developments in noninvasive diagnosis of nonalcoholic fatty liver disease. World J Gastroenterol. 2012;18:3945-3954. [PubMed] [DOI] |
| 9. | Tessari P, Coracina A, Cosma A, Tiengo A. Hepatic lipid metabolism and non-alcoholic fatty liver disease. Nutr Metab Cardiovasc Dis. 2009;19:291-302. [PubMed] [DOI] |
| 10. | Lin HZ, Yang SQ, Chuckaree C, Kuhajda F, Ronnet G, Diehl AM. Metformin reverses fatty liver disease in obese, leptin-deficient mice. Nat Med. 2000;6:998-1003. [PubMed] [DOI] |
| 11. | Nair S, Diehl AM, Wiseman M, Farr GH, Perrillo RP. Metformin in the treatment of non-alcoholic steatohepatitis: a pilot open label trial. Aliment Pharmacol Ther. 2004;20:23-28. [PubMed] [DOI] |
| 12. | Sanyal AJ, Mofrad PS, Contos MJ, Sargeant C, Luketic VA, Sterling RK, Stravitz RT, Shiffman ML, Clore J, Mills AS. A pilot study of vitamin E versus vitamin E and pioglitazone for the treatment of nonalcoholic steatohepatitis. Clin Gastroenterol Hepatol. 2004;2:1107-1115. [PubMed] |
| 13. | Fukui A, Kawabe N, Hashimoto S, Murao M, Nakano T, Shimazaki H, Kan T, Nakaoka K, Ohki M, Takagawa Y. Vitamin E reduces liver stiffness in nonalcoholic fatty liver disease. World J Hepatol. 2015;7:2749-2756. [PubMed] [DOI] |
| 14. | Angulo P. Current best treatment for non-alcoholic fatty liver disease. Expert Opin Pharmacother. 2003;4:611-623. [PubMed] [DOI] |
| 15. | Madsbad S. A review of head-to-head comparisons of GLP-1 receptor agonists. Diabetes Obes Metab. 2015; Oct 29. [Epub ahead of print]. [PubMed] [DOI] |
| 16. | Fan H, Pan Q, Xu Y, Yang X. Exenatide improves type 2 diabetes concomitant with non-alcoholic fatty liver disease. Arq Bras Endocrinol Metabol. 2013;57:702-708. [PubMed] |
| 17. | Shao N, Kuang HY, Hao M, Gao XY, Lin WJ, Zou W. Benefits of exenatide on obesity and non-alcoholic fatty liver disease with elevated liver enzymes in patients with type 2 diabetes. Diabetes Metab Res Rev. 2014;30:521-529. [PubMed] [DOI] |
| 18. | Salehi M, Aulinger BA, D'Alessio DA. Targeting beta-cell mass in type 2 diabetes: promise and limitations of new drugs based on incretins. Endocr Rev. 2008;29:367-379. [PubMed] [DOI] |
| 19. | Ding X, Saxena NK, Lin S, Gupta NA, Anania FA. Exendin-4, a glucagon-like protein-1 (GLP-1) receptor agonist, reverses hepatic steatosis in ob/ob mice. Hepatology. 2006;43:173-181. [PubMed] [DOI] |
| 20. | Kawaguchi T, Itou M, Taniguchi E, Sata M. Exendin 4, a glucagon like peptide 1 receptor agonist, modulates hepatic fatty acid composition and Δ 5 desaturase index in a murine model of non alcoholic steatohepatitis. Int J Mol Med. 2014;34:782-787. [PubMed] [DOI] |
| 21. | O'Neill LA, Hardie DG. Metabolism of inflammation limited by AMPK and pseudo-starvation. Nature. 2013;493:346-355. [PubMed] [DOI] |
| 22. | Hardie DG. AMPK--sensing energy while talking to other signaling pathways. Cell Metab. 2014;20:939-952. [PubMed] [DOI] |
| 23. | Liu JF, Ma Y, Wang Y, Du ZY, Shen JK, Peng HL. Reduction of lipid accumulation in HepG2 cells by luteolin is associated with activation of AMPK and mitigation of oxidative stress. Phytother Res. 2011;25:588-596. [PubMed] [DOI] |
| 24. | Arrese M, Cabrera D, Kalergis AM, Feldstein AE. Innate Immunity and Inflammation in NAFLD/NASH. Dig Dis Sci. 2016; Feb 3. [Epub ahead of print]. [PubMed] [DOI] |
| 25. | Poniachik J, Csendes A, Díaz JC, Rojas J, Burdiles P, Maluenda F, Smok G, Rodrigo R, Videla LA. Increased production of IL-1alpha and TNF-alpha in lipopolysaccharide-stimulated blood from obese patients with non-alcoholic fatty liver disease. Cytokine. 2006;33:252-257. [PubMed] [DOI] |
| 26. | García-Galiano D, Sánchez-Garrido MA, Espejo I, Montero JL, Costán G, Marchal T, Membrives A, Gallardo-Valverde JM, Muñoz-Castañeda JR, Arévalo E. IL-6 and IGF-1 are independent prognostic factors of liver steatosis and non-alcoholic steatohepatitis in morbidly obese patients. Obes Surg. 2007;17:493-503. [PubMed] [DOI] |
| 27. | Li Z, Yang S, Lin H, Huang J, Watkins PA, Moser AB, Desimone C, Song XY, Diehl AM. Probiotics and antibodies to TNF inhibit inflammatory activity and improve nonalcoholic fatty liver disease. Hepatology. 2003;37:343-350. [PubMed] [DOI] |
| 28. | Koca SS, Bahcecioglu IH, Poyrazoglu OK, Ozercan IH, Sahin K, Ustundag B. The treatment with antibody of TNF-alpha reduces the inflammation, necrosis and fibrosis in the non-alcoholic steatohepatitis induced by methionine- and choline-deficient diet. Inflammation. 2008;31:91-98. [PubMed] [DOI] |
| 29. | Gao H, Zeng Z, Zhang H, Zhou X, Guan L, Deng W, Xu L. The Glucagon-Like Peptide-1 Analogue Liraglutide Inhibits Oxidative Stress and Inflammatory Response in the Liver of Rats with Diet-Induced Non-alcoholic Fatty Liver Disease. Biol Pharm Bull. 2015;38:694-702. [PubMed] [DOI] |
| 30. | Yang Z, Kahn BB, Shi H, Xue BZ. Macrophage alpha1 AMP-activated protein kinase (alpha1AMPK) antagonizes fatty acid-induced inflammation through SIRT1. J Biol Chem. 2010;285:19051-19059. [PubMed] [DOI] |
| 31. | Giri S, Nath N, Smith B, Viollet B, Singh AK, Singh I. 5-aminoimidazole-4-carboxamide-1-beta-4-ribofuranoside inhibits proinflammatory response in glial cells: a possible role of AMP-activated protein kinase. J Neurosci. 2004;24:479-487. [PubMed] [DOI] |