修回日期: 2015-11-15
接受日期: 2015-11-30
在线出版日期: 2016-01-08
目的: 本实验的目的在于探讨肌球蛋白轻链激酶(myosin light chain kinase, MLCK)在高甘油三酯血症相关性急性胰腺炎(hypertriglyceridemia-associated acute pancreatitis, HTGP)中的作用.
方法: 应用48只♂SD大鼠随机平均分为A组(高脂饲料饲养)、B组(普通饲料饲养), 均饲养4 wk. 满4 wk时行眶后静脉丛取血, 检测血清甘油三酯(triglyceride, TG)含量. A组随机分为3个亚组: HTG、HTG+AP及HTG+AP+ML-7组; B组随机分为生理盐水组、AP、AP+ML-7 3个亚组. 在雨蛙肽末次注射24 h后处理大鼠, 利用HE染色观察胰腺形态学的变化及电镜观察胰腺的超微结构及紧密连接(tight junction, TJ)的改变; 用底物酶法检测血清淀粉酶(amylase, AMY)含量; 利用免疫组织化学技术检测胰腺组织MLCK、p-JNK蛋白的定位及表达.
结果: 与B组相比, 经高脂饮食后A组TG水平显著升高(P<0.01); 与AP组相比, HTG+AP组的胰腺病理评分、血AMY水平显著升高(P<0.05); HTG+AP、AP组超微结构破坏, TJ显著增宽, 其中以HTG+AP组增宽最显著; 与AP组相比, HTG+AP组中MLCK、p-JNK蛋白含量显著升高(P<0.05), 且MLCK、p-JNK分别与胰腺病理评分呈正相关: r1 = 0.795, r2 = 0.789(均P<0.01); 利用MLCK抑制剂ML-7干预可改善胰腺损伤程度及使血淀粉酶显著下降(P<0.01), 且在HTG+AP组中抑制效果更明显; ML-7干预后还使TJ增宽改善及抑制p-JNK的表达(P<0.05).
结论: MLCK可能与HTGP的严重程度有关, 且他可能通过改变细胞间的TJ及调控JNK通路从而参与HTGP的形成.
核心提示: 肌球蛋白轻链激酶(myosin light chain kinase, MLCK)的报道主要见于急性肺损伤、克罗恩病及溃疡性结肠炎等疾病中, 但关于急性胰腺炎的报道国内尚缺乏. 本文首次初步探讨MLCK在大鼠高甘油三酯血症相关性急性胰腺炎中的作用及其与紧密连接及JNK通路的关系.
引文著录: 何家萍, 唐国都, 覃蒙斌, 石慧荣, 符洪宗, 林沙丹, 罗期. 肌球蛋白轻链激酶在大鼠高甘油三酯血症相关性急性胰腺炎中的作用. 世界华人消化杂志 2016; 24(1): 19-27
Revised: November 15, 2015
Accepted: November 30, 2015
Published online: January 8, 2016
AIM: To investigate the role of myosin light chain kinase (MLCK) in hypertriglyceridemia-associated acute pancreatitis (HTGP).
METHODS: Forty-eight male SD rats were randomly divided into two groups to be fed either a high-fat diet (group A) or a normal diet (group B). After being raised for 4 weeks, blood was harvested from the retroorbital venous plexus to measure serum triglyceride (TG) levels. After that, group A was randomly divided into three subgroups: HTG, HTG + AP, and HTG + AP + ML-7; group B were also randomly divided into three subgroups: C, AP, and AP + ML-7. All rats were sacrificed 24 h after the last injection of cerulein. The pancreases were carefully removed for HE staining and transmission electron microscopy to observe the morphological changes, ultrastructure and tight junction (TJ). Blood was obtained from the heart to measure serum amylase levels. The expression and localization of MLCK and p-JNK in the pancreas were assayed by immunohistochemistry.
RESULTS: Compared with group B, serum TG level was significantly increased in group A after being fed a high fat diet (P < 0.01). The pathologic score of the pancreas and serum amylase (AMY) activity were significantly elevated in the HTG + AP group, compared with the AP group (P < 0.05). The ultrastructure of the pancreas in the HTG + AP and AP groups was damaged and the TJ was broadened (most significant in the HTG + AP group). Besides, MLCK and p-JNK were significantly up-regulated in the HTG + AP group compared with those in the AP group (P < 0.05), and there was a positive correlation between the expression of MLCK and p-JNK in the pancreas and the pathologic score of the pancreas (r1 = 0.795, r2 = 0.789, P < 0.01). ML-7, an inhibitor of MLCK, significantly ameliorated the pathologic signs of the pancreas, down-regulated AMY level (P < 0.01), improved the TJ and decreased the expression of p-JNK (P < 0.05).
CONCLUSION: MLCK may be associated with the severity of HTGP, and involved in the formation of HTGP by broadening cell-cell TJ and activation of the JNK pathway.
- Citation: He JP, Tang GD, Qin MB, Shi HR, Fu HZ, Lin SD, Luo Q. Role of myosin light chain kinase in hypertriglyceridemia-associated acute pancreatitis in rats. Shijie Huaren Xiaohua Zazhi 2016; 24(1): 19-27
- URL: https://www.wjgnet.com/1009-3079/full/v24/i1/19.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i1.19
我国急性胰腺炎以胆源性、酒精性为主, 由于生活水平提高、饮食结构变化, 近年来临床上观察发现高脂血症性急性胰腺炎(hyperlipidemic acute pancreatitis, HLP)所占比例增高, 已成为继胆源性、酒精性急性胰腺炎的第三大病因. 研究[1]显示高甘油三酯血症相关性急性胰腺炎(hypertriglyceridemia-associated acute pancreatitis, HTGP)在急性胰腺炎中所占比例达10%, 而在妊娠期急性胰腺炎中高达50%. HTGP在临床上具有发病重、易复发、进展快等特点, 但其发病机制尚未阐明. 肌球蛋白轻链激酶(myosin light chain kinase, MLCK)参与肌肉收缩、细胞迁移、炎症等形成, 尤其是在细胞间的黏附、紧密连接及屏障功能中发挥重要作用[2]. MLCK早期被认为只存在于肌细胞中, 但越来越多研究显示MLCK还存在非肌细胞中. 在克罗恩病、溃疡性结肠炎、乳糜泻及感染性腹泻等消化系统炎症性疾病中MLCK均能开放紧密连接(tight junction, TJ)从而促进抗原物质入侵, 从而引起一系列肠道炎症反应[3-5]. 同时在急性肺损伤[6,7]、哮喘[8]、乳腺癌的侵袭转移[9]、烧伤引起的肠屏障功能障碍[10]中MLCK也起着重要作用. 但MLCK与急性胰腺炎之间的研究尚缺乏报道. 本实验通过建立HTGP模型并用MLCK的强效抑制剂ML-7进行干预, 观察胰腺的病理变化, 胰腺组织超微结构及TJ的变化, 同时利用免疫组织化学技术检测胰腺组织中MLCK及p-JNK蛋白的表达, 探讨MLCK在HTGP中的作用及其与JNK通路的关系.
48只SPF级SD健康♂大鼠购自广西医科大学实验动物中心, 体质量70-80 g, 4周龄; 胆固醇、胆酸钠(广州威佳公司); 猪油(自制); 普通饲料(北京科奥协力有限公司); 雨蛙肽(美国Sigma-Aldrich公司); 全自动生化检测仪(7600-120型, 日本HITACHI公司); 透射电镜(H7650, 日本HITACHI公司); 通用型SP-9000免疫组织化学试剂盒、DAB试剂盒(北京中杉金桥公司); MLCK抗体(英国Abcam公司); p-JNK抗体(美国Cell signaling公司).
1.2.1 动物分组及造模: 48只♂SD大鼠随机平均分为A、B两组, A、B组分别用高脂饲料、普通饲料饲养4 wk, 满4 wk后行眼球眶后静脉丛取血测血清甘油三酯(triglyceride, TG)含量. 高脂饲料配方为: 15%猪油+2%胆固醇+0.2%的胆酸钠+82.8%的普通饲料. A组随机分为3个亚组: HTG、HTG+AP及HTG+AP+ML-7组; B组随机分为生理盐水组、AP、AP+ML-7 3个亚组; 每组各8只大鼠. 利用腹腔注射雨蛙肽法(50 μg/kg)建立急性胰腺炎模型, 每间隔1 h注射1次, 连续注射7次, 对照组注射等量生理盐水. 同时HTG+AP+ML-7、AP+ML-7组根据Moriez等[11]及Ferrier等[12]的方法改良为利用腹腔注射2 mg/kg ML-7(溶于20 mL/L乙醇中)在首次雨蛙肽注射前24 h、12 h、1 h进行干预. 各组于末次雨蛙肽注射24 h后处死大鼠, 心脏采血离心留血清备用, 同时留取胰腺组织分别用40 g/L甲醛及3%戊二醛固定. 血清TG、AMY的测定: 全自动生化检测仪.
1.2.2 胰腺大体及形态学变化: 40 g/L甲醛固定24 h后进行脱水、石蜡包埋, 并进行HE染色, 胰腺病理评分根据文献[13]的标准从水肿、炎症、出血、坏死四个方面进行评分.
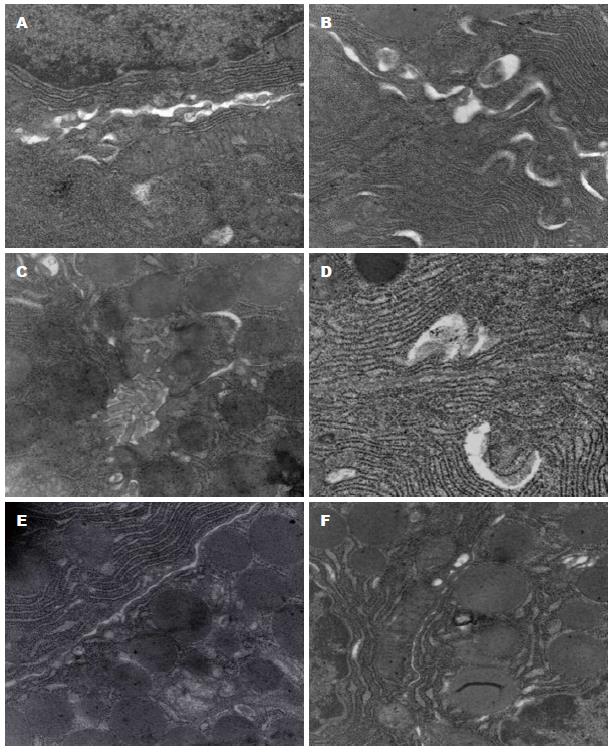
1.2.3 胰腺细胞超微结构及TJ: 0.1 mm3胰腺组织用3%戊二醛固定, 后经后固定、梯度乙醇脱水、包埋、切片等制备透射电镜超薄切片, 在40000倍镜下观察胰腺细胞的超微结构及TJ的变化.
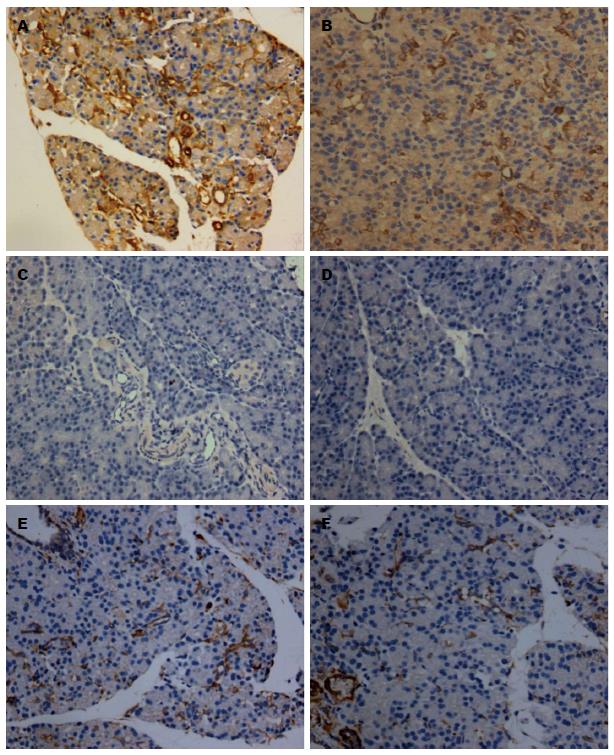
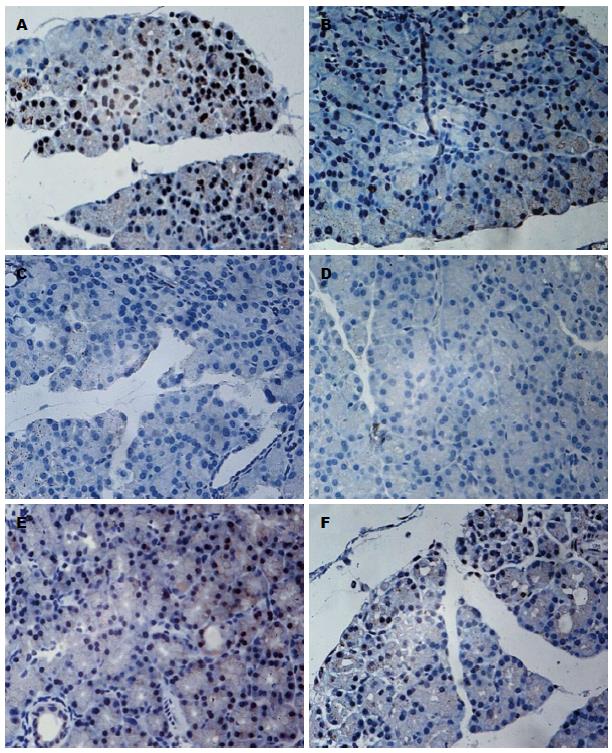
1.2.4 免疫组织化学法检测胰腺组织MLCK、p-JNK的表达: 胰腺组织经石蜡包埋后切片(厚3 μm), 利用pH 6.0柠檬酸钠修复液进行高压修复, 用山羊血清封闭, 滴加MLCK(1:2000)、p-JNK(1:200)抗体4 ℃孵育过夜, 用PBS作为阴性对照, 显微镜下观察胰腺组织的染色强度及范围. 采用双盲法评分, 每张片随机取5个视野, 以胞核、胞质出现明显的黄色或棕黄色颗粒视为免疫组织化学染色阳性, 以阳性细胞染色强度及阳性细胞比率的总积分进行半定量分析. 根据阳性细胞染色程度分为: 无黄色染色(0分); 淡黄色(1分); 棕黄色(2分), 棕褐色(3分). 阳性细胞比率分为: 阳性细胞比率≤5%为0分; 6%-25%为1分; 26%-50%为2分; >50%为3分.
统计学处理 应用SPSS16.0统计学软件进行分析, 计量资料采用mean±SD表示, 两样本计量资料利用完全随机设计t检验; 多组方差齐性计量资料采用one-way ANOVA, 多组方差不齐性计量资料采用Kruskal-Wallis检验, 两组间比较采用LSD法; 相关性用Spearman相关性分析; P<0.05为差异有统计学意义.
B组血清呈淡黄色, 清亮, 而A组的血清呈乳糜样, 混浊; B组TG含量为1.21 mmol/L±0.39 mmol/L, A组TG含量为3.16 mmol/L±0.48 mmol/L, 与B组相比, A组血清TG水平显著升高(P<0.01).
HTG+AP组、AP组血清AMY活性均较对照组HTG、生理盐水组升高(P<0.01), 并且HTG+AP组血清AMY活性较AP组升高(P<0.05), HTG+AP+ML-7组AMY活性较HTG+AP组显著减少(P<0.01), AP+ML-7组AMY活性较AP组显著减少(P<0.01)(表1). AP组及HTG+AP组血清淀粉酶活性被ML-7抑制的程度分别为19.5%及22.7%.
生理盐水组、HTG组的大鼠胰腺外观正常, 镜下见胰腺小叶结构完整, 偶见极少炎症细胞浸润和轻微水肿; 经腹腔注射雨蛙肽诱发AP后, HTG+AP、AP组的大鼠胰腺外观出现明显水肿, 镜下见胰腺小叶及腺泡间隙均增宽, 腺泡细胞空泡样变, 大量的炎性细胞浸润, 有时可见出血, 无坏死, 并且经ML-7干预后胰腺的炎症细胞浸润、水肿程度及出血减轻. HTG+AP组、AP组胰腺病理评分均较对照组显著升高, 其中以HTG+AP组升高最显著(P<0.05); HTG+AP+ML-7组胰腺损伤较HTG+AP组显著减轻(P<0.01), AP+ML-7组胰腺损伤比AP组显著减轻(P<0.01)(表1); 在诱导AP前利用ML-7处理后, AP组及HTG+AP组胰腺损伤被抑制的程度分别为37.2%及48.0%.
HTG组、生理盐水组线粒体、内质网等结构未见异常, 可见大量酶原颗粒, 细胞间紧密连接可见, 无明显改变; HTG+AP、AP组见酶原颗粒数量减少, 线粒体肿胀, 内质网扩张, 细胞连接增宽; HTG+AP组、AP组TJ显著增宽, 其中以HTG+AP组增宽最明显; HTG+AP+ML-7组TJ增宽较HTG+AP组改善, AP+ML-7组TJ较AP组改善(图1).
MLCK及p-JNK的表达水平以免疫组织化学的阳性染色程度及阳性细胞数的总积分表示. MLCK阳性表达于胰腺导管上皮细胞及腺泡细胞的细胞质中, MLCK在HTG+AP、AP、HTG、生理盐水组的总积分分别为5.00分±1.01分、3.38分±2.13分、0.38分±0.74分、0分(P<0.05), 并且在HTG+AP组中表达比AP组明显增高(P<0.05); HTG+AP+ML-7组MLCK的表达较HTG+AP组显著减少(2.00分±1.60分 vs 5.00分±1.01分), AP+ML-7组MLCK的表达较AP组显著减少(1.38分±1.30分 vs 3.38分±2.13分), 差异均有统计学意义(P<0.05); p-JNK阳性表达于细胞核中, p-JNK在HTG+AP、AP、HTG、生理盐水组中的总积分分别为4.00分±1.5分、2.50分±1.69分、0.12分±0.35分、0分(P<0.05), 并且在HTG+AP组中表达最高(P<0.05), HTG+AP+ML-7组p-JNK的表达较HTG+AP组显著减少(2.12分±1.81分 vs 4.00分±1.51分), 差异有统计学意义(P<0.05), p-JNK被ML-7抑制了47%; AP+ML-7组p-JNK的表达与AP组相比减少, 但差异无统计学意义(图2, 3). 胰腺MLCK、p-JNK的总积分与胰腺病理评分的Spearman相关性分析为: r1 = 0.795, r2 = 0.789(均P<0.01), 提示胰腺MLCK、p-JNK的表达与胰腺病理评分呈正相关.
HTGP近年来发病率呈增高趋势, 一些研究[14,15]表明HTGP较胆源性及酒精性引起的急性胰腺炎严重, 及TG水平直接与急性胰腺炎的严重程度相关, 同时HTGP中重症急性胰腺炎所占比例超过20%[16]. 本研究发现HTG+AP组胰腺损伤及血淀粉酶较AP组显著增高(P<0.05), 证实了在高甘油三酯血症存在时易引起更严重的急性胰腺炎, 同时雨蛙肽是经腹腔注射的, 与逆行胰胆管注射牛磺胆酸钠相比, 排除了胆源性因素对急性胰腺炎的影响, 本研究模型能更好地用于高脂血症性急性胰腺炎的发病机制的研究.
MLCK广泛存在于平滑肌、骨骼肌、心肌以及哺乳动物的非肌细胞中, 主要以smMLCK、skMLCK、cMLCK和nmMLCK四种形式存在. MLCK结构由N端肌动蛋白结合区、中心激酶区、钙调蛋白(calmodulin, CaM)结合区以及C端肌球蛋白结合区组成. MLCK属于Ca2+/CaM依赖的蛋白激酶家族, 当细胞内的Ca2+释放后, 与CaM形成复合物, 其为调控MLCK的中心原件[17]. MLCK激活后可以使肌球蛋白轻链(myosin light chain, MLC)的Ser19和Thr18发生磷酸化, 从而促进肌球蛋白-肌动蛋白收缩, 引起细胞骨架重排及使紧密连接增宽, 开放细胞间隙, 使细胞间通透性增加[18,19]. 细胞间连接方式主要有TJ、缝隙连接、黏附连接及桥粒连接, 其中TJ是细胞间连接的主要方式, 当TJ的完整性破坏时, 细胞间连接损伤, 细胞间通透性增加. Clayburgh等[20]发现肿瘤坏死因子α(tumor necrosis factor α, TNF-α)能够激活MLCK从而引起TJs屏障功能障碍在T细胞介导的腹泻模型的发病机制中起着重要作用. 在利用脂多糖诱导的结肠上皮屏障功能障碍的大鼠模型中利用MLCK的抑制剂ML-7可以减轻TJ的损伤并且抑制细菌移位[11]. 在Caco-2细胞中霉酚酸能够激活MLCK从而损伤细胞间的TJ从而引起肠上皮屏障功能障碍, 同时利用ML-7能减少TJ的损伤及改善肠上皮屏障功能[21]. 在动脉粥样硬化模型中ML-7能够通过抑制MLCK的表达及p-MLC的磷酸化使TJ屏障功能改善从而使血管内皮功能不全改善, 对动脉粥样硬化起保护作用[22]. 在利用牛磺胆酸钠诱导的急性胰腺炎中MLCK可能通过改变TJ从而参与急性胰腺炎的发生发展[23]. 研究[24,25]还表明MLCK能够调节胰腺腺泡及胰腺导管上皮细胞的分泌. 本研究发现仅高脂血症存在时并不能引起MLCK表达增加, 但HTG+AP组MLCK表达增加较AP组显著, 且在HTG+AP组中ML-7对血淀粉酶活性及胰腺损伤的抑制更加明显; HTG+AP组TJ增宽较AP组明显, 并且利用ML-7干预后TJ明显改善, 与胰腺严重程度一致, 表明MLCK可能与HTGP的严重程度有关, 可能通过改变TJ参与HTGP的发生发展.
JNK通路是促分裂原活化蛋白激酶信号通路的重要通路之一, 位于胞质, 包含双磷酸化功能区(由3种氨基酸苏氨酸、酪氨酸和脯氨酸组成)与c-Jun N端的活化区. 一旦JNK通路被激活(活化形式为p-JNK), 胞浆中的JNK迅速转移到细胞核中, 参与细胞生长、凋亡、增殖与炎症等. 研究[26,27]表明JNK通路的激活能够加剧急性胰腺炎损伤, 并且利用JNK的抑制剂能够改善急性胰腺炎的严重程度. 蜂毒肽[28]、非瑟酸[29]、孕二烯二酮均通过抑制JNK通路的激活从而在急性胰腺炎中起保护作用[30]. 以上研究均表明JNK通路在急性胰腺炎中发挥着重要作用. 本研究发现p-JNK在诱导急性胰腺炎后表达增加, 且在HTG+AP组表达增加较AP组显著, 与胰腺病理损伤程度一致, 以上结果表明JNK通路的激活在HTGP中起着重要作用. 本研究还发现在HTG+AP组中ML-7干预后能抑制p-JNK表达, 被抑制程度达47%, 表明JNK通路受MLCK的调控. Cheng等[31]研究显示在动脉粥样硬化模型中, MLCK的表达量及活性升高, 但褪黑素能通过抑制ERK、JNK通路的表达下调MLCK的活性及含量而起着重要的保护作用. 但在本研究中, 发现MLCK抑制剂能够抑制JNK的表达, 表明在HTGP的发生发展中MLCK可能通过激活JNK通路促进及加重急性胰腺炎的形成.
总之, 在HTGP中MLCK、 p-JNK表达增加及TJ增宽, 与胰腺损伤程度一致, 同时ML-7干预后可以改善细胞间TJ及抑制p-JNK的表达, 改善胰腺病理损伤. 表明MLCK可能与HTGP严重程度有关, MLCK可能通过改变细胞间TJ及调控JNK通路参与HTGP的形成, 本研究可能为HTGP的临床治疗提供理论依据及新方法.
随着饮食方式的改变, 高甘油三酯血症相关性急性胰腺炎发病率不断上升, 已成为继胆石性及酒精性后的最主要病因, 且具有发病重, 易复发等临床特点, 但其发病机制尚未阐明. 肌球蛋白轻链激酶(myosin light chain kinase, MLCK)参与肌肉收缩、细胞迁移、炎症等形成, 本文初步探讨MLCK在高甘油三酯血症相关性急性胰腺炎中的作用.
丁震, 副主任医师, 武汉协和医院消化内科
MLCK存在于肌细胞及非肌细胞中, MLCK在非肌细胞中的作用受到越来越多的关注, 但MLCK在急性胰腺炎的研究尚缺乏报道. 本研究通过建立高甘油三酯血症相关性急性胰腺炎模型并利用MLCK抑制剂ML-7干预, 初步探讨MLCK是否与高甘油三酯血症相关性急性胰腺炎有关及其作用机制.
研究表明在动脉粥样硬化模型中, MLCK的表达量及活性升高, 但褪黑素能通过抑制ERK、JNK通路的表达下调MLCK的活性及含量而起着重要的保护作用. 但在高甘油三酯血症相关性急性胰腺炎中MLCK与JNK通路的研究尚缺乏报道.
本文研究了MLCK在高甘油三酯血症相关性急性胰腺炎中的表达及作用, 初步探讨了一种用于判断高甘油三酯血症相关性急性胰腺炎严重程度的新型指标: MLCK, 并且初步探讨了MLCK在高甘油三酯血症相关性急性胰腺炎中的作用及机制.
本研究发现MLCK在高甘油三酯血症相关性急性胰腺炎中表达增加, 同时其抑制剂可以改善胰腺病理损伤、改善紧密连接(tight junction, TJ)及抑制JNK的表达, 表明MLCK可能与高甘油三酯血症相关性急性胰腺炎的严重程度有关, 其可能通过改变细胞间TJ及调节JNK通路参与高甘油三酯血症相关性急性胰腺炎的形成, 为高甘油三酯血症相关性急性胰腺炎的临床治疗提供理论依据及新方法.
MLCK: 广泛存在于平滑肌、骨骼肌、心肌以及哺乳动物的非肌细胞中, 主要以smMLCK、skMLCK、cMLCK和nmMLCK 4种形式存在. MLCK结构由N端肌动蛋白结合区、中心激酶区、钙调蛋白结合区以及C端肌球蛋白结合区组成.
本文主要探讨一种用于判断高甘油三酯血症相关性急性胰腺炎严重程度的新型指标-肌球蛋白轻链激酶, 实验方案设计完整, 分组明确, 条理清晰, 有创新性, 结论具有临床意义, 扩展了急性胰腺炎发病机制的研究.
编辑: 于明茜 电编: 都珍珍
| 1. | Ewald N, Hardt PD, Kloer HU. Severe hypertriglyceridemia and pancreatitis: presentation and management. Curr Opin Lipidol. 2009;20:497-504. [PubMed] [DOI] |
| 2. | Shen Q, Rigor RR, Pivetti CD, Wu MH, Yuan SY. Myosin light chain kinase in microvascular endothelial barrier function. Cardiovasc Res. 2010;87:272-280. [PubMed] [DOI] |
| 3. | Nishida M, Yoshida M, Nishiumi S, Furuse M, Azuma T. Claudin-2 regulates colorectal inflammation via myosin light chain kinase-dependent signaling. Dig Dis Sci. 2013;58:1546-1559. [PubMed] [DOI] |
| 4. | Turner JR. Intestinal mucosal barrier function in health and disease. Nat Rev Immunol. 2009;9:799-809. [PubMed] [DOI] |
| 6. | Gao L, Grant A, Halder I, Brower R, Sevransky J, Maloney JP, Moss M, Shanholtz C, Yates CR, Meduri GU. Novel polymorphisms in the myosin light chain kinase gene confer risk for acute lung injury. Am J Respir Cell Mol Biol. 2006;34:487-495. [PubMed] [DOI] |
| 7. | Mirzapoiazova T, Moitra J, Moreno-Vinasco L, Sammani S, Turner JR, Chiang ET, Evenoski C, Wang T, Singleton PA, Huang Y. Non-muscle myosin light chain kinase isoform is a viable molecular target in acute inflammatory lung injury. Am J Respir Cell Mol Biol. 2011;44:40-52. [PubMed] [DOI] |
| 8. | Wang T, Moreno-Vinasco L, Ma SF, Zhou T, Shimizu Y, Sammani S, Epshtein Y, Watterson DM, Dudek SM, Garcia JG. Nonmuscle myosin light chain kinase regulates murine asthmatic inflammation. Am J Respir Cell Mol Biol. 2014;50:1129-1135. [PubMed] [DOI] |
| 9. | Zhou X, Liu Y, You J, Zhang H, Zhang X, Ye L. Myosin light-chain kinase contributes to the proliferation and migration of breast cancer cells through cross-talk with activated ERK1/2. Cancer Lett. 2008;270:312-327. [PubMed] [DOI] |
| 10. | Chen C, Wang P, Su Q, Wang S, Wang F. Myosin light chain kinase mediates intestinal barrier disruption following burn injury. PLoS One. 2012;7:e34946. [PubMed] [DOI] |
| 11. | Moriez R, Salvador-Cartier C, Theodorou V, Fioramonti J, Eutamene H, Bueno L. Myosin light chain kinase is involved in lipopolysaccharide-induced disruption of colonic epithelial barrier and bacterial translocation in rats. Am J Pathol. 2005;167:1071-1079. [PubMed] [DOI] |
| 12. | Ferrier L, Mazelin L, Cenac N, Desreumaux P, Janin A, Emilie D, Colombel JF, Garcia-Villar R, Fioramonti J, Bueno L. Stress-induced disruption of colonic epithelial barrier: role of interferon-gamma and myosin light chain kinase in mice. Gastroenterology. 2003;125:795-804. [PubMed] [DOI] |
| 13. | Schmidt J, Rattner DW, Lewandrowski K, Compton CC, Mandavilli U, Knoefel WT, Warshaw AL. A better model of acute pancreatitis for evaluating therapy. Ann Surg. 1992;215:44-56. [PubMed] [DOI] |
| 14. | Lindkvist B, Appelros S, Regnér S, Manjer J. A prospective cohort study on risk of acute pancreatitis related to serum triglycerides, cholesterol and fasting glucose. Pancreatology. 2012;12:317-324. [PubMed] [DOI] |
| 15. | Zhang XL, Li F, Zhen YM, Li A, Fang Y. Clinical Study of 224 Patients with Hypertriglyceridemia Pancreatitis. Chin Med J (Engl). 2015;128:2045-2049. [PubMed] [DOI] |
| 16. | Lloret Linares C, Pelletier AL, Czernichow S, Vergnaud AC, Bonnefont-Rousselot D, Levy P, Ruszniewski P, Bruckert E. Acute pancreatitis in a cohort of 129 patients referred for severe hypertriglyceridemia. Pancreas. 2008;37:13-12. [PubMed] [DOI] |
| 17. | Kamm KE, Stull JT. Dedicated myosin light chain kinases with diverse cellular functions. J Biol Chem. 2001;276:4527-4530. [PubMed] [DOI] |
| 18. | Belvitch P, Adyshev D, Elangovan VR, Brown ME, Naureckas C, Rizzo AN, Siegler JH, Garcia JG, Dudek SM. Proline-rich region of non-muscle myosin light chain kinase modulates kinase activity and endothelial cytoskeletal dynamics. Microvasc Res. 2014;95:94-102. [PubMed] [DOI] |
| 19. | Pio R, Martinez A, Unsworth EJ, Kowalak JA, Bengoechea JA, Zipfel PF, Elsasser TH, Cuttitta F. Complement factor H is a serum-binding protein for adrenomedullin, and the resulting complex modulates the bioactivities of both partners. J Biol Chem. 2001;276:12292-12300. [PubMed] [DOI] |
| 20. | Clayburgh DR, Barrett TA, Tang Y, Meddings JB, Van Eldik LJ, Watterson DM, Clarke LL, Mrsny RJ, Turner JR. Epithelial myosin light chain kinase-dependent barrier dysfunction mediates T cell activation-induced diarrhea in vivo. J Clin Invest. 2005;115:2702-2715. [PubMed] [DOI] |
| 21. | Qasim M, Rahman H, Ahmed R, Oellerich M, Asif AR. Mycophenolic acid mediated disruption of the intestinal epithelial tight junctions. Exp Cell Res. 2014;322:277-289. [PubMed] [DOI] |
| 22. | Cheng X, Wang X, Wan Y, Zhou Q, Zhu H, Wang Y. Myosin light chain kinase inhibitor ML7 improves vascular endothelial dysfunction via tight junction regulation in a rabbit model of atherosclerosis. Mol Med Rep. 2015;12:4109-4116. [PubMed] [DOI] |
| 24. | Yoshida H, Nozu F, Lankisch TO, Mitamura K, Owyang C, Tsunoda Y. A possible role for Ca(2+)/calmodulin-dependent protein kinase IV during pancreatic acinar stimulus-secretion coupling. Biochim Biophys Acta. 2000;1497:155-167. [PubMed] |
| 25. | Jung SR, Kim MH, Hille B, Koh DS. Control of granule mobility and exocytosis by Ca2+ -dependent formation of F-actin in pancreatic duct epithelial cells. Traffic. 2009;10:392-410. [PubMed] [DOI] |
| 26. | Dabrowski A, Grady T, Logsdon CD, Williams JA. Jun kinases are rapidly activated by cholecystokinin in rat pancreas both in vitro and in vivo. J Biol Chem. 1996;271:5686-5690. [PubMed] [DOI] |
| 27. | Wagner AC, Mazzucchelli L, Miller M, Camoratto AM, Göke B. CEP-1347 inhibits caerulein-induced rat pancreatic JNK activation and ameliorates caerulein pancreatitis. Am J Physiol Gastrointest Liver Physiol. 2000;278:G165-G172. [PubMed] |
| 28. | Yun SW, Bae GS, Kim MS, Park KC, Koo BS, Kim BJ, Kim TH, Seo SW, Shin YK, Lee SH. Melittin inhibits cerulein-induced acute pancreatitis via inhibition of the JNK pathway. Int Immunopharmacol. 2011;11:2062-2072. [PubMed] [DOI] |
| 29. | Jo IJ, Bae GS, Choi SB, Kim DG, Shin JY, Seo SH, Choi MO, Kim TH, Song HJ, Park SJ. Fisetin attenuates cerulein-induced acute pancreatitis through down regulation of JNK and NF-κB signaling pathways. Eur J Pharmacol. 2014;737:149-158. [PubMed] [DOI] |
| 30. | Kim DG, Bae GS, Choi SB, Jo IJ, Shin JY, Lee SK, Kim MJ, Kim MJ, Jeong HW, Choi CM. Guggulsterone attenuates cerulein-induced acute pancreatitis via inhibition of ERK and JNK activation. Int Immunopharmacol. 2015;26:194-202. [PubMed] [DOI] |
| 31. | Cheng X, Wan Y, Xu Y, Zhou Q, Wang Y, Zhu H. Melatonin alleviates myosin light chain kinase expression and activity via the mitogen-activated protein kinase pathway during atherosclerosis in rabbits. Mol Med Rep. 2015;11:99-104. [PubMed] [DOI] |