修回日期: 2015-11-26
接受日期: 2015-11-30
在线出版日期: 2016-01-08
目的: 采用RNA干扰技术(RNA interference, RNAi)抑制骨形态发生蛋白7(bone morphogenetic protein 7, BMP7)的表达, 观察BMP7基因沉默对人肝癌HepG2细胞增殖和迁移的影响.
方法: 设计并化学合成针对BMP7的3对小干扰RNA(small interfering RNA, siRNA), 使用TransLipid® HL Transfection Reagent瞬时转染人肝癌HepG2细胞, 并设正常对照组、Negative-siRNA组及BMP7-siRNA-1、BMP7-siRNA-2、BMP7-siRNA-3转染组. 运用半定量逆转录聚合酶链反应(reverse transcription-polymerase chain reaction, RT-PCR)和Western blot法分别从mRNA和蛋白水平检测HepG2细胞中BMP7的表达变化, 选取沉默效果最明显的siRNA片段进行后续实验. 采用MTT比色法及Transwell迁移实验分别检测转染后细胞增殖及迁移的变化, Western blot法检测各组细胞凋亡相关蛋白(Bax、Bcl-2、Caspase3)表达情况, 流式细胞仪检测转染后细胞周期变化.
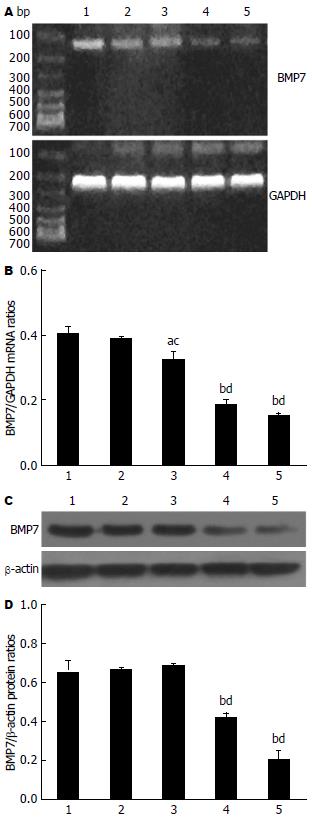
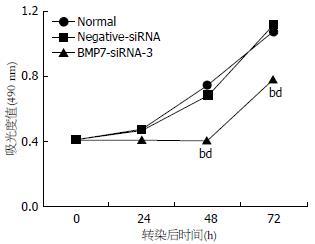
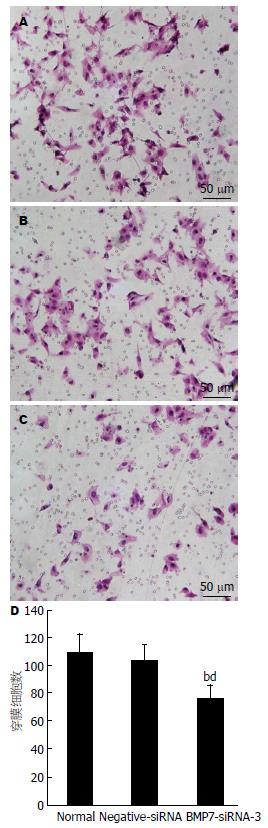
结果: RT-PCR和Western blot结果显示, BMP7-siRNA-3转染组BMP7抑制效果最明显(P<0.01), 选取BMP7-siRNA-3转染组进行后续实验. MTT比色法显示, 转染后48, 72 h细胞生长增殖均受到抑制(P<0.01). Transwell迁移实验显示, 转染24 h后, BMP7-siRNA-3转染组HepG2细胞穿膜数均明显低于正常组和Negative-siRNA组(P<0.01). Western blot检测发现BMP7-siRNA-3组比对照组的细胞凋亡相关蛋白Bax、Caspase3表达增加(P<0.01), Bcl-2表达差异无统计学意义. 流式细胞仪检测发现转染后48 h, BMP7-siRNA-3组HepG2细胞被阻滞在G2期(P<0.01).
结论: siRNA介导BMP7基因沉默对人肝癌HepG2细胞的增殖与迁移具有抑制作用, 对细胞凋亡有促进作用, 并可阻滞细胞在G2期.
核心提示: 骨形态发生蛋白7(bone morphogenetic protein 7, BMP7)可促进人肝癌HepG2细胞的增殖与迁移, 小干扰RNA(small interfering RNA)介导BMP7基因沉默对其具有抑制作用, 可促进细胞凋亡, 并阻滞细胞在G2期. BMP7或许可以成为肝癌基因治疗的一个新靶点.
引文著录: 卢燕军, 付陆军, 杨家进, 曾鹏, 蒋为民, 吴建兵. siRNA介导BMP7基因沉默对人肝癌HepG2细胞增殖和迁移的影响. 世界华人消化杂志 2016; 24(1): 10-18
Revised: November 26, 2015
Accepted: November 30, 2015
Published online: January 8, 2016
AIM: To investigate the effect of small interfering RNA (siRNA) mediated bone morphogenetic protein 7 (BMP7) knockdown on the proliferation and migration of human hepatoma HepG2 cells.
METHODS: Three pairs of siRNAs targeting BMP7 were transiently transfected into HepG2 cells using TransLipid HL Transfection Reagent. HepG2 cells were divided into five groups including a normal control group, a negative-siRNA group and three transfected groups (transfected with BMP7-siRNA-1, BMP7-siRNA-2, and BMP7-siRNA-3, respectively). The expression of BMP7 mRNA and protein was measured by reverse transcript-polymerase chain reaction (RT-PCR) and Western blot, respectively, and the optimal siRNA sequence for BMP7 silencing was selected. The proliferation and migration of HepG2 cells after transfection were assessed by MTT assay and transwell migration assay, respectively. The expression of apoptosis-related proteins (Bax, Bcl-2, and Caspase3) in each group was determined by Western blot, and the cell cycle was analyzed by flow cytometry.
RESULTS: BMP7-siRNA-3 group demonstrated the lowest level of BMP7 expression among the five groups (P < 0.01). Cell growth was significantly slower in the BMP7-siRNA-3 group than in the control groups 48 h and 72 h after cells were transfected (P < 0.01). The numbers of cell passing the membrane were significantly lower in the BMP7-siRNA-3 group than in the control groups 24 h after cells were transfected (P < 0.01). The expression of Bax and Caspase3 (P < 0.01) was significantly increased after BMP7 silencing, and there was no statistically significant difference in the Bcl-2 expression. Flow cytometery showed that cells were significantly blocked in G2 phase 48 h after cells were transfected with BMP7-siRNA-3 (P < 0.01).
CONCLUSION: SiRNA mediated BMP7 knockdown can inhibit HepG2 cell proliferation and migration, promote apoptosis and block cells in G2 phase.
- Citation: Lu YJ, Fu LJ, Yang JJ, Zeng P, Jiang WM, Wu JB. Effect of siRNA mediated bone morphogenetic protein 7 knockdown on cell proliferation and migration in human hepatoma cell line HepG2. Shijie Huaren Xiaohua Zazhi 2016; 24(1): 10-18
- URL: https://www.wjgnet.com/1009-3079/full/v24/i1/10.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i1.10
肝癌是世界范围内癌症死亡率很高的常见肿瘤, 男性多于女性, 是男性第二大癌症致死原因, 我国肝癌发病及死亡数约占全球的50%[1], 严重威胁我国人民健康和生命. 骨形态发生蛋白(bone morphogenetic proteins, BMPs)是一组能广泛参与调节多种细胞的增殖、分化和凋亡的生物学过程的功能蛋白, 能调节细胞的生长、增殖、迁移和胚胎干细胞的自我更新. BMPs的表达不但涉及胚胎、器官的形成, 更包括肿瘤疾病的形成和发展. BMPs除了可以诱导间充质干细胞向骨形成细胞分化外, 还可诱导各种血管活性因子形成并刺激内皮细胞的迁移和新生血管形成[2]. 细胞迁移是器官形成和肿瘤发生的生物学基础, 在肿瘤的侵袭、转移中, BMPs扮演了十分重要的角色. BMP7属于转化生长因子-β(transforming growth factor beta, TGF-β)超家族的成员之一, 现越来越多的研究显示BMP7在多种上皮细胞性肿瘤中显著表达, 如乳腺癌、原发性黑色素瘤、前列腺癌和结直肠癌等[3-6]. 但目前对BMP7基因变化与肝癌恶性分化程度、增殖、侵袭、转移及复发等恶性生物学特征的关系国内外鲜有研究报道. 本研究采用siRNA介导BMP7基因沉默探讨对肝癌细胞的增殖、迁移等恶性生物学特性的影响.
人肝癌HepG2细胞由江西省分子医学重点实验室保存提供. DMEM培养基购自博士德生物有限公司. TRIzol、TransLipid® HL Transfection Reagent、胰酶均购自北京全式金有限公司. 胎牛血清购自Biological Iindustries(BI). BMP7及GAPDH内参引物由南京金斯瑞生物科技有限公司合成. 逆转录试剂盒及PCR试剂盒均购自大连TaKaRa公司. 蛋白抽提试剂盒及BCA蛋白定量试剂盒均购自上海超研生物科技有限公司. 兔抗人BMP7多克隆抗体、羊抗兔β-actin多克隆抗体均购自Proteintech公司. Caspase3多克隆抗体、Bcl-2多克隆抗体及Bax多克隆抗体均购自ImmunoWay公司. 四甲基偶氮唑蓝(MTT)和二甲基亚砜(DMSO)均购自Sigma-Aldrich公司. siRNA序列由江苏百奥迈科生物技术有限公司设计合成及纯化.
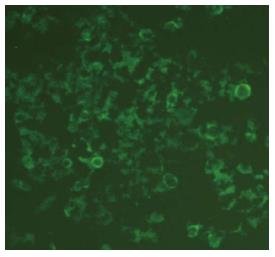
1.2.1 细胞培养与转染: 将人肝癌HepG2细胞以每孔1×105个接种于六孔板, 用含10%胎牛血清DMEM培养基于37 ℃、50 mL/L CO2培养箱中培养, 生长至50%-70%融合度时, 参照TransLipid® HL Transfection Reagent说明书, 以80 nmol/L终浓度用TransLipid® HL Transfection Reagent转染各种siRNA. 转染前细胞用无血清DMEM培养基2 mL培养2 h. 转染后6 h, 更换常规含10%胎牛血清DMEM培养基继续培养. 实验设置正常(Normal)组、阴性siRNA(Negative siRNA)组、BMP7-siRNA-1、BMP7-siRNA-2及BMP7-siRNA-3转染组. 转染后6 h, 在荧光显微镜下观察HepG2细胞绿色荧光蛋白表达情况, 随机选取10个低倍视野, 计数转染细胞占细胞总数的百分比来评价转染效率.
1.2.2 RT-PCR检测人肝癌HepG2细胞BMP7 mRNA水平表达: siRNA转染24 h后收集细胞, 采用TRIzol法提取细胞总RNA, 逆转录合成cDNA, 再以cDNA为模板进行PCR扩增. BMP7引物上游序列为5'-CACGCTACCACCATCGAGAG-3', 引物下游序列为5'-GCTGATCCGGAACGTCTCAT-3', PCR产物长度134 bp; 内参照GAPDH引物上游序列为5'-GTTGGAGGTCGGAGTCAACGGA-3', 引物下游序列为5'-GAGGGATCTCGCTCCTGGAGGA-3', PCR产物长度240 bp. PCR扩增条件: 94 ℃预变性5 min, 然后94 ℃变性30 s, 60 ℃退火30 s, 72 ℃延伸30 s, 共33个循环, 最后72 ℃延伸8 min. 取5 µL PCR产物于1.5%琼脂糖凝胶电泳后拍照并于凝胶图像分析系统进行扫描分析, 计算BMP7 mRNA与GAPDH mRNA的比值, 实验重复3次.
1.2.3 Western blot检测人肝癌HepG2细胞BMP7、Bcl-2、Bax及Caspase3蛋白水平表达: siRNA转染48 h后收集细胞, 提取总蛋白质: 将预冷至4 ℃的5倍体积的裂解缓冲液加入到经PBS漂洗的各培养组细胞中, 冰上作用20 min, 于4 ℃, 12000 g离心2 min后取上清液-20 ℃保存备用. 采用BCA法测定蛋白质浓度, 以60 µg/孔上样, 在10%SDS-PAGE凝胶进行电泳分离(浓缩胶80 V、分离胶120 V)后, 转移至硝酸纤维素膜(260 mA转膜90 min)上, 然后用含5%脱脂奶粉的TBST中室温封闭4 h, 加入1:500稀释的兔抗人BMP7抗体, 4 ℃孵育过夜, 经TBST洗涤10 min×3次后, 加入1:10000稀释的辣根过氧化物酶(horseradish peroxidase, HRP)标记的羊抗兔IgG室温孵育2 h, TBST洗涤10 min×3次. 最后, ECL发光显色, X胶片曝光, 采集图像, 使用Image-Pro Plus软件对目的蛋白进行定量分析. 以β-actin为内参照, 目的蛋白量 = 目的蛋白条带光密度/β-actin条带光密度, 实验重复3次.
1.2.4 BMP7-siRNA靶序列的设计与合成: 3对BMP7-siRNA序列由江苏百奥迈科生物技术有限公司设计合成和纯化, 分别命名为BMP7-siRNA-1、BMP7-siRNA-2及BMP7-siRNA-3并设计阴性对照siRNA, 序列如表1.
| RNA名称 | 序列(5'-3') | 修饰 |
| hs-BMP7-siRNA-1 | 正义链: CAG CCG AAU UCC GGA UCU AdTdT | 无 |
| 反义链: UAG AUC CGG AAU UCG GCU GdTdT | ||
| hs-BMP7-siRNA-2 | 正义链: CAC AAC UCG GCA CCC AUG UdTdT | 无 |
| 反义链: ACA UGG GUG CCG AGU UGU GdTdT | ||
| hs-BMP7-siRNA-3 | 正义链: CCG UCC UCU ACU UCG AUG AdTdT | 无 |
| 反义链: UCA UCG AAG UAG AGG ACG GdTdT | ||
| Negative siRNA | 正义链: UUC UCC GAA CGU GUC ACG UdTdT | FAM或无 |
| 反义链: ACG UGA CAC GUU CGG AGA AdTdT |
1.2.5 MTT法绘制细胞生长曲线: 收集转染后24 h后细胞, 将细胞重悬, 以每孔5×103个接种于96孔板, 每孔200 µL, 并设置5个复孔. 继续培养细胞0、24、48及72 h, 采用MTT法检测细胞生长活性(以490 nm波长处的吸光度值表示), 待测孔加入20 µL MTT, 4 h后弃去旧培养基, 每孔加入150 µL DMSO后水平摇床上轻摇10 min使结晶充分溶解, 在酶标仪上于490 nm波长处测定吸光度值, 以MTT比色值为纵坐标, 时间为横坐标绘制出各组细胞的生长曲线.
1.2.6 Transwell小室检测细胞迁移能力: 将各组肝癌HepG2细胞饥饿24 h后, 以每孔5×103个接种到24孔板用8 µm Transwell小室上室面, 上室培养液采用100 µL不含胎牛血清的DMEM培养基, 下室培养液为500 µL含10%胎牛血清DMEM培养基, 即以血清为趋化因子, 细胞穿过聚碳酸酯膜到下室面, 其穿膜数反映了细胞迁移能力的大小. 培养24 h后采用HE染色下室面的细胞, 在镜下观察并拍照, 随机取5个视野的BMP7-siRNA组、正常组和Negative siRNA组细胞, 检测各组平均穿膜细胞数(numbers of cell permeating septum, NCPS), 进行统计分析.
1.2.7 流式细胞术检测细胞周期: 用0.25%不含EDTA胰蛋白酶消化收集转染48 h后的细胞, 1000 r/min离心5 min, PBS洗涤1遍, 离心, 加入1 mL 700 mL/L乙醇溶液, 固定过夜, 次日重悬细胞于500 µL PBS, 加入2 g/L碘化丙啶(propidium iodide, PI)后, 避光孵育30 min, 然后用流式细胞仪计数各细胞周期的细胞数.
统计学处理 采用SPSS17.0软件进行统计学分析. 采用单因素方差分析进行显著性检验, 以mean±SD表示. 每组实验重复3次, 组间多重比较采用LSD检验. 以P<0.05为差异有统计学意义.
结果示转染效率达91.330%±2.082%, 各转染组之间转染效率无明显差异. 图1示绿色荧光蛋白表达情况.
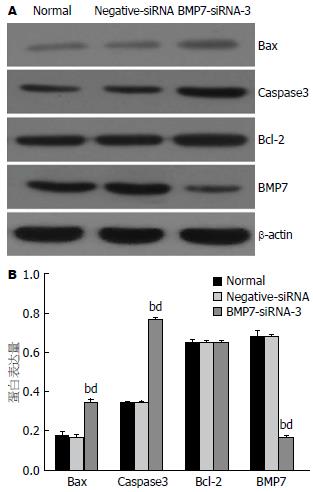
RT-PCR和Western blot结果显示BMP7-siRNA-2及BMP7-siRNA-3组均较Negative-siRNA组有不同程度下调(P<0.01), 其中BMP7-siRNA-3组BMP7下调最明显. 而正常组、Negative-siRNA组及BMP7-siRNA-1转染组BMP7蛋白表达水平无明显差异(图2). 因此, 选取BMP7沉默效应最显著的BMP7-siRNA-3进行后续实验.
采用MTT法检测细胞0、24、48和72 h的生长活性(以490 nm波长处的吸光度值表示), 以MTT比色值为纵坐标, 时间为横坐标绘制出各组细胞的生长曲线, 结果显示BMP7-siRNA-3组转染后48、72 h细胞生长较正常组和Negative-siRNA组明显受到抑制(P<0.01, 图3).
细胞穿过Transwell小室聚碳酸酯膜到下室面, 其穿膜数反映了细胞迁移能力的大小. 培养24 h后采用HE染色下室面的细胞, 在镜下观察并拍照, 随机取5个视野的BMP7-siRNA-3组、正常组、Negative-siRNA组细胞, 检测各组穿膜细胞数, 分别为76.00个±9.67个、108.20个±15.90个、103.80个±11.15个, 提示siRNA介导BMP7基因沉默后, 人肝癌HepG2细胞的迁移能力降低, 与正常组、Negative-siRNA组细胞比较, 差异有统计学意义(P<0.01, 图4).
Western blot检测结果发现BMP7-siRNA-3组下调BMP7后, Bax及Caspase3表达较正常组和Negative-siRNA组增加(P<0.01), Bcl-2表达无明显变化(图5).
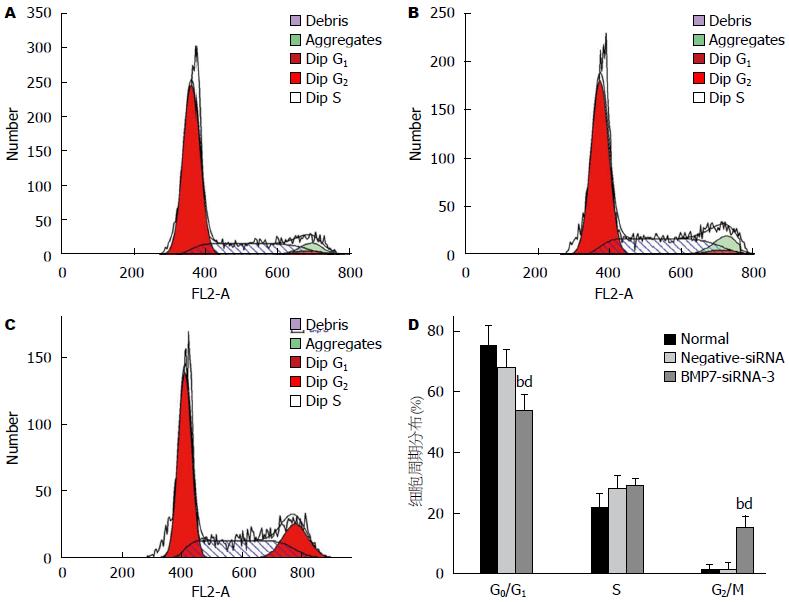
流式细胞术检测细胞周期结果显示, 正常组与Negative-siRNA组中HepG2细胞的细胞周期分布无明显差异, 而转染BMP7-siRNA-3组G2期细胞比例显著增高(P<0.01, 图6), 提示BMP7-siRNA转染能够阻滞细胞周期在G2期.
BMPs是一组能广泛参与调节多种细胞的增殖、分化和凋亡的生物学过程的功能蛋白, 在肿瘤的侵袭、转移中, BMPs扮演了十分重要的角色[7]. BMP成员通过其受体来发挥自身的生物学功能. 首先激活的Ⅱ型受体磷酸化下游Ⅰ型受体, 然后通过磷酸化Smad1、5、8蛋白启动细胞内信号传导, 继而直接或间接通过DNA结合蛋白或重新合成蛋白质来调节靶基因的转录[8]. BMPs可以结合不同的Ⅰ型受体, 表现为信号传递的多样性, 且Ⅰ型受体决定信号传递的特异性[9]. 然而, 另有研究证实BMPs与Ⅰ型受体的结合也具有一定的选择性, 例如: BMP7倾向于与ACVR1A优先结合, 同时他与BMPR1A、BMPR1B也有一定的亲和力, 而BMP2、BMP4倾向于与BMPR1A结合[10-12]. 因此, BMPs信号传导途径(BMPs-BMPRs-Smads-细胞核内基因转录-蛋白质产生)上任何一个环节出现异常均可导致细胞的表型发生改变从而导致肿瘤形成和发展. Piccirillo等[13]报道BMP-BMPR信号系统控制正常脑干细胞的活动, 在恶性胶质瘤形成初期起关键的抑制作用, BMPs可以作为人恶性胶质瘤一个非细胞毒治疗的新靶点. Busch等[14]发现BMP2可以增加黑素瘤B16-F1细胞的侵袭性, 而用BMPs的天然拮抗剂Noggin预处理细胞后则可以阻断该细胞的侵袭力和肿瘤形成的能力. Montesano[15]发现BMP4可促进乳房上皮细胞侵袭性生长, 诱导乳房上皮细胞向外侵袭性生长, 导致细胞与细胞之间黏连的断裂, 使细胞分散, 并促使个体细胞进入周围的胶原基质中, 从而增加细胞的侵袭性, 促使乳腺癌的形成. Deng等[16]研究认为过表达BMP4可以对抗血清饥饿诱导的细胞凋亡和增加其迁移和侵袭性. Darby等[17]报道 BMP6对前列腺癌PC3M和DU145细胞的增殖无明显增强作用, 但显著增加了细胞的迁移和侵袭性, 同时也观察到BMP6可以诱导金属蛋白酶MMP1和MMP9 mRNA以及丝裂素活化蛋白激酶(mitogen-activated protein kinase, MAPK)磷酸化水平的升高. Langenfeld等[18]发现BMP2能显著地增加裸鼠中A549细胞形成的肿瘤中的血管生成, 证明BMP2通过刺激血管生成来促进肿瘤生长. Maegdefrau等[19]研究也认为BMPs在肝细胞癌中广泛表达, 且主要通过激活Smad信号通路对肝癌的生物学行为产生影响.
BMP7又称为成骨蛋白-1(osteogenic protein 1, OP-1), 作为TGF-β超家族的成员之一, 最初发现其能够诱导骨细胞分化, 骨和软骨形成. 近年来, 越来越多的研究发现BMP7可促进细胞增殖, 增加肿瘤细胞的侵袭性, 并促进肿瘤转移. 因为研究[20]发现BMP7有可能在骨微环境中诱导前列腺癌干细胞样细胞的休眠而被评为"2011年度分子". Alarmo等[3]研究22种乳腺癌细胞株和146例原发性乳腺癌患者时发现BMP7基因在原发性乳腺癌中均有显著表达, 而乳腺癌细胞各亚型中差异性并不显著, 因此推测BMP7在乳腺癌的发生发展中有一定作用, 此后其进一步研究认为BMP7可能对乳腺癌患者骨转移高风险的识别具有临床价值, 这也是首次证实骨诱导因子BMP7与乳腺癌骨转移相关[21].
而在消化系肿瘤当中, 有关BMP7研究也成为近年国内外肿瘤研究的热点. Motoyama等[6]研究65例结直肠癌患者和正常结直肠组织中BMP7基因和蛋白表达水平时发现结直肠癌组织中BMP7表达高于正常结直肠组织, 且其表达水平与肿瘤侵犯的深度、病理学侵袭性如肝转移相关, 因此认为BMP7基因表达是结直肠癌患者预后的一个非常有用信号. Aoki等[22]研究了233例胃癌患者, 其中129例(55%)BMP7表达阳性, 发现BMP7阳性与肿瘤大小、淋巴转移、淋巴管浸润、血管侵犯及组织学相关(P<0.05), 并且与患者术后结果密切相关, 多元分析显示BMP7表达情况是仅次于浸润深度和淋巴转移的一个独立的预后因素(P<0.01). Megumi等[23]研究了180例行外科切除的食管鳞癌(esophageal squamous cell carcinoma, ESCC)患者, 发现61.7%的肿瘤标本中BMP7表达阳性, 且BMP7阳性组患者肿瘤进展更深、分期更晚、静脉血管侵袭更广泛、预后更差, 多元分析显示BMP7表达状态是一个独立的预后因素, 从而认为BMP7表达阳性的ESCC患者其恶性潜能更高, BMP7可以作为ESCC的预后标志物. Xu等[24]研究认为BMP7可能通过调节E-cad和MMP-9的表达来影响ESCC的迁移和淋巴结转移. Duangkumpha等[25]研究显示BMP7通过抑制TGF-β介导的Twist和N-cadherin表达来抑制TGF-β诱导的胆管癌细胞迁移. 此外, 亦有研究[4,5,26]发现BMP7具有抑制和促进多种肿瘤发生发展的双重作用.
正因为BMPs与肿瘤关系是如此的密切, 我们在前期的研究[27]当中发现BMP2可通过细胞外调节蛋白激酶(extracellular regulated protein kinases, ERK)信号通路下调MMP2、MMP9对肝癌的侵袭发挥重要作用. 另外, 沉默骨形成蛋白受体-Ⅱ(bone morphogenetic protein receptor Ⅱ, BMPR-Ⅱ)后可以抑制肝癌细胞的增殖和侵袭, 通过MAPK/ERK 1/2信号通路及MAPK/P38信号通路下调VEGF-C的表达是其可能的参与机制[28]. 但有关BMP7对肝癌细胞生物学功能影响的系统研究在国内外鲜有报道. 本研究采用siRNA干扰使BMP7 mRNA和蛋白表达均受到不同程度抑制, MTT比色法显示, 转染后48 h, 72 h细胞生长增殖均受到抑制(P<0.01). Transwell迁移实验显示, 转染24 h后, BMP7-siRNA-3转染组HepG2细胞穿膜数均明显低于正常组和Negative-siRNA组(P<0.01). Western blot检测发现BMP7-siRNA-3组比对照组的细胞凋亡相关蛋白Bax、Caspase3表达增加(P<0.01), Bcl-2表达差异无统计学意义. 流式细胞仪检测发现BMP7-siRNA-3组HepG2细胞被阻滞在G2期(P<0.01). 因此, 我们认为siRNA介导BMP7基因沉默对人肝癌HepG2细胞的增殖与迁移具有抑制作用, 可促进细胞凋亡, 并阻滞细胞在G2期. 这一结果依旧支持BMP7表达可以提高肿瘤细胞的迁移和侵袭能力这一观点[29,30]. 但是BMP7促进肝癌细胞增殖迁移和侵袭的分子机制还需要进一步研究.
肿瘤的发生发展是一个多基因参与、多因素介导的过程, 肝癌作为一种高度恶性肿瘤, 其具有的高度侵袭和转移能力是临床肝癌治疗颇为棘手的难题, 也是影响其预后的关键因素. 我们研究认为BMP7在肝癌的发生发展当中起着重要作用, 或许可以成为肝癌基因治疗的一个新靶点.
肝癌是世界范围内死亡率很高的疾病, 我国肝癌发病及死亡数约占全球的50%, 严重威胁人民生命健康. 本研究采用小干扰RNA(small interfering RNA, siRNA)介导骨形态发生蛋白7(bone morphogenetic protein 7, BMP7)基因沉默探讨对肝癌细胞的增殖、迁移等恶性生物学特性的影响, 可能为肝癌基因治疗提供新靶点.
王阁, 教授, 中国人民解放军第三军医大学第三附属医院
近年来BMPs与肿瘤发生发展关系的研究成为国内外研究热点, 但有关BMP7对肝癌细胞生物学功能影响的系统研究在国内外鲜有报道. 本文通过siRNA介导BMP7基因沉默探讨其对肝癌发生发展的影响.
前期学者的研究已经发现BMP7在结直肠癌、胃癌、食管鳞癌等肿瘤组织或细胞中过表达, 且其表达水平与肿瘤侵犯深度、病理学侵袭性以及预后相关, 亦有研究发现BMP7具有抑制和促进多种肿瘤发生发展的双重作用. 我们的前期研究发现BMP-2、BMP-6、骨形态发生蛋白受体Ⅱ参与肝癌增殖和侵袭并探讨了其分子机制, 本研究为前期课题的延续, 进一步完善BMPs在肝癌发生发展中的作用.
本研究在BMP7基因沉默对肝癌增殖侵袭方面进行了初步探索, 首次从mRNA和蛋白水平检测BMP7在肝癌细胞中的表达水平, 并采用siRNA沉默BMP7基因检测其对肝癌细胞生物学活性的影响, 或许对于寻找肝癌治疗的新靶点有一定价值.
探讨BMP7表达对肝癌发生发展的影响及预后、侵袭的提示意义, 为肝癌临床诊疗寻找新的肿瘤标志物以及肝癌基因治疗提供新靶点.
本文探讨siRNA 介导BMP7基因沉默对人肝癌HepG2细胞增殖和迁移作用, 整篇文章目的明确, 方法合理, 实验图片精良, 讨论详尽, 内容描述准确.
编辑: 郭鹏 电编: 都珍珍
| 1. | Torre LA, Bray F, Siegel RL, Ferlay J, Lortet-Tieulent J, Jemal A. Global cancer statistics, 2012. CA Cancer J Clin. 2015;65:87-108. [PubMed] [DOI] |
| 2. | Langenfeld EM, Langenfeld J. Bone morphogenetic protein-2 stimulates angiogenesis in developing tumors. Mol Cancer Res. 2004;2:141-149. [PubMed] |
| 3. | Alarmo EL, Rauta J, Kauraniemi P, Karhu R, Kuukasjärvi T, Kallioniemi A. Bone morphogenetic protein 7 is widely overexpressed in primary breast cancer. Genes Chromosomes Cancer. 2006;45:411-419. [PubMed] [DOI] |
| 4. | Rothhammer T, Wild PJ, Meyer S, Bataille F, Pauer A, Klinkhammer-Schalke M, Hein R, Hofstaedter F, Bosserhoff AK. Bone morphogenetic protein 7 (BMP7) expression is a potential novel prognostic marker for recurrence in patients with primary melanoma. Cancer Biomark. 2007;3:111-117. [PubMed] |
| 5. | Yang S, Zhong C, Frenkel B, Reddi AH, Roy-Burman P. Diverse biological effect and Smad signaling of bone morphogenetic protein 7 in prostate tumor cells. Cancer Res. 2005;65:5769-5777. [PubMed] [DOI] |
| 6. | Motoyama K, Tanaka F, Kosaka Y, Mimori K, Uetake H, Inoue H, Sugihara K, Mori M. Clinical significance of BMP7 in human colorectal cancer. Ann Surg Oncol. 2008;15:1530-1537. [PubMed] [DOI] |
| 7. | Heinke J, Kerber M, Rahner S, Mnich L, Lassmann S, Helbing T, Werner M, Patterson C, Bode C, Moser M. Bone morphogenetic protein modulator BMPER is highly expressed in malignant tumors and controls invasive cell behavior. Oncogene. 2012;31:2919-2930. [PubMed] [DOI] |
| 8. | Wrana JL, Attisano L. The Smad pathway. Cytokine Growth Factor Rev. 2000;11:5-13. [PubMed] [DOI] |
| 9. | ten Dijke P, Korchynskyi O, Valdimarsdottir G, Goumans MJ. Controlling cell fate by bone morphogenetic protein receptors. Mol Cell Endocrinol. 2003;211:105-113. [PubMed] [DOI] |
| 10. | Greenwald J, Groppe J, Gray P, Wiater E, Kwiatkowski W, Vale W, Choe S. The BMP7/ActRII extracellular domain complex provides new insights into the cooperative nature of receptor assembly. Mol Cell. 2003;11:605-617. [PubMed] [DOI] |
| 11. | Macías-Silva M, Hoodless PA, Tang SJ, Buchwald M, Wrana JL. Specific activation of Smad1 signaling pathways by the BMP7 type I receptor, ALK2. J Biol Chem. 1998;273:25628-25636. [PubMed] [DOI] |
| 12. | Yamashita H, ten Dijke P, Huylebroeck D, Sampath TK, Andries M, Smith JC, Heldin CH, Miyazono K. Osteogenic protein-1 binds to activin type II receptors and induces certain activin-like effects. J Cell Biol. 1995;130:217-226. [PubMed] [DOI] |
| 13. | Piccirillo SG, Reynolds BA, Zanetti N, Lamorte G, Binda E, Broggi G, Brem H, Olivi A, Dimeco F, Vescovi AL. Bone morphogenetic proteins inhibit the tumorigenic potential of human brain tumour-initiating cells. Nature. 2006;444:761-765. [PubMed] [DOI] |
| 14. | Busch C, Drews U, Eisele SR, Garbe C, Oppitz M. Noggin blocks invasive growth of murine B16-F1 melanoma cells in the optic cup of the chick embryo. Int J Cancer. 2008;122:526-533. [PubMed] [DOI] |
| 15. | Montesano R. Bone morphogenetic protein-4 abrogates lumen formation by mammary epithelial cells and promotes invasive growth. Biochem Biophys Res Commun. 2007;353:817-822. [PubMed] [DOI] |
| 16. | Deng H, Makizumi R, Ravikumar TS, Dong H, Yang W, Yang WL. Bone morphogenetic protein-4 is overexpressed in colonic adenocarcinomas and promotes migration and invasion of HCT116 cells. Exp Cell Res. 2007;313:1033-1044. [PubMed] [DOI] |
| 17. | Darby S, Cross SS, Brown NJ, Hamdy FC, Robson CN. BMP-6 over-expression in prostate cancer is associated with increased Id-1 protein and a more invasive phenotype. J Pathol. 2008;214:394-404. [PubMed] [DOI] |
| 18. | Langenfeld EM, Bojnowski J, Perone J, Langenfeld J. Expression of bone morphogenetic proteins in human lung carcinomas. Ann Thorac Surg. 2005;80:1028-1032. [PubMed] [DOI] |
| 19. | Maegdefrau U, Bosserhoff AK. BMP activated Smad signaling strongly promotes migration and invasion of hepatocellular carcinoma cells. Exp Mol Pathol. 2012;92:74-81. [PubMed] [DOI] |
| 20. | Kobayashi A, Okuda H, Xing F, Pandey PR, Watabe M, Hirota S, Pai SK, Liu W, Fukuda K, Chambers C. Bone morphogenetic protein 7 in dormancy and metastasis of prostate cancer stem-like cells in bone. J Exp Med. 2011;208:2641-2655. [PubMed] [DOI] |
| 21. | Alarmo EL, Korhonen T, Kuukasjärvi T, Huhtala H, Holli K, Kallioniemi A. Bone morphogenetic protein 7 expression associates with bone metastasis in breast carcinomas. Ann Oncol. 2008;19:308-314. [PubMed] [DOI] |
| 22. | Aoki M, Ishigami S, Uenosono Y, Arigami T, Uchikado Y, Kita Y, Kurahara H, Matsumoto M, Ueno S, Natsugoe S. Expression of BMP-7 in human gastric cancer and its clinical significance. Br J Cancer. 2011;104:714-718. [PubMed] [DOI] |
| 23. | Megumi K, Ishigami S, Uchikado Y, Kita Y, Okumura H, Matsumoto M, Uenosono Y, Arigami T, Kijima Y, Kitazono M. Clinicopathological significance of BMP7 expression in esophageal squamous cell carcinoma. Ann Surg Oncol. 2012;19:2066-2071. [PubMed] [DOI] |
| 24. | Xu G, Tang S, Yang J, Chen K, Kang J, Zhao G, Feng F, Yang X, Zhao L, Lu Q. BMP7 expression in esophageal squamous cell carcinoma and its potential role in modulating metastasis. Dig Dis Sci. 2013;58:1871-1879. [PubMed] [DOI] |
| 25. | Duangkumpha K, Techasen A, Loilome W, Namwat N, Thanan R, Khuntikeo N, Yongvanit P. BMP-7 blocks the effects of TGF-β-induced EMT in cholangiocarcinoma. Tumour Biol. 2014;35:9667-9676. [PubMed] [DOI] |
| 26. | Alarmo EL, Kuukasjärvi T, Karhu R, Kallioniemi A. A comprehensive expression survey of bone morphogenetic proteins in breast cancer highlights the importance of BMP4 and BMP7. Breast Cancer Res Treat. 2007;103:239-246. [PubMed] [DOI] |
| 27. | Wu JB, Fu HQ, Huang LZ, Liu AW, Zhang JX. Effects of siRNA-targeting BMP-2 on the abilities of migration and invasion of human liver cancer SMMC7721 cells and its mechanism. Cancer Gene Ther. 2011;18:20-25. [PubMed] [DOI] |
| 28. | Zeng P, Cai S, Zhang JN, Yi FM, Jiang WM, Wu JB. Effects of siRNA targeting BMPR-II on the biological activities of human liver cancer cells and its mechanism. Cancer Cell Int. 2014;14:55. [PubMed] [DOI] |
| 29. | Lim M, Chuong CM, Roy-Burman P. PI3K, Erk signaling in BMP7-induced epithelial-mesenchymal transition (EMT) of PC-3 prostate cancer cells in 2- and 3-dimensional cultures. Horm Cancer. 2011;2:298-309. [PubMed] [DOI] |