修回日期: 2015-01-25
接受日期: 2015-01-29
在线出版日期: 2015-03-28
目的: 探讨消化系炎性纤维性息肉(inflammatory fibroid polyp, IFP)的临床、内镜及病理的特征及鉴别诊断.
方法: 收集16例消化系的IFP进行临床、内镜、超声内镜、病理组织学形态观察. 采用免疫组织化学方法检测肿瘤表达Vimentin、CD34、CD117、DOG-1(discovered on GIST-1)、肌动蛋白(smooth muscle actin, SMA)、S-100、Desmin及细胞角蛋白(cytokeratin, CK)的情况.
结果: 消化系的IFP主要发生在40-60岁成年人(56.25%), 女性略占优势. 发生的部位依次为胃(56.25%)、小肠(25.0%)和结肠(18.75%), 胃窦是最常见的发病部位. 内镜下主要表现为息肉、黏膜下隆起及新生物样隆起. 超声内镜下表现为第三层或第二层的低回声, 但未见进入第四层. 与周围组织界限欠清. 病理组织学表现为IFP的病变主体在黏膜下层, 可以侵及黏膜层, 但不会侵入肌层. IFP主要有3种成分组成: 纤维母细胞样梭形细胞、小血管及嗜酸性粒细胞. 特征性的病理表现为: 恒定出现的嗜酸性粒细胞及纤维母细胞样梭形细胞围绕血管呈洋葱皮样或同心圆状排列. 免疫组织化学: Vimentin及CD34的表达率分别为100%及87.5%. 治疗方法为外科手术治疗和内镜黏膜切除(endoscopic mucosal resection, EMR)/内镜黏膜下剥离(endoscopic submucosal dissection, ESD).
结论: 消化系的IFP发生年龄、部位有一定的规律. 内镜和超声内镜下的表现有一定特征. 特征性的病理组织学和免疫组织化学表现能明确诊断IFP, 并且能帮助鉴别诊断发生在黏膜下层的肿瘤.
核心提示: 消化系的炎性纤维性息肉(inflammatory fibroid polyp, IFP)发生年龄、部位有一定的规律. 内镜和超声内镜下的表现有一定特征. 特征性的病理组织学和免疫组织化学表现能明确诊断IFP, 并且能帮助鉴别诊断发生在黏膜下层的肿瘤.
引文著录: 项一宁, 许良璧. 消化系炎性纤维性息肉的临床、内镜及病理特征. 世界华人消化杂志 2015; 23(9): 1514-1520
Revised: January 25, 2015
Accepted: January 29, 2015
Published online: March 28, 2015
AIM: To investigate the clinical, endoscopic and pathologic features, as well as differential diagnosis of gastrointestinal inflammatory fibroid polys (IFPs).
METHODS: The clinical data for 16 cases of IFPs were analyzed. The findings of endoscopy, endoscopic ultrasound, and histopathology were reviewed. Immunohistochemistry studies for Vimentin, CD34, CD117, discovered on GIST-1 (DOG-1), smooth muscle actin (SMA), S-100, and Desmin and cytokeratin (CK) were performed.
RESULTS: IFPs were mainly found in adults aged 40-60 years (56.25%), slightly more frequently in women. IFPs occurred mainly in the stomach (56.25%), small bowel (25%), and colon (18.75%), with the antrum being the most common place. The tumor might present as a polyp, submucosal mass or neoplasm-like mass. Endoscopic ultrasound showed hypoechoic lesions in the third or the second sonographic layer of the gastric wall but without involving the fourth layer, and the margin was poorly circumscribed. Histopathology showed that the tumor was mainly located in the submucosa and could invade the mucosa, but not the muscle layer. Microscopically, the main tumor components were fibroblast-like spindle cells, vascular and polymorphic inflammatory cells, usually dominant by eosinophils. The specific pathologic findings included eosinophils and concentric fibroblast-like spindle cells with an 'onion-skin'-like appearance around vessels. Immunohistochemical staining of the spindle cells of IFPs showed 100% positivity for vimentin and 87.5% positivity for CD34. Treatments for IFPs included surgery and endoscopic submucosal dissection (ESD) or endoscopic mucosal resection (EMR).
CONCLUSION: There are similar patterns for patient age and tumor location in IFPs. Endoscopy and endoscopic ultrasound can provide specific findings. The histopathological and immunohistochemical characteristics are useful for accurately diagnosing IFPs and differential diagnosis of the tumors occurring in the submucosa.
- Citation: Xiang YN, Xu LB. Clinical, endoscopic and pathologic features of inflammatory fibroid polyps of the digestive system. Shijie Huaren Xiaohua Zazhi 2015; 23(9): 1514-1520
- URL: https://www.wjgnet.com/1009-3079/full/v23/i9/1514.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i9.1514
炎性纤维性息肉(inflammatory fibroid polyp, IFP)是一种罕见良性间叶组织来源肿瘤[1], 可以发生在消化系任何部位. 其临床表现、内镜和病理特征均与发生在消化系黏膜下的肿瘤或非肿瘤性疾病相似. 因此在临床及内镜的诊断有一定困难. 我们收集16例IFP病例进行观察研究, 探讨其临床特点、内镜表现、超声内镜, 病理特征, 免疫组织化学表型及鉴别诊断要点.
病例收集: 收集贵阳医学院附属医院病理科2007-01/2013-12诊断为IFP病例16例. 复习所有病理切片、免疫组织化学及临床资料. 所有病理切片均重新复查并诊断. 临床资料: 收集原始病历, 记录患者年龄、性别、临床症状、实验室检查及治疗方式. 所用免疫组织化学试剂均购自上海基因科技有限公司.
1.2.1 内镜及大体表现: 16例病例中共有12例患者接受胃肠镜检查(胃镜9例, 结肠镜3例); 其中4例接受超声内镜检查. 其余4例病例为手术切除的病理大体观察. 记录每例IFP的生长部位, 大小, 形状. 以及超声内镜下的特征.
1.2.2 病理组织学观察: 息肉生长的位置、层次, 病理组织学特点及病理分期.
1.2.3 免疫组织化学检测: 免疫组织化学采用EnVision二步法, 一抗为Vimentin、CD34、CD117、DOG-1(discovered on GIST-1)、肌动蛋白(smooth muscle actin, SMA)、S-100、Desmin及细胞角蛋白(cytokeratin, CK).
收集的16例病例中男性6例, 女性10例, 男: 女为1:1.6, 女性患者略占优势. 年龄21-76岁, 30岁以下1例, 30-40岁4例, 40-60岁9例(56.25%), 70岁以上2例. 中位年龄53岁. 病程从20 d-4年不等. 患者的临床症状与息肉发生的部位与大小相关: 疼痛主要为上腹部疼痛, 仅有2例例外, 1例为中下腹疼痛(息肉的部位为回肠末段), 1例无症状(息肉部位在胃窦, 并且直径为6 mm). 4例因肠梗阻或肠套叠就诊, 分别发生在右半结肠2例及小肠2例. 外周血中嗜酸性粒细胞仅有1例升高(病例6), 其余患者外周血中的嗜酸性粒细胞均正常. 所有的病例均为单发的病变, 没有多发的病变(表1).
| 病例 | 性别 | 年龄(岁) | 部位 | 息肉大小(mm) | 内镜/大体 | 病理组织学层次 | 病理组织学分期 | 治疗 |
| 1 | 女 | 21 | 空肠 | 20×20×20 | 隆起型1 | 黏膜层及黏膜下层 | 纤维血管期 | 外科手术 |
| 2 | 女 | 61 | 回肠末段 | 60×40×20 | 新生物隆起 | 黏膜层及黏膜下层 | 纤维血管期 | 外科手术 |
| 3 | 女 | 36 | 升结肠 | 70×40×20 | 隆起型1 | 黏膜层及黏膜下层 | 纤维血管期 | 外科手术 |
| 4 | 女 | 54 | 胃窦 | 6×6×5 | 山田1型 | 黏膜下层 | 结节期 | EMR |
| 5 | 男 | 51 | 胃窦 | 40×30×20 | 新生物隆起 | 黏膜层及黏膜下层 | 纤维血管期 | 外科手术 |
| 6 | 男 | 46 | 胃窦 | 12×8×3 | 黏膜下隆起 | 黏膜层及黏膜下层 | 纤维血管期 | ESD |
| 7 | 女 | 64 | 胃窦 | 50×48×30 | 新生物隆起 | 黏膜层及黏膜下层 | 纤维血管期 | 外科手术 |
| 8 | 女 | 37 | 回肠 | 30×30×15 | 隆起型1 | 黏膜层及黏膜下层 | 纤维血管期 | 外科手术 |
| 9 | 女 | 54 | 胃窦 | 7×6×5 | 山田2型 | 黏膜下层 | 纤维血管期 | EMR |
| 10 | 男 | 74 | 升结肠 | 45×30×20 | 山田4型 | 黏膜层及黏膜下层 | 硬化期 | EMR |
| 11 | 女 | 68 | 胃窦 | 10×7×5 | 山田2型 | 黏膜层及黏膜下层 | 纤维血管期 | ESD |
| 12 | 男 | 50 | 胃窦 | 8×6×5 | 黏膜下隆起 | 黏膜下层 | 纤维血管期 | ESD |
| 13 | 女 | 69 | 回肠末段 | 15×15×14 | 黏膜下隆起 | 黏膜层及黏膜下层 | 纤维血管期 | EMR |
| 14 | 男 | 35 | 回盲部 | 25×20×20 | 隆起型1 | 黏膜层及黏膜下层 | 硬化期 | 外科手术 |
| 15 | 男 | 35 | 胃窦 | 12×10×7 | 黏膜下隆起 | 黏膜层及黏膜下层 | 结节期 | ESD |
| 16 | 女 | 76 | 胃窦 | 6×4×3 | 黏膜下隆起 | 黏膜层及黏膜下层 | 结节期 | ESD |
IFP发生在胃9例(56.25%); 小肠4例(25%); 大肠3例(18.75%). 并且胃全发生在胃窦(9/9); 小肠的IFP回肠末段占优势(2/4); 大肠全部发生在右半结肠(3/3); 而未见发生在食管的病例. 息肉的最大直径6-70 mm, 平均直径26 mm.
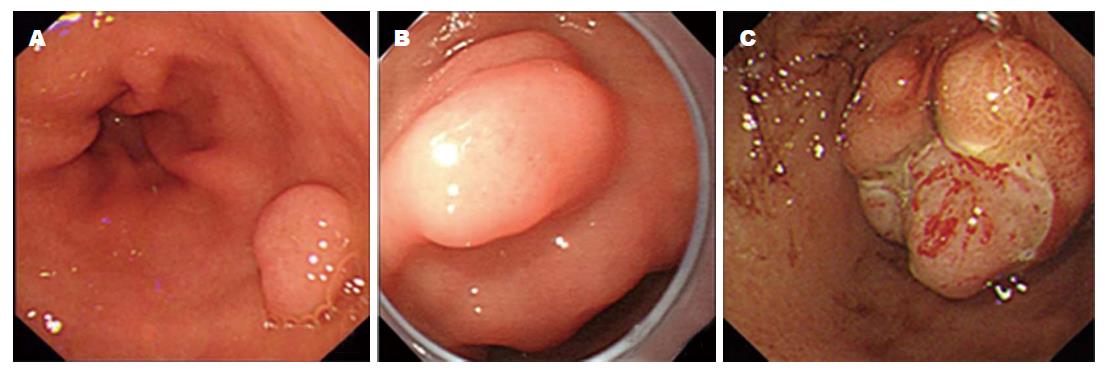
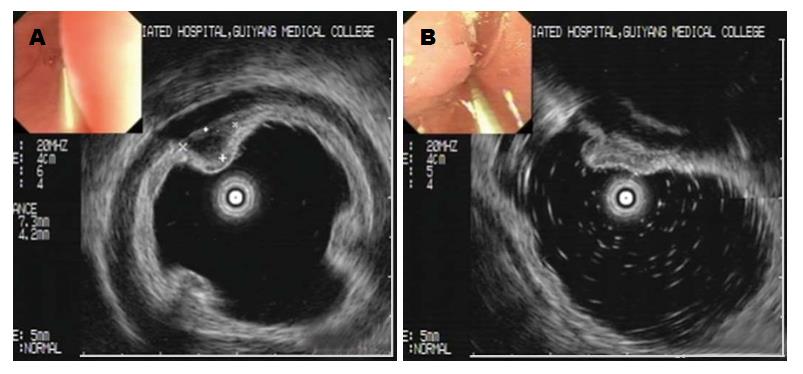
12例IFP在内镜下表现为突向管腔内的隆起, 其中4例呈息肉样隆起(采用山田分类法)(图1A); 5例呈黏膜下隆起(图1B); 3例呈新生物样隆起(图1C). 其余4例病例(病例1、3、8及14发生在小肠或结肠, 以急性肠梗阻的症状就症, 并进行急诊手术, 因此没有内镜资料)的病理大体均表现为隆起型肿块突向肠腔. 除病例10外, 直径<20 mm的IFP表现为息肉或黏膜下隆起; 而直径≥20 mm的IFP表现为新生物隆起或隆起型肿块. 在12例病例中, 有4例发生在胃的病例进行超声内镜检查(病例6, 12, 15和16), 其表现为来源于第三层(图2A)或第二层的低回声(图2B), 内部回声均匀, 边界欠清.
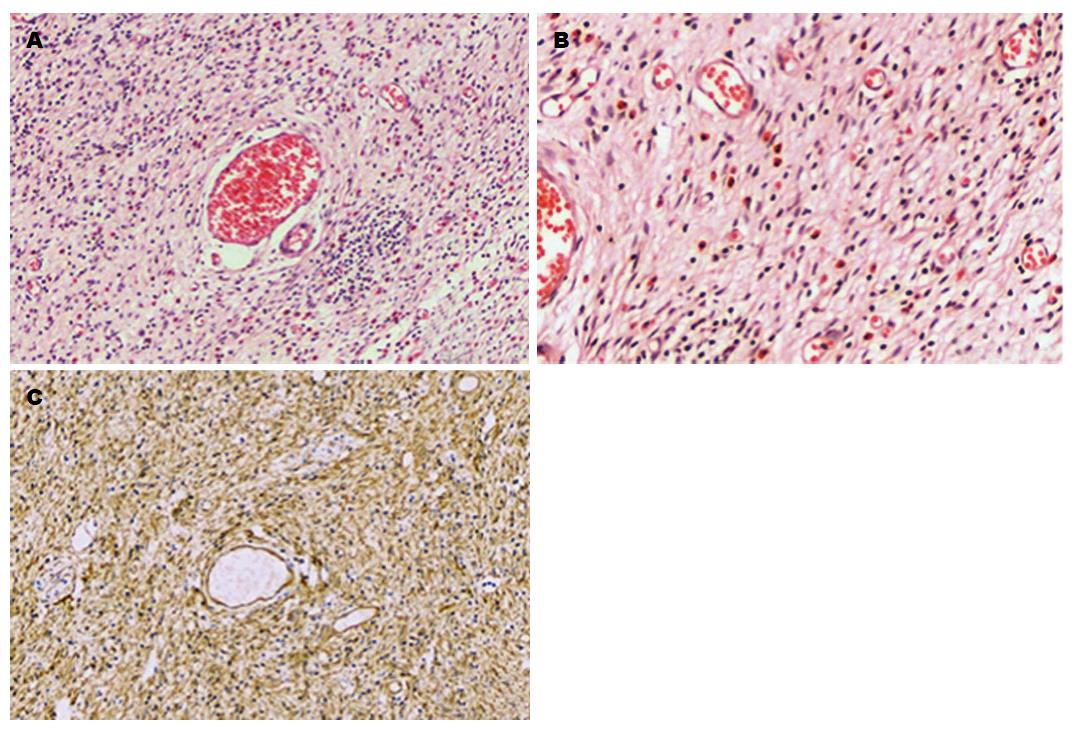
肿瘤主体位于黏膜下层, 使患者的黏膜下层明显增厚. 并向上破坏黏膜肌层, 侵入黏膜层, 但未侵入肌层. 本组病例中16例病变主体均在黏膜下层(100%), 13例侵入黏膜层基底(81.25%). 息肉主要由3种成分组成: (1)过度增生的纤维母细胞样梭形细胞, 伴或不伴水肿及黏液变性; (2)小血管增生, 厚壁和薄壁血管均可见, 血管周围有特征性的病理表现: 血管周围纤维母细胞样梭形细胞增生呈洋葱皮或同心圆状排列(图3A); (3)伴有大量的炎症细胞浸润: 淋巴细胞、浆细胞及嗜酸性粒细胞. 特征性嗜酸性粒细胞在IFP中恒定出现(图3B), 只是在不同的病程或病理分期中含量多少不同. 其中2例伴有淋巴组织增生伴淋巴滤泡形成(病例5和6). 并且嗜酸性粒细胞仅出现在肿瘤中, 肌层及浆膜层均未见嗜酸性粒细胞浸润. 病变发展经过3个阶段[2], 分别为: 结节期、纤维血管期及硬化期. (1)结节期主要由疏松水肿、黏液变性的纤维母细胞样梭形细胞组成, 伴少量的薄壁血管及嗜酸性粒细胞增生. 结节期的嗜酸性粒细胞比纤维血管期和硬化期均少. 结节期的IFP, 薄壁血管为主; (2)纤维血管期是纤维母细胞样梭形细胞增生, 并在血管周围形成同心圆状排列及大量的嗜酸性粒细胞浸润. 同心圆状排列的血管在纤维血管期最明显. 此期薄壁及厚壁血管均可见; (3)硬化期是胶原纤维增生伴或不伴玻璃样变性, 主要由薄壁及厚壁血管均可见, 但厚壁血管增多. 部分血管周围可见纤维母细胞样梭形细胞呈同心圆状排列, 仍可见大量的嗜酸性粒细胞浸润. 本组病例中结节期3例(18.75%), 息肉平均最大直径0.67 cm. 纤维血管期11例(68.75%), 平均最大直径2.92 cm. 硬化期2例(12.5%), 平均最大直径3.5 cm.
6例患者接受外科手术治疗, 10例患者内镜下进行于内镜黏膜切除(endoscopic mucosal resection, EMR)或内镜黏膜下剥离(endoscopic submucosal dissection, ESD)术.
Vimentin阳性率: 100.0%(16/16), 阳性的病例呈弥漫强阳性, CD34阳性率: 87.5%(14/16), 阳性的病例呈弥漫强阳性(图3C); 病例1和病例7 CD34阴性表达. CD117阳性率: 0.0%(0/16); DOG-1阳性率: 0.0%(0/16); SMA阳性率: 12.5%(1/16), 呈局灶灶阳性表达; S-100阳性率: 0.0%(0/16); Desmin阳性率: 0.0%(0/16); CK阳性率: 0.0%(0/16).
IFP是1949年Vanek[3]首次报道, 被命名为黏膜下层肉芽肿伴嗜酸性粒细胞浸润. 由于其发病率低, 因此其在整个消化系中的发病率不太清楚, 但是有研究[4]报道, IFP占胃息肉发病率的0.1%. 以前IFP被认为是一种良性、反应性、增生性、非肿瘤性病变. 但是《2010版WHO消化系统肿瘤分类》(WHO Classification of Tumours of the Digestive System in 2010)将其归入间叶源性良性肿瘤[1]. 文献[5]报道, IFP可以发生在整个消化系, 发病率依次是胃、小肠、结肠、胆囊、食道、十二指肠、阑尾和直肠. 文献报道胃IFP的发病率可占到50%-70%, 本研究结果与文献[5]报道基本一致. 但2013年Liu等[6]的研究中(其研究样本为83例)发现胃占整个消化系的发病率仅31%, 而大肠的发病率可达31%. 发病率差别如此之大, 是否与研究的样本量或人种有关? 而在胃的发病率中所有的文献和本研究均提示胃窦是最常见发病部位. 而Stolte等[7]的研究发现其可以发生胃的其他部位, 77.6%病例位于胃窦, 9.8%位于胃角, 1.4%位于幽门, 0.7%位于胃底, 0.7%位于贲门. IFP发病高峰年龄40-60岁. 男女发病中, 文献及我们的研究均显示女性略占优[2,6]. 临床症状多种多样, 没有规律. 如果发生在肠道, 常常因肠梗阻或肠套叠而急诊原因入院.
IFP的其组织来源尚不清, 但Navas-Palacios等[8]通过免疫组织化学和超微结构的观察, 证实增生的梭形细胞来源于肌纤维母细胞, 其超微结构不同于schwann细胞和血管内皮细胞, 并且免疫组织化学发现其不表达VⅢ因子. 随着分子生物学应用IFP研究, 越来越多的研究[9,10]发现, IFP有血小板源性生长因子受体α(α-platelet-derived growth factor receptor, α-PDGFR)外显子12, 18的基因突变. 并有散发性家族性报道[11]和复发的病例报道[12]. 因此认为IFP是一种克隆性的增生, 而非反应性增生. 越来越多的学者认为其本质为肿瘤, 因此2010版《WHO消化系统肿瘤分类》将其归入消化系的间叶源性的良性肿瘤[1]. 1996年Buciuto等[13]报道胃的IFP伴有幽门螺旋杆菌的感染, 因此有人假设IFP幽门螺旋杆菌免疫反应的结果[14]. 但是此假设有不支持的方面: (1)IFP可以发生在整个消化系, 而且发生在消化系的不同部位的组织学图像相同, 消化系胃以外的其他部位幽门螺旋杆菌的感染情况较为罕见, 因此不会进一步有相应的免疫反应; (2)在IFP中恒定会出现大量的嗜酸性粒细胞浸润, 而当幽门螺旋杆菌感染时, 主要的炎症细胞是嗜中性粒细胞和浆细胞, 而不是嗜酸性粒细胞, 因此在病理学上也不支持此假设.
内镜下观察和手术切除标本的病理大体观察, IFP表现多种多样, 内镜下表现为: 息肉, 黏膜下隆起, 新生物样隆起; 及病理大体: 隆起型肿块. 肿瘤的肉眼特点与肿瘤的大小明显相关: 直径<20 mm时, 表现为息肉及黏膜下层隆起; 直径≥20 mm时, 表现为新生物样隆起或隆起型肿块. 内镜下准确判断隆起的性质是很困难的. 当内镜下表现为息肉时, 可以直接进行内镜下高频电切除术, 通过病理明确诊断. 如果表现为黏膜下隆起及新生物隆起时, 需要和很多发生在黏膜下隆起的病变及恶性肿瘤相鉴别: 神经内分泌肿瘤, 胃肠道间质瘤和异位胰腺等疾病. 超声内镜表现可能有一定的帮助. 胃的IFP在超声内镜下主要表现来源于第三层或第二层的低回声病变, 并未见其侵入第四层, 尤其是病变位于胃窦时更要考虑IFP可能, 这与文献报道基本是一致的[15]. 超声内镜下的表现与病理上观察的结果是相一致, 我们在病理上观察到IFP的病变位于黏膜下层和黏膜层, 并且所有病例的主体病变均位于黏膜下层, 部分病例破坏黏膜肌层长入黏膜层. 因此尽管在超声内镜下及病理组织学中IFP的生长方式均可能为浸润性生长方式, 尤其在病理组织学中观察到黏膜肌层被破坏, 但是其生物学行为仍然是良性肿瘤. 超声内镜下病变表现为低回声, 边界欠清楚. 与病理上的组织学图像相吻合, 组织学上增生纤维母细胞样梭形细胞、血管和炎症细胞, 组织相对比较密集, 因此超声内镜下表现为低回声. 但是仍然很难和胃肠道的一些肿瘤和非肿瘤性疾病难以鉴别: 神经内分泌癌、胃肠道间质瘤、平滑肌瘤、神经鞘瘤和胰腺异位等. 并且由于IFP生长的位置比较深, 因此内镜下黏膜活检对疾病的诊断帮助不大. 我们12例做了内镜检查的病例在术前黏膜活检结果均诊断为黏膜慢性炎症. 有文献报道仅有10%发生在胃的病例在术前活检得到正确的诊断[6]. 因此EMR/ESD术和外科手术后的标本的病理诊断对于IFP的准确诊断至关重要.
IFP在病理组织学中主要由3种成分组成, 纤维母细胞样的梭形细胞, 血管及嗜酸性粒细胞. 特征性的病理变化为: (1)恒定的嗜酸性粒细胞的出现, 仅仅是在不同的病例分期中, 数量多少不同, 但是一定出现; (2)在血管周围纤维母细胞样的梭形细胞围绕血管呈同心圆状或洋葱皮样改变. 病理分期中表现为3种模式: 结节期、纤维血管期和硬化期[2]. 当病变处于纤维血管期时, 有明显的IFP的特征性病理改变, 因此病理诊断并不困难, 但是在结节期和硬化期时, 尤其是结节期时, 主要表现为纤维母细胞样梭形细胞增生并伴明显的黏液变性和水肿, 嗜酸性粒细胞相对少(与纤维血管期和硬化期比较), 并且血管周围没有明显洋葱皮样改变. 有的病例诊断可能有困难. 病理上主要鉴别的是间叶组织来源的肿瘤: 胃肠道间质瘤, 神经鞘瘤、丛状纤维黏液瘤、平滑肌瘤和炎性及纤维母细胞瘤. 这时免疫组织化学染色对于诊断与鉴别诊断有很大的帮助[16-18]: 文献报道100%病例表达Vimentin, 82%-100%病例表达CD34, 不同程度的灶性表达SMA, 但是不表达CD117、CD10、DOG-1、Desmin、S-100、VⅢ因子及间变型淋巴瘤激酶(anaplastic lymphoma kinase, ALK). 我们的研究结果与文献相一致. 因此在病理诊断IFP时, HE染色与免疫组织化学染色同时进行, 对于准确诊断IFP, 有助于鉴别诊断其他肿瘤.
IFP的治疗方式为两种: 内镜下的微创手术(ESD或EMR)和外科手术切除. 现代医学发展, 对于病变<20 mm发生在胃及大肠的IFP用ESD或EMR术切除, 可能是最好的治疗方法.
炎性纤维性息肉(inflammatory fibroid polyp, IFP)是间叶组织来源的罕见良性肿瘤. 其在临床表现、内镜和病理特征与发生在消化系黏膜或黏膜下的肿瘤(如胃肠道间质瘤等)或非肿瘤性疾病(胃肠道胰腺异位)相似, 有时很难鉴别, 因此全面的认识该疾病, 诊断及鉴别诊断在临床工作中非常重要. 本文收集16例IFP对其从临床、内镜及病理方面认识该疾病的特征及规律.
邹小明, 教授, 哈尔滨医科大学附属第二医院普外二科
本文研究热点及重点为IFP在临床表现中的规律(性别、年龄及肿瘤发生部位), 内镜及超声内镜下的表现, 病理组织学及免疫组织化学特征.
(1)IFP发生的性别和年龄有一定的规律, 肿瘤最常见的部位为胃, 尤其是胃窦, 因此在胃窦发生息肉样肿物时, 要想到有IFP 的可能; (2)内镜与超声内镜的具有一定特征; (3)肿瘤在病理表现中有特征性的表现: 组织学及免疫组织化学.
IFP为消化系比较少见的肿瘤, 以往在国内的IFP文献为个案报道, 没有对IFP从临床、内镜、超声内镜及病理有全面的研究及认识. 本文从以上几个方面全面研究IFP, 找出该疾病的一定规律及特征.
(1)消化系的IFP主要发生在40-60岁成年人, 女性略占优势. 胃是最常见的发病部位; (2)内镜下主要表现为息肉、黏膜下隆起及新生物样隆起; (3)超声内镜下表现为第三层或第二层的低回声; (4)病理组织学表现为IFP主要有3种成分组成: 纤维母细胞样梭形细胞、小血管及嗜酸性粒细胞. 特征性的病理表现为: 恒定出现的嗜酸性粒细胞及纤维母细胞样梭形细胞围绕血管呈洋葱皮样或同心圆状排列. 免疫组织化学: Vimentin及CD34的表达率高.
免疫组织化学: 又称为免疫细胞化学, 是指带显色剂标记的特异性抗体在组织细胞原位通过抗原抗体反应和组织化学的呈色反应, 对相应抗原进行定性、定位、定量测定的一项新技术.
本文对IFP的研究比较全面, 便于读者对IFP全面的认识和了解.
编辑: 韦元涛 电编:都珍珍
| 1. | 周 晓军, 樊 祥山. 解读2010年消化系统肿瘤WHO分类(I). 临床与实验病理学杂志. 2011;27:341-346. |
| 2. | Kim YI, Kim WH. Inflammatory fibroid polyps of gastrointestinal tract. Evolution of histologic patterns. Am J Clin Pathol. 1988;89:721-727. [PubMed] |
| 3. | Vanek J. Gastric submucosal granuloma with eosinophilic infiltration. Am J Pathol. 1949;25:397-411. [PubMed] |
| 4. | Carmack SW, Genta RM, Schuler CM, Saboorian MH. The current spectrum of gastric polyps: a 1-year national study of over 120,000 patients. Am J Gastroenterol. 2009;104:1524-1532. [PubMed] [DOI] |
| 5. | Wysocki AP, Taylor G, Windsor JA. Inflammatory fibroid polyps of the duodenum: a review of the literature. Dig Surg. 2007;24:162-168. [PubMed] [DOI] |
| 6. | Liu TC, Lin MT, Montgomery EA, Singhi AD. Inflammatory fibroid polyps of the gastrointestinal tract: spectrum of clinical, morphologic, and immunohistochemistry features. Am J Surg Pathol. 2013;37:586-592. [PubMed] |
| 7. | Stolte M, Finkenzeller G. Inflammatory fibroid polyp of the stomach. Endoscopy. 1990;22:203-207. [PubMed] [DOI] |
| 8. | Navas-Palacios JJ, Colina-Ruizdelgado F, Sanchez-Larrea MD, Cortes-Cansino J. Inflammatory fibroid polyps of the gastrointestinal tract. An immunohistochemical and electron microscopic study. Cancer. 1983;51:1682-1690. [PubMed] [DOI] |
| 9. | Schildhaus HU, Cavlar T, Binot E, Büttner R, Wardelmann E, Merkelbach-Bruse S. Inflammatory fibroid polyps harbour mutations in the platelet-derived growth factor receptor alpha (PDGFRA) gene. J Pathol. 2008;216:176-182. [PubMed] |
| 10. | Calabuig-Fariñas S, López-Guerrero JA, Ribera MJ, Navarro S, Ramos D, Pellín A, Llombart-Bosch A. Inflammatory fibroid polyp of the small bowel with a mutation in exon 12 of PDGFR alpha. Virchows Arch. 2009;454:327-331. [PubMed] |
| 11. | Anthony PP, Morris DS, Vowles KD. Multiple and recurrent inflammatory fibroid polyps in three generations of a Devon family: a new syndrome. Gut. 1984;25:854-862. [PubMed] [DOI] |
| 12. | Zinkiewicz K, Zgodzinski W, Dabrowski A, Szumilo J, Cwik G, Wallner G. Recurrent inflammatory fibroid polyp of cardia: a case report. World J Gastroenterol. 2004;10:767-768. [PubMed] |
| 13. | Buciuto R, Kullman E, Boeryd B, Borch K. Helicobacter pylori gastritis associated with a gastric inflammatory fibroid tumour and sarcoidosis. Eur J Surg. 1996;162:421-424. [PubMed] |
| 14. | Shalom A, Wasserman I, Segal M, Orda R. Inflammatory fibroid polyp and Helicobacter pylori. Aetiology or coincidence? Eur J Surg. 2000;166:54-57. [PubMed] [DOI] |
| 15. | Matsushita M, Hajiro K, Okazaki K, Takakuwa H. Gastric inflammatory fibroid polyps: endoscopic ultrasonographic analysis in comparison with the histology. Gastrointest Endosc. 1997;46:53-57. [PubMed] [DOI] |
| 16. | Kuestermann SA, Saleeb SF, Teplick SK. General case of the day. Jejunal intussusception caused by an inflammatory fibroid polyp (IFP). Radiographics. 1999;19:539-541. [PubMed] [DOI] |
| 17. | Wille P, Borchard F. Fibroid polyps of intestinal tract are inflammatory-reactive proliferations of CD34-positive perivascular cells. Histopathology. 1998;32:498-502. [PubMed] [DOI] |
| 18. | Makhlouf HR, Sobin LH. Inflammatory myofibroblastic tumors (inflammatory pseudotumors) of the gastrointestinal tract: how closely are they related to inflammatory fibroid polyps? Hum Pathol. 2002;33:307-315. [PubMed] [DOI] |