修回日期: 2015-01-12
接受日期: 2015-01-22
在线出版日期: 2015-03-18
目的: 研究白介素-22(interleukin-22, IL-22)对大鼠小肠上皮细胞(intestinal epithelial cells 6, IEC-6)肠三叶因子(trefoil factor family 3, TFF3)表达的影响, 并探讨其可能调控机制.
方法: 采用不同浓度的重组大鼠IL-22(recombinant rat interleukin, rrIL-22)(1、10、100 ng/mL)处理IEC-6细胞, 分别培养(12、24、48 h)后, RT-PCR法检测并比较处理前(0 h)及处理后不同时间点TFF3、信号转导及转录活化因子3(signal transducer and activator of transcription 3, STAT3)、STAT6、细胞核因子κB(nuclear factor-kappa B, NF-κB) mRNA表达变化.
结果: 1 ng/mL的IL-22干预IEC-6细胞12、24、48 h后TFF3和STAT3 mRNA与干预前(0 h)比较, 各组间差异无统计学意义(P>0.05). 10 ng/mL的IL-22干预后, 随着干预时间的延长, TFF3 mRNA表达升高(P<0.05), 但干预24 h与48 h差异不大; STAT3 mRNA表达量随时间的延长而升高, 12 h与0 h比较差异不大(P>0.05), 其余各组间比较差异有统计学意义(P<0.05). 100 ng/mL组, TFF3 mRNA表达量随时间延长而显著升高, 各组比较差异有统计学意义(P<0.05); STAT3 mRNA表达与干预时间的关系与10 ng/mL组相似. 不同浓度组共培养12 h时, IL-22浓度100 ng/mL干预后TFF3 mRNA表达量显著升高(P<0.05), 而实验中10 ng/mL干预后与1 ng/mL干预后比较表达量无明显升高(P>0.05); STAT3 mRNA表达随IL-22浓度升高差异均无统计学意义(P>0.05). 共培养24、48 h后, 随着IL-22浓度升高, TFF3 mRNA表达量显著升高(P<0.05); STAT3 mRNA表达量随IL-22浓度升高同样升高, 但100 ng/mL与10 ng/mL干预后表达量差异无统计学意义(P>0.05)而分别与1 ng/mL干预后表达量相比差异有统计学意义(P<0.05). 我们尚未能测到STAT6 mRNA表达, NF-κB mRNA表达量与处理前相比差异均无统计学意义(P>0.05).
结论: IL-22可能通过STAT3信号转导途径上调IEC-6细胞TFF3表达, 且呈明显的时间、浓度依赖性: IL-22干预的时间延长、浓度升高, STAT3和TFF3表达升高且两者升高趋势基本同步.
核心提示: 白介素-22(interleukin-22, IL-22)可上调大鼠肠上皮细胞-6(intestinal epithelial cells 6)三叶因子(trefoil factor family 3)表达, 其可能机制是通过信号转导及转录活化因子3(signal transducer and activator of transcription 3)信号转导途径, 这可能是IL-22在炎症性肠病(inflammatory bowel disease)中促进黏膜修复、发挥黏膜保护作用的机制之一.
引文著录: 林雪, 刘之枫, 丁玉华, 王帆, 潘华勤, 李瑾. IL-22对肠上皮细胞肠三叶因子的调控作用. 世界华人消化杂志 2015; 23(8): 1290-1297
Revised: January 12, 2015
Accepted: January 22, 2015
Published online: March 18, 2015
AIM: To investigate the effect of interleukin-22 (IL-22) on the intestinal trefoil factor (ITF/TFF3) expression in IEC-6 cells and discuss the possible mechanism.
METHODS: IEC-6 cells were treated with IL-22 at different concentrations (1, 10, or 100 ng/mL) for 12, 24, or 48 h. The mRNA expression of TFF3, signal transducer and activator of transcription 3 (STAT3), STAT6 and nuclear factor-κB (NF-κB) in IEC-6 cells was measured by RT-PCR.
RESULTS: The mRNA expression of TFF3 and STAT3 in IEC-6 cells treated with 1 ng/mL IL-22 was not significantly up-regulated when incubated for 0, 12, 24 or 48 h (P > 0.05). With time increasing, the mRNA expression of TFF3 in IEC-6 cells treated with 10 ng/mL IL-22 increased and the comparison between any two time points of 0, 12, 24 and 48 h showed significant differences (P < 0.05) except the comparison between the time points of 12 and 24 h; the mRNA expression of STAT3 also increased, and there were significant differences in any two time points (P < 0.05), except between 0 and 12 h (P > 0.05). When treated with 100 ng/mL IL-22, the mRNA expression of TFF3 in IEC-6 cells showed obvious up-regulation with time increasing, and the comparison between any two time points was statistically different (P < 0.05); the relationship between the mRNA expression of STAT3 and treatment time was the same as the group of 10 ng/mL. When IEC-6 cells were treated for 12 h, the mRNA expression of TFF3 was significantly higher in the 100 ng/mL group compared with the 1 ng/mL and 10 ng/mL groups (P < 0.05), although there was no statistical difference between the groups of 1 ng/mL and 10 ng/mL; the mRNA expression of STAT3 did not show a statistical difference (P > 0.05). The mRNA expression of TFF3 in IEC-6 cells for 24 and 48 h was significantly up-regulated as the concentration of IL-22 increased, and the comparison between any two concentrations of IL-22 showed a significant difference (P < 0.05); the mRNA expression of STAT3 was also up-regulated, showing a significant difference between any two concentrations of IL-22 except the comparison between the groups of 10 ng/mL and 100 ng/mL. We could not measure the expression of STAT6 mRNA, and the mRNA expression of NF-κB did not show a significant difference among the groups (P > 0.05).
CONCLUSION: IL-22 may up-regulate the mRNA expression of TFF3 in IEC-6 cells through the STAT3 signal transduction pathway in a time- and dose-dependent fashion.
- Citation: Lin X, Liu ZF, Ding YH, Wang F, Pan HQ, Li J. Effect of IL-22 on expression of intestinal trefoil factor in intestinal epithelial cells. Shijie Huaren Xiaohua Zazhi 2015; 23(8): 1290-1297
- URL: https://www.wjgnet.com/1009-3079/full/v23/i8/1290.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i8.1290
炎症性肠病(inflammatory bowel disease, IBD)的发病机制主要包括遗传、感染、免疫、环境. 其中, 肠黏膜免疫紊乱在IBD发病机制中处于中心地位[1]. 免疫、炎症系统可以被多种细胞因子调控, 如白介素(interleukin, IL)、干扰素(interferon, INF)等通过各种途径行使其生物功能. 近来研究[2-5]发现, IL-22除参与炎症和免疫反应外, 还显示黏膜保护作用. 另外, 肠道还合成一些控制炎症和保持上皮屏障完整性的物质, 如肠三叶因子(intestinal trefoil factor, ITF/TFF3), TFF3与IBD的发病亦明显相关, 并有望成为预防和治疗IBD的一种新途径. IL是TFF3表达的重要调节因子, 目前IL-22对TFF3表达的影响尚未见报道, 鉴于IL-22在IBD发病中起重要作用, 而TFF3有望成为应用于IBD临床防治的新途径, 本研究通过动物细胞模型, 观察IL-22对肠上皮细胞TFF3表达的影响并探讨其可能调控机制.
大鼠肠上皮细胞-6(intestinal epithelial cells 6, IEC-6)购自中国科学院典型培养物保藏中心昆明细胞库, 编号: KCB200720YJ. 细胞常规培养于含10%胎牛血清(Hyclone公司)、100 U/mL双抗(Hyclone公司)、0.1 U/mL胰岛素(Sigma公司)的DMEM(高糖)培养基中, 37 ℃、50 mL/L CO2、饱和湿度培箱内培养, 选择第5-10代的细胞用于实验. 重组大鼠IL-22(recombinant rat interleukin, rrIL-22)购自美国RD公司.
1.2.1 细胞分组: 实验分3组进行, 用含高中低(1、10、100 ng/mL)3种浓度rrIL-22的DMEM培养液分别干预IEC-6不同时间(12、24、48 h), 最后检测各组干预前(0 h)及干预后12、24、48 h时TFF3、信号转导及转录活化因子3(signal transducer and activator of transcription 3, STAT3)、STAT6、细胞核因子κB(nuclear factor-kappa B, NF-κB) mRNA的表达量.
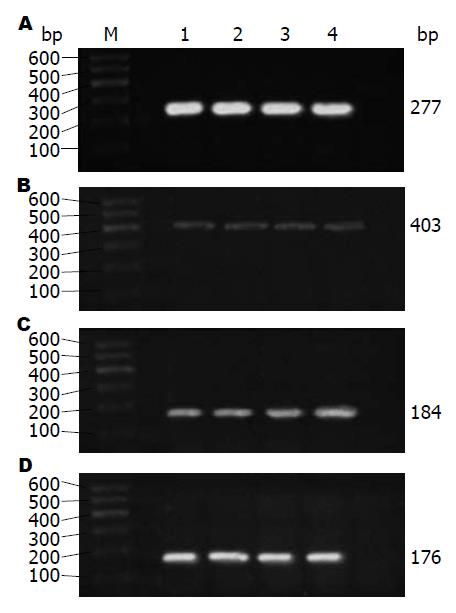
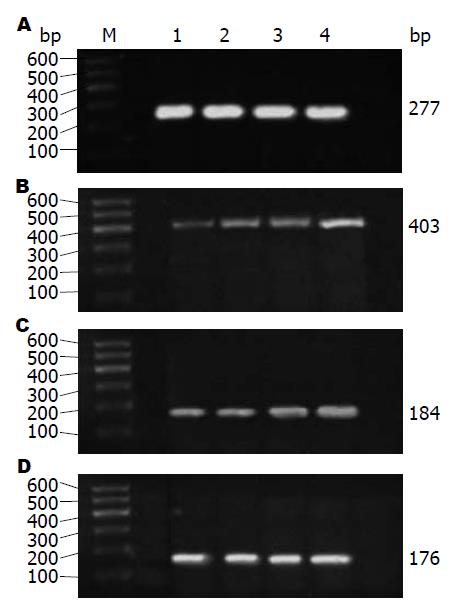
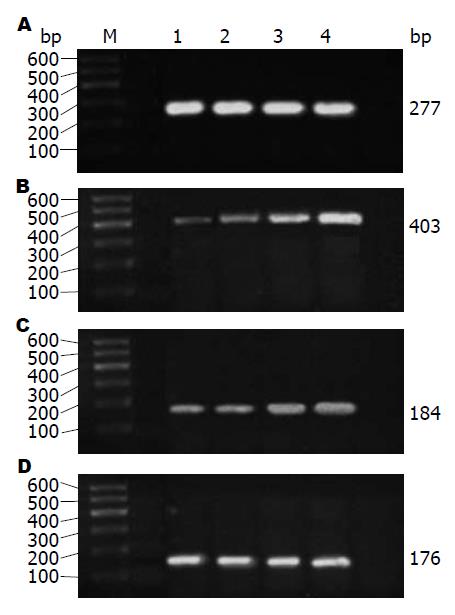
1.2.2 RT-PCR法检测mRNA表达量: (1)收集处于对数生长期的细胞, 并调整细胞密度, 以细胞数1×107个/孔接种于6孔培养板内, 每孔加入DMEM培养液2 mL. 细胞培养24 h后予以换液, 弃去原培养液, 加入含终浓度为1、10、100 ng/mL的rrIL-22新鲜培养液继续培养, 培养12、24、48 h后, 分别提取总RNA, 逆转录并进行PCR扩增(操作步骤按照试剂盒说明); (2)采用GAPDH作为参照, 引物由上海生物工程有限公司合成, 引物序列及反应条件如表1; (3)配制2%的琼脂糖凝胶及0.5×TBE缓冲液, 将PCR产物和DNA Marker点样, 设置电泳仪电源电压为80 V, 电泳约40 min后, 将凝胶放入凝胶成像系统内观察并拍照, AlphaEase FC 4.0凝胶图像分析软件分析计算各目的基因与GAPDH扩增产物的光密度比值, 即为mRNA半定量结果.
| 基因 | 序列 | PCR反应条件 | 片段长度(bp) |
| GAPDH | 上游: 5'-GTCGGTGTGAACGGATTT-3' | 94 ℃预变性3 min; 94 ℃变性30 s, 57 ℃退火30 s, 72 ℃延伸45 s, 25个循环; 72 ℃延伸10 min | 277 |
| 下游: 5'-ACTCCACGACGTACTCAGC-3' | |||
| TFF3 | 上游: 5'-ATGGAGACCAGAGCCTTCTG-3' | 94 ℃预变性3 min; 94 ℃变性30 s, 56 ℃退火30 s, 72 ℃延伸45 s, 30个循环; 72 ℃延伸10 min | 403 |
| 下游: 5'-ACAGCCTTGTGCTGACTGTA-3' | |||
| STAT3 | 上游: 5'-CACAACCTGCGAAGAATCAAG-3' | 94 ℃预变性3 min; 94 ℃变性30 s, 55 ℃退火30 s, 72 ℃延伸45 s, 30个循环; 72 ℃延伸10 min | 184 |
| 下游: 5'-GCTGCTTCTCCGTCACTAC-3' | |||
| STAT6 | 上游: 5'-GGGGACTGCTACCAGAACACT-3' | 94 ℃预变性3 min; 94 ℃变性30 s, 58 ℃退火30 s, 72 ℃延伸30 s, 30个循环; 72 ℃延伸10 min | 358 |
| 下游: 5'-ATCTGTGAGGAGCCATCCTG-3' | |||
| NF-κB | 上游: 5'-GACCAGGAAGTCAGCGAGTC-3' | 94 ℃预变性3 min; 94 ℃变性30 s, 54 ℃退火30 s, 72 ℃延伸45 s, 30个循环; 72 ℃延伸10 min | 176 |
| 下游: 5'-TCCAGAGGGACAGCTCTTGT-3' |
统计学处理 采用SPSS17.0软件处理, 数据以mean±SD表示. 多组间比较采用单因素方差分析(One-way ANOVA), 两两比较, 方差齐则采用LSD-t法比较, 若方差不齐则采用Dunnett's C法, P<0.05为差异有统计学意义.
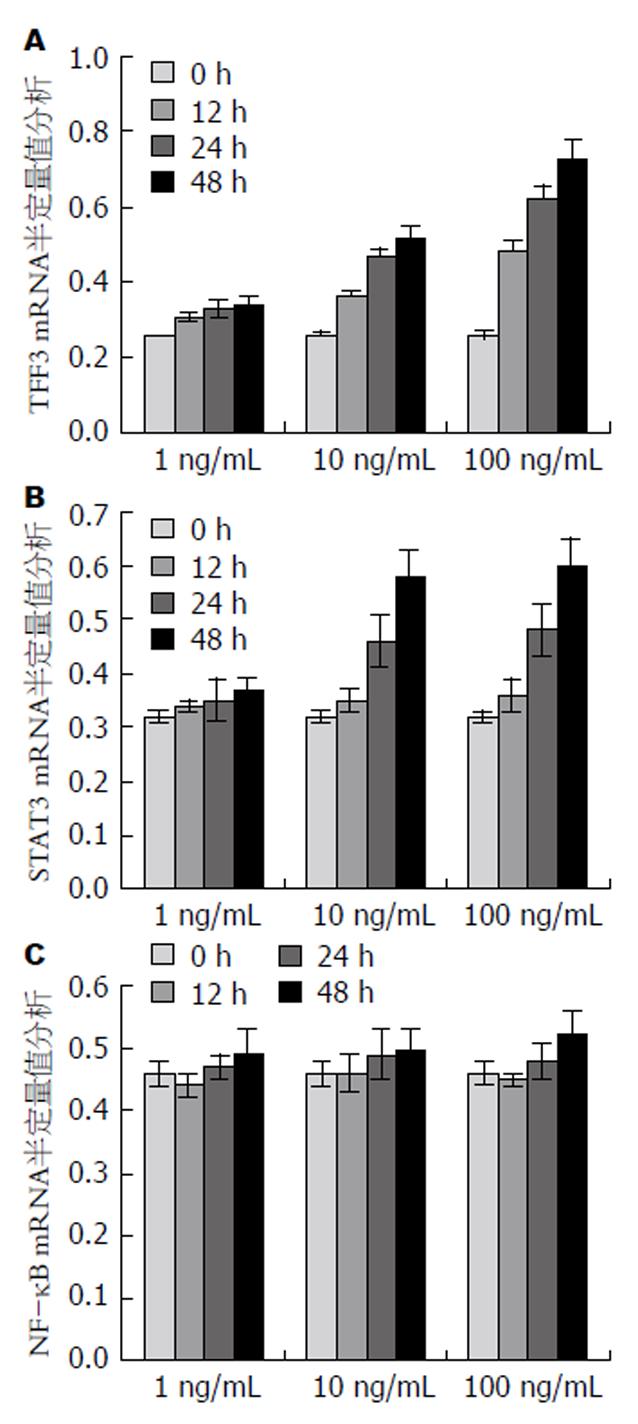
1 ng/mL的IL-22干预IEC-6细胞12、24、48 h后TFF3和STAT3 mRNA与干预前(0 h)比较, 各组间差异无统计学意义(P>0.05). 10 ng/mL组中, 随着干预时间的增加, TFF3 mRNA表达升高, 干预24 h与48 h差异无统计学意义(P>0.05), 其余各时间点比较差异均有统计学意义(P<0.05); STAT3 mRNA表达量随时间的增加而升高, 12 h与0 h比较差异不大(P>0.05), 其余各时间点比较差异有统计学意义(P<0.05). 100 ng/mL组, TFF3 mRNA表达量随时间增加而升高, 各时间点比较差异均有统计学意义(P<0.05); STAT3 mRNA表达与干预时间的关系与10 ng/mL组相同(表2, 3). 从实验分析结果来看, TFF3 mRNA、STAT3 mRNA表达与IL-22干预的时间有一定相关性, 即干预时间延长, 表达量升高(图1-3, 4A, B).
共培养12 h时, TFF3 mRNA在100 ng/mL的IL-22干预后表达量与10 ng/mL、1 ng/mL干预后相比均显著升高(P<0.05), 而统计结果显示10 ng/mL干预后与1 ng/mL干预后比较表达量无明显升高(P>0.05); STAT3 mRNA表达随IL-22浓度升高差异均无显著意义(P>0.05). 共培养24、48 h时, IL-22干预浓度越高, TFF3 mRNA表达量越高, 各组比较差异均有统计学意义(P<0.05); STAT3 mRNA表达量随IL-22浓度升高同样升高, 但100 ng/mL与10 ng/mL干预后表达量差异无统计学意义(P>0.05)而分别与1 ng/mL干预后相比差异有统计学意义(P<0.05)(表2, 3). 总的来看, TFF3 mRNA、STAT3 mRNA表达量均存在IL-22浓度依赖性, 即IL-22浓度越高, 表达量越高(图4A, B).
各浓度组均未能测到STAT6表达, IEC-6细胞培养12、24、48 h后NF-κB mRNA与处理前相比差异均无统计学意义(P>0.05)(表4, 图4C).
| 浓度(ng/mL) | 时间 | F值 | P值 | |||
| 0 h | 12 h | 24 h | 48 h | |||
| 1 | 0.46±0.02 | 0.44±0.02 | 0.47±0.02 | 0.49±0.04 | 2.27 | 0.097 |
| 10 | 0.46±0.02 | 0.46±0.03 | 0.49±0.04 | 0.50±0.03 | 2.27 | 0.094 |
| 100 | 0.46±0.02 | 0.45±0.01 | 0.48±0.03 | 0.52±0.04 | 2.371 | 0.087 |
| F值 | 0.000 | 1.912 | 2.007 | 1.832 | ||
| P值 | 1.000 | 0.183 | 0.146 | 0.169 | ||
TFF3能促进黏膜重建和损伤修复, 在胃肠黏膜保护和维持黏膜屏障稳定性中起着重要作用. IL-22可以促进肠上皮细胞增殖、迁移及黏膜愈合, 并上调保护因子β防御素及黏蛋白2(mucin 2, MUC2)的表达, 增强上皮细胞紧密连接, 增强上皮屏障功能而在IBD中发挥保护作用. 已有研究[2]证实IL-22在实验性结肠炎肠黏膜中表达增加且与疾病活动度正相关, TFF3在实验性结肠炎后期黏膜修复过程中亦明显增加[6], IL-22与TFF3的表达是否有关值得进一步研究. 本研究发现IL-22可能是TFF3的重要调控因子, 通过上调TFF3表达参与黏膜修复. 实验结果显示, TFF3 mRNA表达与IL-22在总体上呈现时间、浓度依赖性, 即随着IL-22浓度升高、干预时间的延长, TFF3表达升高更为显著. 我们发现低浓度的IL-22(1 ng/mL)不能上调TFF3的表达, 而高浓度的IL-22(10、100 ng/mL)可以上调TFF3表达, 从而推测, 生理剂量的IL-22对TFF3表达可能没有影响或者影响较小, 而炎症情况下IL-22表达增加则可发挥黏膜保护及促进修复作用.
IL-22调控TFF3表达的具体机制尚未明确. 有关IL-22和TFF3两者各自的信号转导途径已有较多研究. IL-22发挥生物学效应的机制主要有STAT信号途径、JAK1和TYK2信号途径、MEK-ERK-RSK、SAPK/JNK、P38激酶的MAPK途径[7]. Brand等[5]证实, IL-22可以通过激活依赖MAP激酶的ERK1/2、Akt途径增加IEC的增殖及β-防御素的表达. Auernhammer等[8]发现IL-22可以通过STAT1/STAT3途径上调IEC细胞表达细胞因子信号抑制物3(suppressor of cytokine signaling, SOCS3). 另有相关研究[9]表明IL-22可以通过PI3-Akt途径、ERK-MAPK途径增加上皮细胞迁移及上皮损伤修复. Hommes等[10]在小鼠克罗恩病模型中, 发现IL-22通过激活SAPK/JNK途径, 从而促进肠道黏膜愈合, 使临床症状得到改善. Andoh等[11]证实IL-22可以通过NF-κB、AP-1以及MAP激酶途径上调一些炎症基因, 如: IL-6、IL-8、IL-11、白血病抑制因子的表达. Pickert等[4]应用STAT3IEC-KO小鼠模型, 证实IL-22可以通过STAT3信号途径增强结肠损伤黏膜修复. 另外, 多种细胞因子也可以通过不同的调控途径影响TFF3的表达. Blanchard等[12]发现IL-4和IL-13可以通过STAT6途径上调TFF3的表达. Dossinger等[13]证实IL-6对TFF3的表达具有双重作用, 他既可以通过C/EBPβ途径抑制TFF3的表达, 又可以通过STAT3途径明显增加TFF3基因转录. 根据上述研究, 推测IL-22可能通过STAT3、STAT6及NF-κB途径调节TFF3表达.
STAT蛋白家族参与了多种细胞因子、生长因子的信号转导, 调控人体免疫反应、炎症反应以及细胞的生长、分化等. 关于IBD患者的研究[14]均提示, 总STAT3和磷酸化的STAT3水平在UC和CD患者炎症肠黏膜中持续性高表达, 且磷酸化的STAT3升高水平与这些组织炎症损伤程度呈正相关. Dossinger等[13]研究证实, IL-6可以活化肠上皮细胞STAT3, 进而明显增加TFF3的转录. Monteleone等[3]发现相对于IL-6, STAT3的活化更依赖于IL-22, 敲除STAT3基因的小鼠, 更容易发生结肠炎, 而且这种小鼠的肠上皮细胞缺乏明显的自我修复功能, IL-22诱导结肠炎损伤黏膜处STAT3活化, 不仅促进肠上皮细胞增殖、迁移及防治细胞凋亡, 而且可以有效控制细菌在损伤黏膜处繁殖. Brand等[5]曾研究证实, 在肠上皮细胞, IL-22通过激活STAT3途径, 从而增加一些促炎性细胞因子的转录, 如IL-8和TNF-α. 本实验亦发现IL-22可以诱导STAT3在肠上皮细胞表达增加, 且基本与TFF3的表达同步增加, 从而可以推测, IL-22可能通过活化STAT3信号通路而上调TFF3表达. STAT6主要在IL-4和IL-13产生的反应中发挥作用, Blanchard等[12]研究证实, 在结肠癌细胞, IL-4和IL-13可以通过STAT6途径上调TFF3表达. 但本实验结果则显示, 在IL-22干预IEC-6细胞前后, 均未检测到STAT6表达, 其原因可能为IEC-6为正常肠上皮细胞而非癌细胞, STAT6本身在IEC-6不表达.
NF-κB是参与调控肠道免疫炎性反应的关键因子之一. 许多IBD临床治疗用药, 如糖皮质激素、5-氨基水杨酸以及细胞因子抑制剂等的药理作用均与抑制NF-κB有关[15]. 研究[11]报道, 在肠上皮细胞及结肠下成纤维细胞, IL-22可以激活NF-κB, 进而上调一些促炎因子如IL-6、IL-8、IL-11、TNF-α以及趋化因子和金属蛋白酶的产生和释放, 在IBD的致病机制中发挥重要作用. 同样, TFF3的表达也受NF-κB调节信号的影响, 如IL-1β可以通过NF-κB途径下调TFF3的表达[13]. 但本实验结果显示IEC-6细胞经不同浓度IL-22干预不同的时间, NF-κB转录水平与干预前无明显变化. 分析其原因, 可能不同来源的细胞有不同的信号通路. 而且有研究报道, IL-22的主要信号转导通路是Jak1/Tyk2/SATA3. 另外, IL-22需在特殊条件下与其异质二聚体受体复合物结合才可以激活STAT1、MAPK、NF-κB、AP-1及蛋白激酶B这些信号转导因子[16]. Teng等[17]研究证实, TFF3减轻实验性结肠炎动物模型肠道炎症的机制之一是TFF3可以下调Toll样受体4(Toll-like receptor 4, TLR4)和NF-κB的转录, 从而抑制促炎因子TNF-α的转录而减轻炎症. 由此推测, 本实验中IL-22上调TFF3表达的同时, TFF3反过来可能抑制NF-κB的表达, 从而使NF-κB的表达增加被抵消.
总之, 本实验发现IL-22可上调IEC-6细胞TFF3表达, 其可能机制是通过STAT3信号转导途径, 这可能是IL-22在IBD中促进黏膜修复、发挥黏膜保护作用的机制之一.
肠三叶因子(intestinal trefoil factor, ITF/TFF3)能促进黏膜重建和损伤修复, 在胃肠黏膜保护中起着重要作用. 白介素(interleukin, IL)-22参与IBD保护机制, 促进肠上皮细胞增殖、迁移及黏膜愈合, 上调某些保护因子表达如β防御素等. 已有研究证实IL-22在结肠炎肠黏膜中表达升高且与疾病活动度正相关, TFF3在黏膜修复过程中明显增加, 而IL-22与TFF3的作用关系, 目前国内外尚未见报道.
董玉兰, 副教授, 中国农业大学动物医学院
随着动物实验的不断发展, 发现IL-22在IBD的肠黏膜修复中发挥积极作用, TFF3在胃肠黏膜保护和维持黏膜屏障稳定性中起着重要作用, 进一步明确IL-22与TFF3的作用关系, 有望为IBD的治疗提供新思路.
国内外已有相关研究证实IL是TFF3表达的重要调控因子, IL-22在实验性结肠炎肠黏膜中表达增加且与疾病活动度正相关, TFF3在实验性结肠炎后期黏膜修复过程中亦明显增加, 而IL-22与TFF3的作用关系, 目前国内外尚未见报道, IL-22调控TFF3表达的具体机制尚未明确.
既往研究多关注TFF3与IL-4、IL-6、IL-13及IL-β的关系, 本文在此基础上对IL-22与TFF3的关系做了进一步阐述.
本研究发现IL-22可上调IEC-6细胞TFF3的表达, 若将IL-22应用于IBD患者治疗, 可能会改善患者肠道炎症反应, 促进黏膜愈合.
重组大鼠白介素-22(rrIL-22): 利用基因重组技术作用于大鼠获得的, 为白细胞或免疫细胞间相互作用的淋巴因子, 是白介素家族成员之一, 发挥免疫调节作用.
文章关注了IL-22对IEC-6细胞TFF3表达的影响及可能的作用机制, 研究设计合理、方法得当, 与大多数研究关注IL-4、IL-6、IL-13及IL-β与TFF3表达的关系相比, 具有一定创新性.
编辑: 郭鹏 电编: 闫晋利
| 1. | Rescigno M. The pathogenic role of intestinal flora in IBD and colon cancer. Curr Drug Targets. 2008;9:395-403. [PubMed] [DOI] |
| 2. | Brand S. Crohn's disease: Th1, Th17 or both? The change of a paradigm: new immunological and genetic insights implicate Th17 cells in the pathogenesis of Crohn's disease. Gut. 2009;58:1152-1167. [PubMed] [DOI] |
| 3. | Monteleone I, Pallone F, Monteleone G. Interleukin-23 and Th17 cells in the control of gut inflammation. Mediators Inflamm. 2009;2009:297645. [PubMed] [DOI] |
| 4. | Pickert G, Neufert C, Leppkes M, Zheng Y, Wittkopf N, Warntjen M, Lehr HA, Hirth S, Weigmann B, Wirtz S. STAT3 links IL-22 signaling in intestinal epithelial cells to mucosal wound healing. J Exp Med. 2009;206:1465-1472. [PubMed] [DOI] |
| 5. | Brand S, Beigel F, Olszak T, Zitzmann K, Eichhorst ST, Otte JM, Diepolder H, Marquardt A, Jagla W, Popp A. IL-22 is increased in active Crohn's disease and promotes proinflammatory gene expression and intestinal epithelial cell migration. Am J Physiol Gastrointest Liver Physiol. 2006;290:G827-G838. [PubMed] [DOI] |
| 7. | Sonnenberg GF, Fouser LA, Artis D. Functional biology of the IL-22-IL-22R pathway in regulating immunity and inflammation at barrier surfaces. Adv Immunol. 2010;107:1-29. [PubMed] [DOI] |
| 8. | Auernhammer CJ, Bousquet C, Melmed S. Autoregulation of pituitary corticotroph SOCS-3 expression: characterization of the murine SOCS-3 promoter. Proc Natl Acad Sci USA. 1999;96:6964-6969. [PubMed] [DOI] |
| 9. | Brand S, Dambacher J, Beigel F, Olszak T, Diebold J, Otte JM, Göke B, Eichhorst ST. CXCR4 and CXCL12 are inversely expressed in colorectal cancer cells and modulate cancer cell migration, invasion and MMP-9 activation. Exp Cell Res. 2005;310:117-130. [PubMed] [DOI] |
| 10. | Hommes D, van den Blink B, Plasse T, Bartelsman J, Xu C, Macpherson B, Tytgat G, Peppelenbosch M, Van Deventer S. Inhibition of stress-activated MAP kinases induces clinical improvement in moderate to severe Crohn's disease. Gastroenterology. 2002;122:7-14. [PubMed] [DOI] |
| 11. | Andoh A, Zhang Z, Inatomi O, Fujino S, Deguchi Y, Araki Y, Tsujikawa T, Kitoh K, Kim-Mitsuyama S, Takayanagi A. Interleukin-22, a member of the IL-10 subfamily, induces inflammatory responses in colonic subepithelial myofibroblasts. Gastroenterology. 2005;129:969-984. [PubMed] [DOI] |
| 12. | Blanchard C, Durual S, Estienne M, Bouzakri K, Heim MH, Blin N, Cuber JC. IL-4 and IL-13 up-regulate intestinal trefoil factor expression: requirement for STAT6 and de novo protein synthesis. J Immunol. 2004;172:3775-3783. [PubMed] [DOI] |
| 13. | Dossinger V, Kayademir T, Blin N, Gött P. Down-regulation of TFF expression in gastrointestinal cell lines by cytokines and nuclear factors. Cell Physiol Biochem. 2002;12:197-206. [PubMed] [DOI] |
| 14. | Musso A, Dentelli P, Carlino A, Chiusa L, Repici A, Sturm A, Fiocchi C, Rizzetto M, Pegoraro L, Sategna-Guidetti C. Signal transducers and activators of transcription 3 signaling pathway: an essential mediator of inflammatory bowel disease and other forms of intestinal inflammation. Inflamm Bowel Dis. 2005;11:91-98. [PubMed] [DOI] |
| 15. | Dijkstra G, Moshage H, Jansen PL. Blockade of NF-kappaB activation and donation of nitric oxide: new treatment options in inflammatory bowel disease? Scand J Gastroenterol Suppl. 2002;37-41. [PubMed] [DOI] |
| 16. | Ziesché E, Bachmann M, Kleinert H, Pfeilschifter J, Mühl H. The interleukin-22/STAT3 pathway potentiates expression of inducible nitric-oxide synthase in human colon carcinoma cells. J Biol Chem. 2007;282:16006-16015. [PubMed] [DOI] |
| 17. | Teng X, Xu LF, Zhou P, Sun HW, Sun M. Effects of trefoil peptide 3 on expression of TNF-alpha, TLR4, and NF-kappaB in trinitrobenzene sulphonic acid induced colitis mice. Inflammation. 2009;32:120-129. [PubMed] [DOI] |