修回日期: 2015-01-12
接受日期: 2015-01-16
在线出版日期: 2015-03-08
目的: 研究肠内营养(enteral nutrition, EN)与肠外营养(parenteral nutrition, PN)对重症急性胰腺炎(severe acute pancreatitis, SAP)患者白介素(interleukin, IL)-6、IL-10、肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)、内毒素水平的影响, 探索早期EN对SAP影响的机制.
方法: 2009-06/2013-06萍乡市人民医院消化科收治的72例SAP患者在常规综合治疗的基础上随机分为EN组及PN组各36例, 检测比较EN组与PN组入院时、营养支持第4天、第7天、第14天的常规指标、TNF-α、IL-6、IL-10、内毒素水平, 并比较两组患者感染率、死亡率及患者住院天数和费用.
结果: 治疗第14天时EN组的C反应蛋白(C-reactive protein, CRP)和白细胞计数(white blood cell, WBC)均较PN组低(P<0.05); 从开始治疗第4天起, EN组患者内毒素水平明显低于PN组患者内毒素水平(P<0.05); 在治疗第7天, EN组患者TNF-α和IL-6明显下降, 并与PN组差异有统计学意义(P<0.05); EN组患者IL-10水平在治疗4 d后明显高于PN组, 差异有统计学意义(P<0.05).
结论: 对SAP患者早期实施EN可以调节炎症反应, 延缓全身炎症反应综合征(systemic inflammatory response syndrome, SIRS)、多器官功能不全综合征(multiple organ dysfunction syndrome, MODS)等并发症的发生发展; EN可以降低血浆内毒素水平, 减少全身感染的发生几率.
核心提示: 本研究表明, 对重症急性胰腺炎(severe acute pancreatitis, SAP)早期实施肠内营养(enteral nutrition, EN)是一种安全、经济、有效的治疗措施. 早期EN可以调节SAP患者炎症反应, 延缓全身炎症反应综合征(systemic inflammatory response syndrome)、多器官功能不全综合征(multiple organ dysfunction syndrome)等并发症的发生发展; EN可以降低血浆内毒素水平, 减少全身感染的发生机率.
引文著录: 付云辉, 文剑波, 王桂良, 文萍, 龚敏, 韩明, 李兴. 早期肠内营养对重症急性胰腺炎患者细胞因子水平及内毒素的影响. 世界华人消化杂志 2015; 23(7): 1174-1179
Revised: January 12, 2015
Accepted: January 16, 2015
Published online: March 8, 2015
AIM: To assess the influence of enteral nutrition (EN) on interleukin (IL)-6, IL-10, and tumor necrosis factor-α (TNF-α) production and plasma endotoxin level in patients with severe acute pancreatitis (SAP).
METHODS: Seventy-two patients with SAP were randomly divided into two groups to receive either EN or parenteral nutrition (PN) on the basis of routine comprehensive treatment. Conventional indicators, TNF-α, IL-6, IL-10 and plasma concentration of endotoxin were evaluated on 0, 1, 4, 7, and 14 d after treatment. The infection rates, mortality, hospitalization days and hospitalization costs were compared for the two groups.
RESULTS: After 14 d of treatment, C-reactive protein (CRP) and white blood cell count (WBC) in the EN group were significantly lower than those in the PN group (P < 0.05). After 4 d of treatment, plasma concentration of endotoxin in the EN group was significantly lower than that in the PN group. On day 7, plasma concentrations of TNF-α and IL-6 in the EN group significantly declined compared with the PN group (P < 0.05). Plasma concentration of IL-10 in the EN group was significantly higher than that in the PN group after 4 d of treatment (P < 0.05).
CONCLUSION: In patients with SAP, early implementation of EN can regulate inflammation, and delay the development of complications such as systemic inflammatory response syndrome (SIRS) and multiple organ dysfunction syndrome (MODS). EN can protect the intestinal mucosal barrier, decrease plasma endotoxin level, and reduce systemic infection.
- Citation: Fu YH, Wen JB, Wang GL, Wen P, Gong M, Han M, Li X. Effect of enteral nutrition on cytokine production and plasma endotoxin in patients with severe acute pancreatitis. Shijie Huaren Xiaohua Zazhi 2015; 23(7): 1174-1179
- URL: https://www.wjgnet.com/1009-3079/full/v23/i7/1174.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i7.1174
重症急性胰腺炎(severe acute pancreatitis, SAP)是消化科并不少见的急、危重疾病, 其临床过程凶险、复杂, 并发症多, 医疗花费较大, 死亡率仍较高. 因SAP患者能量消耗巨大, 且需长期限制进食, 故SAP患者后期往往出现营养不良及低蛋白血症, 影响预后. 因此营养支持成为治疗SAP重要的一环. 以前提倡全胃肠外营养(parenteral nutrition, PN), 但PN的长期应用可导致肠黏膜萎缩, 肠黏膜屏障功能破坏, 促进肠道细菌易位发生, 增加胰周感染和腹腔感染的发生率[1]. 近年来, 随着对肠内营养(enteral nutrition, EN)研究的深入, 对SAP患者早期实施EN已经成为共识. 本研究将EN与PN治疗SAP作前瞻性随机对照研究, 检测EN与PN对SAP患者白介素(interleukin, IL)-6、IL-10、肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)及内毒素水平的影响, 探索早期EN对SAP影响的机制.
2009-06/2014-06萍乡市人民医院消化科共收治的356例急性胰腺炎(acute pancreatitis, AP)患者, 其中93例符合2003年中华医学会消化病学分会制定的《中国急性胰腺炎诊治指南(草案)》[2]中的SAP诊断标准, 排除: (1)年龄>65岁或<14岁者; (2)慢性肾功能不全并接受血透患者; (3)预计需要行连续肾脏替代(continuous renal replacement therapy, CRRT)治疗患者; (4)妊娠及哺乳期患者; (5)合并炎症性肠病患者; (6)入院后48 h内死亡患者; (7)起病时间超过48 h入院患者, 共72例患者纳入本研究. 其中男43例, 女29例, 年龄25-75岁, 平均年龄50.1岁±11.3岁. 病因包括胆源性胰腺炎45例, 饮酒史9例, 高酯血症12例, 其他6例. 72例患者随机进入EN组36例, PN组36例, 两组患者年龄、性别、病因构成比较差异无统计学意义(P>0.05), 两组患者入院后初始急性生理功能和慢性健康状况(acute physiology and chronic health evaluation, APACHE)Ⅱ评分及计算机断层扫描(computed tomography, CT)严重指数(CT severity index, CTSI)比较差异无统计学意义(P>0.05)(表1, 2).
| 分组 | 性别 | 年龄(岁) | APACHEⅡ评分 | CTSI积分 | |
| 男 | 女 | ||||
| EN组 | 20 | 16 | 48.9±12.2 | 11.4±4.9 | 15.5±1.8 |
| PN组 | 23 | 13 | 51.3±13.6 | 12.3±5.1 | 15.8±1.6 |
| 分组 | 胆石症 | 高酯血症 | 酒精 | 其他 |
| EN组 | 24 | 5 | 4 | 3 |
| PN组 | 21 | 7 | 5 | 3 |
1.2.1 临床治疗: 所有患者入院后常规予禁食、早期液体复苏、抑制胰腺外分泌、抑制胰酶活性、中药、改善微循环等治疗, 胆源性胰腺炎或疑有感染者予抗感染治疗, 胆源性胰腺炎患者视情况急诊内镜逆行胰胆管造影(endoscopic retrograde cholangiopancreatography, ERCP), 需要呼吸支持患者予机械辅助通气. 所有患者入院后常规予中心静脉置管便于监测中心静脉压及液体输入. EN组患者在入院后24-48 h内在X线引导下或胃镜引导下置鼻-空肠管至Treitz韧带下约30-40 cm处, 如无休克、消化系出血、肠梗阻、肠瘘、严重肠麻痹等情况, 开始实施EN, 实施过程中遵循由少到多、由淡到浓、由慢到快的原则, 并密切注意观察患者的反应. 营养物质先采用短肽类制剂(百普素), 如果患者能够耐受和无不良反应, 便逐渐过渡到整蛋白类制剂(能全力), 同时适当补充谷氨酰胺制剂及肠道微生态制剂(枯草杆菌肠球菌二联活菌), 如EN能量不能满足患者, 辅以PN. PN组患者在血流动力学稳定后即开始实施PN, 通过中心静脉通道路给予, 非蛋白热量控制在25-30 kcal/(kg•d), 蛋白质1.0-1.5 g/(kg•d), 脂肪乳剂视血酯情况而定, 同时适量补充各种维生及其他微量元素. 常规观察并记录所有患者的腹痛、腹胀、呕吐、发热、黄疸、大便性状等症状以及生命体征、心肺腹等体征.
1.2.2 检测指标: 常规检测EN组与PN组入院时、营养支持第4天、第7天、第14天的体质量、血常规、肝肾功能电解质、血淀粉酶、C反应蛋白(C-reactive protein, CRP)等指标. 分别抽取入院时、第4天、第7天、第14天静脉血检测TNF-α、IL-6、IL-10及内毒素检测, TNF-α、IL-6、IL-10的检测采用ELISE试剂盒定量检测, 内毒素采用鲎试验定量检测. 对所有患者入院时及入院后14 d进行APACHEⅡ及CTSI评分. 记录两组患者感染率、死亡率及其患者住院天数和费用.
统计学处理 使用SPSS13.0软件包对数据进行分析, 计量数据结果以mean±SD表示, 采用t检验分析进行组间比较, 计数资料采用χ2检验, P<0.05为差异有统计学意义.
EN组患者均在48 h内成功实施EN, 耐受良好, 5例患者在实施EN初期出现一过性恶心、呕吐及腹胀症状加重, 但在调整输入速度及浓度后症状很快缓解, 未出现因不能耐受而中断EN的病例. EN组的感染率、住院天数及治疗费用均低于PN组. 治疗第14天时EN组APACHEⅡ评分显著低于PN组, 两组死亡率差异无统计学意义(表3).
两组患者治疗后第7天的血淀粉酶均显著下降(P<0.05), 两组间比较差异无统计学意义; 两组患者治疗后第14天血清白蛋白明显回升(P<0.05), 两组间比较差异无统计学意义; 两组患者治疗前后体质量均无显著变化. 两组患者治疗第14天时CRP及WBC均显著下降(P<0.05), 两组间比较EN组较PN组下降更明显, 差异有统计学意义(P<0.05)(表4).
| 指标 | 入院时 | 营养支持第7天 | 营养支持第14天 | |||
| EN组 | PN组 | EN组 | PN组 | EN组 | PN组 | |
| 体质量(kg) | 62.3±6.8 | 61.4±6.5 | 59.9±8.2 | 60.8±4.8 | 58.3±4.2 | 56.6±2.6 |
| 血淀粉酶(IU) | 1543.0±321.0 | 1589.0±283.0 | 425.0±96.0 | 403.0±108.0 | 180.0±64.0 | 191.0±59.0 |
| 白蛋白(g/L) | 26.1±3.5 | 26.8±2.9 | 27.5±2.8 | 28.4±3.6 | 30.1±3.3 | 29.3±3.1 |
| CRP(mg/L) | 156.0±49.3 | 159.0±52.3 | 98.4±9.8 | 121.0±6.9 | 20.3±5.5 | 42.1±6.2a |
| WBC(×109/L) | 18.5±3.2 | 17.9±3.5 | 15.8±2.8 | 16.5±3.2 | 7.5±1.4 | 11.5±2.6a |
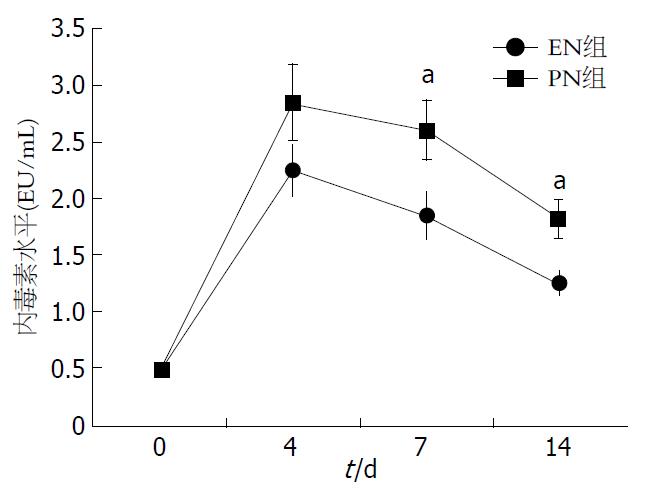
两组患者血浆内毒素水平均较入院时均有明显升高, 但从治疗后第4天直到治疗后14 d, EN组患者血浆内毒素水平均明显低于PN组患者内毒素水平(P<0.05)(图1).
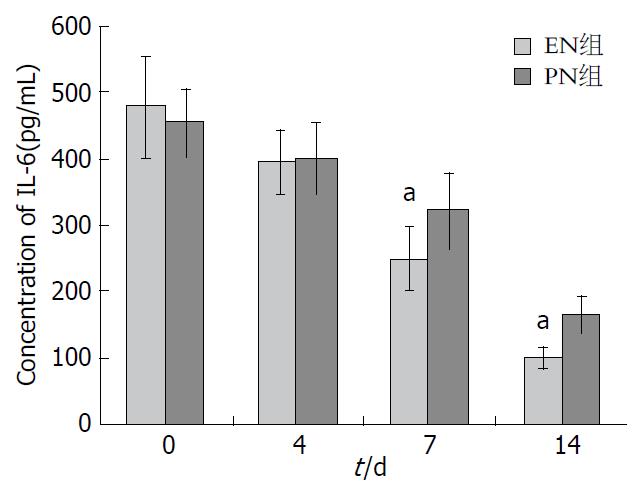
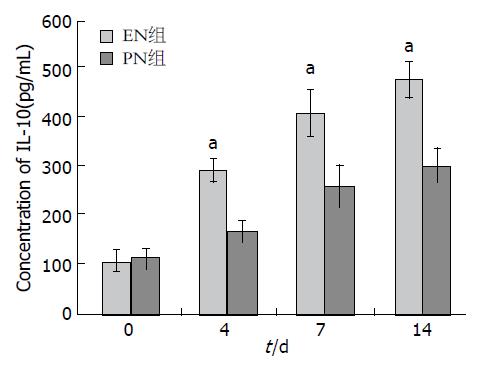
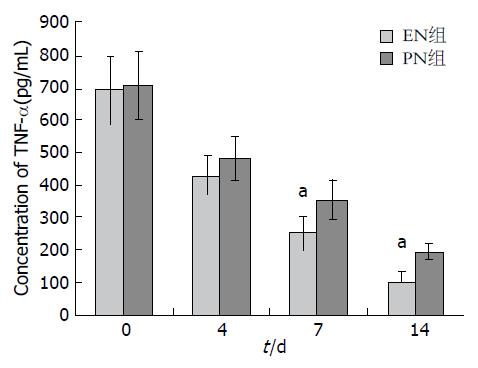
两组患者血清TNF-α、IL-6水平均呈下降趋势, 血清IL-10呈升高趋势. 从治疗第7日开始, EN组患者血清TNF-α、IL-6水平下降更加明显, 且与PN组比较差异有统计学意义(P<0.05). 从治疗第4天开始直到治疗后第14天, EN组患者血清IL-10水平升高幅度明显高于PN组, 两组比较差异有统计学意义(P<0.05)(图2-4).
SAP发病机制中, 各种细胞因子在SAP发病机制中扮演着重要角色. 胰腺损伤后过度激活细胞因子及炎症介质, 形成级联瀑式反应, 最终导致全身炎症反应综合征(systemic inflammatory response syndrome, SIRS)及肺部、肾脏等其他脏器的损伤甚至多器官功能不全综合征(multiple organ dysfunction syndrome, MODS). 各种炎症因子相互作用, 形成复杂的免疫网络, 对SAP的起病及病情演变有着重大影响[3]. TNF-α是开启SAP炎症反应的重要细胞因子之一, 在SAP胰腺组织损伤中发挥着重要作用[4,5]. IL-6[6,7]可以促进B细胞分化成熟和急性期反应蛋白的生成, 介导急性期反应, 是调节SAP炎症反应的重要细胞因子, 参与SAP的多器官损伤. IL-10[8,9]是由Th2细胞产生的具有广泛作用的抗炎细胞因子, 其功能主要是抑制单核-巨噬细胞释放促炎细胞因子, 调节全身免疫和炎症反应, 在阻止SAP发展中发挥着重要作用. 有研究[10]表明EN可以影响SAP患者炎症介质的产生, 但这方面研究多限于动物实验或仅仅选取其中1-2种炎症介质作为检测指标, 不能全面反应各种炎症介质间相互作用. 本课题组选取最具代表性的TNF-α、IL-6、IL-10 3种细胞因子作为观察指标, 研究EN对SAP患者细胞因子水平的影响, 我们发现早期EN可以降低血清中TNF-α及IL-6水平, 升高血清IL-10水平, 与PN组差异有统计学意义(P<0.05), 进一步证实了早期EN可以通过调节SAP患者炎症因子, 对SAP患者SIRS、MODS等并发症的发生发展起到一定的延缓作用, 从而改善SAP预后. 为早期EN治疗SAP提供了进一步理论支持.
在SAP发病机制中, "二次打击"学说[11]占据重要地位, SAP患者因肠道通透性增加而导致肠内细菌移位及肠源性内毒素血症, 最终可能引起的脓毒败血症、胰腺感染、腹腔感染等并发症. 早期EN可以促进肠道功能恢复, 可以保持肠道黏膜结构的完整, 从而维护肠道黏膜屏障功能[12]. 在EN液中, 加入微生态制剂, 则可以保持和调整肠道微生态的平衡, 减少肠道细菌移位. 本研究中, 我们在EN患者EN液中常规加用微生态制剂(枯草杆菌肠球菌二联活菌), 结果表明, EN组患者血浆内毒素水平显著低于PN组, 同时EN组患者感染发生率也明显低于PN组患者, 结果与相关报道[1,12]一致, 进一步证实了早期EN加微生态制剂在治疗SAP中意义重大.
目前EN治疗SAP已成为共识, 但实施时机与途径仍存在争议. 由于SAP发病数小时后, 肠道黏膜屏障即受损, 加重SIRS及MODS[13], 基于EN在改善肠道黏膜屏障中的作用, 理论上EN实施越早, 受益越大, 但早期EN的安全性受到质疑. Marik[14]研究发现入院24 h内给予EN能有效降低AP患者的死亡率、入院天数以及并发症发生率, 2006年欧洲肠外肠内营养协会[11]提出在SAP发病24 h后可通过空肠管饲给予EN, 2012年的国际胰腺炎治疗的国际共识指南建议尽可能早的使用EN[15]. 本研究中, EN均在48 h内开始经鼻空肠管给予, 实施过程中, 采取循序渐进的原则, 早期辅以PN, 逐渐过渡到全EN, 患者耐受较好, 并未出现与EN实施有关的严重并发症; EN组APACHEⅡ评分、感染发生率、住院天数及治疗费用均显著低于PN组. 因此我们认为, 在SAP起病48 h以内实施EN是安全的、且患者受益明显. 在EN实施途径方面, 目前主流观点是经空肠给予, 因为经空肠给予营养物质对胰腺刺激较小, 但最近几年来, 该观点也受到挑战, Petrov等[16]的研究为SAP患者经鼻胃管饲同样具备安全性及耐受性. 我们在平时临床工作中发现, 部分SAP患者在排便、排气功能恢复后即经口进食少量低脂流质或半流质, 未出现症状加重的情况. 因缺乏更多支持经鼻胃管饲的证据, 目前国内外相关指南仍是提倡经空肠EN, 我们建议早期经鼻空肠管给予EN, 在患者腹痛、腹胀症状缓解, 恢复排便、排气后适当经口补充营养物质, 争取尽早实现拔掉鼻空肠管.
在这里值得一提的是, 中华医学会消化病学分会在2013年制定了新的《中国急性胰腺炎诊治指南(2013年, 上海)》[17], 在该指南中, 将中度急性胰腺炎(moderately severe acute pancreatitis, MSAP)从SAP中划分出来, 如按新的指南, 本研究中大部分入选病例可归为MSAP, 因此本研究结果应适用于MSAP和SAP.
重症急性胰腺炎(severe acute pancreatitis, SAP)是消化科急、危重疾病, 其临床过程凶险、复杂, 死亡率仍较高. SAP发病机制中, 各种细胞因子在SAP发病机制中扮演着重要角色. 营养支持是治疗SAP重要的一环. 营养支持治疗方式的选择一直是SAP研究中一个热点.
肖卫东, 副教授, 副主任医师, 第三军医大学附属新桥医院普通外科
近年来, 随着研究的深入, 对SAP患者实施肠内营养(enteral nutrition, EN)已经成为共识, 但实施EN的时机仍存在争议, 早期EN对SAP患者的影响仍未完全揭示清楚.
有研究表明, 早期EN可以改善肠道通透性, 减少肠道细菌移位及肠源性内毒素的吸收, 调节免疫反应, 但相关大部分研究基于动物实验, 临床对照研究相对较少.
本研究将EN与肠外营养(parenteral nutrition, PN)治疗SAP作前瞻性随机对照研究, 选取最具代表性的白介素(interleukin, IL)-6、IL-10、肿瘤坏死因子α 3种细胞因子作为观察指标, 探索早期EN对SAP患者的影响.
本研究选择临床病例作为研究对象, 结果可靠, 可为临床工作提供重要参照.
本文主要就早期EN与PN对SAP患者炎症因子水平、治疗效果及费用进行了对照研究, 进一步证实了早期EN对SAP治疗的有效性.
编辑: 韦元涛 电编: 都珍珍
| 1. | Krüüner A, Yates MD, Drobniewski FA. Evaluation of MGIT 960-based antimicrobial testing and determination of critical concentrations of first- and second-line antimicrobial drugs with drug-resistant clinical strains of Mycobacterium tuberculosis. J Clin Microbiol. 2006;44:811-818. [PubMed] [DOI] |
| 4. | Satoh A, Gukovskaya AS, Edderkaoui M, Daghighian MS, Reeve JR, Shimosegawa T, Pandol SJ. Tumor necrosis factor-alpha mediates pancreatitis responses in acinar cells via protein kinase C and proline-rich tyrosine kinase 2. Gastroenterology. 2005;129:639-651. [PubMed] [DOI] |
| 5. | Denham W, Fink G, Yang J, Ulrich P, Tracey K, Norman J. Small molecule inhibition of tumor necrosis factor gene processing during acute pancreatitis prevents cytokine cascade progression and attenuates pancreatitis severity. Am Surg. 1997;63:1045-1049; discussion 1049-1050. [PubMed] |
| 6. | Sathyanarayan G, Garg PK, Prasad H, Tandon RK. Elevated level of interleukin-6 predicts organ failure and severe disease in patients with acute pancreatitis. J Gastroenterol Hepatol. 2007;22:550-554. [PubMed] [DOI] |
| 7. | Inagaki T, Hoshino M, Hayakawa T, Ohara H, Yamada T, Yamada H, Iida M, Nakazawa T, Ogasawara T, Uchida A. Interleukin-6 is a useful marker for early prediction of the severity of acute pancreatitis. Pancreas. 1997;14:1-8. [PubMed] [DOI] |
| 8. | Laveda R, Martinez J, Munoz C, Penalva JC, Saez J, Belda G, Navarro S, Feu F, Mas A, Palazon JM. Different profile of cytokine synthesis according to the severity of acute pancreatitis. World J Gastroenterol. 2005;11:5309-5313. [PubMed] |
| 9. | Han XC, Zhang YC, Wang Y, Jia MK. Clinical evaluation of serum interleukin 10 in patients with acute pancreatitis. Hepatobiliary Pancreat Dis Int. 2003;2:135-138. [PubMed] |
| 11. | Meier R, Ockenga J, Pertkiewicz M, Pap A, Milinic N, Macfie J, Löser C, Keim V. ESPEN Guidelines on Enteral Nutrition: Pancreas. Clin Nutr. 2006;25:275-284. [PubMed] [DOI] |
| 12. | Gupta R, Patel K, Calder PC, Yaqoob P, Primrose JN, Johnson CD. A randomised clinical trial to assess the effect of total enteral and total parenteral nutritional support on metabolic, inflammatory and oxidative markers in patients with predicted severe acute pancreatitis (APACHE II & gt; or =6). Pancreatology. 2003;3:406-413. [PubMed] |
| 13. | Yasuda T, Takeyama Y, Ueda T, Shinzeki M, Sawa H, Nakajima T, Kuroda Y. Breakdown of intestinal mucosa via accelerated apoptosis increases intestinal permeability in experimental severe acute pancreatitis. J Surg Res. 2006;135:18-26. [PubMed] [DOI] |
| 14. | Marik PE. What is the best way to feed patients with pancreatitis? Curr Opin Crit Care. 2009;15:131-138. [PubMed] [DOI] |
| 15. | Mirtallo JM, Forbes A, McClave SA, Jensen GL, Waitzberg DL, Davies AR. International consensus guidelines for nutrition therapy in pancreatitis. JPEN J Parenter Enteral Nutr. 2012;36:284-291. [PubMed] [DOI] |