修回日期: 2015-02-02
接受日期: 2015-02-06
在线出版日期: 2015-03-08
目的: 观察miR-214对人结肠癌细胞株LoVo中轴突导向因子4D(semaphorin 4D, Sema4D)表达水平的影响, 探讨miR-214对Sema4D的调控作用.
方法: 设计并合成miR-214模拟物(miR-214 mimics), miR-214抑制剂(miR-214 inhibitor), 二者对照序列(mi-control, in-control), 分别与以脂质体lipofectamine 2000包裹后转染人结肠癌细胞株LoVo. RT-PCR检测转染24 h后各细胞株内miR-214的表达及Sema4D mRNA的表达变化, 并用Western blot检测Sema4D蛋白的表达变化.
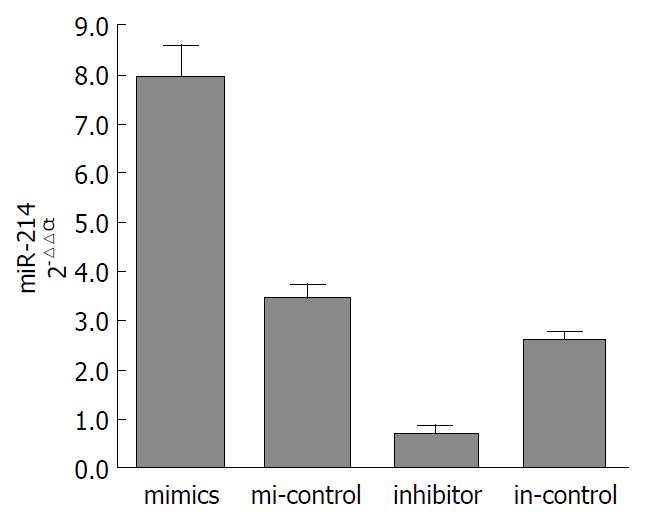
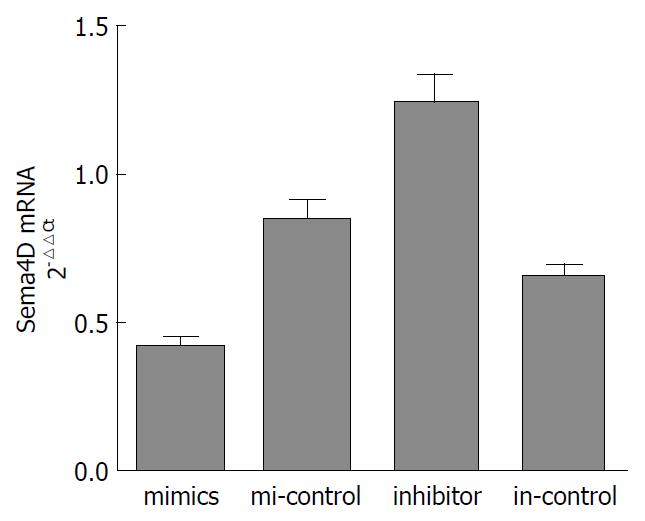
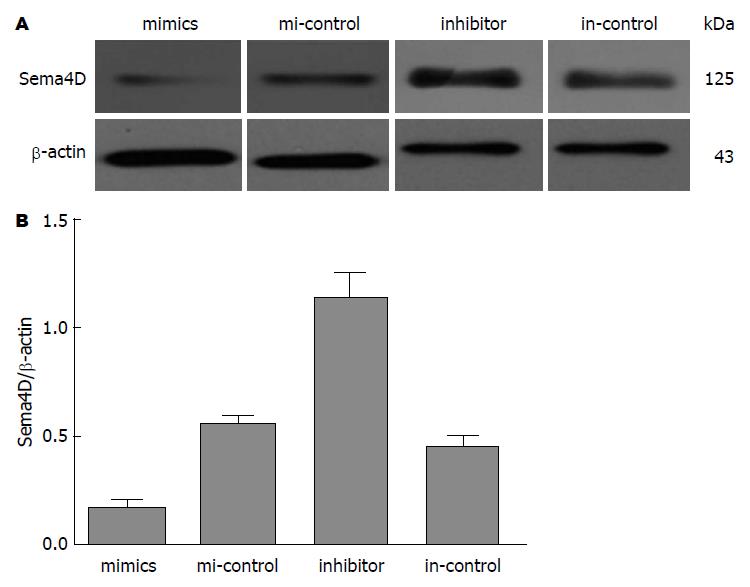
结果: LoVo细胞株转染miR-214 mimics、mi-control, inhibitor、in-control 24 h后miR-214的相对表达量为8.003±0.651, 3.464±0.332, 0.740±0.088, 2.620±0.166, mimics组miR-214表达较其对照组升高, inhibitor组表达较其对照组降低(P<0.05). Sema4D mRNA的相对表达量为: 0.420±0.027, 0.851±0.062, 1.243±0.087, 0.660±0.042; Sema4D蛋白/β-actin分别为: 0.163±0.037, 0.550±0.038, 1.137±0.112, 0.457±0.046. Sema4D mRNA及蛋白mimics组表达较其对照组降低, inhibitor组较其对照组升高(P<0.05).
结论: 人结肠癌细胞株LoVo中, Sema4D受miR-214的调控, miR-214可负向调控Sema4D mRNA的表达水平进而影响其蛋白的表达. miR-214可能作为结肠癌治疗的新靶点.
核心提示: 探讨了在结肠癌细胞株LoVo中, miR-214对轴突导向因子4D(semaphorin 4D, Sema4D)的负性调控作用, 证明了Sema4D能被miR-214负性调控. 对阐明miR-214的作用机制以及结肠癌的治疗提供重要的理论依据.
引文著录: 刘洋, 周红林, 侯友芳, 张捷. miR-214负向调控结肠癌细胞株LoVo中Sema4D的表达. 世界华人消化杂志 2015; 23(7): 1115-1120
Revised: February 2, 2015
Accepted: February 6, 2015
Published online: March 8, 2015
AIM: To observe the effect of miR-214 on Sema4D expression in human colon cancer cell line LoVo.
METHODS: miR-214 mimic, miR-214 inhibitor, and two control sequences (mi-control, in-control) were designed, synthesized and transfected into LoVo cells, respectively. RT-PCR was used to detect the expression changes of miR-214 and Sema4D mRNA in transfected cells, and the expression change of Sema4D protein was detected by Western blot.
RESULTS: The relative expression levels of miR-214 in LoVo cells transfected with miR-214 mimic, mi-control, miR-214 inhibitor, and in-control were 8.003 ± 0.651, 3.464 ± 0.332, 0.740 ± 0.088, and 2.620 ± 0.166, respectively. The expression of miR-214 increased significantly in the mimic group compared with the control group, but was significantly lower in the inhibitor group than in the control group (P < 0.05). The relative expression levels of Sema4D mRNA in LoVo cells transfected with miR-214 mimic, mi-control, miR-214 inhibitor, and in-control were 0.420 ± 0.027, 0.851 ± 0.062, 1.243 ± 0.087, and 0.660 ± 0.042, respectively, and the relative expression levels of Sema4D protein were 0.163 ± 0.037, 0.550 ± 0.038, 1.137 ± 0.112, and 0.457 ± 0.046, respectively. Sema4D mRNA and protein expression in the mimic group was decreased significantly compared with the control group, but was significantly increased in the inhibitor group compared with the control group (P < 0.05).
CONCLUSION: Sema4D expression is regulated by miR-214 in human colon cancer cell line LoVo, and miR-214 can down-regulate the expression of Sema4D mRNA and thereby influence the protein expression. miR-214 could be used as a new target for treatment of colon carcinoma.
- Citation: Liu Y, Zhou HL, Hou YF, Zhang J. miR-214 down-regulates Sema4D expression in colon cancer LoVo cells. Shijie Huaren Xiaohua Zazhi 2015; 23(7): 1115-1120
- URL: https://www.wjgnet.com/1009-3079/full/v23/i7/1115.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i7.1115
调查[1]显示, 我国结直肠癌发病率为20.9/10万, 是第六大常见的癌症, 已成为严重影响人类健康的疾病之一. 近年的研究[2]发现, 轴突导向因子4D(semaphorin 4D, Sema4D)在肿瘤的发生、肿瘤细胞的运动、转移、肿瘤血管生成中发挥着重要的作用. Mu等[3]研究表明Sema4D在结直肠癌中的表达明显高于正常组织, 并与患者的预后相关. 微小RNA(microRNA, miRNA)是一类新近发现的具有调控基因作用的内源性非编码短序列RNA, miRNA表达谱的变化与肿瘤细胞的增殖、凋亡、迁移、浸润、转移密切相关[4]. miR-214属于miRNAs的一员, Shih等[5]研究发现在肝癌中下调的miR-214与肝癌的转移、复发和不良预后有关, 并参与调控细胞凋亡, 影响细胞周期, 并能抑制肿瘤血管生成, 并有研究[6]发现miR-214能抑制肿瘤细胞的迁徙及侵袭能力.
miR-214与Sema4D是否存在相关性, 在结肠癌中miR-214对Sema4D所起的调控作用如何? 本研究采用脂质体包裹的方法将miR-214模拟物及空白对照物转染至人结肠上皮性癌细胞株LoVo, 通过上调和下调胞内miR-214表达水平的方法, 探讨miR-214与Sema4D作用关系, 为该病的发病机制和治疗开辟新思路.
人结直肠腺癌细胞株LoVo购自长沙赢润生物技术有限公司; RPMI 1640培养基购自美国Hyclone公司; OPti-MEM培养基购自美国Gibco公司; 转染脂质体Lipofectamine 2000购自美国Invitrogen公司; miR-214 mimics、mi-control、inhibitor、in-control序列委托广州复能公司合成. TRIzol购自美国MRC公司; BCA蛋白浓度测定试剂盒购自上海碧云天(beyotime)生物技术有限公司; Sema4D兔抗人抗体购英国Abcam公司.
1.2.1 细胞培养: 用含10%胎牛血清、100 U/mL青霉素、100 mg/mL链霉素的RPMI 1640细胞培养液, 置于37 ℃, 50 mL/L CO2的恒温细胞培养箱. 待细胞密度达80%-90%时, 用胰酶消化细胞, 传代培养.
1.2.2 细胞转染: 转染前1 d, 接种适当数量的细胞至6孔培养板中, 每孔中加入不含抗生素的培养基, 使转染时的细胞密度能够达到30%-50%. 按Lipofectamine 2000说明书转染细胞. 用250 µL不含血清培养基Opti-MEM稀释100 pmol miRNA mimics、mi-control、inhibitor、in-control(加入细胞中的终浓度50 nmol/L, 轻轻混匀, 室温孵育5 min; 用250 µL不含血清培养基Opti-MEM稀释5 µL Lipofectamine 2000, 轻轻混匀并室温孵育5 min; 将以上2者混匀室温孵育20 min. 将混合液加入含有细胞以及培养液的培养孔中, 轻轻混匀; 将培养板置于37 ℃的CO2培养箱中培养24 h做相关检测.
1.2.3 实时荧光定量(RT-PCR)法检测miR-214及Sema4D mRNA的表达: 转染24 h后, 采用TRIzol试剂盒提取细胞总RNA的A值测定, 电泳检测, 逆转录反应, 定量PCR检测LoVo mimics组、mi-control组, inhibitor组、in-control组中miR-214及Sema4D mRNA表达. 并以公式2-△△Ct计算出最后数值.
1.2.4 Western blot检测各组细胞内Sema4D蛋白的表达: 细胞总蛋白的提取与变性, 用BCA蛋白定量试剂盒测定样品中蛋白含量, 电泳、转膜、孵育抗体及显影一抗孵育60 min后, 用TBST洗至无脱脂奶粉. 随后, 室温孵育二抗60 min. 二抗均使用通用二抗, 二抗浓度使用1:5000, 二抗孵育完后, TBST洗3次, 每次5 min. 随后, 即可进行显影. 将化学发光底物A液和B液各500 µL混合好, 置于避光的盒子中. 3 min后, 将要显影的PVDF膜用纸吸干多余的TBST后置于裁剪好的保鲜膜上, 滴加混合好的化学发光底物, 2 min后, 用保鲜膜将PVDF膜包好置于暗盒中用透明胶固定好, 关灯, 根据肉眼看到的荧光效果确定压片时间, 时间到后, 将片子置于显影液中, 待显出条带后, 置于蒸馏水中洗片, 洗好后再置于定影液中定影, 最后再置于蒸馏水中洗片, 晾干, 做好相应的标记. 检测各组细胞中Sema4D蛋白质的表达.
统计学处理 统计学处理采用SPSS19.0软件进行处理, 实验数据以mean±SD表示, 多组问比较采用单因素方差分析, P<0.05为差异有统计学意义.
LoVo转染miR-214 mimics及其对照mi-control 24 h后, miR-214的相对表达量为: 8.003±0.651, 3.464±0.332, P = 0.003. 转染miR-214 inhibitor及in-control 24 h后miR-214的相对表达量为: 0.740±0.088, 2.620±0.166, P = 0.0006. 与对照组相比, 成功上调LoVo mimics组内miR-214的表达, 下调LoVo inhibitor组miR-214的表达(图1).
转染24 h后, LoVo mimics组及mi-control组Sema4D mRNA相对表达量分别为0.420±0.027和0.851±0.062, mimics组较mi-control组表达明显下降, P = 0.003. LoVo inhibitor组及in-control组Sema4D mRNA相对表达量分别为1.243±0.087和0.660±0.042, inhibitor组较in-control组表达明显升高(P = 0.003)(图2).
Western blot结果显示, LoVo转染miR-214 mimics、mi-control, inhibitor、in-control 24 h后, Sema4D/β-actin的表达分别为0.163±0.037, 0.550±0.038, 1.137±0.112, 0.457±0.046. Sema4D蛋白mimics组较mi-control组明显下降(P = 0.0019), inhibitor组较in-control组明显升高(P = 0.005)(图3).
1993年Lee等[7]及其研究小组成员第1次发现miRNAs, 目前其家族成员近3000种. 其能够识别特定的目标基因, 通过与目标mRNA互补配对导致mRNA降解或抑制转录后翻译诱导基因沉默, 从而调控靶基因的表达[8]. 在这数千种己知的miRNAs中发现miR-214是一个有多种功能的miRNA, 在许多生理病理过程中发挥重要作用[9]. miR-214调控的靶基因及相关信号途径众多, Misiewicz-Krzeminska等[10]研究发现骨髓瘤细胞内, miR-214通过靶定调节P53, 抑制DNA复制而发挥抑制骨髓瘤细胞生长的作用. Chen等[11]的研究发现, 较结肠正常组织相比, 结肠癌组织内miR-214表达明显下调. 增加的结肠癌细胞LoVo内miR-214的表达能够明显抑制癌细胞的增殖, 并且能负向调控靶基因FGFR1的表达. Qiang等[12]的研究显示miR-214通过靶定Plexin-B1抑制肿瘤细胞的运动和增殖能力. 研究[13]表明Plexin-B1是Sema4D的主要受体, Sema4D通过结合Plexin-B1在很多方而参与了肿瘤的发生、发展, 包括促进肿瘤血管生成, 调控肿瘤相关巨噬细胞进而促进肿瘤侵袭等. 由于, 一个miRNA通常可以调控下游多个靶基因的表达[14], 我们考虑除了上述研究表明的靶基因以外, 是否还存在着其他靶基因被miR-214调控.
Sema4D是一种跨膜同源二聚体糖蛋白, 由Stone等[15]在1992年于免疫系统首先发现. 在多种疾病的组织和细胞中Sema4D基因常出现表达异常. Binmadi等[16]的研究发现在肿瘤血管新生方面, Sema4D可以借助神经丛素Plexin-B1, 激活Rho蛋白/Rho激酶信号传导途径, 诱导血管内皮细胞迁移, 促进细胞管样结构形成, 进而促进血管的再生, 被认为是重要的促血管新生因子. 有研究[17]发现肿瘤微环境中的肿瘤相关性巨噬细胞是分泌Sema4D的主要来源, Sema4D的表达对肿瘤的血管发生和脉管的成熟起关键作用, 并增加肿瘤细胞的成瘤性; 但缺乏Sema4D的环境中, 肿瘤的成瘤性及转移能力被严重的削弱. 牟林军等[18]发现结肠癌组织中Sema4D阳性表达率显著高于正常组织, M型巨噬细胞显著促进LoVo细胞分泌Sema4D, 进而诱导人脐静脉血管内皮细肚成管, 发挥血管的发生功能.
本研究选择了已被Donnard等[19]证明Sema4D表达的结肠癌上皮性腺癌LoVo细胞株, 首先我们同样检测到了在LoVo细胞株中Sema4D的表达阳性, 并成功上调及下调了LoVo细胞中miR-214表达水平, 检测到在高表达miR-214的细胞中, Sema4D mRNA的表达较对照组明显降低, 而低表达miR-214的细胞中, Sema4D mRNA的表达较其对照组明显升高. 验证了在结肠癌细胞系LoVo中, Sema4D受miR-214调控, miR-214能够负向调控Sema4D mRNA的表达. 为了验证Sema4D mRNA表达变化后其蛋白表达水平是否受影响, 我们同时检测了miR-214表达改变后的各细胞株的Sema4D的蛋白水平, 发现蛋白表达水平的变化结果同mRNA改变一致.
总之, 本研究发现在结肠癌细胞株LoVo中, miR-214能调控Sema4D mRNA的表达, 进而影响其蛋白的表达. 表明Sema4D是受miR-214负向调控的靶基因之一. 临床上可能能够通过对miR-214的调控, 间接抑制Sema4D的表达, 从而抑制Sema4D对肿瘤发生发展的促进作用, 对恶性肿瘤的治疗提供新的思路.
轴突导向因子4D(semaphorin 4D, Sema4D)最初的研究是集中在神经系统功能方面, 但近年的研究发现Sema4D在肿瘤的发生、肿瘤细胞的运动、转移、肿瘤血管生成中也发挥着重要的作用. Sema4D在多种恶性肿瘤包括结肠癌中已被证明高表达, 并且能通过结合其受体Plexin-B1而发挥促进血管生成的作用, 致肿瘤的发生、发展. miR-214是microRNAs中重要的一员, 在许多生理病理过程中发挥重要作用, miR-214调控的靶基因及相关信号途径众多, 通过对不同靶基因发挥不同的调控作用, 发挥癌基因或抑癌基因的作用.
王良静, 研究员, 副主任医师, 浙江大学医学院附属第二医院消化内科
在恶性肿瘤中, miRNAs是通过调控不同的基因而发挥作用的, 寻找并完善miRNAs的调控的基因, 对阐明miRNAs的作用机制有重要意义. 在LoVo中, 明确miR-214对Sema4D的调控作用, 为结肠癌的临床治疗提供有价值的理论依据.
Qiang等研究报道, 在宫颈癌细胞株Hela中, miR-214能够靶定Plexin-B1的表达而抑制肿瘤细胞的运动及增殖能力. Tamagnone研究表明Plexin-B1是Sema4D的主要受体, Sema4D通过结合Plexin-B1在很多方而参与了肿瘤的发生、发展, 包括促进肿瘤血管生成, 调控肿瘤相关巨噬细胞进而促进肿瘤侵袭等.
近年来, 关于肿瘤机制的研究热点多集中在表观遗传学方面, miRNA是表观遗传学中一种新颖的基因表达调控机制, miR-214是其家族重要成员之一. 同时Sema4D已被多个研究证明在癌症发生发展过程中有重要作用, 而其被调控的机制鲜有说明. 探讨miR-214对Sema4D的调控作用, 结合了当下肿瘤调控机制的热点, 并能够开启探讨Sema4D被调控机制的新篇章.
Sema4D作为已被证明促进肿瘤发生发展的重要因子, 在本研究中验证了其表达受miR-214的负向调控. 这为探讨Sema4D在肿瘤中表达升高的机制提供路. miR-214对Sema4D的负向调控作用也可能使其成为将来治疗结肠癌的新靶点.
轴突导向因子4D(Sema4D): 是一个150 kDa的跨膜糖蛋白, 由862个氨基酸构成, 1992年于免疫系统首先发现, 最初发现他可以诱导轴突长锥的定向生杖, 对神经发育影响重大, 近年来研究发现, 其在肿瘤的发生、发展中起重要作用. Sema4D通过结合其主要受体Plexin-B1促进肿瘤侵袭性生长, 促进肿瘤血管生成.
本文探讨了结肠癌细胞株LoVo中miR-214对Sema4D表达的负向调控作用. 通过转染miR-214类似物或抑制剂从正反两方面验证了Sema4D的mRNA和蛋白质水平随miR-214表达的变化而变化, 具有一定的价值.
编辑: 郭鹏 电编: 都珍珍
| 1. | Zheng ZX, Zheng RS, Zhang SW, Chen WQ. Colorectal cancer incidence and mortality in China, 2010. Asian Pac J Cancer Prev. 2014;15:8455-8460. [PubMed] [DOI] |
| 2. | Zhou H, Yang YH, Binmadi NO, Proia P, Basile JR. The hypoxia-inducible factor-responsive proteins semaphorin 4D and vascular endothelial growth factor promote tumor growth and angiogenesis in oral squamous cell carcinoma. Exp Cell Res. 2012;318:1685-1698. [PubMed] [DOI] |
| 3. | Mu L, Wang J, Guo X, Zheng S, Shan K, Jing C, Li L. [Correlation and clinical significance of expressions of HIF-1α and Sema4D in colorectal carcinoma tissues]. Zhonghua WeiChang WaiKe ZaZhi. 2014;17:388-392. [PubMed] |
| 4. | Xuan Y, Yang H, Zhao L, Lau WB, Lau B, Ren N, Hu Y, Yi T, Zhao X, Zhou S. MicroRNAs in colorectal cancer: Small molecules with big functions. Cancer Lett. 2014; Dec 15. [Epub ahead of print]. [PubMed] [DOI] |
| 5. | Shih TC, Tien YJ, Wen CJ, Yeh TS, Yu MC, Huang CH, Lee YS, Yen TC, Hsieh SY. MicroRNA-214 downregulation contributes to tumor angiogenesis by inducing secretion of the hepatoma-derived growth factor in human hepatoma. J Hepatol. 2012;57:584-591. [PubMed] [DOI] |
| 6. | Sa N, Yu L, Mu Y, Sun G, Xu W. [Expression and effect of microRNA-214 in advanced hypopharyngeal carcinoma]. Zhonghua Er Bi Yan Hou Tou Jing Waike Zazhi. 2014;49:990-994. [PubMed] |
| 7. | Lee RC, Feinbaum RL, Ambros V. The C. elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14. Cell. 1993;75:843-854. [PubMed] [DOI] |
| 8. | Miles GD, Seiler M, Rodriguez L, Rajagopal G, Bhanot G. Identifying microRNA/mRNA dysregulations in ovarian cancer. BMC Res Notes. 2012;5:164. [PubMed] [DOI] |
| 9. | Sharma T, Hamilton R, Mandal CC. miR-214: a potential biomarker and therapeutic for different cancers. Future Oncol. 2015;11:349-363. [PubMed] [DOI] |
| 10. | Misiewicz-Krzeminska I, Sarasquete ME, Quwaider D, Krzeminski P, Ticona FV, Paíno T, Delgado M, Aires A, Ocio EM, García-Sanz R. Restoration of microRNA-214 expression reduces growth of myeloma cells through positive regulation of P53 and inhibition of DNA replication. Haematologica. 2013;98:640-648. [PubMed] [DOI] |
| 11. | Chen DL, Wang ZQ, Zeng ZL, Wu WJ, Zhang DS, Luo HY, Wang F, Qiu MZ, Wang DS, Ren C. Identification of microRNA-214 as a negative regulator of colorectal cancer liver metastasis by way of regulation of fibroblast growth factor receptor 1 expression. Hepatology. 2014;60:598-609. [PubMed] [DOI] |
| 12. | Qiang R, Wang F, Shi LY, Liu M, Chen S, Wan HY, Li YX, Li X, Gao SY, Sun BC. Plexin-B1 is a target of miR-214 in cervical cancer and promotes the growth and invasion of HeLa cells. Int J Biochem Cell Biol. 2011;43:632-641. [PubMed] [DOI] |
| 13. | Tamagnone L. Emerging role of semaphorins as major regulatory signals and potential therapeutic targets in cancer. Cancer Cell. 2012;22:145-152. [PubMed] [DOI] |
| 14. | Xue J, Niu J, Wu J, Wu ZH. MicroRNAs in cancer therapeutic response: Friend and foe. World J Clin Oncol. 2014;5:730-743. [PubMed] [DOI] |
| 15. | Stone RG, Pedersen BM, Harvey CC, Canu P, Cornilleau-Wehrlin N, Desch MD, de Villedary C, Fainberg J, Farrell WM, Goetz K. Ulysses radio and plasma wave observations in the jupiter environment. Science. 1992;257:1524-1531. [PubMed] [DOI] |
| 16. | Binmadi NO, Yang YH, Zhou H, Proia P, Lin YL, De Paula AM, Guimarães AL, Poswar FO, Sundararajan D, Basile JR. Plexin-B1 and semaphorin 4D cooperate to promote perineural invasion in a RhoA/ROK-dependent manner. Am J Pathol. 2012;180:1232-1242. [PubMed] [DOI] |
| 17. | Mu L, Wang J, Chen Y, Li L, Guo X, Zheng S, Jing C. Hypoxia-inducible factor-1α and semaphorin4D genes involved with tumor-associated macrophage-induced metastatic behavior and clinical significance in colon cancer. Chin Med J (Engl). 2014;127:3568-3575. [PubMed] |
| 18. | 牟 林军, 王 金申, 郭 晓波, 靖 昌庆, 李 乐平. Sema4D蛋白高表达与结直肠癌血管形成和临床进展的相关性. 中国现代普通外科进展. 2013;16:942-946. |
| 19. | Donnard E, Asprino PF, Correa BR, Bettoni F, Koyama FC, Navarro FC, Perez RO, Mariadason J, Sieber OM, Strausberg RL. Mutational analysis of genes coding for cell surface proteins in colorectal cancer cell lines reveal novel altered pathways, druggable mutations and mutated epitopes for targeted therapy. Oncotarget. 2014;5:9199-9213. [PubMed] |