修回日期: 2015-01-07
接受日期: 2015-01-12
在线出版日期: 2015-02-28
目的: 探讨维生素D3(vitamin D3, VitD3)对四氯化碳(CCl4)诱小鼠实验性肝损伤肝组织超微结构的影响.
方法: 将25只SPF级♂Balb/c小鼠随机分为正常组、模型组、VitD3低、中、高剂量干预组. 干预组使用VitD3预处理2 wk, VitD3高、中、低剂量组分别每日给予VitD3 15.0、7.5、l.0 μg/kg腹腔注射, 正常组与模型组腹腔注射等量生理盐水, VitD3预处理1 wk后, 模型组与各干预组每只小鼠隔日腹腔注射0.1%CCl4橄榄油溶液0.2 mL造模, 正常对照组与模型组同步隔日腹腔注射生理盐水, CCl4给药1 wk后, 全部小鼠眼眶采血和留取肝脏组织标本, 光镜下观察肝组织HE染色的病理变化; 常规方法测定血清谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate transaminase, AST); 透射电镜观察肝脏超微结构的变化.
结果: VitD3高剂量组和中剂量组的肝脏指数和血清ALT、AST的水平则显著低于模型组(高剂量组: P = 0.0000, P = 0.0000, P = 0.0002; 中剂量组: P = 0.0019, P = 0.0005, P = 0.0012), 模型组小鼠的肝脏指数和血清ALT、AST的水平较正常组显著性升高(P = 0.0000, P = 0.0000, P = 0.0000). 各VitD3干预组小鼠肝脏HE染色及超微结构的改善情况均明显优于模型组.
结论: VitD3对CCl4诱导急性肝损伤小鼠肝脏的超微结构具有一定的保护作用.
核心提示: 维生素D在肝病的发生、发展中发挥了一定抗炎、抗纤维化的保护作用, 深入研究其对肝脏超微结构的影响, 有助于为临床研究和治疗提供新的思路.
引文著录: 王家健, 谷俊莹, 蒋红梅, 胡朝晖. 维生素D3对实验性肝损伤小鼠肝脏超微结构改变的影响. 世界华人消化杂志 2015; 23(6): 885-893
Revised: January 7, 2015
Accepted: January 12, 2015
Published online: February 28, 2015
AIM: To investigate the effect of vitamin D3 (VitD3) on the ultramicrostructural changes of hepatic tissue in Balb/c mice with CCl4 induced acute liver injury.
METHODS: Twenty-five Balb/c mice were randomly and equally divided into five groups: a control group, a vehicle group, and high-, medium- and low-dose VitD3 groups. Mice in the three VitD3 groups were intraperitoneally injected daily with VitD3 15.0, 7.5, and 1.0 μg/kg, respectively. Mice in the control group and vehicle group were daily intraperitoneally injected with 0.9% NaCl. After 2 wk of treatment, the vehicle group and treatment groups were intraperitoneally injected with 0.1% CCl4 in olive (0.2 mL/2 d) for 7 d. Meanwhile, the control group was given equal volume of 0.9% NaCl. At the end of administration of CCl4 solution, eye blood and liver tissue samples were taken from all the mice. Alanine aminotransferase (ALT) and aspartate transaminase (AST) were detected routinely, and pathological changes in liver tissues were detected by HE staining. The ultramicrostructural changes of hepatic tissue were observed with an electron microscope.
RESULTS: The levels of liver index, ALT, and AST were significantly lower in the high- and medium-dose VitD3 groups than in the vehicle group (high-dose group: P = 0.0000, 0.0000, 0.0002; medium-dose group: P = 0.0019, 0.0005, 0.0012). Compared with the control group, the levels of liver index, ALT, and AST were significantly higher in the vehicle group (P = 0.0000 for all). The improvement of histological changes in the treatment groups was significantly superior to that in the control group.
CONCLUSION: VitD3 has a significant protective effect on hepatic ultramicrostructural damage in mice with experimental hepatic injury.
- Citation: Wang JJ, Gu JY, Jiang HM, Hu CH. Influence of vitamin D3 on ultramicrostructural changes of hepatic tissue in rats with experimental hepatic injury. Shijie Huaren Xiaohua Zazhi 2015; 23(6): 885-893
- URL: https://www.wjgnet.com/1009-3079/full/v23/i6/885.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i6.885
我国是世界上肝脏疾病高发的国家之一, 病毒性肝炎、肝纤维化、脂肪肝、酒精肝、药物性肝损伤、肝硬化及肝癌等肝病的发病率日益升高, 给国家和人民带来了严重的经济负担, 也是当今社会威胁人类健康的公共卫生难题. 近年来, 维生素D在肝脏疾病的作用已经有着很多的关注, 维生素D与各种病因导致肝病的发生发展有一定的关系[1-8]. 维生素D3(vitamin D3, VitD3)是一种具有生物活性脂溶性类固醇衍生物, 最广为认知的是其在钙、磷代谢的调节作用. 研究[9-15]显示, VitD3还具有更为广泛的生物学效应, 除了参与细胞增殖、分化及凋亡, 还具有免疫调节、抗炎、抗氧化、抗纤维化、抗肿瘤等多种生物学功能. 众多研究[16-21]表明维生素缺乏在各种肝脏疾病中普遍存在, 且与肝病的严重程度密切相关. 研究[22,23]显示, 乙型肝炎患者普遍存在维生素D缺乏, 25-羟基维生素D3(25-OH-D3)的水平与乙型肝炎病毒载量呈一定关系, 高乙型肝炎病毒载量的25-OH-D3水平低下. Petta等[24]研究发现, 体内的25-OH-D3水平可能会影响进行标准抗病毒治疗患者的炎症反应以及纤维化的过程, 低维生素D水平导致严重纤维化以及低水平的持续病毒学应答率[24-26]. 各种肝病皆能引起不同程度组织学和功能上的肝损伤, 可以继发肝纤维化、肝癌等更为严重的肝脏疾病, 而维生素D在肝病的发生、发展中发挥了一定作用. 因此, 深入探讨维生素D对肝损伤的病理形态及超微结构的影响, 有助于为肝损伤的临床研究提供新的思路. 本实验利用四氯化碳(CCl4)建立小鼠急性肝损伤模型, 同时给予VitD3预处理, 观察VitD3对实验性肝损伤肝组织超微结构病理特点的影响, 探讨其对肝脏超微结构的保护作用.
CCl4(广东光华科技股份有限公司, 批号: 20131230), VitD3注射液(上海通用药业股份有限公司, 批号: 12118). DL-45RC-L低速冷冻大容量离心机. 光学显微镜(奥林巴斯). BSA223S分析天平, 赛多利斯科学仪器(北京)有限公司. JEM1400-透射电镜, 日本电子. Balb/c小鼠由广东省医学实验动物中心提供, 合格证号: 44007200010966.
1.2.1 小鼠实验性肝损伤模型的建立: 本次实验使用橄榄油为溶剂, 取0.1%CCl4溶解于橄榄油中, 混匀备用. VitD3各干预组与模型组隔日腹腔注射0.1%CCl4橄榄油溶液(0.1 mL/10 g, ip), 分别于VitD3预处理1 wk后给药. 正常对照组则仅腹腔注射等量的无菌生理盐水.
1.2.2 动物分组及给药: Balb/c小鼠, 购自广东省医学动物中心后, 饲养于广州医科大学实验动物中心. 饲养温度20 ℃-26 ℃, 湿度40%-70%, 12 h光照和黑夜循环, 普通饲料喂养, 自由饮水, 经免疫观察1 wk, 适应新环境后, 随机分为5组, 动物实验给药方法如表1, 表2所示, 引用参考文献[27]加以改进. (1)第1组为正常对照组: 腹腔注射等量生理盐水(0.2 mL, ip); (2)第2组为模型组: 前7 d给予等量生理盐水(0.2 mL, ip), 后7 d给予0.1%CCl4橄榄油溶液和生理盐水(0.2 mL, ip); (3)第3组为VitD3低剂量组: 前7 d给予等量VitD3 1 μg/kg(0.2 mL, ip), 后7 d给予0.1%CCl4橄榄油溶液(隔日)+VitD3 1 μg/kg(0.2 mL, ip); (4)第4组为VitD3中剂量组: 前7 d给予VitD3 7.5 μg/kg, 后7 d给予0.1%CCl4橄榄油溶液+VitD3 7.5 μg/kg; (5)第5组为VitD3高剂量组, 前7 d给予VitD3 15 μg/kg, 后7 d给予CCl4橄榄油溶液+VitD3 15 μg/kg. 所有组小鼠后7 d给药后禁食不禁水15 h后, 称质量, 在10%水合氯醛麻醉下(0.1 mL/10 g)采集全部血液, 以3000 r/min离心5 min, 分离血清置于冰箱保存; 取出肝脏, 观察肝脏形态并称质量, 取一小部分肝组织浸在40 g/L甲醛中固定, 进行HE染色, 同时, 另取一小部分肝脏于4%戊二醛固定, 4 ℃冰箱保存, 待制备超微病理标本.
| 分组 | VitD3(μg/kg) | 生理盐水(mL/小鼠) |
| 正常组 | - | 0.2 |
| 模型组 | - | 0.2 |
| VitD3低剂量组 | 1.0 | - |
| VitD3中剂量组 | 7.5 | - |
| VitD3高剂量组 | 15.0 | - |
| 分组 | 0.1%CCl4橄榄油溶液 (隔日) (mL/小鼠) | VitD3(每日) (μg/kg) | 生理盐水 (mL/小鼠) |
| 正常组 | - | - | 0.2 |
| 模型组 | 0.2 | - | 0.2 |
| VitD3低剂量组 | 0.2 | 1.0 | - |
| VitD3中剂量组 | 0.2 | 7.5 | - |
| VitD3高剂量组 | 0.2 | 15.0 | - |
1.2.3 肝功能检测: 谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate transaminase, AST)用罗氏ModularP+ISE900系统检测.
1.2.4 肝组织的一般形态观察及脏器系数分析: 肉眼观察肝脏的一般形态改变, 同时计算各组肝脏指数: 肝脏指数(%) = 肝脏湿质量/小鼠体质量×100.
1.2.5 肝组织HE染色观察: 将切好的片子烘干, 然后分别进行脱蜡、染色(苏木素-伊红)、脱水、透明、封片, 在光学显微镜观察肝组织形态变化.
1.2.6 肝组织超微病理切片制作: 取米粒样大小(约1 mm3)的肝组织, 2.5%中性戊二醛2 h固定, 磷酸缓冲液漂洗, 再经过1%锇酸固定, 磷酸盐缓冲液漂洗, 梯度乙醇、丙酮系列脱水, 树脂渗透, 纯树脂包埋, 固化, 半膜切片定位, 超薄切片, 醋酸双氧铀-柠檬酸铅双重染色, 透射电镜下观察超微结构改变.
统计学处理 使用SPSS19.0统计软件进行数据统计分析, 计量资料以mean±SD表示, 各组间比较用单因素方差分析(ANOVA), 以P<0.05为差异具有统计学意义.
如表3所示, 模型组Balb/c小鼠的肝脏系数和血清ALT、AST均比正常组显著升高(P<0.01). VitD3高剂量组和中剂量组小鼠的肝脏系数血清ALT、AST均比模型组显著降低(ALT: P<0.01, AST: P<0.01). VitD3高剂量组Balb/c小鼠血清ALT、AST比低剂量组显著降低(P<0.01).
正常组小鼠肝脏红褐色, 边缘锐利, 表面光滑, 质软有弹性, 颜色正常. 模型组小鼠明显肝脏肿大易碎, 边缘圆钝, 色呈苍黄、呈结节状, 切面有油腻感. 经VitD3预处理的各剂量组虽也呈现不同程度的肿大, 但有所改善, 表面也稍微光滑, 质地呈不同程度较韧, 颜色偏黄.
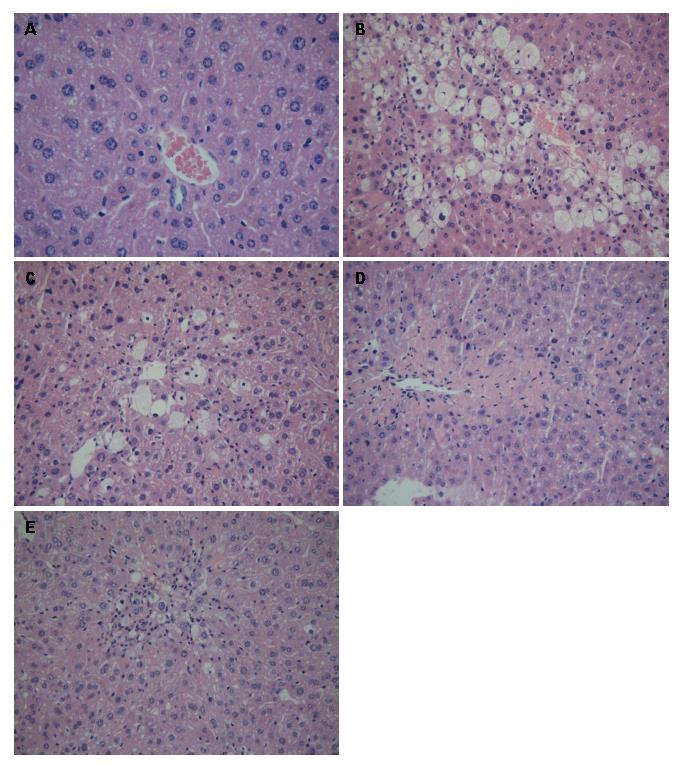
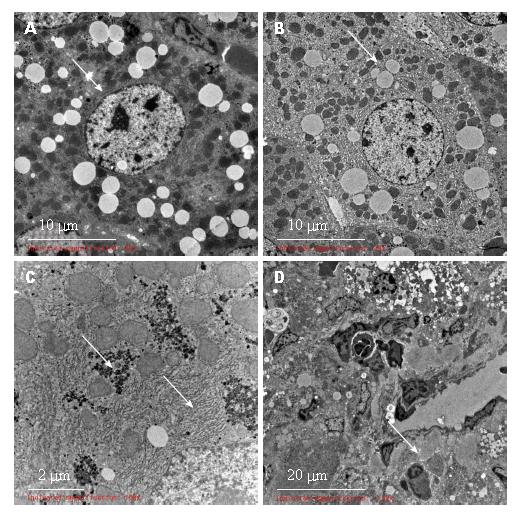
肝组织经HE染色后如图1所示: 正常组, 肝索排列整齐, 肝组织形态结构均正常, 肝小叶及汇管区基本正常, 无炎症细胞浸润. 模型组, 肝小叶及汇管区见大量中性粒细胞及淋巴细胞浸润, 肝细胞出现严重的脂肪变性, 部分肝细胞肿大, 胞质内可见大小不均的脂滴空泡, 呈现渔网状, 片状坏死区域; 低剂量组, 肝小叶及汇管区可见中性粒细胞, 可见脂滴空泡及淋巴细胞浸润, 点状坏死. 中剂量组, 可见少量脂滴空泡, 汇管区见少量炎细胞浸润, 可见点状坏死区域. 高剂量组, HE染色肝小叶基本正常, 脂滴空泡明显减少, 淋巴基本浸润, 纤维组织未见增生, 未见坏死区域.
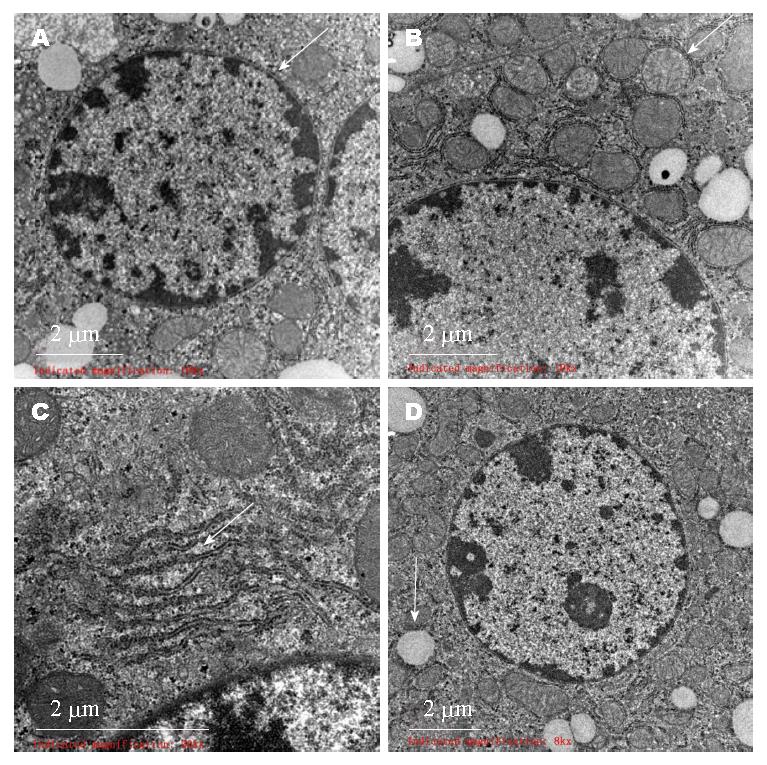
2.3.1 正常组: 肝细胞形态正常, 核圆形, 居中, 常染色质为主, 核仁易见. 线粒体丰富, 圆形或椭圆形, 结构清晰. 粗面内质网丰富, 无明显扩张. 糖原颗粒及少量小脂滴散在. 胞质中未见其他异常形态结构(图2).
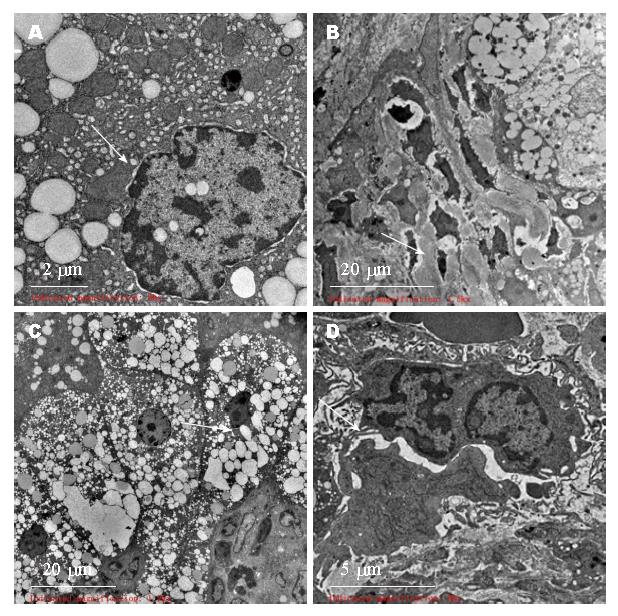
2.3.2 模型组: 肝细胞核形态不一, 部分细胞核染色质凝集成小块, 核周间隙增宽. 肝细胞胞质内小脂滴明显增多. 线粒体肿胀, 数量减少, 线粒体嵴变短或模糊. 粗面内质网数量减少, 滑面内质网增生、扩张. 区域性肝细胞间及Disse间隙束状胶原纤维沉积. 局灶淋巴细胞浸润(图3).
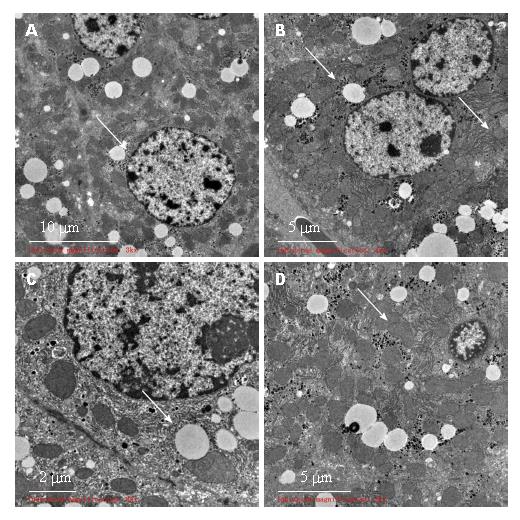
2.3.3 VitD3低剂量组: 肝细胞核形态多不规则. 胞质内小脂滴明显增多. 线粒体肿胀, 数量减少, 线粒体嵴变短或模糊. 滑面内质网增生、扩张. 可见毛细胆管增多、扩张. 肝细胞间及Disse间隙可见少量胶原纤维沉积(图4).
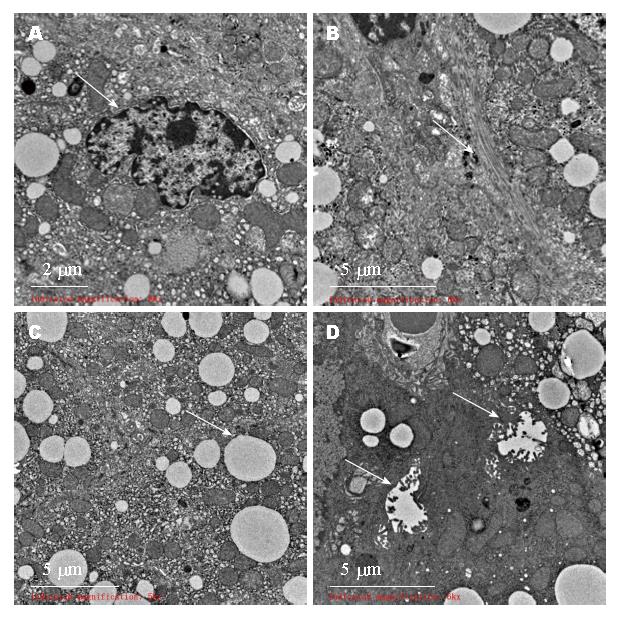
2.3.4 VitD3中剂量组: 肝细胞核多呈圆形或卵圆形, 居中, 常染色质为主. 胞质内小脂滴减少, 粗面内质网丰富呈片层状分布, 部分粗面内质网轻度扩张. 线粒体轻度肿胀, 峭模糊. 可见毛细胆管扩张. 部分肝细胞内糖原聚集分布. 区域性肝细胞间及Disse间隙见少量束状胶原纤维沉积(图5).
2.3.5 VitD3高剂量组: 肝细胞核多呈圆形或卵圆形, 居中, 常染色质为主. 胞质内小脂滴明显减少, 粗面内质网丰富呈片层状分布, 线粒体轻度肿胀. 部分肝细胞内糖原聚集分布(图6).
CCl4是一种可引起急慢性损伤的化学剧毒物, 广泛应用于保肝药物研究. 本研究通过CCl4诱导小鼠急性肝损伤, 制备实验性肝损伤动物模型. CCl4可造成肝中毒, 致使肝细胞变性、坏死及纤维组织增生, 甚至发生肝硬化. 由于肝小叶结构紊乱, 静脉回流受阻, 肝静脉与门静脉高压, 促进肝内动静脉吻合支形成, 造成肝细胞供血减少, 血清蛋白降低, 血清转氨酶活性升高[28]. 大量研究表明, CCl4主要用于肝损伤, 因为其主要代谢高活性三氯甲基自由基, 其产生的自由基代谢紊乱可引起脂质过氧化物的积累, 进而直接作用于肝细胞膜、细胞器膜或大生物分子, 导致膜脂质氧化、膜蛋白变性, 使肝细胞直接死亡.
维生素D是一种人体必需的维生素, 人体循环中的维生素D可通过食物来源以及阳光中紫外线的照射. 经肾脏激活后, 维生素D与维生素D受体在单核细胞和T细胞中结合. 激活后的维生素D受体进入细胞核, 参与抗炎细胞因子的转录调控, 抑制促炎细胞因子, 参与免疫调节、抗炎、抗纤维化、抗肿瘤等免疫调控[10-15].
近期研究[29-31]表明, 维生素D的缺乏与慢性肝病患者相关, 且与疾病的严重程度紧密关联. 在本研究中, 模型组Balb/c小鼠的肝脏系数和血清ALT、AST均比正常组显著升高(P<0.01), 肝组织HE染色出现严重的脂肪变性, 部分肝细胞肿大, 胞质内可见大小不均一的脂滴空泡, 肝组织电镜结果显示肝细胞浆可见大量小脂滴; 线粒体肿胀, 电子密度增高, 数量减少, 线粒体嵴变短或模糊消失; 粗面内质网数量也明显减少, 滑面内质网增多、扩张明显等病理特点, 由此表明本次使用CCl4造模成功. 维生素D预处理的高剂量组和中剂量组小鼠的肝脏系数血清ALT、AST均显著性均比模型组显著降低(P<0.01), 肝损伤情况有不同程度地改善, 呈现一定剂量依赖性. 维生素D高剂量组肝细胞形态趋向正常, 小脂滴减少, 线粒体肿胀程度减轻, 胶原沉积减少, 内质网、糖原等细胞器损伤有所减轻. 结果显示, 维生素D对实验性肝损伤, 具有一定的保护作用, 由此提示, 维持体内充足的维生素D水平, 可能与上调肝脏抗炎、抗损伤、抗纤维化等方面的免疫功能调控有关.
感谢广州金域医学检验中心王春霞博士、徐炜老师、候晓涛老师在论文选题、实验操作的指导.
近年来更多的研究显示, 维生素D3(vitamin D3, VitD3)除了具有钙磷调节功能, 还具有更为广泛的生物学效应, 除了参与细胞增殖、分化及凋亡, 还具有免疫调节、抗炎、抗氧化、抗纤维化、抗肿瘤等多种生物学功能, 因此深入探究VitD3对实验性肝损伤肝脏超微结构的影响, 为临床治疗提供新的理论依据.
王蒙, 副教授, 中国人民解放军第二军医大学附属东方肝胆外科医院肝外综合治疗一科
越来越多的研究表明, VitD3在各种肝病的发病机制、抗炎、抗病毒疗、抗肝纤维化进展等方面均具有重要作用, 但是VitD3对实验性肝损伤超微结构的改变尚未见报道.
维生素D在慢性肝病中的作用受到越来越多的关注, 维生素缺乏在各种肝病中普遍存在, 且与肝病的严重程度密切相关.
本实验通过生化肝功能检测、常规病理形态学及超微病理结构的观察, 发现VitD3可以改善肝功能, 可以减缓实验性肝损伤, 并对肝脏的超微结构损伤具有一定的保护作用.
本文较直观地阐述了VitD3对实验性肝损伤超微结构的一定保护作用, 可能对防治肝病提供了新的思路.
Disse间隙(Disse's space): Disse间隙(Disse's space): 肝细胞与血窦内皮细胞之间的狭窄间隙, 宽约0.4 μm, 窦腔内充满来自血窦的血浆, 肝细胞血窦面上的微绒毛浸于其中, 是肝细胞与血液之间进行物质交换的场所. 电镜下, 有的相邻肝细胞间有细胞间通道与窦周间隙相连, 表面也有许多微绒毛, 从而使肝细胞与血液之间有更大的交换面积.
本文研究设计合理, 统计方法得当, 深入研究了肝脏病理形态学的变化, 具有一定阅读价值.
编辑: 韦元涛 电编: 闫晋利
| 1. | Reddy KK. Vitamin D level and basal cell carcinoma, squamous cell carcinoma, and melanoma risk. J Invest Dermatol. 2013;133:589-592. [PubMed] [DOI] |
| 2. | Stokes CS, Volmer DA, Grünhage F, Lammert F. Vitamin D in chronic liver disease. Liver Int. 2013;33:338-352. [PubMed] [DOI] |
| 3. | Petta S, Ferraro D, Cammà C, Cabibi D, Di Cristina A, Di Marco V, Di Stefano R, Grimaudo S, Mazzola A, Levrero M. Vitamin D levels and IL28B polymorphisms are related to rapid virological response to standard of care in genotype 1 chronic hepatitis C. Antivir Ther. 2012;17:823-831. [PubMed] [DOI] |
| 4. | Malham M, Peter Jørgensen S, Lauridsen AL, Ott P, Glerup H, Dahlerup JF. The effect of a single oral megadose of vitamin D provided as either ergocalciferol (D2) or cholecalciferol (D2) in alcoholic liver cirrhosis. Eur J Gastroenterol Hepatol. 2012;24:172-178. [PubMed] [DOI] |
| 5. | Lim LY, Chalasani N. Vitamin d deficiency in patients with chronic liver disease and cirrhosis. Curr Gastroenterol Rep. 2012;14:67-73. [PubMed] [DOI] |
| 6. | Ladero JM, Torrejón MJ, Sánchez-Pobre P, Suárez A, Cuenca F, de la Orden V, Devesa MJ, Rodrigo M, Estrada V, López-Alonso G. Vitamin D deficiency and vitamin D therapy in chronic hepatitis C. Ann Hepatol. 2013;12:199-204. [PubMed] |
| 7. | Milczarek M, Rosinska S, Psurski M, Maciejewska M, Kutner A, Wietrzyk J. Combined colonic cancer treatment with vitamin D analogs and irinotecan or oxaliplatin. Anticancer Res. 2013;33:433-444. [PubMed] |
| 8. | Smyk DS, Orfanidou T, Invernizzi P, Bogdanos DP, Lenzi M. Vitamin D in autoimmune liver disease. Clin Res Hepatol Gastroenterol. 2013;37:535-545. [PubMed] [DOI] |
| 9. | Kwok RM, Torres DM, Harrison SA. Vitamin D and nonalcoholic fatty liver disease (NAFLD): is it more than just an association? Hepatology. 2013;58:1166-1174. [PubMed] [DOI] |
| 10. | Stratos I, Li Z, Herlyn P, Rotter R, Behrendt AK, Mittlmeier T, Vollmar B. Vitamin D increases cellular turnover and functionally restores the skeletal muscle after crush injury in rats. Am J Pathol. 2013;182:895-904. [PubMed] [DOI] |
| 11. | Agmon-Levin N, Theodor E, Segal RM, Shoenfeld Y. Vitamin D in systemic and organ-specific autoimmune diseases. Clin Rev Allergy Immunol. 2013;45:256-266. [PubMed] [DOI] |
| 12. | Golden GA, Wyatt TA, Romberger DJ, Reiff D, McCaskill M, Bauer C, Gleason AM, Poole JA. Vitamin D treatment modulates organic dust-induced cellular and airway inflammatory consequences. J Biochem Mol Toxicol. 2013;27:77-86. [PubMed] [DOI] |
| 13. | Kono K, Fujii H, Nakai K, Goto S, Kitazawa R, Kitazawa S, Shinohara M, Hirata M, Fukagawa M, Nishi S. Anti-oxidative effect of vitamin D analog on incipient vascular lesion in non-obese type 2 diabetic rats. Am J Nephrol. 2013;37:167-174. [PubMed] [DOI] |
| 14. | Chen EQ, Shi Y, Tang H. New insight of vitamin D in chronic liver diseases. Hepatobiliary Pancreat Dis Int. 2014;13:580-585. [PubMed] |
| 15. | Neeman R, Abramovitch S, Sharvit E, Elad-Sfadia G, Haklai R, Kloog Y, Reif S. Vitamin D and S-farnesylthiosalicylic acid have a synergistic effect on hepatic stellate cells proliferation. Dig Dis Sci. 2014;59:2462-2469. [PubMed] [DOI] |
| 17. | Malham M, Jørgensen SP, Ott P, Agnholt J, Vilstrup H, Borre M, Dahlerup JF. Vitamin D deficiency in cirrhosis relates to liver dysfunction rather than aetiology. World J Gastroenterol. 2011;17:922-925. [PubMed] [DOI] |
| 18. | Chiang KC, Yeh CN, Chen MF, Chen TC. Hepatocellular carcinoma and vitamin D: a review. J Gastroenterol Hepatol. 2011;26:1597-1603. [PubMed] [DOI] |
| 19. | Nonaka K, Onizuka S, Ishibashi H, Uto Y, Hori H, Nakayama T, Matsuura N, Kanematsu T, Fujioka H. Vitamin D binding protein-macrophage activating factor inhibits HCC in SCID mice. J Surg Res. 2012;172:116-122. [PubMed] [DOI] |
| 20. | Hadjittofi C, Coran AG, Mogilner JG, Pollak Y, Matter I, Sukhotnik I. Dietary supplementation with vitamin D stimulates intestinal epithelial cell turnover after massive small bowel resection in rats. Pediatr Surg Int. 2013;29:41-50. [PubMed] [DOI] |
| 21. | Ferder M, Inserra F, Manucha W, Ferder L. The world pandemic of vitamin D deficiency could possibly be explained by cellular inflammatory response activity induced by the renin-angiotensin system. Am J Physiol Cell Physiol. 2013;304:C1027-C1039. [PubMed] [DOI] |
| 22. | Farnik H, Bojunga J, Berger A, Allwinn R, Waidmann O, Kronenberger B, Keppler OT, Zeuzem S, Sarrazin C, Lange CM. Low vitamin D serum concentration is associated with high levels of hepatitis B virus replication in chronically infected patients. Hepatology. 2013;58:1270-1276. [PubMed] [DOI] |
| 24. | Petta S, Cammà C, Scazzone C, Tripodo C, Di Marco V, Bono A, Cabibi D, Licata G, Porcasi R, Marchesini G. Low vitamin D serum level is related to severe fibrosis and low responsiveness to interferon-based therapy in genotype 1 chronic hepatitis C. Hepatology. 2010;51:1158-1167. [PubMed] [DOI] |
| 25. | Amanzada A, Goralczyk AD, Moriconi F, van Thiel DH, Ramadori G, Mihm S. Vitamin D status and serum ferritin concentration in chronic hepatitis C virus type 1 infection. J Med Virol. 2013;85:1534-1541. [PubMed] [DOI] |
| 26. | Atsukawa M, Tsubota A, Shimada N, Abe H, Kondo C, Itokawa N, Nakagawa A, Iwakiri K, Kawamoto C, Aizawa Y. Serum 25(OH)D3 levels affect treatment outcomes for telaprevir/peg-interferon/ribavirin combination therapy in genotype 1b chronic hepatitis C. Dig Liver Dis. 2014;46:738-743. [PubMed] [DOI] |
| 27. | 朴 美兰. 维生素D3对四氯化碳诱导小鼠急性肝损伤的保护作用. 吉林: 延边大学 2013; . |
| 28. | 李 才, 任 立群. 人类疾病动物模型的复制(第1版). 北京: 人民卫生出版社 2011; 117-118. |
| 29. | 何 薇, 陈 熙, 陶 莉, 齐 军, 黄 家惠, 张 程, 徐 德祥, 许 建明. 维生素D缺乏对四氯化碳急性肝损伤过程肝脏炎症的影响. 中华疾病控制杂志. 2014;18:405-410. |
| 30. | 张 艳茹. 维生素D对慢性丙型肝炎抗病毒治疗疗效和预后的影响分析. 广州: 南方医科大学 2014; . |
| 31. | Gal-Tanamy M, Bachmetov L, Ravid A, Koren R, Erman A, Tur-Kaspa R, Zemel R. Vitamin D: an innate antiviral agent suppressing hepatitis C virus in human hepatocytes. Hepatology. 2011;54:1570-1579. [PubMed] [DOI] |