修回日期: 2014-12-29
接受日期: 2015-01-09
在线出版日期: 2015-02-18
目的: 探讨胃泌素受体拮抗剂丙谷胺和选择性环氧合酶-2(cyclooxygenase-2, COX-2)抑制剂塞来昔布对人胃癌细胞株BGC-823增殖的抑制作用及其对COX-2、15-羟基前列腺素脱氢酶(15-hydroxyprostaglandin dehydrogenase, 15-PGDH)和前列腺素E2(prostaglandin E2, PGE2)的影响.
方法: 采用MTT法分别检测丙谷胺和塞来昔布单独及联合应用对人胃癌细胞株BGC-823增殖的影响; RT-PCR法检测COX-2和15-PGDH mRNA的表达; Western blot检测COX-2和15-PGDH蛋白质的表达; ELISA检测细胞培养液中PGE2含量变化.
结果: 丙谷胺和塞来昔布呈剂量和时间依赖性地抑制胃癌BGC-823细胞的增殖. 采用低于细胞增殖半数抑制浓度(the half maximal inhibitory concentration, IC50)的丙谷胺(6 mmol/L)和塞来昔布(50 μmol/L)联合应用, 48 h时对胃癌细胞BGC-823的增殖抑制率为65.1%±7.7%, 显著高于单独应用丙谷胺(6 mmol/L, 38.1%±7.1%)和塞来昔布(50 μmol/L, 32.6%±3.3%)时的抑制率(P值均<0.05). 丙谷胺和塞来昔布两药均能下调胃癌BGC-823细胞中COX-2及上调15-PGDH mRNA和蛋白的表达, 联合应用比单独用药更为显著(P值分别<0.05, <0.01). 同时, 两药也能降低BGC-823细胞分泌PGE2, 联合用药作用更加明显(P值分别<0.05, <0.01).
结论: 丙谷胺、塞来昔布均呈时间和剂量依赖性抑制胃癌细胞株BGC-823的增殖, 其可能机制之一为通过下调COX-2 mRNA和蛋白的表达, 同时上调15-PGDH mRNA和蛋白的表达, 进而减少PGE2合成与分泌而实现. 两药联合应用可能具有协同抗癌作用.
核心提示: 本文探讨胃泌素受体拮抗剂丙谷胺和选择性环氧合酶-2(cyclooxygenase-2, COX-2)抑制剂塞来昔布对人胃癌细胞株BGC-823增殖的抑制作用及其对COX-2、15-羟基前列腺素脱氢酶(15-hydroxyprostaglandin dehydrogenase)和前列腺素E2(prostaglandin E2)的影响, 结果提示了丙谷胺、塞来昔布均呈时间和剂量依赖性抑制胃癌细胞株BGC- 823的增殖, 两药联合应用可能具有协同抗癌作用.
引文著录: 方兴国, 赵逵, 朱蓉, 付晓霏, 王红. 胃泌素受体拮抗剂丙谷胺和选择性COX2抑制剂塞来昔布对人胃癌细胞株BGC-823增殖和PGE2分泌的影响. 世界华人消化杂志 2015; 23(5): 719-727
Revised: December 29, 2014
Accepted: January 9, 2015
Published online: February 18, 2015
AIM: To investigate the effect of proglumide (a gastrin receptor antagonist) and celecoxib [a selective cyclooxygenase-2 (COX-2) inhibitor] on cell proliferation and COX-2, 15-hydroxyprostaglandin dehydrogenase (15-PGDH) and prostaglandin E2 (PGE2) expression in human gastric cancer cell line BGC-823.
METHODS: BGC-823 cells were treated with proglumide and celecoxib, alone or in combination. MTT assay was used to detect the proliferation of BGC-823 cells. Real-time PCR was used to detect COX-2 and 15-PGDH mRNA expression. Western blot was used to detect COX-2 and 15-PGDH protein expression, and ELISA was used to determine the content of PGE2 in culture medium.
RESULTS: Proglumide and celecoxib inhibited the growth of BGC-823 cells in a dose- and time-dependent manner. Treatment with combined proglumide (6 mmol/L, less than IC50) and celecoxib (50 μmol/L, less than IC50) for 48 h was associated with a significantly higher inhibition rate than either of the agents alone (65.1% ± 7.7% vs 38.1% ± 7.1%, 32.6% ± 3.3%, P < 0.05). Proglumide and celecoxib down-regulated the expression of COX-2 mRNA and protein, and up-regulated the expression of 15-PGDH mRNA and protein in BGC-823 cells, and the effects of combined treatment were more significant than treatment with either of the agents alone (P < 0.05 vs proglumide; P < 0.01 vs celecoxib). Proglumide and celecoxib reduced the secretion of PGE2, and the effects of combined treatment were more significant than either of the agents alone (P < 0.05 vs proglumide; P < 0.01 vs celecoxib).
CONCLUSION: Proglumide and celecoxib inhibit the growth of cultured BGC-823 cells time- and dose-dependently, possibly by down-regulating the expression of COX-2 mRNA and protein, up-regulating the expression of 15-PGDH mRNA and protein, and reducing PGE2 synthesis or secretion. Combined use of proglumide and celecoxib has a synergistic effect.
- Citation: Fang XG, Zhao K, Zhu R, Fu XF, Wang H. Impact of combined proglumide and celecoxib on cell proliferation and PGE2 secretion in human gastric cancer cell line BGC-823. Shijie Huaren Xiaohua Zazhi 2015; 23(5): 719-727
- URL: https://www.wjgnet.com/1009-3079/full/v23/i5/719.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i5.719
胃癌是人类共同面临的最常见的恶性肿瘤之一, 尤其是中晚期胃癌对人们的身心健康造成严重的威胁. 如何尽早对胃癌进行必要干预, 是医务工作者目前所面临的挑战. 近年来在胃癌研究上虽取得了一些的进展, 但治疗上仍未获得实质性突破. 既往的研究表明, 胃泌素(gastrin)及其受体(cholecystokinin-B, CCK-B)、环氧合酶-2(cyclooxygenase-2, COX-2)、前列腺素E2(prostaglandin E2, PGE2)升高及15-羟基前列腺素脱氢酶(15-hydroxyprostaglandin dehydrogenase, 15-PGDH)降低或缺失与胃癌的发生、发展密切相关[1-4]. 但他们在胃癌发生与发展中的相互作用仍不清楚, 我们以前的临床研究发现, 胃泌素和COX-2在胃癌前病变和胃癌中表达逐渐增强, 并参与了黏膜的增殖[5,6]. 在本研究采用胃泌素受体拮抗剂丙谷胺和选择性COX-2抑制剂塞来昔布通过单独及联合应用对体外培养表达胃泌素基因的胃癌细胞株BGC-823[7]进行干预, 通过检测COX-2、15-PGDH及PGE2在癌细胞中的表达情况, 探讨他们在胃癌中的相互作用以及可能的作用机制.
胃癌细胞株BGC-823(重庆医科大学细胞工程实验室); 丙谷胺钠(proglumide sodium salt)(Sigma公司); 塞来昔布(celecoxib)(辉瑞制药有限公司); RPMI-1640培养(Gibco公司); MTT(Sigma公司); 人PGE2 ELISA试剂盒(上海西唐生物科技有限公司); COX-2引物、15-PGDH引物、β-actin引物、PCR逆转录、荧光定量PCR试剂盒, 和20 bp DNA Ladder Marker(宝生物工程有限公司); COX-2多克隆抗体(山羊来源); BCA法蛋白定量试剂盒(上海捷瑞生物工程有限公司); 15-PGDH多克隆抗体(兔来源); β-actin多克隆抗体(小鼠来源)(Santa Cruz公司); 辣根酶标记山羊抗小鼠IgG(H+L)(中杉金桥公司); 辣根酶标记兔抗山羊IgG(H+L); 辣根酶标记山羊抗兔IgG(H+L); Prestained Protein Ladder(Fermentas公司).
1.2.1 细胞培养: 将BGC-823细胞培养于含10%FCS的RPMI 1640培养基中, 放于37 ℃, 含50 mL/L CO2的细胞培养箱中培养到细胞贴壁生长至70%-80%时, 用0.25%胰蛋白酶对培养的细胞消化传代继续培养, 2-3 d传代1次.
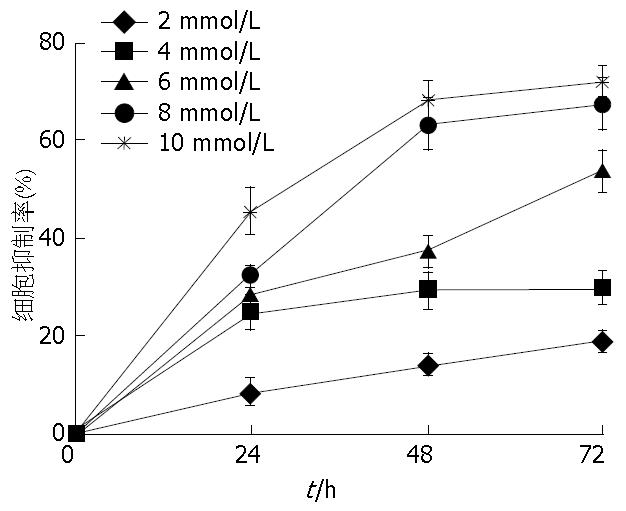
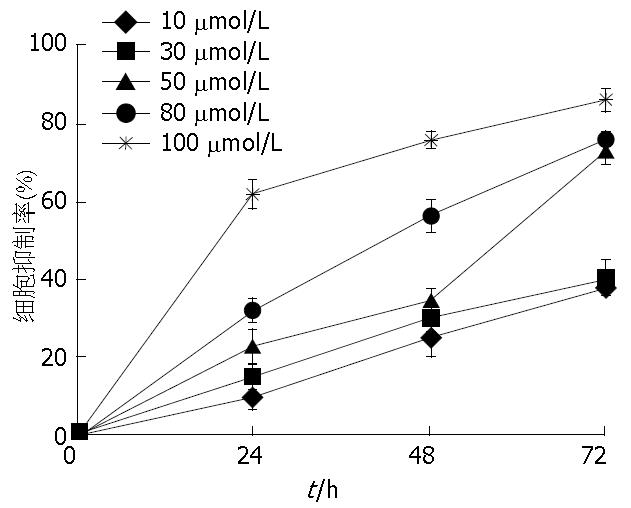
1.2.2 MTT法检测丙谷胺、塞来昔布及联合用药对BGC-823细胞的增殖的抑制作用: (1)取对数生长期的BGC-823细胞, 用胰酶消化稀释至5×104个/mL的单细胞悬液, 以100 µL/孔接种于96孔培养板置于含50 mL/L CO2细胞培养箱中培养; (2)培养24 h后进行分组: 对照组和不同浓度的丙谷胺组(2、4、6、8、10 mmol/L); 对照组和不同浓度的塞来昔布组(10、30、50、80、100 µmol/L); (3)加药后分别继续培养24、48、72 h, 在每孔中加入0.5%MTT溶液20 µL再培养4 h, 分别每孔加入DMSO 150 µL, 放于水平震器上震荡10 min, 使结晶颗粒完全溶解, 于酶标仪测定490 nm波长处的A值. 每组设6个平行孔, 重复3次实验. 细胞的生长抑制率 = (1-实验组A值/对照组A值)×100%; (4)根据药物浓度与增殖抑制率进行回归分析, 计算出丙谷胺和塞来昔布在48 h时对BGC-823细胞增殖的半数抑制浓度(the half maximal inhibitory concentration, IC50); (5)再按上述方法接种细胞, 实验分为: 对照组, <IC50丙谷胺组, <IC50塞来昔布组, 联合用药组(<IC50丙谷胺+<IC50塞来昔布). 求得各组48 h细胞的生长抑制率.
1.2.3 收集实验细胞及细胞培养液: 分别将培养满48 h的对照组, <IC50塞来昔布组, <IC50丙谷胺组, 联合用药组(<IC50塞来昔布+<IC50丙谷胺)分别留取各组一部分细胞培养液, 以500 µL/管放置于-20 ℃冰箱保存备用. 各组细胞按实验需要进行相应处理.
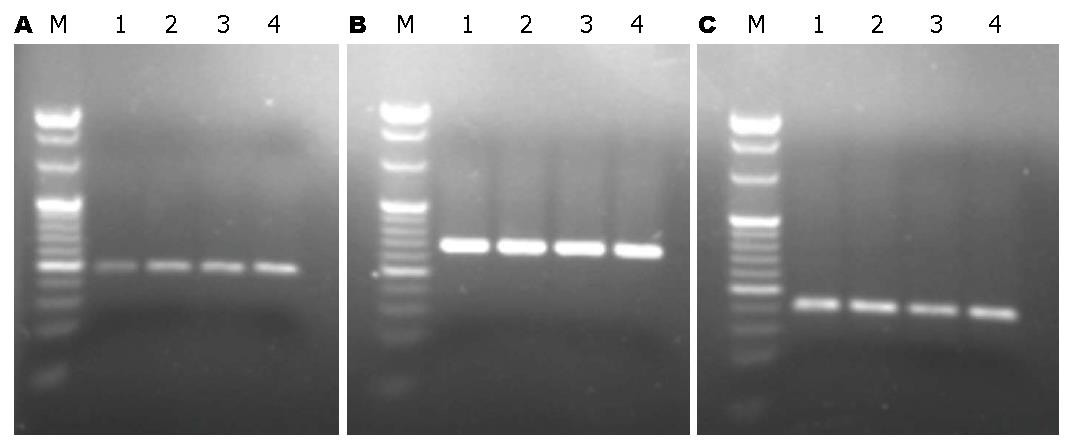
1.2.4 RT-PCR检测COX-2和15-PGDH mRNA在BGC-823中的表达: 用TRIzol试剂分别提取各实验组细胞中RNA. 取RNA 6.5 µL(200 ng), 5×PrimeScripe™ Buffer 2 µL, Prime Oligod T Primer(50 µmol/L) 0.5 µL, Scripe™ RT Enzyme Mix I 0.5 µL, Random 6 mers(100 µmol/L) 0.5 µL, 37 ℃ 15 min 85 ℃ 5 s逆转录合成cDNA, 逆转录产物再稀释5倍. COX-2、15-PGDH及β-actin基因引物系列由大连宝生物工程公司合成(表1). RT-PCR反应体系20 µL, 含稀释后的cDNA 4 µL, SYBR superMix荧光混合物10 µL, COX-2、15-PGDH及β-actin上游引物和下游引物各0.4 µL, 三蒸水5.2 µL. 反应条件: 95 ℃预变性10 s, 1 cycle, PCR反应95 ℃ 5 s, 58.5 ℃ 20 s, 40 cycle, 融解曲线55 ℃, 80 cycle. 取PCR产物2 µL置3%琼脂糖凝胶电泳分离, 紫外线下观察结果, 用全自动凝胶成像分析系统进行拍照. COX-2产物长度为81 bp; 15-PGDH产物长度为91 bp; β-actin产物的长度为186 bp. 以COX-2/β-actin和15-PGDH/β-actin比值分别表示COX-2和15-PGDH mRNA相对表达量.
| 基因名称 | 基因代码 | 正向引物(5'-3') | 反向引物(5'-3') |
| COX-2 | NM000963 | CTGGAACATGGAATTACCCAGTTTG | TGGAACATTCCTACCACCAGCA |
| 15-PGDH | NM000860 | AAGCATGGCATAGTTGGATTCACA | AGCCTGGACAAATGGCATTCA |
| β-actin | NM001101 | TGGCACCCAGCACAATGAA | CTAAGTCATAGTCCGCCTAGAAGCA |
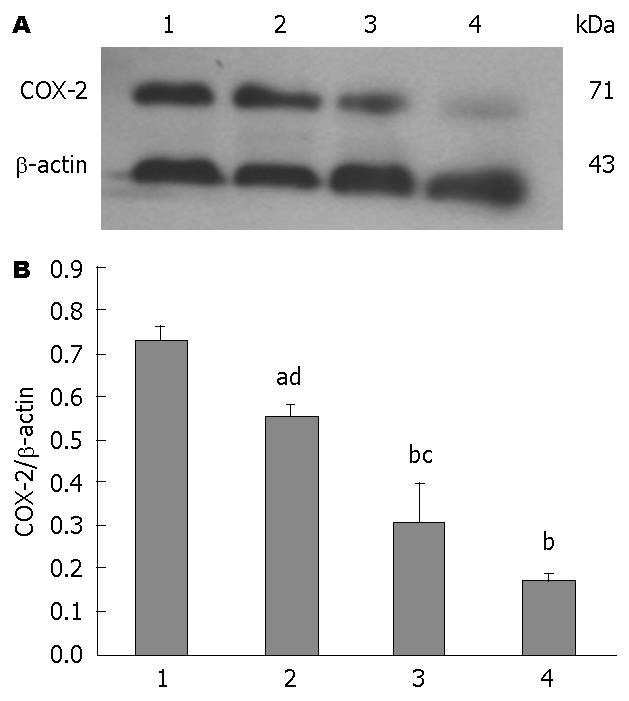
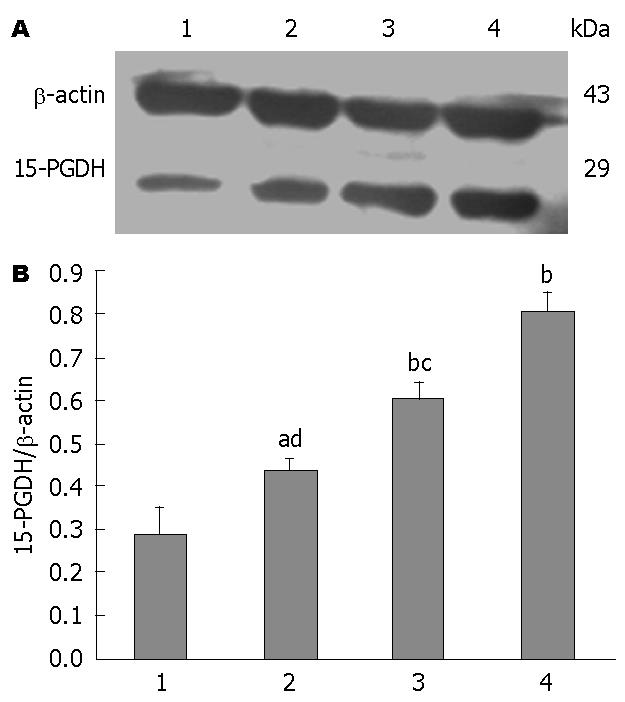
1.2.5 Western blot检测COX-2和15-PGDH蛋白在BGC-823中的表达: 把经PBS洗涤过的BGC-823细胞, 用细胞裂解液充分裂解细胞; 在以4 ℃ 12000 r/min离心共15 min, BCA法测定离心上清液蛋白含量. 取40 µg蛋白质常规进行SDS-PAGE电泳后转印至PVDF膜, 室温下用5%的脱脂奶粉进行常规封闭2 h, 用TBST洗膜; 分别加入一抗COX-2多克隆抗体(1∶200), 15-PGDH多克隆抗体(1∶500), β-actin抗体(1∶1000), 4 ℃冰箱中过夜, TBST洗膜; 分别加入兔抗山羊、山羊抗兔IgG(H+L)(均为1∶500)和山羊抗小鼠(1∶2000)二抗2 h. 充分漂洗后ECL发光, X线胶片感光后洗片; 用全自动凝胶成像分析系统扫描印迹胶片并分别测出各实验组COX-2、15-PGDH及β-actin蛋白电泳带积分光密度值, 以COX-2/β-actin、15-PGDH/β-actin比值分别表示COX-2和15-PGDH蛋白相对表达量, 再进行半定量分析.
1.2.6 ELISA法检测BGC-823培养液中PGE2含量: 将收集的各组细胞培养液. 按照ELISA试剂盒操作说明对各组培养液进行实验, 分别计算出各组标本的PGE2含量(µg/L). 每组做6个平行孔.
统计学处理 实验数据按完全随机对照设计的要求整理, 所有实验数据以mean±SD表示, 并采用SPSS11.0统计学软件包对各组数据进行单因素方差分析, P<0.05为差异有统计学意义.
DMSO溶媒组与对照组之间比较差异无统计学意义(P>0.05); 在用药干预的各实验组均随着用药物浓度的增加和作用时间的延长, 对BGC-823增殖的抑制率逐渐增加, 呈时间和剂量依赖性地抑制BGC-823的增殖(图1, 2).
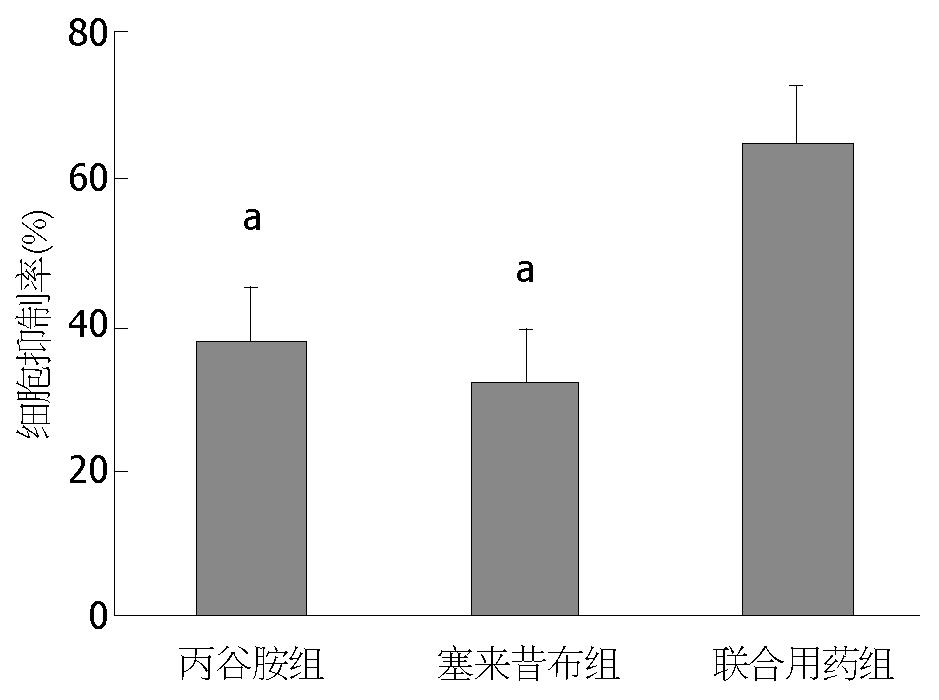
根据药物浓度与增殖抑制率的回归分析及药物浓度抑制率曲线求出直线回归方程. 计算出丙谷胺和塞来昔布在细胞培养48 h时的IC50分别为6.46 mmol/L、53.78 µmol/L. 取<IC50的药物浓度单独及联合给药. 丙谷胺(6 mmol/L)和塞来昔布(50 µmol/L)及联合(丙谷胺6 mmol/L+塞来昔布50 µmol/L)给药干预, 在48 h时对BGC-823细胞增殖抑制率分别为38.1%±7.1%, 32.6%±3.3%和65.1%±7.7%. 与对照组比较差异均具有统计学意义(均P<0.05), 联合用药组明显高于单独用药组(均P<0.05)(表2, 图3, 4). 根据金正均[8]的方法, 丙谷胺和塞来昔布联合作用48 h后q值为1.167, 提示丙谷胺和塞来昔布联合应用具有协同抑制胃癌细胞BGC-823增殖作用.
丙谷胺、塞来昔布单独和联合作用于BGC-823细胞48 h后, 各组的COX-2 mRNA和15-PGDH mRNA相对表达量均分别低于、高于对照组(均P<0.05), 联合用药组作用增强(均P<0.05)(表3). 各组标本的荧光定量扩增曲线呈典型的S型, 熔解曲线为单峰, 排除了非特异性扩增, 凝胶电泳图呈特异性条带, 印证为目的产物(图5).
丙谷胺、塞来昔布单独和联合作用于BGC-823细胞48 h后, 各组中COX-2蛋白和15-PGDH蛋白相对表达量均分别低于和高于对照组(P<0.05, P<0.01), 联合用药组较单独用药组作用更为显著(P<0.05, P<0.01)(图6, 7).
胃泌素是一种最常见的胃肠激素, 是由胃窦G细胞合成, 其主要的生理功能除了调节胃酸分泌外, 在胃上皮细胞中还调节多种重要的细胞活动, 包括细胞的增殖、凋亡、组织化生及肿瘤的血管形成、浸润和转移. 在我们课题组在结肠癌大鼠动物模型中同样证实了胃泌素参与了结肠癌的发生与发展[9]. 研究发现, 胃癌细胞(如BGC-823)也能合成和分泌胃泌素, 其作用可通过其受体CCK-B介导细胞内一系列信号传导, 促进细胞分裂和DNA合成, 他在胃癌的发生、发展中起重要作用[1,10]. 胃泌素受体拮抗剂在过去的实验及临床研究中对恶性肿瘤具有预防和一定抗癌疗效[11,12]. 本实验同样证明, 丙谷胺能抑制BGC-823的增殖, 并随着药物浓度的增加和/或作用时间的延长, 对细胞增殖抑制作用随之增强, 呈时间和剂量依赖性. 这表明BGC-823细胞可通过自分泌胃泌素并作用于自身受体来促进细胞的增殖, 而丙谷胺能够抑制这一作用. 胃癌细胞除表达胃泌素基因外, 还表达COX-2基因[13]. 已有研究[3,5,14]表明, COX-2在癌前病变及组织胃癌中呈现较高的表达. Yao等[15]用特异性COX-2小干扰RNA转染胃癌细胞后, 当COX-2的表达下调时可抑制多种肿瘤血管生成因子, 从而提出COX-2可能具有调节肿瘤血管生成与生长的作用, 王涛等[16]用同样的方法, 在有效抑制COX-2的表达同时能够抑制胃腺癌细胞的增殖和促使癌细胞的凋亡. 选择性COX-2抑制剂可通过抑制COX-2的表达对胃癌具有预防及治疗作用[17,18]. 本实验结果表明, 塞来昔布同丙谷胺一样, 同样也以时间和剂量依赖的方式抑制BGC-823细胞的增殖, 这与进来的研究[19]结果一致. 胃泌素能诱导人胃癌细胞株COX-2表达, 给予选择性CCK-B拮抗剂能抑制胃泌素诱导的COX-2表达[20]. 联合应用丙谷胺和塞来昔布实验结果显示, 胃泌素受体拮抗剂与COX-2抑制剂联合应用可协同抑制胃癌细胞增殖和促进凋亡作用[21].
15-PGDH是前列腺素生物灭活的关键酶, 在15-羟基前列腺素氧化成为活性较弱的15-酮基前列腺素反应中起催化作用, 同时又对COX-2有天然拮抗作用, 两者具有相互反向的调节作用, 但具体机制不详, 可能与白介素-1β、表皮生长因子等上调COX-2表达, 抑制15-PGDH合成有关[4], Ryu等[22]研究也证明在感染幽门螺杆菌的胃癌中15-PGDH表达受到抑制, 其作用是通过TLR4/MyD88路径所介导. 而在胃肠道另一肿瘤结肠癌临床试验中[23], COX-2为高表达, 15-PGDH表达明显受抑制提供一些理论依据. 我们课题组在以前的研究[24]中发现, 胃泌素可刺激胃癌细胞合成和分泌EGF, 并可被丙谷胺部分抑制. 国内外研究[25-27]均表明, 15-PGDH在胃癌中表达表达降低或缺失并参与胃癌的发生与发展, 而15-PGDH抑制剂Cay1039通过抑制15-PGDH表达可促进人胃癌细胞增殖[28]. 本实验通过RT-PCR和Western blot检测发现, 胃癌细胞BGC-823 COX-2 mRNA和蛋白质呈高表达, 15-PGDH mRNA和蛋白质均呈低表达; 丙谷胺和塞来昔布均使胃癌BGC-823细胞中的COX-2 mRNA及蛋白表达下调, 15-PGDH mRNA和蛋白质上调, 联合给药时具有协同作用. 结果提示, 丙谷胺和塞来昔布可通过直接或间接途径来抑制COX-2表达. 丙谷胺可通过拮抗胃泌素受体来减少COX-2的表达, 我们认为COX-2可能是胃泌素的下游目标之一. PGE2既是COX-2的下游产物又是15-PGDH的底物, 他参与机体的多种生理和病理过程[29]. COX-2的作用主要是通过其产物PGE2来实现的[30]. 本实验结果表明, 丙谷胺和塞来昔布可单独和协同抑制胃癌细胞PGE2的分泌, 反映了上述两药均可下调COX-2表达, 上调15-PGDH表达的效应.
总之, 丙谷胺和塞来昔均能抑制胃癌细胞BGC-823的增殖, 两药联合具有协同作用. 其机制可能是通过协同抑制COX-2的表达, 同时上调15-PGDH的表达, 从而减少了PGE2的分泌, 促进了PGE2的分解. 这一研究结果可为联合应用胃泌素受体拮抗剂和环氧合酶抑制剂这两类不同性质的非细胞毒性药物协助治疗胃癌提供理论支持.
胃癌是人类共同面临的最常见的恶性肿瘤之一. 胃泌素(gastrin)及其受体(cholecystokinin-B, CCK-B)、环氧合酶-2(cyclooxygenase-2, COX-2)、前列腺素E2(prostaglandin E2, PGE2)升高及15-羟基前列腺素脱氢酶(15-hydroxyprostaglandin dehydrogenase, 15-PGDH)降低或缺失与胃癌的发生、发展密切相关. 但他们在胃癌发生与发展中的相互作用仍不清楚.
郑鹏远, 教授, 主任医师, 博士生导师, 副院长, 郑州大学第二附属医院消化科
本研究立足临床常见的胃癌, 有体外实验的方法研究药物对胃癌细胞系的影响及其机制, 具有一定的理论意义和潜在的临床价值.
编辑: 郭鹏 电编: 都珍珍
| 1. | Burkitt MD, Varro A, Pritchard DM. Importance of gastrin in the pathogenesis and treatment of gastric tumors. World J Gastroenterol. 2009;15:1-16. [PubMed] |
| 2. | Liu XJ, Chen ZF, Li HL, Hu ZN, Liu M, Tian AP, Zhao D, Wu J, Zhou YN, Qiao L. Interaction between cyclooxygenase-2, Snail, and E-cadherin in gastric cancer cells. World J Gastroenterol. 2013;19:6265-6271. [PubMed] [DOI] |
| 3. | Oshima H, Oshima M. The role of PGE2-associated inflammatory responses in gastric cancer development. Semin Immunopathol. 2013;35:139-150. [PubMed] [DOI] |
| 4. | Kang JH, Kang SH, Seo SH, Shin JH, An MS, Ha TK, Bae KB, Kim TH, Choi CS, Oh SH. Relationship between 15-hydroxyprostaglandin dehydrogenase and gastric adenocarcinoma. Ann Surg Treat Res. 2014;86:302-308. [PubMed] [DOI] |
| 7. | Song J, Ren H, Li Y, Xu J, Kong H, Tong W, Zhou Y, Gao S, Liu Y, Hui Q. rG17PE38, a novel immunotoxin target to gastric cancer with overexpressed CCK-2R. J Drug Target. 2013;21:375-382. [PubMed] [DOI] |
| 10. | Lee KH, Koh SA, Kim JR. Hepatocyte growth factor-mediated gastrin-releasing peptide induces IL-8 expression through Ets-1 in gastric cancer cells. Oncol Res. 2013;20:393-402. [PubMed] [DOI] |
| 11. | Smith JP, Cooper TK, McGovern CO, Gilius EL, Zhong Q, Liao J, Molinolo AA, Gutkind JS, Matters GL. Cholecystokinin receptor antagonist halts progression of pancreatic cancer precursor lesions and fibrosis in mice. Pancreas. 2014;43:1050-1059. [PubMed] [DOI] |
| 12. | 孙 为豪, 苏 菡, 章 礼久, 邵 耘, 许 海尘, 张 涛, 薛 绮萍, 丁 国宪, 程 蕴琳. 胃泌素受体拮抗剂与环氧合酶-2抑制剂对胃癌细胞增殖和凋亡的影响. 中华医学杂志. 2006;86:250-254. |
| 13. | Shao Y, Sun K, Xu W, Li XL, Shen H, Sun WH. Helicobacter pylori infection, gastrin and cyclooxygenase-2 in gastric carcinogenesis. World J Gastroenterol. 2014;20:12860-12873. [PubMed] [DOI] |
| 14. | Lazăr D, Tăban S, Ardeleanu C, Simionescu C, Sporea I, Cornianu M, Vernic C. Immuno-histochemical expression of the cyclooxygenase-2 (COX-2) in gastric cancer. The correlations with the tumor angiogenesis and patients' survival. Rom J Morphol Embryol. 2008;49:371-379. [PubMed] |
| 15. | Yao L, Liu F, Hong L, Sun L, Liang S, Wu K, Fan D. The function and mechanism of COX-2 in angiogenesis of gastric cancer cells. J Exp Clin Cancer Res. 2011;30:13. [PubMed] [DOI] |
| 17. | Yanaoka K, Oka M, Yoshimura N, Deguchi H, Mukoubayashi C, Enomoto S, Maekita T, Inoue I, Ueda K, Utsunomiya H. Preventive effects of etodolac, a selective cyclooxygenase-2 inhibitor, on cancer development in extensive metaplastic gastritis, a Helicobacter pylori-negative precancerous lesion. Int J Cancer. 2010;126:1467-1473. [PubMed] [DOI] |
| 18. | Han X, Li H, Su L, Zhu W, Xu W, Li K, Zhao Q, Yang H, Liu H. Effect of celecoxib plus standard chemotherapy on serum levels of vascular endothelial growth factor and cyclooxygenase-2 in patients with gastric cancer. Biomed Rep. 2014;2:183-187. [PubMed] |
| 19. | Liu M, Li CM, Chen ZF, Ji R, Guo QH, Li Q, Zhang HL, Zhou YN. Celecoxib regulates apoptosis and autophagy via the PI3K/Akt signaling pathway in SGC-7901 gastric cancer cells. Int J Mol Med. 2014;33:1451-1458. [PubMed] [DOI] |
| 20. | Subramaniam D, Ramalingam S, May R, Dieckgraefe BK, Berg DE, Pothoulakis C, Houchen CW, Wang TC, Anant S. Gastrin-mediated interleukin-8 and cyclooxygenase-2 gene expression: differential transcriptional and posttranscriptional mechanisms. Gastroenterology. 2008;134:1070-1082. [PubMed] [DOI] |
| 21. | Lou LH, Jing DD, Lai YX, Lu YY, Li JK, Wu K. 15-PGDH is reduced and induces apoptosis and cell cycle arrest in gastric carcinoma. World J Gastroenterol. 2012;18:1028-1037. [PubMed] [DOI] |
| 22. | Ryu YM, Myung SJ, Park YS, Yang DH, Song HJ, Jeong JY, Lee SM, Song M, Kim do H, Lee HJ. Inhibition of 15-hydroxyprostaglandin dehydrogenase by Helicobacter pylori in human gastric carcinogenesis. Cancer Prev Res (Phila). 2013;6:349-359. [PubMed] [DOI] |
| 23. | Lim SC, Cho H, Lee TB, Choi CH, Min YD, Kim SS, Kim KJ. Impacts of cytosolic phospholipase A2, 15-prostaglandin dehydrogenase, and cyclooxygenase-2 expressions on tumor progression in colorectal cancer. Yonsei Med J. 2010;51:692-699. [PubMed] [DOI] |
| 25. | Song HJ, Myung SJ, Kim IW, Jeong JY, Park YS, Lee SM, Nam WH, Ryu YM, Fink SP, Yang DH. 15-hydroxyprostaglandin dehydrogenase is downregulated and exhibits tumor suppressor activity in gastric cancer. Cancer Invest. 2011;29:257-265. [PubMed] [DOI] |
| 27. | Li L, Yang F, Wang X, Hu J, Yang L, Tang C, Wu Y, Miao K, Liu R, Shou T. Effect of 15-hydroxyprostaglandin dehydrogenase gene on the proliferation of gastric cancer cell murine forestomach carcinoma. Exp Ther Med. 2014;7:290-294. [PubMed] |
| 29. | Piazuelo E, Santander S, Cebrián C, Jiménez P, Pastor C, García-González MA, Esteva F, Esquivias P, Ortego J, Lanas A. Characterization of the prostaglandin E2 pathway in a rat model of esophageal adenocarcinoma. Curr Cancer Drug Targets. 2012;12:132-143. [PubMed] |
| 30. | Greenhough A, Smartt HJ, Moore AE, Roberts HR, Williams AC, Paraskeva C, Kaidi A. The COX-2/PGE2 pathway: key roles in the hallmarks of cancer and adaptation to the tumour microenvironment. Carcinogenesis. 2009;30:377-386. [PubMed] [DOI] |