修回日期: 2015-10-19
接受日期: 2015-11-03
在线出版日期: 2015-12-28
目的: 系统评价p53基因突变和/或蛋白表达异常对食管鳞癌预后影响及其与临床病理特征之间的关系.
方法: 系统检索PubMed、SCI-Ex-panded、EMBASE、Cochrane图书馆、中国期刊全文数据库(CNKI)、中国生物医学文献数据库(CBM)、维普中文科技期刊数据库(VIP); 并追踪已获文献的参考文献. 纳入有关的临床对照研究. 根据预先设定的纳入和排除标准, 2名研究者独立对文献进行筛选及数据提取. 根据Newcastle-Ottawa scale(NOS)标准对文献质量进行评估; 采用Revman5.3软件进行发表偏倚评估及数据综合; 根据异质性的大小采用固定或随机效应模型.
结果: 共有85项研究(8825例)符合纳入标准, p53基因突变、P53蛋白表达异常4608例(研究组), P53野生型/蛋白表达阴性4217例(对照组). 纳入研究两组间OS的风险比(hazard ratio, HR) 为1.35(95%CI: 1.23-1.47, P<0.00001, 异质性P = 0.39, I2 = 5%); 两组间5年生存率的危险比(risk ratio, RR)为0.73(95%CI: 0.62-0.87, P = 0.0003, 异质性P = 0.001, I2 = 50%); 3年生存率的RR值为0.87(95%CI: 0.74-1.02, P = 0.09, 异质性P = 0.28, I2 = 18%). P53突变/蛋白表达异常的食管鳞癌的T分期(RR = 1.09, P = 0.004)、N分期(RR = 1.24, P<0.00001)、M分期(RR = 1.65, P<0.00001)、TNM分期(RR = 1.25, P<0.00001)更晚, 分化程度(RR = 1.06, P = 0.03)更差; 而P53状态与肿瘤的血管侵犯、位置、大小及患者年龄、性别间无明显相关性(均P>0.05).
结论: P53突变/蛋白表达异常是食管鳞癌预后不良的标志物之一. 同时, P53突变/蛋白表达异常的患者较对照组肿瘤浸润深度更深、淋巴结及远处转移率更高、TNM分期更晚、分化程度更差.
核心提示: 本文纳入85篇国内外关于P53状态与食管鳞癌的预后或临床病理特征间关系的研究, 对文献质量及发表偏倚进行评估, 对数据进行提取分析, 得出p53突变是食管鳞癌预后不良的标志物之一, 为临床决策提供可靠的证据.
引文著录: 马怀幸, 刘伟巍, 李世伟, 李苏宜. P53状态与食管鳞癌预后及临床病理特征关系的系统评价. 世界华人消化杂志 2015; 23(36): 5829-5842
Revised: October 19, 2015
Accepted: November 3, 2015
Published online: December 28, 2015
AIM: To evaluate the prognostic role of p53 status and its relationship with clinicopathologic characteristics in esophagus squamous cell carcinoma (ESCC).
METHODS: A systematic search of PubMed, SCI-Ex-panded, EMBASE, the Cochrane library, China National Knowledge Infrastructure (CNKI), Chinese Biomedical Database (CBM), and science and technology periodical database (VIP) was performed. Related references were also searched for additional clinical studies. Two reviewers independently performed screening of identified studies and data extracting according to inclusion and exclusion criteria. The quality assessment was conducted on the basis of the Newcastle-Ottawa Quality Assessment Scale (NOS). The evaluation of the publication bias of the included studies and data synthesis were performed with RevMan 5.3. A fixed-effect or random effects model was adopted according to heterogeneity.
RESULTS: A total of 85 studies involing 8825 cases met the inclusion criteria. The experimental group (4608 cases) was positive for either p53 gene mutation or protein expression, and the control group (4217 cases) was negative for either p53 gene mutation or protein expression. The pooled hazard ratio (HR) for OS was 1.35 (95%CI: 1.23-1.47, P < 0.00001; heterogeneity: P = 0.39, I2 = 5%). The pooled risk ratio (RR) for the 5-year and 3-year survival rates was 0.73 (95%CI: 0.62-0.87, P = 0.0003; heterogeneity: P = 0.001, I2 = 50%) and 0.87 (95%CI: 0.74-1.02, P = 0.09; heterogeneity: P = 0.28, I2 = 18%). p53 gene mutation or protein expression was significantly associated with poorer T stage (RR = 1.09, P = 0.004), N stage (RR = 1.24, P < 0.00001), M stage (RR = 1.65, P < 0.00001), TNM stage (RR = 1.25, P < 0.00001) and differentiation degree (RR = 1.06, P = 0.03). However, there were no association between P53 status and vascular invasion, tumor location, size, age or gender in ESCC (P>0.05).
CONCLUSION: p53 gene mutation or protein expression abnormality is a marker of poor prognosis in patients with ESCC. Meantime, patients with P53 abnormalities are associated with higher depth of invasion, higher rate of lymph node metastasis and distant metastasis, later TNM stage, and poorer grade of differentiation.
- Citation: Ma HX, Liu WW, Li SW, Li SY. Relationship between P53 status and prognosis and clinicopathologic characteristics in esophagus squamous cell carcinoma: A systematic review. Shijie Huaren Xiaohua Zazhi 2015; 23(36): 5829-5842
- URL: https://www.wjgnet.com/1009-3079/full/v23/i36/5829.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i36.5829
2015年国际癌症研究中心(International Agency for Research on Cancer, IARC)全球肿瘤学统计报告显示[1]: 2012年全球食管癌新增数为455800例, 死亡400200例, 其中男性患者居所有新发肿瘤的第7位, 病死率居第6位, 主要病理类型有鳞癌和腺癌. 高发区分布在东亚、东非和南非一带, 高发区90%以上患者为食管鳞癌(esophagus squamous cell carcinoma, ESCC). 中国处于高发区, 年发病率居第5位, 年死亡率居第4位[2]. 即使接受根治术的患者, 由于局部复发或远处转移, 5年生存率也难以达到20%[3]. 探寻ESCC预后、疗效评估相关预测因子, 为制定相应的临床干预措施提供思路, 是显著提升ESCC临床疗效的切入点之一.
p53基因是一种抑癌基因, 定位于染色体17P13.1上, 编码393个氨基酸组成的核内磷酸化蛋白, 在人类恶性病变过程中超过50%的肿瘤发生突变, 包括食管癌; 突变在外显子5-8多见, 主要集中在DNA结合域的100-300位点[4]. 野生型P53与细胞周期的阻滞、衰老、凋亡及自噬相关, 而P53突变后失去抑制肿瘤衰老、凋亡能力, 进而促进肿瘤的发生、发展. P53突变与食管癌的疗效预测、预后的关系以及基因治疗的研究一直是研究者的焦点之一. 2013年, Zhang等[5]对28篇文献的数据进行荟萃分析, 结果显示, P53野生型食管癌患者治疗反应率明显高于突变者, 风险比(risk ratio, RR)为1.09(P = 0.003); Shimada等[6]对10例不能行根治术、对放化疗不敏感的进展期ESCC患者予以p53基因治疗, 其中9例达到稳定, 且安全性和耐受性均可. 但目前关于P53状态与ESCC预后及临床病理特征的关系仍存在不一致结论, 故收集有关研究进行Meta分析, 进一步明确p53基因突变或蛋白过表达对ESCC预后的影响及其与临床病理特征间的关系, 为临床提供可靠证据.
计算机检索以下数据库: PubMed、SCI-Ex-panded、EMBASE、Cochrane图书馆、中国期刊全文数据库(China National Knowledge Infrastructure, CNKI)、中国生物医学文献数据库(Chinese Biomedical Database, CBM)、维普中文科技期刊数据库(VIP science and technology periodical database). 英文检索词: "P53 or TP53 or P53 protein or P53 mutation", "esophageal or esophagus", "neoplasms or carcinoma or cancer or tumor", "squamous or squamous cell", "prognos* or surviv*", "clinicopathologic or clinical pathological", and "features or factors or characteristics or parameters". 中文检索词: "食管鳞癌或食管癌"、"P53"、"预后"、"病理特征". 发表年限为1994-01/2015-05. 同时追踪所获得文献的相关参考文献.
1.2.1 纳入及排除标准: 纳入标准: (1)纳入研究为公开发表的临床对照研究, 探讨p53基因突变或蛋白表达异常与ESCC预后或临床病理特征间关系; (2)纳入人群为病理学确诊的ESCC, 无起病部位、年龄、性别、治疗方案、地域限制; (3)研究组为p53基因突变或蛋白表达异常ESCC患者, 对照组为p53基因野生型或蛋白表达阴性ESCC; (4)结局指标: 总生存期(overall survival, OS)、5年生存率、3年生存率; P53与临床病理特征(肿瘤浸润深度、淋巴结转移、远处转移、TNM分期、分化程度、血管侵犯、位置、大小、年龄、性别)间关系; (5)纳入语种为英文或中文; (6)样本量≥40. 排除标准: 综述、Meta分析、系统评价、摘要、学位论文; 动物研究; 研究中含食管腺癌或未给出病理类型; 数据不全或无法提取; 重复研究或部分数据有重复的研究.
1.2.2 文献质量评估: 根据Newcastle-Ottawa scale(NOS)文献质量评估标准[7]由2位研究者对所纳入的研究独立进行质量评估. 该评估主要从病例的选择、人群的可比较性及结局指标的报道随访情况进行, 最高为9星, NOS≥6星为较高质量文献. 如意见不一致时通过讨论决定.
1.2.3 数据提取: 根据纳入标准, 2位研究者在互不知情的情况下独立对检索的原始文献进行评估; 如有异议, 则获取全文进一步决定. 同样, 由2位研究者独立提取纳入文献的数据, 包括一般情况(作者、发表年份、样本大小)、研究背景、试验特点(试验设计、质量评估、随访)、纳入人群(年龄、性别、纳入及排除标准)及结局指标(预后指标、临床病理特征指标)等.
1.2.4 异质性及敏感性分析: 采用Cochrane协作网提供卡方检验分析各研究间的异质性, 如异质性P≤0.1、I2>50%, 认为其异质性较大; 反之, 认为研究间异质性较小. 如P值和I2有冲突时, 以P值作为选择依据. 必要时对文献质量高低间研究进行敏感性分析.
1.2.5 发表偏倚评估: 对纳入文献采用漏斗图进行发表偏倚评估.
统计学处理 二分变量采用RR、与时间相关变量采用危险比(hazard ratio, HR)及其95%可信区间(confidence intervals, CI)进行数据统计及综合. HR值由文中生存曲线直接算出或经多/单生存因素分析模型计算出, 如同时有单因素及多因素分析结果, 取多因素分析值. 数据采用Cochrane协作网提供的RevMan5.3软件进行处理, 根据异质性大小选取固定或随机效应模型, 异质性小者选取固定效应模型. 异质性大者首先寻找异质性大的原因, 包括数据提取、输入是否有误, 临床特征或方法学是否差别较大等, 如排除这些原因后采用随机效应模型进行分析.
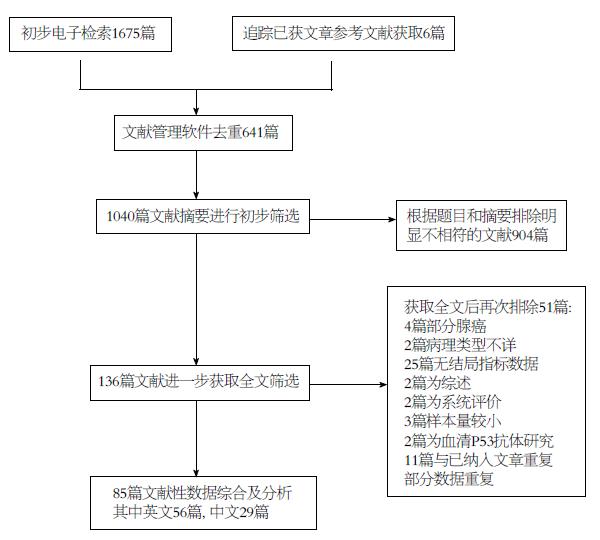
文献筛选流程如图1, 根据检索策略初步检索到文献1681篇, 文献管理软件初步去重后剩余1040篇, 根据题目和摘要排除明显不符合标准904篇, 初步纳入136篇, 获取全文后进一步排除51篇, 最终纳入85篇[8-92], 其中英文56篇, 中文29篇, 共8825例, 研究组4608例(英文3261例, 中文1347例), 对照组4217例(英文3069例, 中文1148例), 研究样本量在40-830之间, 平均为103.8, P53阳性率在27.5%-75.4%之间. 使用免疫组织化学法检测P53蛋白表达的73篇, PCR检测p53基因突变的3篇, 同时使用免疫组织化学及PCR检测的9篇, 纳入研究基线特点如表1.
| 作者/出版年 | 地区 | 样本量 | 检测方法 | P53阳性/阴性 | 治疗方案 | 预后指标 | P值 | NOS |
| Huang等[86]2014 | 中国 | 118 | IHC | 58/60 | 手术 | OS | <0.05 | 8 |
| Shang等[88]2014 | 中国 | 590 | IHC | 232/307 | 手术 | OS | <0.05 | 6 |
| Yao等[89]2014 | 中国 | 136 | IHC | 57/79 | / | OS | <0.05 | 7 |
| Xu等[87]2014 | 中国 | 830 | IHC | 305/525 | 手术 | OS、PFS | <0.05 | 7 |
| Okamoto等[84]2013 | 日本 | 86 | IHC | 57/29 | 手术 | 5年生存率 | >0.05 | 7 |
| Wang等[85]2013 | 中国 | 114 | IHC | 61/53 | 手术+放化疗 | OS、5年生存率 | >0.05 | 7 |
| Yen等[78]2011 | 台湾 | 132 | IHC | 69/63 | 手术 | OS、PFS | <0.05 | 8 |
| Luo等[79]2011 | 中国 | 134 | IHC | 56/78 | 手术 | 5年生存率 | >0.05 | 8 |
| Egashira等[80]2011 | 日本 | 94 | PCR/IHC | 53/41 | 手术 | OS | >0.05 | 7 |
| Taghavi等[72]2010 | 伊朗 | 80 | IHC | 45/35 | 手术或其他 | OS | >0.05 | 8 |
| Kaneko等[73]2010 | 日本 | 57 | PCR | 25/32 | 放化疗 | 3年生存率 | >0.05 | 7 |
| Yamasaki等[74]2010 | 日本 | 97 | PCR/IHC | 46/51 | 放化疗、手术 | OS | >0.05 | 7 |
| Makino等[75]2010 | 日本 | 64 | PCR/IHC | 20/44 | 放化疗、手术 | OS | >0.05 | 6 |
| Cheng等[68]2009 | 台湾 | 119 | IHC | 61/58 | 手术 | 5年生存率 | >0.05 | 7 |
| Nam等[67]2008 | 韩国 | 51 | IHC | 14/37 | 放化疗 | 2年生存率 | >0.05 | 7 |
| Hsu等[66]2008 | 台湾 | 68 | IHC | 43/25 | 手术 | 5年生存率 | >0.05 | 6 |
| Inoue等[65]2008 | 日本 | 65 | IHC/PCR | 39/26 | 手术 | OS | >0.05 | 7 |
| kii等[62]2007 | 日本 | 51 | IHC | 17/34 | 放化疗 | OS | >0.05 | 6 |
| Han等[61]2007 | 土耳其 | 40 | IHC | 20/20 | 手术 | OS | >0.05 | 7 |
| Okumura等[57]2006 | 日本 | 222 | IHC | 104/118 | 手术 | OS、DFS | >0.05 | 8 |
| Kunisaki等[56]2006 | 日本 | 41 | PCR | 25/16 | 放化疗 | OS | >0.05 | 8 |
| Gibault等[54]2005 | 法国 | 107 | IHC | 71/36 | 手术、放化疗 | OS | >0.05 | 6 |
| Matsumoto等[51]2004 | 日本 | 137 | IHC | 90/47 | 手术 | OS | >0.05 | 7 |
| Takeuchi等[52]2004 | 日本 | 90 | IHC | 47/43 | 手术 | OS | >0.05 | 7 |
| Cao等[53]2004 | 中国 | 92 | IHC/PCR | 47/45 | 手术 | 5年生存率 | <0.05 | 7 |
| Rosa等[48]2003 | 巴西 | 47 | IHC | 25/22 | 手术 | OS、5年生存率 | >0.05 | 7 |
| Kishi等[47]2003 | 日本 | 150 | IHC | 101/49 | 手术 | OS | >0.05 | 7 |
| Güner等[46]2003 | 德国 | 53 | IHC/PCR | 39/14 | 手术 | OS | >0.05 | 6 |
| Shimada等[36]2002 | 日本 | 52 | IHC | 30/22 | 放化疗 | 5年生存率 | >0.05 | 7 |
| Takeno等[40]2002 | 德国 | 71 | IHC | 45/26 | 手术 | OS | >0.05 | 8 |
| Liu等[37]2002 | 中国 | 50 | IHC | 22/28 | 手术 | / | / | 6 |
| Shinohara等[41]2002 | 日本 | 114 | IHC | 81/33 | 手术 | OS | >0.05 | 6 |
| Ahn等[35]2002 | 韩国 | 79 | IHC | 41/38 | 手术 | 0S | >0.05 | 7 |
| Noguchi等[39]2002 | 德国 | 71 | IHC | 45/26 | 手术 | OS | >0.05 | 7 |
| Makoto等[38]2002 | 日本 | 96 | IHC | 44/52 | 手术 | 5年生存率 | >0.05 | 6 |
| Kato等[31]2001 | 日本 | 89 | IHC | 49/40 | 手术 | 5年生存率 | >0.05 | 7 |
| Hsia等[34]2001 | 台湾 | 40 | IHC | 29/11 | 手术 | 5年生存率 | >0.05 | 6 |
| Okuda等[30]2001 | 日本 | 57 | PCR | 43/14 | 手术 | OS | >0.05 | 7 |
| Koide等[32]2001 | 日本 | 60 | IHC | 37/23 | 手术 | / | / | 7 |
| Chino等[33]2001 | 日本 | 77 | IHC | 54/23 | 手术 | / | / | 7 |
| Ikeguchi等[29]2000 | 日本 | 191 | IHC | 112/79 | 手术 | 5年生存率 | >0.05 | 6 |
| Natsugoe等[20]1999 | 日本 | 111 | IHC | 47/64 | 手术 | 5年生存率 | >0.05 | 7 |
| Shimada等[26]1999 | 日本 | 116 | IHC | 50/66 | 手术、放化疗 | OS | >0.05 | 8 |
| Lam等[23]1999 | 香港 | 153 | IHC | 98/55 | 手术 | OS | >0.05 | 8 |
| Hirai等[27]1999 | 日本 | 64 | IHC | 31/33 | 手术、放化疗 | OS | >0.05 | 8 |
| Kanamoto等[28]1999 | 日本 | 239 | IHC | 115/124 | 手术 | OS | >0.05 | 8 |
| Ikeda等[19]1999 | 日本 | 53 | IHC | 38/15 | 手术 | 5年生存率 | <0.05 | 7 |
| Hashimoto等[21]1999 | 日本 | 71 | IHC | 47/24 | 手术、放化疗 | OS | >0.05 | 7 |
| Nita等[22]1999 | 巴西 | 62 | IHC | 31/31 | 手术 | 3、5年生存率 | >0.05 | 6 |
| Inada等[25]1999 | 日本 | 40 | IHC | 21/19 | 手术 | 5年生存率 | >0.05 | 7 |
| Kobayashi等[24]1999 | 日本 | 42 | PCR | 14/28 | 手术 | 5年生存率 | >0.05 | 8 |
| Ishikawa等[12]1997 | 日本 | 73 | IHC/PCR | 36/37 | 手术 | / | / | 7 |
| Chanvitan等[11]1995 | 加拿大 | 80 | IHC | 40/40 | 手术 | OS | <0.05 | 8 |
| Nakamura等[10]1995 | 日本 | 61 | IHC/PCR | 32/29 | 手术 | OS | <0.05 | 5 |
| Sarbia等[8]1994 | 德国 | 204 | IHC | 137/67 | 手术 | OS | >0.05 | 7 |
| Wang等[9]1994 | 中国 | 100 | IHC | 65/35 | 手术 | 3、10年生存率 | <0.05 | 7 |
| 陈少平等[91]2014 | 中国 | 102 | IHC | 56/46 | 手术 | OS | >0.05 | 7 |
| 宁忠华等[92]2014 | 中国 | 222 | IHC | 123/99 | 手术、放疗 | 5年生存率 | <0.05 | 8 |
| 童永平[90]2014 | 中国 | 154 | IHC | 88/66 | 手术 | / | / | 7 |
| 李俭杰等[83]2012 | 中国 | 96 | IHC | 47/49 | 手术 | 5年生存率 | P>0.05 | 6 |
| 阿不力孜等[82]2012 | 中国 | 50 | IHC | 19/31 | 手术 | / | / | 6 |
| 罗永富[81]2011 | 中国 | 66 | IHC | 32/34 | 手术 | 5年生存率 | >0.05 | 7 |
| 黄俊辉等[77]2010 | 中国 | 62 | IHC | 30/32 | 手术 | / | / | 6 |
| 犹东等[76]2010 | 中国 | 56 | IHC | 32/24 | 手术 | OS | >0.05 | 7 |
| 杨胜利等[71]2009 | 中国 | 85 | IHC | 38/47 | 手术 | / | / | 8 |
| 苗战会等[70]2009 | 中国 | 62 | IHC | 30/32 | 手术 | / | / | 7 |
| 杨含金等[69]2009 | 中国 | 53 | IHC | 34/19 | 手术 | 3、5年生存率 | >0.05 | 7 |
| 刘立刚等[64]2007 | 中国 | 100 | IHC | 44/56 | 手术 | / | / | 7 |
| 薛丽燕等[63]2007 | 中国 | 116 | IHC | 43/73 | 手术 | 5年生存率 | >0.05 | 7 |
| 杨宣琴等[58]2006 | 中国 | 56 | IHC/PCR | 34/22 | 手术 | 3年生存率 | <0.05 | 7 |
| 李超霞等[60]2006 | 中国 | 85 | IHC | 60/25 | 手术 | / | / | 7 |
| 王忠明等[59]2006 | 中国 | 50 | IHC | 37/13 | 手术 | / | / | 6 |
| 马锴等[55]2005 | 中国 | 60 | IHC | 39/21 | 手术 | / | / | 6 |
| 郑毓任等[49]2003 | 中国 | 43 | IHC | 29/14 | 手术 | / | / | 6 |
| 高琨等[50]2003 | 中国 | 69 | IHC | 33/36 | / | / | / | 5 |
| 孙瑞清等[42]2002 | 中国 | 94 | IHC | 62/32 | 手术 | 5年生存率 | <0.05 | 5 |
| 柳德斌等[44]2002 | 中国 | 76 | IHC | 46/30 | 手术 | / | / | 7 |
| 柳宏等[43]2002 | 中国 | 56 | IHC | 27/29 | 手术 | 5年生存率 | >0.05 | 7 |
| 陈守惠等[45]2002 | 中国 | 112 | IHC | 49/63 | 手术 | 3年生存率 | <0.05 | 7 |
| 谢德荣等[17]1999 | 中国 | 63 | IHC | 39/24 | 手术 | OS | <0.05 | 6 |
| 王建芳等[18]1999 | 中国 | 80 | IHC | 46/34 | 手术 | 5年生存率 | <0.05 | 6 |
| 张惠忠等[16]1999 | 中国 | 65 | IHC | 39/26 | 手术 | 1年生存率 | >0.05 | 8 |
| 金玲等[14]1998 | 中国 | 117 | IHC | 69/48 | 手术 | 3年生存率 | >0.05 | 5 |
| 陈志坚等[15]1998 | 中国 | 64 | IHC | 37/27 | 放疗 | 5年生存率 | >0.05 | 7 |
| 廖琼等[13]1998 | 中国 | 181 | IHC | 85/96 | / | 2年生存率 | >0.05 | 7 |
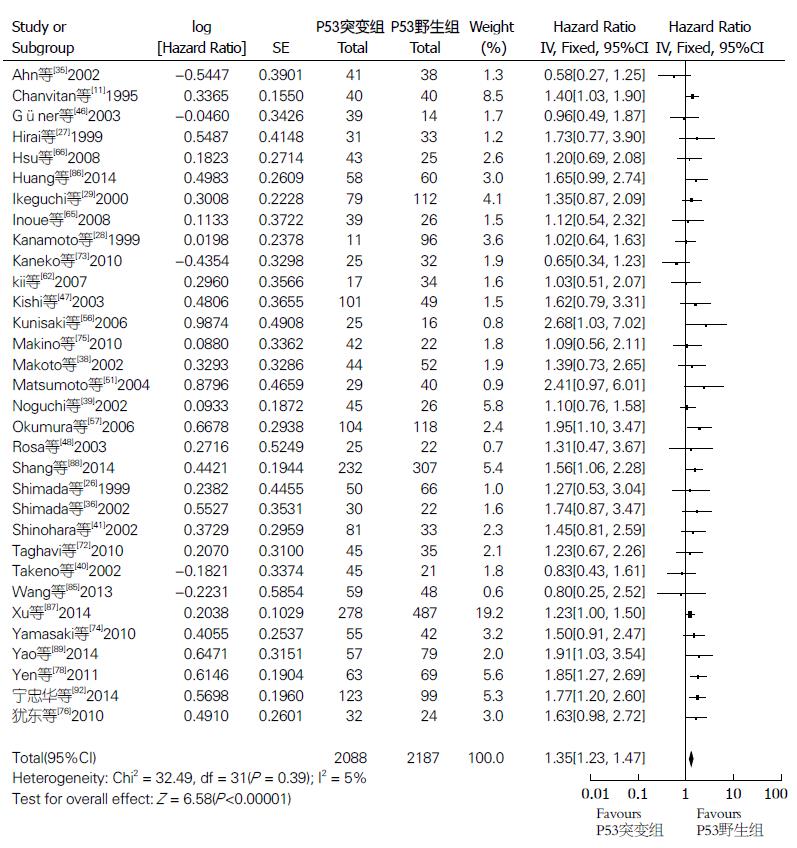
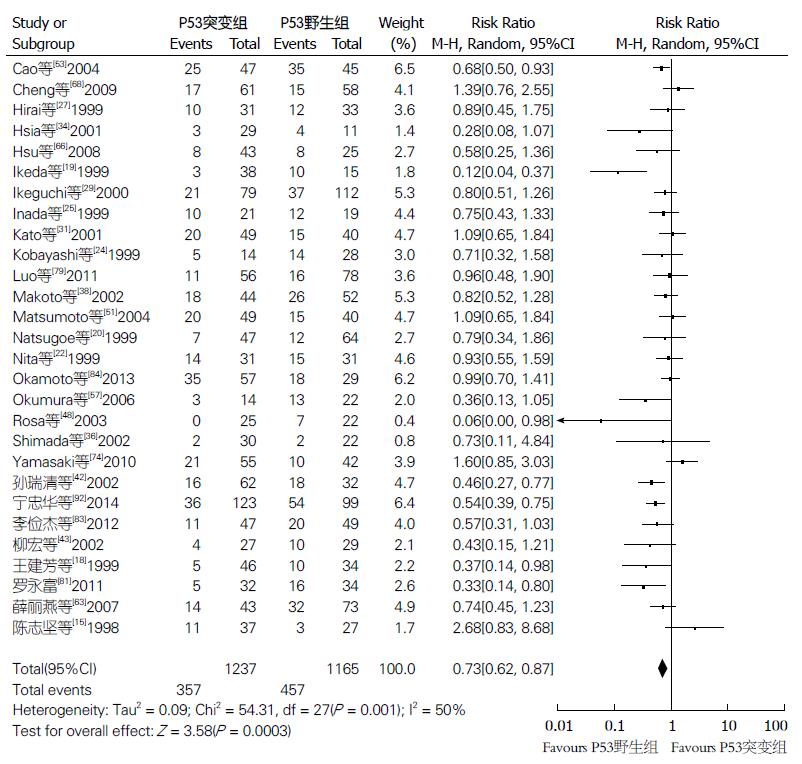
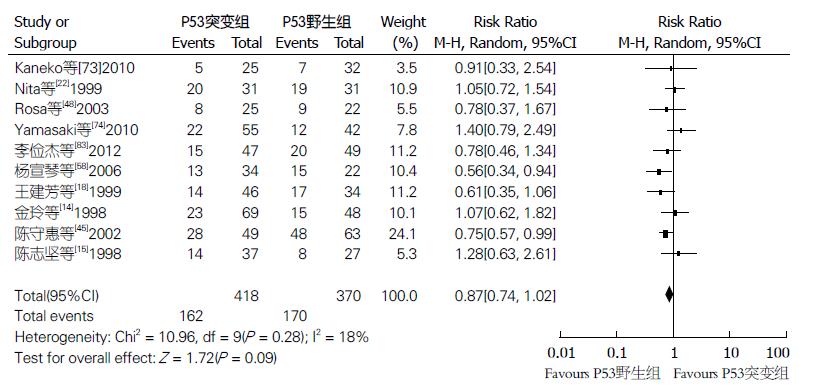
2.3.1 预后指标: (1)OS: 共32项研究4275例(研究组2088例, 对照组2187例)给出OS的HR或多/单因素分析值, 综合的HR值为1.35(95%CI: 1.23-1.47, P<0.00001, 异质性P = 0.39, I2 = 5%), 研究间异质性较小, 采用固定效应模型分析. 结果显示p53基因突变或蛋白过表达ESCC患者较对照组总生存期明显缩短, 预后更差(图2); (2)5年生存率: 共28项研究2402例(研究组1237例, 对照组1165例)给出5年生存率值, 综合的RR值0.73(95%CI: 0.62-0.87, P = 0.0003, 异质性P = 0.001, I2 = 50%), 研究间异质性较大, 采用随机效应模型分析. 结果显示, 研究组5年生存率明显低于对照组, 差别有统计学意义(图3); (3)3年生存率: 10项研究788例(研究组418例, 对照组370例)给出3年生存率值, 结果显示, 两组间差异无统计学意义(RR = 0.87, 95%CI: 0.74-1.02, P = 0.09, 异质性P = 0.28, I2 = 18%), 研究间异质性较小, 采用固定效应模型(图4).
2.3.2 p53基因突变或蛋白过表达与患者临床病理特征间关系: (1)与T分期关系: 38项研究4724例(研究组2353例, 对照组2371例)报道了P53状态与T分期关系, 将T1+T2及T3+T4分期分别研究. 结果显示P53突变或蛋白过表达的食管鳞癌患者T3+T4比例较对照组高(RR = 1.09, 95%CI: 1.03-1.15, P = 0.004, 异质性P = 0.03, I2 = 33%); T1+T2分期在研究组的比例较对照组低(RR = 0.86, 95%CI: 0.80-0.93, P<0.0001, 异质性P = 0.19, I2 = 16%). 根据异质性大小, 分别采用随机和固定效应模型分析; (2)与N分期关系: 53项研究5860例(研究组2970例, 对照组2890例)报道了P53状态与N分期关系. 结果显示研究组淋巴结阳性的比例较对照组明显高, RR值为1.24(95%CI: 1.15-1.34, P<0.00001, 异质性P<0.0001, I2 = 48%), 研究间异质性较大, 采用随机效应模型分析; (3)与M分期关系: 16项研究1564例(研究组885例, 对照组679例)报道了P53状态与M分期关系. 结果显示研究组患者远处转移比例较对照组高(RR = 1.65, 95%CI: 1.37-2.00, P<0.00001, 异质性P = 0.42, I2 = 3%). 研究间异质性较小, 采用固定效应模型分析; (4)与TNM分期关系: 29项研究3751例(研究组1754例, 对照组1997例)报道了P53状态与TNM分期关系, 将Ⅰ+Ⅱ期及Ⅲ+Ⅳ期分别研究. 结果显示研究组Ⅲ+Ⅳ期患者比例较对照组高(RR = 1.25, 95%CI: 1.14-1.36, P<0.00001, 异质性P = 0.01, I2 = 41%); Ⅰ+Ⅱ期比例低于对照组(RR = 0.79, P<0.00001, 异质性P = 0.33, I2 = 9%). 根据异质性, 分别采用随机和固定效应模型分析; (5)与分化程度关系: 将G1及≥G2分别研究, 分别有47项研究5740例、48项研究5807例报道了该指标, 结果显示研究组肿瘤分化程度≥G2比例明显高于对照组(RR = 1.06, 95%CI: 1.01-1.12, P = 0.03, 异质性P<0.0003, I2 = 53%); G1比例低于对照组(RR = 0.89, 95%CI: 0.80-0.99, P = 0.03, 异质性P = 0.001, I2 = 43%), 研究间异质性较大, 采用随机效应模型分析; (6)与血管侵犯关系: 9项研究综合RR值为1.09(95%CI: 0.95-1.24, P = 0.22, 异质性P = 0.26, I2 = 21%), 结果显示, P53状态与血管侵犯之间无明显相关性, 研究间异质性较小, 采用固定效应模型分析; (7)与肿瘤位置关系: 20项研究报道P53状态与肿瘤位置关系. 可提取的数据中, 肿瘤位于上、中、下段者分别为16项(RR = 1.02, P = 0.87)、16项(RR = 0.93, P = 0.06)、20项(RR = 1.08, P = 0.08). 结果显示, 两者间无明显相关性, 研究间异质性均较小, 采用固定效应模型; (8)与肿瘤大小的关系: 分别有12项和8项研究报道P53状态与肿瘤直径5 cm(>5 cm RR = 1.03, P = 0.49;<5 cm RR = 0.99, P = 0.76)和3 cm(>3 cm RR = 1.25, P = 0.18;<3 cm RR = 0.70, P = 0.21)的关系, 结果显示, P53状态与肿瘤直径大小无明显相关性. 根据异质性的大小采用固定和随机效应模型; (9)与性别、年龄关系: 35项研究报道P53状态与患者性别关系, 统计分析显示, 两者之间无明显相关性. 本研究将60岁年龄作为分界线, 10项研究可提取数据, 综合的数据显示P53状态与患者年龄无明显相关性. 以上研究间异质性均较小, 采用固定效应模型(表2).
| 临床病理特征 | n | 研究/对照组 | R r值 | 95%CI | P值 | 异质性P值 | 异质性I2(%) | 效应模型 |
| T分期 | ||||||||
| T1+T2 | 38 | 2353/2371 | 0.86 | 0.80-0.93 | <0.0001 | 0.19 | 16 | 固定效应 |
| T3+T4 | 38 | 2353/2371 | 1.09 | 1.03-1.15 | 0.004 | 0.03 | 33 | 随机效应 |
| N分期 | ||||||||
| n = 0 | 53 | 2970/2890 | 0.79 | 0.73-0.86 | <0.00001 | <0.0001 | 51 | 随机效应 |
| N≥1 | 53 | 2970/2890 | 1.24 | 1.15-1.34 | <0.00001 | <0.0001 | 48 | 随机效应 |
| M分期 | ||||||||
| M = 0 | 16 | 885/679 | 0.89 | 0.84-0.94 | <0.0001 | 0.16 | 26 | 固定效应 |
| M =1 | 16 | 885/679 | 1.65 | 1.37-2.00 | <0.00001 | 0.42 | 3 | 固定效应 |
| TNM分期 | ||||||||
| Ⅰ+Ⅱ | 29 | 1754/1997 | 0.79 | 0.74-0.85 | <0.00001 | 0.33 | 9 | 固定效应 |
| Ⅲ+Ⅳ | 29 | 1754/1997 | 1.25 | 1.14-1.36 | <0.00001 | 0.01 | 41 | 随机效应 |
| 分化程度 | ||||||||
| G1 | 47 | 2877/2863 | 0.89 | 0.80-0.99 | 0.03 | 0.001 | 43 | 随机效应 |
| G≥2 | 48 | 2919/2888 | 1.06 | 1.01-1.12 | 0.03 | <0.0001 | 53 | 随机效应 |
| 肿瘤位置 | ||||||||
| 上段 | 16 | 959/988 | 1.02 | 0.84-1.23 | 0.87 | 0.99 | 0 | 固定效应 |
| 中段 | 16 | 973/1006 | 0.93 | 0.86-1.00 | 0.06 | 0.51 | 0 | 固定效应 |
| 下段 | 20 | 1413/1656 | 1.08 | 0.99-1.17 | 0.08 | 0.30 | 13 | 固定效应 |
| 肿瘤大小(cm) | ||||||||
| >5 | 12 | 1044/1223 | 1.03 | 0.94-1.13 | 0.49 | 0.92 | 0 | 固定效应 |
| <5 | 12 | 1044/1223 | 0.99 | 0.91-1.07 | 0.76 | 0.63 | 0 | 固定效应 |
| >3 | 8 | 321/330 | 1.25 | 0.90-1.72 | 0.18 | <0.00001 | 83 | 随机效应 |
| <3 | 8 | 321/330 | 0.70 | 0.40-1.22 | 0.21 | <0.00001 | 86 | 随机效应 |
| 血管侵犯 | 9 | 750/928 | 1.09 | 0.95-1.24 | 0.22 | 0.26 | 21 | 固定效应 |
| 性别 | ||||||||
| 男 | 35 | 2086/2218 | 1.01 | 0.98-1.04 | 0.56 | 0.88 | 0 | 固定效应 |
| 女 | 35 | 2080/2212 | 0.97 | 0.86-1.08 | 0.56 | 0.90 | 0 | 固定效应 |
| 年龄(岁) | ||||||||
| <60 | 10 | 411/406 | 0.94 | 0.86-1.03 | 0.61 | 0.22 | 24 | 固定效应 |
| ≥60 | 10 | 411/406 | 1.04 | 0.90-1.19 | 0.61 | 0.18 | 29 | 固定效应 |
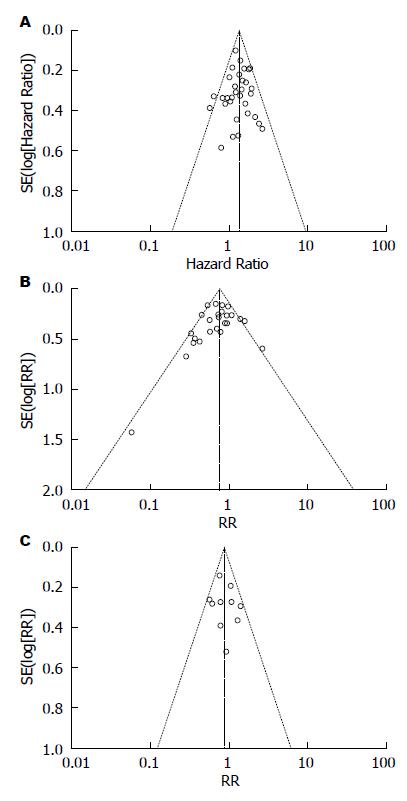
对纳入研究的OS、5年生存率、3年生存率指标行漏斗图检测发表偏倚, 结果显示漏斗图两侧基本对称, 无明显发表偏倚, 具体如图5.
P53与ESCC预后的关系是食管癌中研究最多的分子标志物之一. 本研究依据严格的纳入及排除标准, 对纳入的85篇研究进行综合评估, 结果显示p53基因突变或蛋白过表达的ESCC较对照组总生存期更短(HR = 1.35, P<0.00001), 5年生存率更低(RR = 0.73, P = 0.0003). 至于3年生存率在两组间未见统计学差异(RR = 0.87, P = 0.09), 考虑可能与随访时间较短, 生存差异尚未显现有关. P53突变患者肿瘤浸润深度(P = 0.004)及TNM分期(P<0.00001)较对照组更差, 淋巴结转移(P<0.00001)及远处转移(P<0.00001)率较对照组更高, 分化程度(P = 0.03)较对照组更差, 更进一步支持其与预后之间的关系; 但肿瘤的血管侵犯、部位、大小及患者的年龄与性别在研究组和对照组间未见明显统计学差异. 2013年, 在Chen等[93]进行的一篇13个食管癌预后分子靶标荟萃分析报告中, P53状态与食管癌预后的联系, 结果与本文一致. 不过, 作者仅纳入31篇原始文献, 并未纳入作为食管癌高发区中国的研究文献, 且无系统评价研究P53与临床病理特征间的关系. 就P53状态与肿瘤预后联系的研究结果, 本研究还与其他类似研究基本一致. Pharoah等[94]研究P53与乳腺癌的Meta分析显示突变型P53与差的预后有明显相关性; Mitsudomi等[95]进行的Meta分析显示P53突变的患者是肺腺癌预后的标志物之一, 但在肺鳞癌中与预后无明显相关性.
针对突变型p53基因治疗为一种有效抗肿瘤手段. 常用腺病毒介导野生型p53基因载体有Advexin 、Gendicine和SCH-58500, 在食管癌[8]、头颈部肿瘤[96]等的研究, 无论单药治疗还是与化疗联合使用, 均显示有一定临床疗效. 且除了发热常见, 未见其他严重不良反应. 作用机制除了针对细胞凋亡途径发挥作用, 还有"旁观者效应", 即抑制血管生成因子表达以及增加抗血管因子表达, 从而抑制肿瘤新生血管生成[97]. 但目前基因治疗在食管癌中研究相对较少, 安全性和有效性仍需进一步证实.
本文所纳入研究对P53状态的检测包括p53基因突变或蛋白异常表达, 但不同研究间检测的基因序列或蛋白阳性定义不同. 部分研究检测外显子4-9, 有些检测外显子5-8, 只有1篇研究[80]检测外显子2-11, 而该研究显示, 检测外显子5-9时P53的突变率在47.4%, 而检测2-11时突变率增加至60.6%, 说明不同检测位点会影响P53的突变率. 同时, 不同研究间对P53蛋白过表达或阳性的"截点"定义不同, 多数研究定义为检测时蛋白染色超过10%, 有些为染色超过20%, 但有研究[67,87]定义蛋白染色超过50%为阳性, 故两者的阳性率均偏低(分别为27.5%、36.7%). 而同时检测p53基因突变或蛋白过表达的研究[65,80]显示, p53基因突变和蛋白表达之间存在一定差异, 相关性并不高.
P53突变患者血清P53抗体也会升高, 研究显示血清P53抗体升高与食管癌的复发转移及预后有明显相关性[98]. 血清P53抗体检测简便、可复制, 是一种简便、易实施、易获得大量标本检测P53状态方式, 值得进一步探讨.
本研究文献主要来自于亚洲地区, 均为回顾性研究, 同时P53检测标准存在不一致性, 因此, 证据的应用需谨慎. 未来研究应注意采用相对统一的P53检测标准、随访时间及评估标准; 同时给出详细的方法学及相关数据; 进一步扩大研究样本量, 尽可能实施多中心、前瞻性研究.
总之, 本研究结果显示P53与食管鳞癌患者的预后、分期及分化程度之间存在明显相关性. 鉴于p53基因治疗在食管癌及其他肿瘤治疗中显示的作用, P53状态对食管鳞癌的预后评估及治疗有较大的指导价值, 但考虑到部分研究存在的不足, 尚需大规模、高质量的研究进一步验证.
我国属于食管癌的高发区, 年发病率居恶性肿瘤的第5位, 年死亡率居第4位. 食管癌预后较差, 5年生存率不到20%. P53是目前研究最多的分子标志物之一, 但目前研究显示P53状态与食管鳞癌的预后及临床病理特征间关系存在不一致结论, 故行该研究进一步明确.
吕宾, 教授, 浙江中医药大学附属医院(浙江省中医院)
探寻食管癌预后、疗效评估相关预测因子, 为制定相应的临床干预措施提供思路, 是提升其临床疗效的切入点之一. P53作为研究热点之一, 大量研究探讨了其与食管癌预后、疗效的关系以及p53基因治疗的可行性.
Xu等纳入830例中国患者的研究显示P53蛋白表达阳性的食管鳞癌患者OS及PFS更差, 同时淋巴结转移率更高, 肿瘤分化程度更差. Murata等对266例日本患者的研究显示P53与食管鳞癌的预后及与TNM分期, 病理学分级等均无明显相关性.
本文严格遵守系统评价标准, 对国内外已发表的大量相关文献(85篇)进行系统、客观的质量评估及数据处理, 得出准确可靠的结论, 为临床决策提供有价值的参考依据.
P53突变或蛋白表达异常是食管鳞癌预后不良的标志物之一. 同时, P53与TNM分期及肿瘤分化程度的关系进一步支持其与预后的关系. P53在食管癌预后、疗效预测及治疗中有较大的指导价值, 值得进一步探讨.
异质性: 广义上的异质性用于描述参与试验的干预措施和多个研究测量结果的变异, 即各研究的内在真实性变异, 包括临床异质性、方法学异质性、统计学异质性; 狭义上的专指统计学异质性, 用于描述多个研究中效应量的变异程度, 也可以用于描述除偶然机会外, 多个研究间存在的差异.
本文评价了有关食管鳞癌P53突变与否与预后及临床病理特征的文献, 所评述的文献较多, 采用的系统评价方法得当, 论文表述较好, 结果可信.
编辑: 于明茜 电编:闫晋利
| 1. | Torre LA, Bray F, Siegel RL, Ferlay J, Lortet-Tieulent J, Jemal A. Global cancer statistics, 2012. CA Cancer J Clin. 2015;65:87-108. [PubMed] [DOI] |
| 2. | Tang WR, Fang JY, Wu KS, Shi XJ, Luo JY, Lin K. Epidemiological characteristics and prediction of esophageal cancer mortality in China from 1991 to 2012. Asian Pac J Cancer Prev. 2014;15:6929-6934. [PubMed] |
| 3. | Kim T, Grobmyer SR, Smith R, Ben-David K, Ang D, Vogel SB, Hochwald SN. Esophageal cancer--the five year survivors. J Surg Oncol. 2011;103:179-183. [PubMed] [DOI] |
| 4. | Leroy B, Anderson M, Soussi T. TP53 mutations in human cancer: database reassessment and prospects for the next decade. Hum Mutat. 2014;35:672-688. [PubMed] [DOI] |
| 5. | Zhang SS, Huang QY, Yang H, Xie X, Luo KJ, Wen J, Cai XL, Yang F, Hu Y, Fu JH. Correlation of p53 status with the response to chemotherapy-based treatment in esophageal cancer: a meta-analysis. Ann Surg Oncol. 2013;20:2419-2427. [PubMed] [DOI] |
| 6. | Shimada H, Matsubara H, Shiratori T, Shimizu T, Miyazaki S, Okazumi S, Nabeya Y, Shuto K, Hayashi H, Tanizawa T. Phase I/II adenoviral p53 gene therapy for chemoradiation resistant advanced esophageal squamous cell carcinoma. Cancer Sci. 2006;97:554-561. [PubMed] [DOI] |
| 7. | Stang A. Critical evaluation of the Newcastle-Ottawa scale for the assessment of the quality of nonrandomized studies in meta-analyses. Eur J Epidemiol. 2010;25:603-605. [PubMed] [DOI] |
| 8. | Sarbia M, Porschen R, Borchard F, Horstmann O, Willers R, Gabbert HE. p53 protein expression and prognosis in squamous cell carcinoma of the esophagus. Cancer. 1994;74:2218-2223. [PubMed] |
| 9. | Wang DY, Xiang YY, Tanaka M, Li XR, Li JL, Shen Q, Sugimura H, Kino I. High prevalence of p53 protein overexpression in patients with esophageal cancer in Linxian, China and its relationship to progression and prognosis. Cancer. 1994;74:3089-3096. [PubMed] |
| 10. | Nakamura T, Ide H, Eguchi R, Hayashi K, Hanyu F, Nagasako K, Yukawa M, Asaka K, Fujimori T, Maeda S. Expression of p53 protein related to human papillomavirus and DNA ploidy in superficial esophageal carcinoma. Surg Today. 1995;25:591-597. [PubMed] |
| 11. | Chanvitan A, Nekarda H, Casson AG. Prognostic value of DNA index, S-phase fraction and p53 protein accumulation after surgical resection of esophageal squamous-cell carcinomas in Thailand. Int J Cancer. 1995;63:381-386. [PubMed] |
| 12. | Ishikawa T, Furihata M, Ohtsuki Y, Ono H, Inoue A, Ogoshi S. Aberrant expression of p53 and retinoblastoma gene products in human esophageal squamous cell carcinoma. Int J Oncol. 1997;11:1109-1114. [PubMed] |
| 19. | Ikeda G, Isaji S, Chandra B, Watanabe M, Kawarada Y. Prognostic significance of biologic factors in squamous cell carcinoma of the esophagus. Cancer. 1999;86:1396-1405. [PubMed] |
| 20. | Natsugoe S, Nakashima S, Matsumoto M, Xiangming C, Okumura H, Kijima F, Ishigami S, Takebayashi Y, Baba M, Takao S. Expression of p21WAF1/Cip1 in the p53-dependent pathway is related to prognosis in patients with advanced esophageal carcinoma. Clin Cancer Res. 1999;5:2445-2449. [PubMed] |
| 21. | Hashimoto N, Tachibana M, Dhar DK, Yoshimura H, Nagasue N. Expression of p53 and RB proteins in squamous cell carcinoma of the esophagus: their relationship with clinicopathologic characteristics. Ann Surg Oncol. 1999;6:489-494. [PubMed] |
| 22. | Nita ME, Nagawa H, Tominaga O, Tsuno N, Hatano K, Kitayama J, Tsuruo T, Domene CE, Muto T. p21Waf1/Cip1 expression is a prognostic marker in curatively resected esophageal squamous cell carcinoma, but not p27Kip1, p53, or Rb. Ann Surg Oncol. 1999;6:481-488. [PubMed] |
| 23. | Lam KY, Law S, Tin L, Tung PH, Wong J. The clinicopathological significance of p21 and p53 expression in esophageal squamous cell carcinoma: an analysis of 153 patients. Am J Gastroenterol. 1999;94:2060-2068. [PubMed] |
| 24. | Kobayashi S, Koide Y, Endo M, Isono K, Ochiai T. The p53 gene mutation is of prognostic value in esophageal squamous cell carcinoma patients in unified stages of curability. Am J Surg. 1999;177:497-502. [PubMed] |
| 25. | Inada S, Koto T, Futami K, Arima S, Iwashita A. Evaluation of malignancy and the prognosis of esophageal cancer based on an immunohistochemical study (p53, E-cadherin, epidermal growth factor receptor). Surg Today. 1999;29:493-503. [PubMed] |
| 26. | Shimada Y, Imamura M, Watanabe G, Uchida S, Harada H, Makino T, Kano M. Prognostic factors of oesophageal squamous cell carcinoma from the perspective of molecular biology. Br J Cancer. 1999;80:1281-1288. [PubMed] [DOI] |
| 27. | Hirai T, Kuwahara M, Yoshida K, Osaki A, Toge T. The prognostic significance of p53, p21 (Waf1/Cip1), and cyclin D1 protein expression in esophageal cancer patients. Anticancer Res. 1999;19:4587-4591. [PubMed] |
| 28. | Kanamoto A, Kato H, Tachimori Y, Watanabe H, Nakanishi Y, Kondo H, Yamaguchi H, Gotoda T, Muro K, Matsumura Y. No prognostic significance of p53 expression in esophageal squamous cell carcinoma. J Surg Oncol. 1999;72:94-98. [PubMed] |
| 29. | Ikeguchi M, Oka S, Gomyo Y, Tsujitani S, Maeta M, Kaibara N. Combined analysis of p53 and retinoblastoma protein expressions in esophageal cancer. Ann Thorac Surg. 2000;70:913-917. [PubMed] |
| 30. | Okuda E, Osugi H, Morimura K, Takada N, Takemura M, Fukushima S, Higashino M, Kinoshita H. Detection of p53 gene mutations in human esophageal squamous cell carcinomas using a p53 yeast functional assay: possible difference in esophageal carcinogenesis between the young and the elderly group. Clin Cancer Res. 2001;7:600-606. [PubMed] |
| 31. | Kato H, Yoshikawa M, Miyazaki T, Nakajima M, Fukai Y, Tajima K, Masuda N, Tsukada K, Fukuda T, Nakajima T. Expression of p53 protein related to smoking and alcoholic beverage drinking habits in patients with esophageal cancers. Cancer Lett. 2001;167:65-72. [PubMed] |
| 32. | Koide N, Nishio A, Hiraguri M, Hanazaki K, Adachi W, Amano J. Coexpression of vascular endothelial growth factor and p53 protein in squamous cell carcinoma of the esophagus. Am J Gastroenterol. 2001;96:1733-1740. [PubMed] [DOI] |
| 33. | Chino O, Kijima H, Shimada H, Nishi T, Tanaka H, Kise Y, Kenmochi T, Himeno S, Machimura T, Tanaka M. Accumulation of p53 in esophageal squamous cell carcinoma. Int J Mol Med. 2001;8:359-363. [PubMed] |
| 34. | Hsia JY, Chen CY, Hsu CP, Shai SE, Yang SS, Chuang CY, Wang PY, Chen JT. Expression of apoptosis-regulating proteins p53, Bcl-2, and Bax in primary resected esophageal squamous cell carcinoma. Neoplasma. 2001;48:483-488. [PubMed] |
| 35. | Ahn MJ, Jang SJ, Park YW, Choi JH, Oh HS, Lee CB, Paik HK, Park CK. Clinical prognostic values of vascular endothelial growth factor, microvessel density,and p53 expression in esophageal carcinomas. J Korean Med Sci. 2002;17:201-207. [PubMed] |
| 36. | Shimada H, Hoshino T, Okazumi S, Matsubara H, Funami Y, Nabeya Y, Hayashi H, Takeda A, Shiratori T, Uno T. Expression of angiogenic factors predicts response to chemoradiotherapy and prognosis of oesophageal squamous cell carcinoma. Br J Cancer. 2002;86:552-557. [PubMed] [DOI] |
| 37. | Liu L G, Pan T C, Li J, Zhang M, Song D W, Hu M. The correlation of p53 and nm23-H1 expression with invasiveness and metastasis in esophageal carcinoma. Chinese-German Journal of Clinical Oncology. 2002;1:194-198. |
| 38. | Makoto O, Takeda A, Ting-Leig L, Shinnichi O, Hisahiro M, Yutaka F, Yoshihiro N, Kobayashi S, Gunji Y, Suzuki T. Prognostic significance of thymidine phosphorylase and p53 co-expression in esophageal squamous cell carcinoma. Oncol Rep. 2002;9:23-28. [PubMed] |
| 39. | Noguchi T, Takeno S, Shibata T, Uchida Y, Yokoyama S, Müller W. Expression of heat shock protein 70 in grossly resected esophageal squamous cell carcinoma. Ann Thorac Surg. 2002;74:222-226. [PubMed] |
| 40. | Takeno S, Noguchi T, Kikuchi R, Uchida Y, Yokoyama S, Müller W. Prognostic value of cyclin B1 in patients with esophageal squamous cell carcinoma. Cancer. 2002;94:2874-2881. [PubMed] [DOI] |
| 41. | Shinohara M, Aoki T, Sato S, Takagi Y, Osaka Y, Koyanagi Y, Hatooka S, Shinoda M. Cell cycle-regulated factors in esophageal cancer. Dis Esophagus. 2002;15:149-154. [PubMed] |
| 42. | 孙 瑞清, 王 永忠. 食管鳞状细胞癌中p53蛋白和PCNA表达的研究. 江苏大学学报(医学版). 2002;12:324-325. |
| 43. | 柳 宏, 陈 克能, 曹 晓哲, 赵 玉元. 同源盒基因PBX1和p53基因在食管鳞癌的表达及临床意义. 世界最新医学信息文摘. 2002;1:161-164. |
| 46. | Güner D, Sturm I, Hemmati P, Hermann S, Hauptmann S, Wurm R, Budach V, Dörken B, Lorenz M, Daniel PT. Multigene analysis of Rb pathway and apoptosis control in esophageal squamous cell carcinoma identifies patients with good prognosis. Int J Cancer. 2003;103:445-454. [PubMed] [DOI] |
| 47. | Kishi K, Doki Y, Yano M, Yasuda T, Fujiwara Y, Takiguchi S, Kim S, Higuchi I, Monden M. Reduced MLH1 expression after chemotherapy is an indicator for poor prognosis in esophageal cancers. Clin Cancer Res. 2003;9:4368-4375. [PubMed] |
| 48. | Rosa AR, Schirmer CC, Gurski RR, Meurer L, Edelweiss MI, Kruel CD. Prognostic value of p53 protein expression and vascular endothelial growth factor expression in resected squamous cell carcinoma of the esophagus. Dis Esophagus. 2003;16:112-118. [PubMed] |
| 51. | Matsumoto M, Furihata M, Kurabayashi A, Sasaguri S, Araki K, Hayashi H, Ohtsuki Y. Prognostic significance of serine 392 phosphorylation in overexpressed p53 protein in human esophageal squamous cell carcinoma. Oncology. 2004;67:143-150. [PubMed] [DOI] |
| 52. | Takeuchi H, Ozawa S, Shih CH, Ando N, Kitagawa Y, Ueda M, Kitajima M. Loss of p16INK4a expression is associated with vascular endothelial growth factor expression in squamous cell carcinoma of the esophagus. Int J Cancer. 2004;109:483-490. [PubMed] [DOI] |
| 53. | Cao W, Chen X, Dai H, Wang H, Shen B, Chu D, McAfee T, Zhang ZF. Mutational spectra of p53 in geographically localized esophageal squamous cell carcinoma groups in China. Cancer. 2004;101:834-844. [PubMed] [DOI] |
| 54. | Gibault L, Metges JP, Conan-Charlet V, Lozac'h P, Robaszkiewicz M, Bessaguet C, Lagarde N, Volant A. Diffuse EGFR staining is associated with reduced overall survival in locally advanced oesophageal squamous cell cancer. Br J Cancer. 2005;93:107-115. [PubMed] [DOI] |
| 56. | Kunisaki C, Imada T, Yamada R, Hatori S, Kinbara K, Watai K, Akiyama H, Nomura M, Matsuda G, Otsuka Y. Prognostic factors after chemoradiotherapy for patients with inoperable esophageal squamous cell carcinoma. Hepatogastroenterology. 2006;53:366-371. [PubMed] |
| 57. | Okumura H, Natsugoe S, Yokomakura N, Kita Y, Matsumoto M, Uchikado Y, Setoyama T, Owaki T, Ishigami S, Aikou T. Expression of p53R2 is related to prognosis in patients with esophageal squamous cell carcinoma. Clin Cancer Res. 2006;12:3740-3745. [PubMed] [DOI] |
| 61. | Han U, Can OI, Han S, Kayhan B, Onal BU. Expressions of p53, VEGF C, p21: could they be used in preoperative evaluation of lymph node metastasis of esophageal squamous cell carcinoma? Dis Esophagus. 2007;20:379-385. [PubMed] [DOI] |
| 62. | Kii T, Takiuchi H, Kawabe S, Gotoh M, Ohta S, Tanaka T, Kuwakado S, Nishitani H, Katsu K. Evaluation of prognostic factors of esophageal squamous cell carcinoma (stage II-III) after concurrent chemoradiotherapy using biopsy specimens. Jpn J Clin Oncol. 2007;37:583-589. [PubMed] [DOI] |
| 63. | 薛 丽燕, 任 立群, 罗 巍, 管 向军, 邹 霜梅, 郑 闪, 毕 蕊, 谢 永强, 何 祖根, 吕 宁. Fas、Fas配体、Fas相关死亡结构域蛋白、天冬氨酸特异性半胱氨酸蛋白酶8和突变型P53蛋白在食管鳞癌患者中的表达. 中华医学杂志. 2007;87:150-154. |
| 65. | Inoue A, Moriya H, Katada N, Tanabe S, Kobayashi N, Watanabe M, Okayasu I, Ohbu M. Intratumoral lymphangiogenesis of esophageal squamous cell carcinoma and relationship with regulatory factors and prognosis. Pathol Int. 2008;58:611-619. [PubMed] [DOI] |
| 66. | Hsu PK, Li AF, Wang YC, Hsieh CC, Huang MH, Hsu WH, Hsu HS. Reduced membranous beta-catenin protein expression is associated with metastasis and poor prognosis in squamous cell carcinoma of the esophagus. J Thorac Cardiovasc Surg. 2008;135:1029-1035. [PubMed] [DOI] |
| 67. | Nam TK, Lee JH, Cho SH, Chung IJ, Ahn SJ, Song JY, Yoon MS, Chung WK, Nah BS. Low hMLH1 expression prior to definitive chemoradiotherapy predicts poor prognosis in esophageal squamous cell carcinoma. Cancer Lett. 2008;260:109-117. [PubMed] [DOI] |
| 68. | Cheng TH, Hsu PK, Li AF, Hung IC, Huang MH, Hsu HS. Correlation of p53, MDM2 and p14(ARF) protein expression in human esophageal squamous cell carcinoma. J Cancer Res Clin Oncol. 2009;135:1577-1582. [PubMed] [DOI] |
| 70. | 苗 战会, 路 平, 陆 志红, 李 荣. p53蛋白在食管鳞癌中的表达及其临床病理参数关系. 医学信息(内、外科版). 2009;22:696-697. |
| 71. | 杨 胜利, 杨 明, 杨 劼, 徐 致祥, 古 卫权, 叶 国麟, 王 晋, 司 建华, 陈 少湖, 谭 家驹. Survivin与P53、Rb蛋白在我国南北高发区食管癌组织中的表达及其临床意义. 中国现代医学杂志. 2009;19:2258-2260. |
| 72. | Taghavi N, Biramijamal F, Sotoudeh M, Moaven O, Khademi H, Abbaszadegan MR, Malekzadeh R. Association of p53/p21 expression with cigarette smoking and prognosis in esophageal squamous cell carcinoma patients. World J Gastroenterol. 2010;16:4958-4967. [PubMed] |
| 73. | Kaneko K, Kumekawa Y, Makino R, Nozawa H, Hirayama Y, Kogo M, Konishi K, Katagiri A, Kubota Y, Muramoto T. EGFR gene alterations as a prognostic biomarker in advanced esophageal squamous cell carcinoma. Front Biosci (Landmark Ed). 2010;15:65-72. [PubMed] |
| 74. | Yamasaki M, Miyata H, Fujiwara Y, Takiguchi S, Nakajima K, Nishida T, Yasuda T, Matsuyama J, Mori M, Doki Y. p53 genotype predicts response to chemotherapy in patients with squamous cell carcinoma of the esophagus. Ann Surg Oncol. 2010;17:634-642. [PubMed] [DOI] |
| 75. | Makino T, Yamasaki M, Miyata H, Yoshioka S, Takiguchi S, Fujiwara Y, Nakajima K, Nishida T, Mori M, Doki Y. p53 Mutation status predicts pathological response to chemoradiotherapy in locally advanced esophageal cancer. Ann Surg Oncol. 2010;17:804-811. [PubMed] [DOI] |
| 78. | Yen CC, Tsao YP, Chen PC, Wu YC, Liu JH, Pan CC, Liu CY, Tzeng CH, Chen PM, Chen YJ. PML protein as a prognostic molecular marker for patients with esophageal squamous cell carcinomas receiving primary surgery. J Surg Oncol. 2011;103:761-767. [PubMed] [DOI] |
| 79. | Luo KJ, Hu Y, Wen J, Fu JH. CyclinD1, p53, E-cadherin, and VEGF discordant expression in paired regional metastatic lymph nodes of esophageal squamous cell carcinoma: a tissue array analysis. J Surg Oncol. 2011;104:236-243. [PubMed] [DOI] |
| 80. | Egashira A, Morita M, Yoshida R, Saeki H, Oki E, Sadanaga N, Kakeji Y, Tsujitani S, Maehara Y. Loss of p53 in esophageal squamous cell carcinoma and the correlation with survival: analyses of gene mutations, protein expression, and loss of heterozygosity in Japanese patients. J Surg Oncol. 2011;104:169-175. [PubMed] [DOI] |
| 84. | Okamoto H, Fujishima F, Nakamura Y, Zuguchi M, Ozawa Y, Takahashi Y, Miyata G, Kamei T, Nakano T, Taniyama Y. Significance of CD133 expression in esophageal squamous cell carcinoma. World J Surg Oncol. 2013;11:51. [PubMed] [DOI] |
| 85. | Wang ZB, Peng XZ, Chen SS, Ning FL, Du CJ, Wang K, Ma W, Cheng YF. High p53 and MAP1 light chain 3A co-expression predicts poor prognosis in patients with esophageal squamous cell carcinoma. Mol Med Rep. 2013;8:41-46. [PubMed] [DOI] |
| 86. | Huang K, Chen L, Zhang J, Wu Z, Lan L, Wang L, Lu B, Liu Y. Elevated p53 expression levels correlate with tumor progression and poor prognosis in patients exhibiting esophageal squamous cell carcinoma. Oncol Lett. 2014;8:1441-1446. [PubMed] [DOI] |
| 87. | Xu XL, Zheng WH, Tao KY, Li XX, Xu WZ, Wang Y, Zhu SM, Mao WM. p53 is an independent prognostic factor in operable esophageal squamous cell carcinoma: a large-scale study with a long follow-up. Med Oncol. 2014;31:257. [PubMed] [DOI] |
| 88. | Shang L, Liu HJ, Hao JJ, Jiang YY, Shi F, Zhang Y, Cai Y, Xu X, Jia XM, Zhan QM. A panel of overexpressed proteins for prognosis in esophageal squamous cell carcinoma. PLoS One. 2014;9:e111045. [PubMed] [DOI] |
| 89. | Yao W, Qin X, Qi B, Lu J, Guo L, Liu F, Liu S, Zhao B. Association of p53 expression with prognosis in patients with esophageal squamous cell carcinoma. Int J Clin Exp Pathol. 2014;7:7158-7163. [PubMed] |
| 92. | 宁 忠华, 裴 红蕾, 徐 国平, 韩 阳, 奚 丹, 黄 瑾. 增殖细胞核抗原、p53和Nm23的表达以及辅助放疗对进展期胸段食管鳞癌患者术后的预后影响. 肿瘤防治研究. 2014;41:1209-1214. |
| 93. | Chen J, Jiang P, Wang HJ, Zhang JY, Xu Y, Guo MH, Zhang B, Tang CY, Cao HY, Wang S. The efficacy of molecular subtyping in predicting postoperative recurrence in breast-conserving therapy: a 15-study meta-analysis. World J Surg Oncol. 2014;12:212. [PubMed] [DOI] |
| 94. | Pharoah PD, Day NE, Caldas C. Somatic mutations in the p53 gene and prognosis in breast cancer: a meta-analysis. Br J Cancer. 1999;80:1968-1973. [PubMed] [DOI] |
| 95. | Mitsudomi T, Hamajima N, Ogawa M, Takahashi T. Prognostic significance of p53 alterations in patients with non-small cell lung cancer: a meta-analysis. Clin Cancer Res. 2000;6:4055-4063. [PubMed] |
| 96. | Nemunaitis J, Nemunaitis J. Head and neck cancer: response to p53-based therapeutics. Head Neck. 2011;33:131-134. [PubMed] [DOI] |
| 97. | Tazawa H, Kagawa S, Fujiwara T. Advances in adenovirus-mediated p53 cancer gene therapy. Expert Opin Biol Ther. 2013;13:1569-1583. [PubMed] [DOI] |
| 98. | Blanchard P, Quero L, Pacault V, Schlageter MH, Baruch-Hennequin V, Hennequin C. Prognostic significance of anti-p53 and anti-KRas circulating antibodies in esophageal cancer patients treated with chemoradiotherapy. BMC Cancer. 2012;12:119. [PubMed] [DOI] |