修回日期: 2015-11-12
接受日期: 2015-11-24
在线出版日期: 2015-12-18
目的: 探讨胃肠道间质瘤(gastrointestinal stromal tumors, GISTs)中环氧合酶2(cyclooxygenase 2, COX2)基因的蛋白及mRNA表达与临床病理特征及预后之间的关系.
方法: 采用免疫组织化学EnVision两步法检测GISTs病例肿瘤组织中COX2蛋白的表达情况; 采用原位杂交方法检测GISTs中COX2 mRNA的表达情况; 并对患者进行随访.
结果: 74例GISTs中, COX2蛋白阳性表达62例, 阳性表达率为83.8%; COX2 mRNA阳性表达58例, 阳性表达率为78.4%. COX2蛋白及mRNA表达情况在GISTs不同危险度分组间比较差异有统计学意义(P<0.05), 在高危险度组中阳性表达率最高, 而在不同性别、年龄、发生部位、组织学类型及是否转移组间比较差异均无统计学意义(P>0.05). 38例患者获访, 随访率51.4%; COX2蛋白强阳性表达(+++)24例, 其中5例转移, 2例死亡; 其余阴性(-)、弱阳性(+)及中度阳性(++)表达病例均未发现复发、转移或死亡. COX2 mRNA强阳性表达(+++)17例, 其中3例转移, 2例死亡; 阴性表达(-)6例, 未发现复发、转移或死亡; 而弱阳性(+)及中度阳性(++)表达病例中均有1例发生转移, 未发现复发及死亡.
结论: GISTs中COX2蛋白及mRNA的表达上调提示COX2可作为评估GISTs危险度分级的另一潜在指标, 并且可能影响患者预后.
核心提示: 胃肠道间质瘤(gastrointestinal stromal tumors, GISTs), 可发生于不同部位, 形态多样, 生物学行为具有恶性潜能, 预后难以准确评估. 特征性免疫组织化学表现及基因改变能明确诊断, 并指导手术后进一步的靶向治疗.
引文著录: 李小红, 成元华, 郭立新. 胃肠道间质瘤中环氧合酶2基因的表达. 世界华人消化杂志 2015; 23(35): 5628-5635
Revised: November 12, 2015
Accepted: November 24, 2015
Published online: December 18, 2015
AIM: To investigate the correlation of cyclooxygenase 2 (COX2) protein and mRNA expression with clinicopathological characteristics and prognosis in gastrointestinal stromal tumors (GISTs).
METHODS: EnVision technique was used to detect COX2 protein expression in GISTs and in situ hybridization method was used to detect COX2 mRNA expression. The patients were followed for prognosis evaluation.
RESULTS: Of 74 cases of GISTs, positive expression of COX2 protein was observed in 62 (83.8%) cases and positive expression of COX2 mRNA was observed in 58 (78.4%). COX2 protein and mRNA expression between different risk groups was statistically significant (P < 0.05), with the highest positive expression in the high risk group. COX2 protein and mRNA expression had no significant correlation with gender, age, lesion location, histological type, or metastasis (P > 0.05). A total of 38 (51.4%) patients were followed; of 24 patients with strongly positive expression of COX2 protein, 5 had metastases and 2 died. No recurrence, metastasis or death was observed in cases with negative, weakly positive or moderately positive expression. Of 17 cases showing strongly positive expression of COX2 mRNA, 3 had metastases and 2 died. No recurrence, metastasis or death was found in all 6 cases with negative expression of COX2 mRNA. Metastasis was observed in a case with weekly positive expression and a case with moderately positive expression, with no recurrence or death.
CONCLUSION: Upregulation of COX2 protein and mRNA expression in GISTs suggests that COX2 is a possible indicator for GISTs risk stratification and might affect prognosis.
- Citation: Li XH, Cheng YH, Guo LX. Expression of cyclooxygenase 2 in gastrointestinal stromal tumors. Shijie Huaren Xiaohua Zazhi 2015; 23(35): 5628-5635
- URL: https://www.wjgnet.com/1009-3079/full/v23/i35/5628.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i35.5628
胃肠道间质瘤(gastrointestinal stromal tumors, GISTs)是消化系统最常见的间叶源性肿瘤. 可发生于不同部位, 主要发生于胃和小肠[1,2], 部分病例位于直肠及食道[3-5]. 除胃肠道外肿瘤还发生于腹腔内、盆腔、肠系膜或腹膜后[6-9], 也称胃肠道外间质瘤. GISTs形态多样, 生物学行为具有恶性潜能, 预后难以准确评估[10]. 环氧合酶(cyclooxygenase, COX)在前列腺素合成过程中发挥着重要作用, 目前将其分为COX1、COX2和COX3三个亚型[11]. COX1存在于大多数正常细胞, 在维持内环境稳定中起重要作用; COX3是COX1的同工酶, 其作用还有待进一步研究. COX2基因是一种诱生型基因, 在正常组织中检测不出, 只有接受相应刺激后细胞内才开始合成, 其表达上调常提示炎症或肿瘤的存在. 近年来研究[12,13]发现, 在多种肿瘤组织中COX2呈高表达, 表明COX2参与了多种肿瘤的发生发展, 但COX2在GISTs中的表达情况却鲜见报道. 本研究应用免疫组织化学方法及原位杂交方法分别检测了GISTs病例肿瘤组织中COX2基因的蛋白及mRNA表达情况, 以期了解COX2基因表达与GISTs病例临床病理特征及预后之间的关系.
收集2010-01/2015-03贵州医科大学附属医院病理科及2008-01/2009-12四川大学华西医院病理科保存的发生在胃肠道及腹腔并经组织形态学、免疫组织化学和/或分子生物学检测确诊的74例GISTs病例的蜡块及临床资料作为研究对象, 由两位高年资病理医师复查切片. 根据中国抗癌协会临床肿瘤学协作专业委员会(CSCO)胃肠道间质瘤专家委员会推荐的GISTs危险度分级标准[14], 分为四个组: 极低危险度组14例、低危险度组24例、中危险度组11例及高危险度组25例.
1.2.1 免疫组织化学: 采用免疫组织化学EnVision两步法进行染色, 多克隆COX2抗体购自美国CST公司, 稀释度1:500, 染色步骤按试剂盒说明书进行. 每次实验均设立相应的阳性对照, PBS液代替一抗作为空白对照.
1.2.2 原位杂交: 采用经地高辛标记的COX2寡核苷酸探针检测GISTs中mRNA的表达情况, 原位杂交试剂盒购自天津灏洋生物技术有限公司, 探针序列: (1)5'-GTCAAATCCCACACTCATACATACACCTCGG; (2)5'-CAGAAGGGGATGCCAGTGATAGAGGGTGTTA. 实验步骤严格按试剂盒说明书进行.
1.2.3 结果判定: COX2蛋白及mRNA阳性信号均定位于肿瘤细胞细胞质, 根据以下两方面的总分综合判定: A: 选10个高倍视野, 按阳性细胞所占百分比计分(0-3分): 无阳性细胞, 记0分;<25%, 记1分; 25%-50% , 记2分;>50%, 记3分. B: 按染色强度计分(0-3分): 不着色, 0分; 黄色, 1分; 棕黄色, 2分; 黄褐色, 3分. 将A和B两项评分相加, 0-1分为阴性(-), 2分为弱阳性(+), 3-4分为中度阳性(++), 5-6分为强阳性(+++).
1.2.4 随访: 对所有病例进行电话随访, 随访截止时间: 2015-04-30.
统计学处理 采用SPSS19.0统计软件, 分类资料进行χ2检验; 相关性采用Spearson相关性检验. P<0.05差异有统计学意义.
74例原发性GISTs中: 女性38例, 男性36例, 女:男 = 1.06:1; 年龄19-80岁, 中位年龄55岁. 肿瘤位于胃48例、肠17例和胃肠外9例; 发生于胃者最多见, 占64.9%, 其次为肠(23.0%). 梭形细胞为主型61例(82.4%)、上皮样细胞为主型7例(9.5%)和混合细胞型6例(8.1%). 极低危险度、低危险度及中危险度组中未见转移病例; 高危险度组中5例发生转移(转移至肝2例、淋巴结2例及肺1例), 2例死亡.
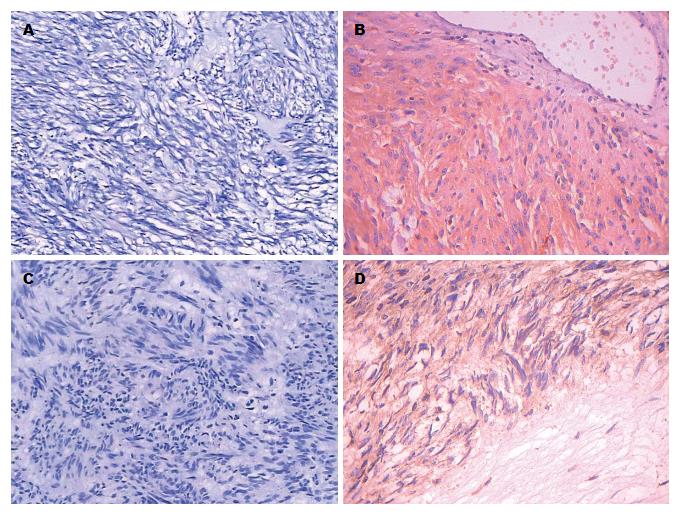
74例GISTs中COX2蛋白阳性表达62例(图1A, B), 阳性表达率为83.8%. COX2蛋白表达情况在GISTs危险度分组中比较差异有统计学意义(P<0.05)(表1), 随着危险度增加, COX2蛋白表达阳性率增加, 且COX2蛋白表达与危险度分级呈正相关(表2), 但在不同性别、年龄、发生部位及组织学类型组间比较差异均无统计学意义(P>0.05).
| 分组 | n | COX2蛋白表达情况 | 阳性率(%) | χ2值 | P值 | |
| - | + | |||||
| 性别 | 0.010 | 0.919 | ||||
| 男 | 36 | 6 | 30 | 83.3 | ||
| 女 | 38 | 6 | 32 | 84.2 | ||
| 年龄(岁) | 3.273 | 0.070 | ||||
| <55 | 33 | 2 | 31 | 93.9 | ||
| ≥55 | 41 | 10 | 31 | 75.6 | ||
| 发生部位 | 3.089 | 0.143 | ||||
| 胃 | 48 | 11 | 37 | 77.1 | ||
| 肠 | 17 | 1 | 16 | 94.1 | ||
| 胃肠外 | 9 | 0 | 9 | 100.0 | ||
| 组织学类型 | 0.695 | 0.826 | ||||
| 梭形细胞为主型 | 61 | 10 | 51 | 80.9 | ||
| 上皮样细胞为主型 | 7 | 1 | 6 | 85.7 | ||
| 混合细胞型 | 6 | 0 | 6 | 100.0 | ||
| 危险度分级 | 7.340 | 0.033 | ||||
| 极低危险度 | 14 | 6 | 8 | 57.1 | ||
| 低危险度 | 24 | 3 | 21 | 87.5 | ||
| 中危险度 | 11 | 1 | 10 | 90.9 | ||
| 高危险度 | 25 | 2 | 23 | 92.0 | ||
| 危险度分级 | COX2蛋白表达情况 | 合计 | r值 | P值 | |||
| - | + | ++ | +++ | ||||
| 极低危险度 | 6 | 2 | 2 | 4 | 14 | 0.338 | 0.000 |
| 低危险度 | 3 | 5 | 3 | 13 | 24 | ||
| 中危险度 | 1 | 2 | 4 | 4 | 11 | ||
| 高危险度 | 2 | 2 | 2 | 19 | 25 | ||
| 合计 | 12 | 11 | 11 | 40 | 74 | ||
74例GISTs中COX2 mRNA阳性表达58例(图1C, D), 阳性表达率为78.4%. COX2 mRNA表达情况在GISTs危险度分组中比较差异有统计学意义(P<0.05), 在高危险度组中其阳性表达率最高(表3), 且与危险度分级呈正相关(表4), 但在不同性别、年龄、发生部位及组织学类型之间比较差异均无统计学意义(P>0.05).
| 类别 | n | COX2 mRNA表达情况 | 阳性率 (%) | χ2值 | P值 | |
| - | + | |||||
| 性别 | 0.196 | 0.658 | ||||
| 男 | 36 | 7 | 29 | 80.6 | ||
| 女 | 38 | 9 | 29 | 6.3 | ||
| 年龄(岁) | 0.416 | 0.519 | ||||
| <55 | 33 | 6 | 27 | 81.8 | ||
| ≥55 | 41 | 10 | 31 | 75.6 | ||
| 发生部位 | 4.537 | 0.082 | ||||
| 胃 | 48 | 14 | 34 | 70.8 | ||
| 肠 | 17 | 2 | 15 | 88.2 | ||
| 胃肠外 | 9 | 0 | 9 | 100.0 | ||
| 组织学类型 | 3.333 | 0.138 | ||||
| 梭形细胞为主型 | 61 | 16 | 45 | 73.8 | ||
| 上皮样细胞为主型 | 7 | 0 | 7 | 100.0 | ||
| 混合细胞型 | 6 | 0 | 6 | 100.0 | ||
| 危险度分级 | 9.466 | 0.016 | ||||
| 极低危险度 | 14 | 7 | 7 | 50.0 | ||
| 低危险度 | 24 | 6 | 18 | 75.0 | ||
| 中危险度 | 11 | 1 | 10 | 90.9 | ||
| 高危险度 | 25 | 2 | 23 | 92.0 | ||
| 危险度分级 | COX2 mRNA表达情况 | 合计 | r值 | P值 | |||
| - | + | ++ | +++ | ||||
| 极低危险度 | 7 | 4 | 1 | 2 | 14 | 0.398 | 0.000 |
| 低危险度 | 6 | 6 | 6 | 6 | 24 | ||
| 中危险度 | 1 | 4 | 4 | 2 | 11 | ||
| 高危险度 | 2 | 4 | 7 | 12 | 25 | ||
| 合计 | 16 | 18 | 18 | 22 | 74 | ||
74例GISTs中53例均检测到COX2蛋白和mRNA阳性表达, 5例只检测到mRNA表达, 9例只检测到蛋白表达, 7例两者均不表达. 在GISTs中COX2蛋白与mRNA的表达具有相关性且呈正相关(表5).
| COX2蛋白表达情况 | COX2 mRNA表达情况 | 合计 | r值 | P值 | |
| - | + | ||||
| - | 7 | 5 | 12 | ||
| + | 9 | 53 | 62 | 0.392 | 0.000 |
| 合计 | 16 | 58 | 74 | ||
74例GISTs中38例患者获访, 随访率为51.4%. 这38例中17例为高危险度患者, 其中2例死亡; 2例肝转移, 2例淋巴结转移; 1例肺转移. 极低危险度、低危险度及中危险度3组患者均未发生转移、复发或死亡. 结果显示, COX2蛋白及mRNA表达均与患者的预后具有相关性(P<0.05), 且呈正相关(表6).
| 预后 | COX2蛋白表达情况 | r值 | P值 | COX2 mRNA表达情况 | r值 | P值 | ||||||
| - | + | ++ | +++ | - | + | ++ | +++ | |||||
| 健在 | 6 | 5 | 3 | 17 | 6 | 6 | 11 | 8 | ||||
| 转移 | 0 | 0 | 0 | 5 | 0.351 | 0.015 | 0 | 1 | 1 | 3 | 0.352 | 0.015 |
| 死亡 | 0 | 0 | 0 | 2 | 0 | 0 | 0 | 2 | ||||
COX作为前列腺素合成过程中的限速酶, 目前将其分为COX1、COX2和COX3三个亚型. 其中COX2具有过氧化物酶和环氧化酶双重功能. 生理状态下, 在绝大多数组织中检测不到COX2的存在, 只有细胞在接受相应刺激后才开始合成, 并参与肿瘤的发生发展[15]. 目前普遍认为COX2参与肿瘤的发生发展可能是通过促进细胞增殖并抑制细胞凋亡来完成, 也可能是通过促进血管形成和抑制免疫功能的形式来实现的[16,17]. COX2的过度表达可使花生四烯酸增加, 而花生四烯酸代谢可产生诱变剂[18], 与前列腺素合成过程中的毒性产物(如自由基等)共同作用可促进肿瘤细胞的恶变. Yao等[19]已经证实COX2可以独立诱导肿瘤发生.
GISTs作为胃肠道最常见的间叶源性肿瘤, 在遗传学上绝大多数存在原癌基因c-kit或血小板衍生生长因子受体α基因的激活突变, 免疫表型上CD117蛋白阳性是其主要表现. 目前临床主要采用CD117作为诊断GISTs的主要标志物. 但CD117在其他肿瘤组织中也表达, 如尤文氏肉瘤、精原细胞瘤、恶性黑色素瘤、肥大细胞肿瘤、滑膜肉瘤、肺小细胞癌及髓系白血病等, 在去分化脂肪肉瘤及平滑肌肉瘤中也偶有表达[20-22]. 已有研究[23]认为, 当CD117呈弱阳性、局灶阳性或组织学以上皮样细胞成分为主时, COX2可作为GISTs诊断及鉴别诊断的有用标志物.
本研究检测了GISTs中COX2蛋白及mRNA的表达情况, 结果显示: 随着GISTs危险级别的增加, COX2蛋白及mRNA的阳性表达率增加, 这与以往的报道一致, 提示COX2可作为判断GISTs恶性潜能的指标之一. 但COX2蛋白的表达略高于mRNA的表达, 可能与组织固定剂的种类、固定时间长短及mRNA更容易降解有关. 我们还发现GISTs中COX2蛋白及mRNA的表达在GISTs不同的发生部位及不同组织学类型组间比较差异均无统计学意义, 这与以往报道的COX2在发生于胃的GISTs中的表达强于发生于肠者及当组织学以上皮样形态为主时COX2表达阳性率增加不符[23,24], 这可能与本研究中上皮样细胞为主型及混合细胞型GISTs所占比例过少有关. 游猛等[25]检测了COX2及VEGF在GISTs中的表达, 结果显示COX2可能通过调节VEGF的表达从而促进GISTs的浸润及转移. 由于本研究病例数及随访例数过少, COX2基因的表达与预后之间的关系尚需进一步研究.
已有研究[26]证明, 使用COX2抑制剂celecoxib和鱼油处理小鼠乳腺癌可对乳腺癌形成的初期起到防治作用. COX2抑制剂可抑制肿瘤的发生发展并且降低肿瘤的复发已在以往的研究中得到了证实[27-29]. 闫竞一等[30]研究发现COX2抑制剂可诱导GISTs肿瘤细胞的凋亡, 为GISTs中伊马替尼的耐药问题提供了新的研究方向.
总之, COX2可能在GISTs的发生发展中发挥着重要作用, 可作为GISTs危险度分级评估的另一参考指标, 并为解决GISTs中伊马替尼耐药问题提供了一个新的探索方向. 但目前对COX2的研究多集中于上皮源性肿瘤中, 其在间叶源性肿瘤中的研究有待进一步深入.
胃肠道间质瘤(gastrointestinal stromal tumors, GISTs), 消化系最常见的间叶源性肿瘤, 在遗传学上绝大多数存在原癌基因c-kit或血小板衍生生长因子受体α基因的激活突变. 因其多发生于消化系的肌层, 曾被误诊为平滑肌瘤、平滑肌肉瘤等. 近年来, 随着报道病例的不断增加, GISTs的发生发展及靶向治疗渐渐引起众多研究者的兴趣.
喻春钊, 教授, 主任医师, 南京医科大学第二附属医院普通外科九区; 白日星, 主任医师, 首都医科大学附属北京天坛医院普通外科
本文研究热点及重点为GISTs中COX2蛋白及mRNA的表达与临床病理特征(性别、年龄、部位、组织学类型及危险度分级)及预后之间的关系.
在CD117呈弱阳性、局灶阳性或组织学以上皮样成分为主时COX2可作为诊断GISTs及鉴别诊断的有用指标; COX2可通过调节血管内皮生长因子的表达而促进GISTs的浸润与转移.
GISTs是消化系统最常见的间叶源性肿瘤, 目前的报道多为COX2蛋白在GISTs中的表达. 本文进一步研究了COX2 mRNA在GISTs中的表达及其与GISTs病理特征及预后的关系.
伊马替尼是GISTs的靶向治疗药物, 但近年来对伊马替尼耐药的报道逐渐增加, 对GISTs的治疗迫切需要找到新的靶点. 本文通过检测GISTs中COX2蛋白及mRNA表达情况, 可能为GISTs中伊马替尼的耐药问题提供了新的研究方向.
原位杂交: 将带有标记的(有放射性同位素、荧光素生物素、地高辛等)核酸探针与细胞或组织中的核酸杂交, 然后在光镜或电镜下观察目的mRNA或DNA的存在并定位. 该技术有很高的敏感性和特异性, 可进一步从分子水平来探讨细胞的功能表达及其调节机制.
本研究在胃肠道间质瘤中对COX2蛋白和mRNA的表达进行了相关探讨.
编辑: 于明茜 电编:都珍珍
| 1. | Miettinen M, Makhlouf H, Sobin LH, Lasota J. Gastrointestinal stromal tumors of the jejunum and ileum: a clinicopathologic, immunohistochemical, and molecular genetic study of 906 cases before imatinib with long-term follow-up. Am J Surg Pathol. 2006;30:477-489. [PubMed] [DOI] |
| 2. | Miettinen M, Kopczynski J, Makhlouf HR, Sarlomo-Rikala M, Gyorffy H, Burke A, Sobin LH, Lasota J. Gastrointestinal stromal tumors, intramural leiomyomas, and leiomyosarcomas in the duodenum: a clinicopathologic, immunohistochemical, and molecular genetic study of 167 cases. Am J Surg Pathol. 2003;27:625-641. [PubMed] [DOI] |
| 3. | Miettinen M, Furlong M, Sarlomo-Rikala M, Burke A, Sobin LH, Lasota J. Gastrointestinal stromal tumors, intramural leiomyomas, and leiomyosarcomas in the rectum and anus: a clinicopathologic, immunohistochemical, and molecular genetic study of 144 cases. Am J Surg Pathol. 2001;25:1121-1133. [PubMed] [DOI] |
| 5. | Miettinen M, Sarlomo-Rikala M, Sobin LH, Lasota J. Esophageal stromal tumors: a clinicopathologic, immunohistochemical, and molecular genetic study of 17 cases and comparison with esophageal leiomyomas and leiomyosarcomas. Am J Surg Pathol. 2000;24:211-222. [PubMed] [DOI] |
| 7. | 侯 英勇, 孙 孟红, 魏 永昆, 谭 云山, 陆 孝禹, 王 坚, 朱 雄增, 郑 爱华. 腹内胃肠道外间质瘤临床病理、免疫组化学及分子遗传学研究. 中华病理学杂志. 2003;32:422-426. |
| 8. | Miettinen M, Monihan JM, Sarlomo-Rikala M, Kovatich AJ, Carr NJ, Emory TS, Sobin LH. Gastrointestinal stromal tumors/smooth muscle tumors (GISTs) primary in the omentum and mesentery: clinicopathologic and immunohistochemical study of 26 cases. Am J Surg Pathol. 1999;23:1109-1118. [PubMed] [DOI] |
| 9. | Reith JD, Goldblum JR, Lyles RH, Weiss SW. Extragastrointestinal (soft tissue) stromal tumors: an analysis of 48 cases with emphasis on histologic predictors of outcome. Mod Pathol. 2000;13:577-585. [PubMed] [DOI] |
| 10. | Fletcher CD, Berman JJ, Corless C, Gorstein F, Lasota J, Longley BJ, Miettinen M, O'Leary TJ, Remotti H, Rubin BP. Diagnosis of gastrointestinal stromal tumors: A consensus approach. Hum Pathol. 2002;33:459-465. [PubMed] [DOI] |
| 11. | Chandrasekharan NV, Dai H, Roos KL, Evanson NK, Tomsik J, Elton TS, Simmons DL. COX-3, a cyclooxygenase-1 variant inhibited by acetaminophen and other analgesic/antipyretic drugs: cloning, structure, and expression. Proc Natl Acad Sci U S A. 2002;99:13926-13931. [PubMed] [DOI] |
| 12. | Xi H, Baldus SE, Warnecke-Eberz U, Brabender J, Neiss S, Metzger R, Ling FC, Dienes HP, Bollschweiler E, Moenig S. High cyclooxygenase-2 expression following neoadjuvant radiochemotherapy is associated with minor histopathologic response and poor prognosis in esophageal cancer. Clin Cancer Res. 2005;11:8341-8347. [PubMed] [DOI] |
| 13. | Da MX, Wu XT, Wang J, Guo TK, Zhao ZG, Luo T, Zhang MM, Qian K. Expression of cyclooxygenase-2 and vascular endothelial growth factor-C correlates with lymphangiogenesis and lymphatic invasion in human gastric cancer. Arch Med Res. 2008;39:92-99. [PubMed] |
| 16. | Cao Y, Prescott SM. Many actions of cyclooxygenase-2 in cellular dynamics and in cancer. J Cell Physiol. 2002;190:279-286. [PubMed] [DOI] |
| 17. | Krysan K, Dalwadi H, Sharma S, Põld M, Dubinett S. Cyclooxygenase 2-dependent expression of survivin is critical for apoptosis resistance in non-small cell lung cancer. Cancer Res. 2004;64:6359-6362. [PubMed] [DOI] |
| 18. | Pai R, Nakamura T, Moon WS, Tarnawski AS. Prostaglandins promote colon cancer cell invasion; signaling by cross-talk between two distinct growth factor receptors. FASEB J. 2003;17:1640-1647. [PubMed] |
| 19. | Yao M, Zhou W, Sangha S, Albert A, Chang AJ, Liu TC, Wolfe MM. Effects of nonselective cyclooxygenase inhibition with low-dose ibuprofen on tumor growth, angiogenesis, metastasis, and survival in a mouse model of colorectal cancer. Clin Cancer Res. 2005;11:1618-1628. [PubMed] [DOI] |
| 21. | Riddle ND, Gonzalez RJ, Bridge JA, Antonia S, Bui MM. A CD117 and CD34 immunoreactive sarcoma masquerading as a gastrointestinal stromal tumor: diagnostic pitfalls of ancillary studies in sarcoma. Cancer Control. 2011;18:152-159. [PubMed] |
| 22. | Miettinen M, Lasota J. KIT (CD117): a review on expression in normal and neoplastic tissues, and mutations and their clinicopathologic correlation. Appl Immunohistochem Mol Morphol. 2005;13:205-220. [PubMed] [DOI] |
| 23. | Stewart AE, Heslin MH, Arch J, Jhala N, Ragland B, Gomez F, Bland KI, Arnoletti JP. Cyclooxygenase-2 expression and clinical outcome in gastrointestinal stromal tumors. J Gastrointest Surg. 2006;10:315-319. [PubMed] [DOI] |
| 24. | Sheehan KM, Sabah M, Cummins RJ, O'Grady A, Murray FE, Leader MB, Kay EW. Cyclooxygenase-2 expression in stromal tumors of the gastrointestinal tract. Hum Pathol. 2003;34:1242-1246. [PubMed] [DOI] |
| 26. | Kansal S, Negi AK, Kaur R, Sarotra P, Sharma G, Aggarwal R, Agnihotri N. Evaluation of the role of oxidative stress in chemopreventive action of fish oil and celecoxib in the initiation phase of 7,12-dimethyl benz(α)anthracene-induced mammary carcinogenesis. Tumour Biol. 2011;32:167-177. [PubMed] [DOI] |
| 27. | Mukherjee P, Basu GD, Tinder TL, Subramani DB, Bradley JM, Arefayene M, Skaar T, De Petris G. Progression of pancreatic adenocarcinoma is significantly impeded with a combination of vaccine and COX-2 inhibition. J Immunol. 2009;182:216-224. [PubMed] [DOI] |
| 28. | Glasner A, Avraham R, Rosenne E, Benish M, Zmora O, Shemer S, Meiboom H, Ben-Eliyahu S. Improving survival rates in two models of spontaneous postoperative metastasis in mice by combined administration of a beta-adrenergic antagonist and a cyclooxygenase-2 inhibitor. J Immunol. 2010;184:2449-2457. [PubMed] [DOI] |
| 29. | Benjamin B, Hazut O, Shaashua L, Benish M, Zmora N, Barshack I, Hoffman A, Ben-Eliyahu S, Zmora O. Effect of beta blocker combined with COX-2 inhibitor on colonic anastomosis in rats. Int J Colorectal Dis. 2010;25:1459-1464. [PubMed] [DOI] |