修回日期: 2015-10-14
接受日期: 2015-11-09
在线出版日期: 2015-12-18
目的: 探讨人肝癌细胞(HepG2)中瘦素(Leptin)介导JAK/STAT3信号系统对人端粒酶逆转录酶(human telomerase reverse transcriptase, hTERT)的影响, 解析在肝癌细胞中Leptin诱导hTERT表达的分子机制.
方法: 采用Western blot测定HepG2细胞中Leptin受体的表达情况及检测Tyrphostin AG490(JAK抑制剂)处理HepG2细胞后hTERT蛋白的表达情况; 应用STAT3-siRNA转染HepG2细胞, 用MTT法检测细胞增殖情况、RT-PCR检测hTERT mRNA的表达、Western blot测hTERT蛋白的表达变化.
结果: 在HepG2细胞中存在Leptin受体的表达; Western blot结果显示在AG490处理组及AG490联合Leptin处理组的蛋白表达较Leptin诱导hTERT蛋白表达量减少; 而STAT3-siRNA转染HepG2细胞后, 细胞增殖能力降低; 在HepG2细胞中干扰STAT3片段, Leptin诱导的hTERT mRNA和蛋白的表达量减少.
结论: 在人肝癌细胞HepG2中存在Leptin受体表达; 在肝癌HepG2细胞中, 应用Leptin诱导JAK-STATS信号通路是上调hTERT表达的可能机制.
核心提示: 本文探讨人肝癌细胞(HepG2)中Leptin介导JAK/STAT3信号系统对人端粒酶逆转录酶(human telomerase reverse transcriptase, hTERT)的影响, 采用Western blot测定HepG2细胞中瘦素受体的表达情况、瘦素处理后检测细胞增殖情况、hTERT mRNA及hTERT蛋白的表达变化, 证实在HepG2细胞中存在瘦素受体的表达; 在HepG2细胞中干扰STAT3片段, 瘦素诱导的hTERT mRNA和蛋白的表达量减少, 在肝癌HepG2细胞中, 应用瘦素诱导JAK-STATS信号通路是上调hTERT表达的可能机制.
引文著录: 高培亮, 李海洋, 杨晓峰, 王方园, 曹坤, 向华, 徐媛. JAK/STAT3信号系统通过瘦素调控hTERT在肝癌细胞中的作用. 世界华人消化杂志 2015; 23(35): 5613-5619
Revised: October 14, 2015
Accepted: November 9, 2015
Published online: December 18, 2015
AIM: To explore the influence of Leptin mediated JAK/STAT3 signaling on human telomerase reverse transcriptase (hTERT) in human liver cancer cells (HepG2) and elucidate the molecular mechanisms by which Leptin induces hTERT expression in hepatocellular carcinoma cells.
METHODS: The expression of ob-R in HepG2 cells was determined by Western blot. The expression of hTERT protein in cells after treatment with AG490 inhibitor was also detected by Western blot. Cell proliferation was detected by MTT method. The expression of hTERT mRNA was tested by RT-PCR, and the expression of hTERT protein was tested by Western blot.
RESULTS: HepG2 cells expressed ob-R. Western blot analysis showed that the hTERT protein expression in AG490 treatment group and AG490 plus Leptin treatment group was lower than that of Leptin treatment group. HepG2 cell proliferation was reduced after STAT3-siRNA transfection. The expression of hTERT protein and hTERT mRNA was reduced in STAT3-siRNA transfected HepG2 cells after treatment with STAT3 inhibitor.
CONCLUSION: HepG2 cells express ob-R. Leptin induced JAK-STAT3 signaling downregulates the hTERT mRNA and protein expression in hepatocellular carcinoma cells.
- Citation: Gao PL, Li HY, Yang XF, Wang FY, Cao K, Xiang H, Xu Y. JAK/STAT3 signaling regulates human telomerase reverse transcriptase via Leptin in hepatoma cells. Shijie Huaren Xiaohua Zazhi 2015; 23(35): 5613-5619
- URL: https://www.wjgnet.com/1009-3079/full/v23/i35/5613.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i35.5613
原发性肝癌(hepatocellular carcinoma, HCC)是一发病率高、治疗困难、死亡率高的恶性肿瘤[1]. 在我国肝癌为常见恶性肿瘤之一, 占全国肿瘤相关死亡的第3位[2]. 现已证实肥胖与瘦素(Leptin)的过表达密切相关. 而且Leptin及其受体也参与肿瘤的形成和发展[3]. 同样在人正常肝细胞和肝癌细胞中都可检测到Leptin受体(Leptin receptor, ob-R)表达, 且其表达差异有统计学意义[4]. 而Leptin的信号传导主要依靠Janus激酶/信号传导及转录激活因子3(Janus kinase-signal transducer and activator of transcription 3, JAK/STAT3)通路. 研究[5]证实STAT3为人端粒酶逆转录酶(human telomerase reverse transcriptase, hTERT)的一个关键性调节因子. 就肝病而言, 国内外相关研究[6,7]已表明, Leptin与肝脏疾病关系密切. 对正常肝、肝硬化、慢性病毒性肝炎及HCC患者的组织进行Leptin与hTERT表达的相关性研究, 结果证实Leptin与hTERT表达有明显差异性, 且这种表达只存在于HCC组织中[8]. 本课题组之前研究显示, Leptin可以促进HepG2细胞hTERT mRNA及蛋白水平的表达, 且与剂量呈相关性. 本课题组拟采用干扰STAT3, 探讨在肝癌细胞中Leptin介导JAK/STAT3信号系统对hTERT表达的分子机制.
重组人Leptin购自美国PeproTech公司, hTERT引物、AG490(P-STAT3抑制剂)购自北京鼎国生物技术有限公司, Anti-TERT Antibody购自美国ABZOOM公司, STAT3-siRNA购自广州仪涛科技有限公司, Lipofectamine 2000购自Life technologies. 人肝癌细胞株(HepG2)由贵阳医学院禹文峰教授课题组提供, 人乳腺癌细胞株(MCF7)由贵阳医学院生理教研室提供.
1.2.1 细胞分组及培养: 对照组: HepG2细胞组; 实验组: 加Leptin孵育的HepG2细胞组和加Leptin孵育后再将STAT3-siRNA转染到HepG2细胞组; 采用10%胎牛血清, 置于37 ℃, 50 mL/L CO2恒温孵育箱中培养. 取对数生长细胞用于试验.
1.2.2 瞬时转染: 将STAT3-siRNA转染到HepG2细胞内, 加Leptin(120 ng/mL)孵育2 h, 然后采用MTT法检测细胞的增殖能力.
1.2.3 Western blot检测: 用MCF7细胞作为阳性对照组, 然后孵育ob-R和β-actin抗体, 用辣根过氧化物酶的二抗标记, 洗脱后加电化学发光荧光增强剂在暗室曝光显影. HepG2细胞分别经AG490(100 µmol/L)和STAT3-siRNA转染后, 加Leptin(120 ng/mL)孵育2 h, 提取蛋白, 按每孔25 µg加样, 电泳后转至PVDF膜上, 然后孵育hTERT和β-actin抗体, 用辣根过氧化物酶的二抗标记, 洗脱后加电化学发光荧光增强剂在暗室曝光显影.
1.2.4 用逆转录聚合酶链反应(PCR)检测hTERT mRNA的表达: HepG2细胞经STAT3-siRNA和Leptin处理后, 提取细胞总RNA, 然后将其逆转录成cDNA用于PCR扩增, hTERT的上游引物为5'-CGGAAGAGTGTCTGGAGCAA-3', 下游引物为5'-GGATGAAGCGGAGTCTGGA-3', β-肌动蛋白(β-actin)为内参引物[9], 其上游引物为5'-ACCCCCACTGAAAAAGATGA-3', 下游引物为5'-ATCTTCAAACCTCCATGATG-3'.
统计学处理 用SPSS17.0统计软件进行分析, 采用One-way ANOVA进行方差分析, 方差齐采用LDS分析进行两两比较, 方差不齐采用Dunnett's T3进行两两比较分析, 计量资料采用mean±SD表示, P<0.05为差异有统计学意义.
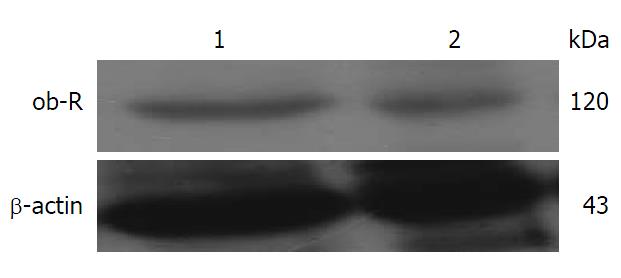
我们以乳腺癌细胞(MCF7)为阳性对照, 试验结果显示肝癌HepG2细胞中存在ob-R的表达(图1).
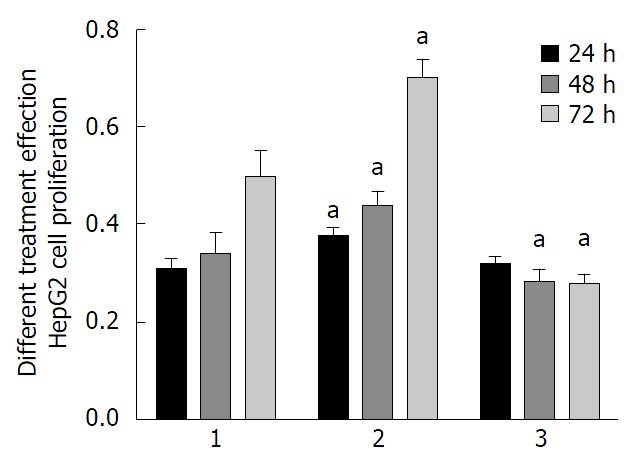
结果显示经Leptin孵育的HepG2细胞增殖率为0.71±0.08, 而经STAT3-siRNA转染后的HepG2细胞增殖为0.28±0.04(P<0.05)(图2).
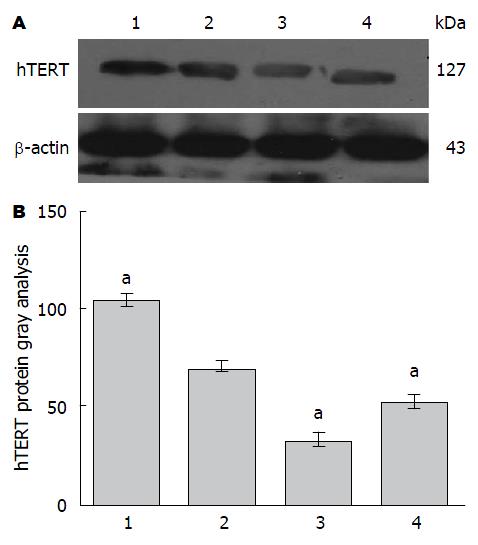
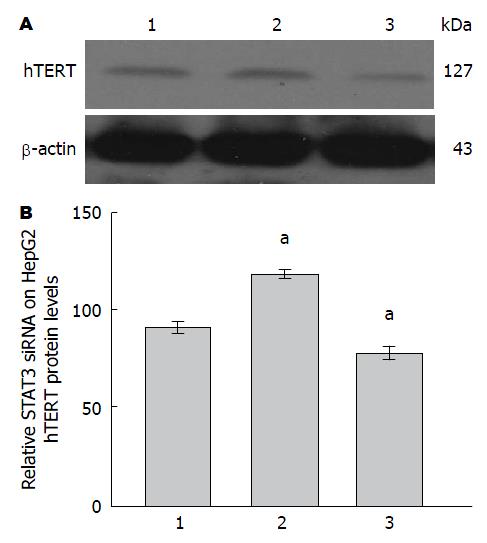
siRNA在HepG2细胞中对hTERT蛋白表达水平的影响 AG490处理组、Leptin和AG490共同处理组中与阴性对照组和Leptin处理组对比, hTERT蛋白的表达量减少; 经STAT3-siRNA转染HepG2细胞48 h后再用Leptin处理结果与对照组比较显示hTERT蛋白表达量下降(图3, 图4).
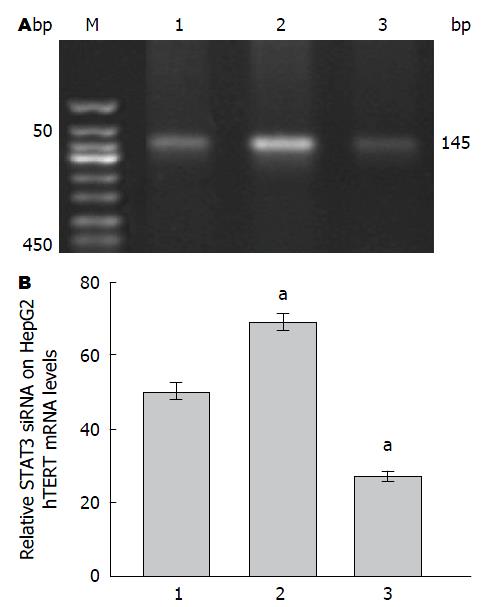
Leptin处理组较对照组发现hTERT mRNA活性明显增加, 而转染STAT3-siRNA后Leptin诱导的hTERT mRNA转录活性有所降低, 差异具有统计学意义(图5).
目前研究发现, 肥胖已成为某些恶性肿瘤的独立危险因素[10], 如结肠癌、乳腺癌、肾细胞癌等. 正常情况下, 肝脏并不产生Leptin, 只有在肝纤维化时, 活化的肝星状细胞(hepatic stellate cell, HSC)可产生Leptin. 由于HSC存在大量的ob-R, Leptin通过ob-R直接作用于HSC, 进一步激活和促进肝纤维化的发生[11]. 临床研究显示肝脏纤维化损伤过程中, Bolukbas等[12]检测了乙型肝炎和丙型肝炎后肝硬化与正常对照组的血清Leptin水平, 发现肝硬化患者Leptin水平明显升高. 石国辉等[13]研究发现, 肝炎后肝硬化患者血清Leptin水平及肝纤维化指标HA、PⅢP较健康对照组显著升高, 肝炎后肝硬化患者的血清Leptin水平与血HA、PⅢP呈正相关, 说明Leptin是肝纤维化形成的重要促进因子. Campillo等[14]研究发现酒精性肝硬化患者血清Leptin水平高于正常组. Floreani等[15]研究发现原发性胆汁性肝硬化与血清Leptin水平的升高有关.
近期研究[16]发现, 肥胖还可能与原发性肝癌的发病率和病死率关系密切. 肥胖(ob)基因中的蛋白产物Leptin是一种脂肪组织源性激素, 在张宪真等[17]研究报告中发现, Leptin与肿瘤的发生密切相关, 同时肿瘤的发生、发展和转归在肿瘤疾病患者的血清中Leptin与脂肪百分比、体质量指数呈显著正相关性. 因此可根据Leptin的表达情况来调整肿瘤性疾病患者的营养状况, 对预防肿瘤性恶病质的发生和发展有一定价值, 同时可通过降低血清中Leptin的浓度来阻止HCC的发生、发展, 为改善肿瘤性疾病患者的生活质量和预后开辟新途径[18].
在临床工作中, 早期对肝癌的诊断缺少明显的依据, 而甲胎蛋白(α-fetoprotein, AFP)是目前临床上诊断HCC最常用的肿瘤标志物之一, 但敏感性较低(70%左右), 特异性也较低(64%)[19], 因此单独应用AFP诊断HCC容易造成漏诊和误诊. 有研究[20]证实, Leptin可对肿瘤细胞发生发展有一定相关性, 根据Wang等[21,22]分别对68例和66例肝癌患者的研究发现, 60.3%和53%的患者肝癌细胞内出现ob-R高表达. 据Wang等[23]对36例肝癌样本的研究发现, Leptin及其受体在邻近非肿瘤肝组织中呈高表达, 而在肝癌细胞中呈低表达. Ribatti等[24]通过免疫组织化学法检测Leptin及其受体的表达与肝癌的血管生成程度高度相关, 进而得出Leptin有一定的促肝癌血管生成作用. 所以, 在今后的研究工作中, ob-R的表达情况能否成为肝癌早期的诊断依据仍需要我们进一步研究.
研究证实Leptin存在多条信号转导途径如Ras途径、JAK/STAT3信号通路、MAPK途径等还有其他脂类代谢的信号途径, 而JAK/STAT3信号通路是Leptin的主要信号传导途径. 而Elinav等[25]研究发现Leptin有抗肿瘤作用, 考虑与其诱导肝癌细胞株中抗增殖的STAT2与细胞因子信号抑制物1的过度表达有关. Thompsom等[26]研究发现Leptin可能依靠丝裂原激活的蛋白激酶系统通路转导信号对肝癌产生作用. Chen等[27]的研究显示, Leptin对肝癌生长的直接作用主要是通过AK2-PI3K/Akt-MEK/ERKl/2之间的串扰联系实现的. 根据Gonzalez等[28]在对乳腺癌的研究中显示, Leptin可以通过JAK2/STAT3、ERKl/2及PI3K等信号传导途径增加VEGF及其受体VEGF-R2和cyclin D1的表达, 从而促进肿瘤细胞增殖及转移.
Saxena等[29]的研究发现Leptin可以促进肝癌细胞的生长、侵袭以及转移, 而JAK/STAT3信号通路是Leptin活动的重要介质. 由此我们推测Leptin在肝癌细胞中也可通过JAK/STAT3通路来调节肝癌细胞的生成过程, 影响肝癌细胞的增殖、侵袭及转移. 因此, 对Leptin信号通路的研究有助于为肝癌治疗靶点的选择提供新的参考. 同时相关实验室通过对正常肝脏、肝硬化、慢性病毒性肝炎及HCC患者的肝组织中进行Leptin与hTERT表达相关性检测, 其结果证实Leptin表达与hTERT表达有差异性存在, 且具有统计学意义, 而这种相关性只存在于HCC组织中[9]. 研究证实STAT3为hTERT的一个关键性调节因子[5]. 在相关肿瘤细胞中激活TA的活性, hTERT基因的表达起了非常关键性的作用[30]. Stefanou等[31]证实Leptin与hTERT的表达存在相关性.
总之, 我们实验研究发现干扰STAT3信号通路后Leptin诱导HepG2细胞的增殖活性降低, hTERT mRNA活性及蛋白表达情况受到抑制; 由此我们推断Leptin可能通过JAK/STAT3信号通路调控hTERT来影响肝癌细胞的生物学活性. 这一结果可能为临床上有效地预防和治疗肥胖带来相关肿瘤疾病提供新的思路. 但因 肿瘤的发生、发展是多基因、多因素调控的结果, 所以我们相信随着人们Leptin、端粒酶与肿瘤关系的多方面的深入研究, 不久的将来会产生一系列针对肥胖治疗肿瘤的药物, 从而为肿瘤的治疗提供一种新的途径.
原发性肝癌是一发病率高、治疗困难、死亡率高的恶性肿瘤. 瘦素(Leptin)表达与肝癌呈相关性, 而相关实验证实在乳腺癌(MCF7)Leptin通过信号系统Janus激酶/信号传导及转录激活因子3(Janus kinase-signal transducer and activator of transcription 3, JAK/STAT3)可以调节人端粒酶逆转录酶(human telomerase reverse transcriptase, hTERT)表达, 所以我们试图采用干扰STAT3的方法, 探讨在肝癌细胞中Leptin介导JAK/STAT3对hTERT表达的影响机制.
黄成, 副主任医师, 复旦大学附属中山医院肝外科
研究证实在人肝癌细胞HepG2中存在Leptin受体表达; 在肝癌HepG2细胞中, 应用Leptin诱导JAK-STATS信号通路是上调hTERT表达的可能机制, 亟待研究的问题是明确Leptin还通过哪些途径影响hTERT的表达及对肝癌的影响.
在HepG2细胞中通过干扰STAT3片段, Leptin诱导的hTERT mRNA和蛋白的表达量减少, 初步验证在肝癌HepG2细胞中, 应用Leptin诱导JAK-STATS信号通路是上调hTERT表达的可能机制.
本文分析了肝癌细胞(HepG2)中Leptin介导JAK/STAT3信号系统对hTERT的影响, 存在一定的实验基础, 具有研究价值.
编辑: 郭鹏 电编:都珍珍
| 1. | Tang ZY, Ye SL, Liu YK, Qin LX, Sun HC, Ye QH, Wang L, Zhou J, Qiu SJ, Li Y. A decade's studies on metastasis of hepatocellular carcinoma. J Cancer Res Clin Oncol. 2004;130:187-196. [PubMed] [DOI] |
| 2. | Livraghi T, Mäkisalo H, Line PD. Treatment options in hepatocellular carcinoma today. Scand J Surg. 2011;100:22-29. [PubMed] |
| 3. | Bosch FX, Ribes J, Díaz M, Cléries R. Primary liver cancer: worldwide incidence and trends. Gastroenterology. 2004;127:S5-S16. [PubMed] [DOI] |
| 5. | Konnikova L, Simeone MC, Kruger MM, Kotecki M, Cochran BH. Signal transducer and activator of transcription 3 (STAT3) regulates human telomerase reverse transcriptase (hTERT) expression in human cancer and primary cells. Cancer Res. 2005;65:6516-6520. [PubMed] [DOI] |
| 6. | Tsochatzis E, Papatheodoridis GV, Hadziyannis E, Georgiou A, Kafiri G, Tiniakos DG, Manesis EK, Archimandritis AJ. Serum adipokine levels in chronic liver diseases: association of resistin levels with fibrosis severity. Scand J Gastroenterol. 2008;43:1128-1136. [PubMed] |
| 8. | Satra M, Gatselis N, Iliopoulos D, Zacharoulis D, Dalekos GN, Tsezou A. Real-time quantification of human telomerase reverse transcriptase mRNA in liver tissues from patients with hepatocellular cancer and chronic viral hepatitis. J Viral Hepat. 2007;14:41-47. [PubMed] [DOI] |
| 9. | Li SS, Sheng J, Yuan ZN, Wang XC, Zhao TS, Ren H, Hao JH. [Leptin promotes the expression of hTERT via STAT3 in breast cancer cells]. Zhonghua Yixue Zazhi. 2012;92:2386-2388. [PubMed] |
| 10. | Calle EE, Kaaks R. Overweight, obesity and cancer: epidemiological evidence and proposed mechanisms. Nat Rev Cancer. 2004;4:579-591. [PubMed] |
| 12. | Bolukbas FF, Bolukbas C, Horoz M, Gumus M, Erdogan M, Zeyrek F, Yayla A, Ovunc O. Child-Pugh classification dependent alterations in serum leptin levels among cirrhotic patients: a case controlled study. BMC Gastroenterol. 2004;4:23. [PubMed] |
| 14. | Campillo B, Sherman E, Richardet JP, Bories PN. Serum leptin levels in alcoholic liver cirrhosis: relationship with gender, nutritional status, liver function and energy metabolism. Eur J Clin Nutr. 2001;55:980-988. [PubMed] [DOI] |
| 15. | Floreani A, Variola A, Niro G, Premoli A, Baldo V, Gambino R, Musso G, Cassader M, Bo S, Ferrara F. Plasma adiponectin levels in primary biliary cirrhosis: a novel perspective for link between hypercholesterolemia and protection against atherosclerosis. Am J Gastroenterol. 2008;103:1959-1965. [PubMed] [DOI] |
| 16. | Qian Y, Fan JG. Obesity, fatty liver and liver cancer. Hepatobiliary Pancreat Dis Int. 2005;4:173-177. [PubMed] |
| 18. | 侯 振江, 王 秀文, 张 丽华, 周 秀艳, 戴 殿禄, 闫 金辉. 原发性肝癌患者血清leptin, VEGF和AFP表达的意义. 世界华人消化杂志. 2006;14:3195-3200. [DOI] |
| 19. | Soresi M, Magliarisi C, Campagna P, Leto G, Bonfissuto G, Riili A, Carroccio A, Sesti R, Tripi S, Montalto G. Usefulness of alpha-fetoprotein in the diagnosis of hepatocellular carcinoma. Anticancer Res. 2003;23:1747-1753. [PubMed] |
| 20. | Calle EE, Rodriguez C, Walker-Thurmond K, Thun MJ. Overweight, obesity, and mortality from cancer in a prospectively studied cohort of U.S. adults. N Engl J Med. 2003;348:1625-1638. [PubMed] [DOI] |
| 21. | Wang SN, Yeh YT, Yang SF, Chai CY, Lee KT. Potential role of leptin expression in hepatocellular carcinoma. J Clin Pathol. 2006;59:930-934. [PubMed] [DOI] |
| 22. | Wang SN, Chuang SC, Yeh YT, Yang SF, Chai CY, Chen WT, Kuo KK, Chen JS, Lee KT. Potential prognostic value of leptin receptor in hepatocellular carcinoma. J Clin Pathol. 2006;59:1267-1271. [PubMed] [DOI] |
| 23. | Wang XJ, Yuan SL, Lu Q, Lu YR, Zhang J, Liu Y, Wang WD. Potential involvement of leptin in carcinogenesis of hepatocellular carcinoma. World J Gastroenterol. 2004;10:2478-2481. [PubMed] [DOI] |
| 24. | Ribatti D, Belloni AS, Nico B, Di Comite M, Crivellato E, Vacca A. Leptin-leptin receptor are involved in angiogenesis in human hepatocellular carcinoma. Peptides. 2008;29:1596-1602. [PubMed] [DOI] |
| 25. | Elinav E, Abd-Elnabi A, Pappo O, Bernstein I, Klein A, Engelhardt D, Rabbani E, Ilan Y. Suppression of hepatocellular carcinoma growth in mice via leptin, is associated with inhibition of tumor cell growth and natural killer cell activation. J Hepatol. 2006;44:529-536. [PubMed] [DOI] |
| 26. | Thompson KJ, Lau KN, Johnson S, Martinie JB, Iannitti DA, McKillop IH, Sindram D. Leptin inhibits hepatocellular carcinoma proliferation via p38-MAPK-dependent signalling. HPB (Oxford). 2011;13:225-233. [PubMed] [DOI] |
| 27. | Chen C, Chang YC, Liu CL, Liu TP, Chang KJ, Guo IC. Leptin induces proliferation and anti-apoptosis in human hepatocarcinoma cells by up-regulating cyclin D1 and down-regulating Bax via a Janus kinase 2-linked pathway. Endocr Relat Cancer. 2007;14:513-529. [PubMed] [DOI] |
| 28. | Gonzalez RR, Cherfils S, Escobar M, Yoo JH, Carino C, Styer AK, Sullivan BT, Sakamoto H, Olawaiye A, Serikawa T. Leptin signaling promotes the growth of mammary tumors and increases the expression of vascular endothelial growth factor (VEGF) and its receptor type two (VEGF-R2). J Biol Chem. 2006;281:26320-26328. [PubMed] [DOI] |
| 29. | Saxena NK, Sharma D, Ding X, Lin S, Marra F, Merlin D, Anania FA. Concomitant activation of the JAK/STAT, PI3K/AKT, and ERK signaling is involved in leptin-mediated promotion of invasion and migration of hepatocellular carcinoma cells. Cancer Res. 2007;67:2497-2507. [PubMed] [DOI] |
| 30. | Schepelmann S, Ogilvie LM, Hedley D, Friedlos F, Martin J, Scanlon I, Chen P, Marais R, Springer CJ. Suicide gene therapy of human colon carcinoma xenografts using an armed oncolytic adenovirus expressing carboxypeptidase G2. Cancer Res. 2007;67:4949-4955. [PubMed] [DOI] |
| 31. | Stefanou N, Papanikolaou V, Furukawa Y, Nakamura Y, Tsezou A. Leptin as a critical regulator of hepatocellular carcinoma development through modulation of human telomerase reverse transcriptase. BMC Cancer. 2010;10:442. [PubMed] |