修回日期: 2015-10-19
接受日期: 2015-10-26
在线出版日期: 2015-11-28
目的: 初步研究异甘草素(isoliquiritigenin, ISL)对人胃癌SGC7901细胞凋亡诱导作用的影响, 并探讨信号通路中蛋白质丝氨酸苏氨酸激酶(protein kinase B, Akt)、磷酸化Akt(P-Akt)及下游凋亡蛋白Bax表达水平的变化.
方法: 取对数生长期人胃癌SGC7901细胞分为对照组、ISL实验组, 培养24、48、72 h后采用MTT实验检测ISL对细胞生长的抑制情况, 摸索后续实验药物浓度和作用时间; 应用流式细胞仪检测各组细胞凋亡情况; 应用Western blot法检测凋亡调节蛋白Bax、Akt和P-Akt的表达.
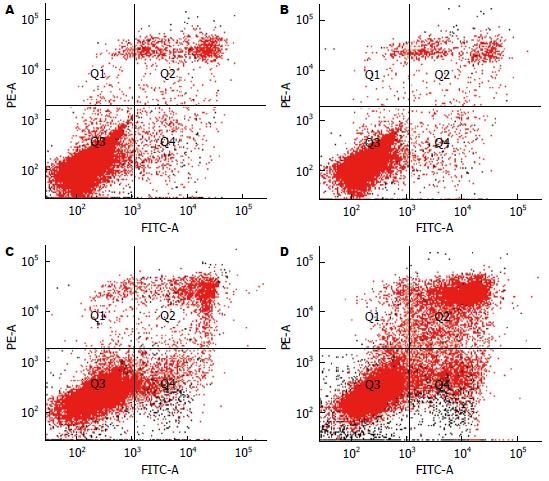
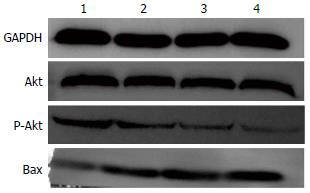
结果: 10 μmol/L ISL不能抑制胃癌细胞株SGC7901的生长, 而25、50、100 μmol/L ISL可明显抑制其生长, 且呈时间和浓度依赖性. 与对照组凋亡率3.23%±0.45%相比, 25 μmol/L组(6.13%±0.61%)、50 μmol/L组(11.70%±0.75%)、100 μmol/L组(26.60%±1.51%)凋亡率逐渐增高(P<0.05). 随ISL浓度的增加, P-Akt蛋白表达水平逐渐降低, 凋亡蛋白Bax表达水平逐渐增加(均P<0.05), 各组间Akt蛋白水平差异无统计学意义.
结论: ISL能够诱导SGC7901细胞凋亡, 其机制可能与下调PI3K/AKT信号转导通路蛋白的表达以及上调其下游的凋亡蛋白Bax有关.
核心提示: 人胃癌SGC7901细胞分为对照组、异甘草素(isoliquiritigenin, ISL)实验组, 通过MTT实验、流式细胞仪及Western blot, 发现ISL能够诱导SGC7901细胞凋亡, 其机制可能与下调PI3K/AKT信号转导通路蛋白的表达以及上调其下游的凋亡蛋白Bax有关, 为其将来在临床上抗肿瘤应用提供有价值的参考.
引文著录: 牛琼, 刘方康, 王爱丽, 贾兴芳, 刘成霞. 异甘草素通过PI3K/Akt通路诱导人胃癌SGC7901细胞凋亡. 世界华人消化杂志 2015; 23(33): 5342-5347
Revised: October 19, 2015
Accepted: October 26, 2015
Published online: November 28, 2015
AIM: To investigate the effect of isoliquiritigenin (ISL) on the apoptosis of human gastric carcinoma SGC7901 cells and to explore the possible mechanism involved.
METHODS: SGC7901 cells in logarithmic growth phase were divided into a control group and an ISL group. After cells were treated with different concentrations of ISL for different durations, cell proliferation was assessed by MTT assay, apoptosis of SGC7901 cells was assessed by flow cytometry, and the expression of Bax, Akt, and P-Akt was tested by Western blot.
RESULTS: The proliferation of SGC7901 cells could not be inhibited by 10 μmol/L ISL, but was significantly inhibited by 25 μmol/L, 50 μmol/L, and 100 μmol/L ISL, and the inhibitory effect was concentration- and time-dependent. Compared with the control group (3.23% ± 0.45%), the apoptosis rates of cells treated with 25 μmol/L (6.13% ± 0.61%), 50 μmol/L (11.70% ± 0.75%), and 100 μmol/L ISL (26.60% ± 1.51%) significantly increased (P < 0.05). The expression level of P-Akt decreased gradually and Bax increased gradually with the increase of the ISL concentration (P < 0.05). There was no statistically significant difference between groups in the expression level of Akt protein.
CONCLUSION: ISL can significantly induce the apoptosis of SGC7901 cells, possibly via mechanisms related to downregulation of the expression of signal transduction pathways protein PI3K/AKT and upregulation of its downstream protein Bax.
- Citation: Niu Q, Liu FK, Wang AL, Jia XF, Liu CX. Isoliquiritigenin induces apoptosis of human gastric carcinoma SGC7901 cells through PI3K/AKT pathway. Shijie Huaren Xiaohua Zazhi 2015; 23(33): 5342-5347
- URL: https://www.wjgnet.com/1009-3079/full/v23/i33/5342.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i33.5342
异甘草素(isoliquiritigenin, ISL), 是甘草中的一种异黄酮化合物. 研究[1-3]表明ISL有着较强的药理活性, 具有抗肿瘤、抗病毒、抗氧化、清除自由基、松弛血管、抑制脂质过氧化等生物活性, 随着研究的深入, ISL抗肿瘤作用逐渐成为近年来的研究热点. 据研究[4]报道, ISL有杀伤胃肿瘤细胞的作用, 其作用机制尚不十分明确. 近年来有研究[5]表明, 信号转导通路的异常改变是肿瘤细胞的重要生物学特征, 其中磷脂酰肌醇3-激酶(phosphatidylinositol 3 kinase, PI3K)-蛋白质丝氨酸苏氨酸激酶(protein kinase B, Akt)在肿瘤信号转导中起着重要的调节作用. PI3K家族成员属于原癌基因, 是肌醇与磷脂酰肌醇(phosphatidylinositol, PI)的重要激酶. 正常情况下, 由其活化而产生的类脂产物作为细胞内的第二信使, 是Akt(又名蛋白激酶B, PKB)转位于胞膜并被活化所必需的, PI3K与Akt所组成的PI3K/Akt信号通路在肿瘤细胞的增殖、迁移、黏附及抗凋亡中起着重要作用[6,7]. 该通路有望在筛选特异性靶向药物的的肿瘤治疗中成为一个很有前景的靶点. 为此本研究力图探讨ISL诱导SGC7901细胞凋亡与PI3K/Akt信号通路蛋白和下游凋亡蛋白Bax表达水平的相关性.
人胃癌细胞系SGC7901(武汉博士德公司), ISL(含量≥98%, 大连美仑生物技术有限公司), 细胞培养基RPMI 1640、胎牛血清(美国Thermo公司), 0.25%胰蛋白酶、细胞裂解液(Solarbio公司, 中国), 噻唑蓝(MTT, Promega公司, 美国). AnnexinⅤ-FITC/PI双染细胞凋亡检测试剂盒购自南京凯基生物公司; 凋亡调节蛋白Bax抗体(一抗)、Akt抗体和磷酸化蛋白激酶B(P-Akt)抗体(一抗)均购自美国Abcam公司; 辣根酶标记的山羊抗兔IgG(二抗)购自北京中杉金桥生物技术有限公司; BCA蛋白浓度测定试剂盒购自上海碧云天生物技术有限公司; 内参GAPDH购自杭州贤至生物科技有限公司. CO2培养箱购自Thermo Fisher Scientific公司(HERAcell 150i, 美国); 多功能酶标仪购自Molecular Devices公司(SpectraMax M2, 美国); CliNX曝光仪购自上海勤翔科学仪器有限公司(ChemiScope 3500 Mini); 流式细胞仪购自BD Pharmingen公司(美国).
1.2.1 细胞培养: SGC7901细胞以含10%胎牛血清的RPMI 1640培养基在37 ℃、50 mL/L CO2的培养箱中常规培养, 每2-3 d用0.25%的胰蛋白酶消化、传代, 取对数生长期细胞用于实验.
1.2.2 MTT实验: 取对数生长期人胃癌SGC7901细胞, 0.25%胰酶消化, 用细胞培养液(含10%胎牛血清的RPMI 1640培养基)制成1×105/mL单细胞悬液接种于96孔板, 每孔100 μL, 于37 ℃、50 mL/L CO2及饱和湿度条件下培养12 h. 实验设对照组(正常细胞培养液), ISL实验组(ISL溶于细胞培养液, 摩尔浓度分别为10、25、50、100 μmol/L), 每组4个复孔. 12 h后将对照组换上100 μL新鲜培养液, ISL实验组去除细胞培养液后换上100 μL相应浓度的ISL培养液. 分别培养24、48、72 h后, 吸去培养液, 各孔加入MTT(5 g/L)20 μL, 继续培养4 h, 小心吸去上层液体, 加DMSO各120 μL, 振荡10 min, 使结晶充分溶解, 在酶标仪上读取490 nm处吸光度(A)值. 计算细胞生长抑制率 = (对照组A值-实验组A值)/对照组A值×100%. 并用Bliss法计算半数抑制浓度(IC50).
1.2.3 AnnexinⅤ-FITC/PI双染法检测细胞凋亡: 用3.5 cm培养皿接种1×105个处于对数生长期的SGC7901细胞, 37 ℃、50 mL/L CO2孵育24 h后, 待贴壁后, 加入ISL使其浓度为25、50、100 μmol/L. 待药物作用于SGC7901细胞24 h后, 收集细胞并离心, 弃上清液, 用4 ℃预冷的PBS液洗2次, 离心、弃上清液, 1×结合缓冲液重悬细胞, 并吹打混匀, 加入5 μL AnnexinⅤ-FITC和10 μL PI染色液(20 mg/L), 避光30 min. 筛网过滤, 使用流式细胞仪测定采集数据. 实验重复3次.
1.2.4 Western blot法检测Bax、Akt和P-Akt的表达: 收集25、50、100 μmol/L的ISL处理的SGC-7901细胞和对照组细胞, 加入100 μL预冷的细胞裂解液, 冰上裂解30 min, 提取总蛋白, 采用碧云天BCA蛋白浓度测定试剂盒进行蛋白定量. 常规制胶、上样, 进行蛋白质电泳, 然后转膜, 封闭. 加入兔抗人Akt(1:1000)、兔抗人P-Akt(1:5000)、兔抗人Bax(1:1000), 4 ℃孵育过夜. 漂洗过后再分别加入辣根酶标记的山羊抗兔IgG(1:5000), 于37 ℃摇床温育2 h. 用CLiNX曝光仪曝光. 每个浓度组重复3次, 取平均值. 以GAPDH为参照, 实验在相同条件下重复3次.
统计学处理 实验数据以mean±SD表示, 采用SPSS19.0统计分析软件进行单因素方差分析比较各组间差异, 多重比较采用LSD-t检验, P<0.05为差异有统计学意义.
10 μmol/L ISL不能抑制胃癌细胞株SGC7901的生长, 而25、50、100 μmol/L ISL可明显抑制胃癌细胞株SGC7901细胞的生长, 随药物浓度的增加, 其抑制作用逐渐增强(均P<0.05), 且ISL对胃癌细胞株SGC7901的生长抑制作用随作用时间呈增强趋势, 24、48、72 h其IC50值分别为60.81、53.95、41.39 μmol/L(表1). 依据以上结果, 筛选25、50、100 μmol/L的ISL用于后续实验, 作用时间为24 h.
| 分组 | A(mean±SD) | 抑制率(%) | ||||
| 24 h | 48 h | 72 h | 24 h | 48 h | 72 h | |
| 对照组 | 0.964±0.042 | 1.519±0.061 | 2.277±0.826 | - | - | - |
| 10 μmol/L组 | 0.907±0.007 | 1.456±0.115 | 2.220±0.107 | - | - | - |
| 25 μmol/L组 | 0.752±0.015ac | 1.052±0.101bc | 1.474±0.058bd | 21.9 | 30.7 | 35.2 |
| 50 μmol/L组 | 0.547±0.073ace | 0.799±0.087bde | 0.856±0.060acf | 43.2 | 47.4 | 62.4 |
| 100 μmol/L组 | 0.392±0.017adfg | 0.537±0.092bdfg | 0.428±0.018aceh | 59.4 | 64.6 | 81.2 |
SGC7901细胞凋亡在不同浓度的ISL干预24 h后, 与对照组相比, 细胞凋亡比例明显增加, 对照组及25、50、100 μmol/L的ISL组凋亡细胞所占的比例分别为3.23%±0.45%、6.13%±0.61%、11.70%±0.75%、26.60%±1.51%, 差异有统计学意义(F = 378.787, P<0.05)(图1).
各组间Akt蛋白水平差异无统计学意义. 与对照组相比, 不同浓度ISL可明显降低SGC7901细胞P-Akt、Bax蛋白水平, 且随药物浓度的增加, P-Akt、Bax蛋白水平逐渐降低, 组间多重比较差异均有统计学意义(均P<0.05)(表2, 图2).
我国是一个胃癌大国, 胃癌位居我国恶性肿瘤发病率为第2位, 死亡率为第3位, 发病人数及死亡人数均占全球胃癌发病总人数的一半左右[8]. 我国的胃癌具有发病率和病死率高、早期胃癌比例低(仅10%左右)、进展期病例为主要诊治对象等特点. 胃癌的发生发展是一个多基因参与、多步骤完成的复杂生物学过程, 从不同的分子水平探求胃癌的发生机制对于制定新的治疗策略具有重要的临床意义. 胃癌目前是尚未攻克和治愈的疾病, 病因复杂, 无特效的根治方法. 常用的治疗方法是手术、放疗、化疗和介入治疗. 而我国的传统医学往往被忽视. 相反, 中医药在肿瘤的治疗方面大有文章可做. 甘草中的有效成分ISL的抗肿瘤作用是近年来研究的热点. 研究[3]表明, ISL可通过抑制肿瘤细胞增殖、诱导肿瘤细胞凋亡、抑制肿瘤组织血管生成、促进肿瘤细胞自噬发生、诱导肿瘤细胞分化等方式发挥抗肿瘤作用. 研究[9]发现, ISL通过WIF1去甲基化下调下游的β-catenin蛋白及细胞周期阻滞, 实现对乳腺癌干细胞的增殖抑制作用. Wang等[10]研究发现, ISL可通过促进低氧诱导因子-1α蛋白酶体的降解抑制血管内皮生长因子(vascular endothelial growth factor, VEGF)的表达, 减少VEGF与其受体VEGFR-2的结合, 抑制肿瘤血管的生成, 从而达到抗肿瘤的目的. ISL可以通过抑制蛋白p-eIF2α和GRP78的表达, 促使细胞线粒体功能障碍, 从而抑制宫颈癌细胞的增殖[11]. 但是尚少见有关ISL诱导人胃癌细胞凋亡及可能机制的报道. 本研究结果显示, ISL能显著抑制SGC7901细胞的增殖, 其抑制作用呈浓度和时间依赖性. 另外, 与对照组相比, 25、50、100 μmol/L组SGC7901细胞的凋亡细胞数逐渐增加, 呈浓度依赖性, 提示ISL能诱导胃癌SGC7901细胞的凋亡, 在25-100 μmol/L的浓度范围内, 药物浓度越高, 其对该胃癌细胞的凋亡诱导作用越大.
在肿瘤发生和发展过程中, 细胞不仅发生了异常增殖, 更重要的是其发生凋亡的能力和倾向降低了. PI3K/Akt信号通路与肺癌、胃癌、大肠癌、乳腺癌、卵巢癌、前列腺癌等多种肿瘤的发生、发展关系密切, 在肿瘤细胞增殖、凋亡、迁移、侵袭等方面发挥重要作用. Akt是PI3K/Akt信号通路的关键分子, 活化的Akt通过影响下游多种效应分子的活化状态而发挥作用. 近年来, 关于活化的Akt与肿瘤的发生、发展的研究取得了重大进展, 活化的Akt可通过抑制细胞凋亡、调节细胞周期、促进血管生成、促进细胞的侵袭和转移等方式促进肿瘤的发生、发展[12].
总之, PI3K/Akt信号通路在避免细胞发生凋亡、维持细胞生物学的特征发挥重要作用, 其中在抑制肿瘤细胞凋亡方面, 研究[13]发现, 活化的Akt能磷酸化Bcl-2家族成员Bax的Serl84位点, 使Bax停留在细胞质中, 促进他和Mcl-1、Bcl-xL形成异源二聚体, 因此抑制细胞凋亡. 另外Akt磷酸化Caspase9前体的Serl96位点, 抑制其蛋白酶活性, 使核因子-κB磷酸化后, 激活他的转录功能, 使促进细胞存活的Bcl-2家族成员Bcl-xL表达增强, 从而促进细胞存活、阻止凋亡的发生. Bax是Bcl-2家族中研究最广泛的促凋亡蛋白. Bax定位于细胞浆, 自身可形成同源二聚体或与Bcl-2形成异源二聚体, 在细胞凋亡中起着重要的调控作用[14]. 有研究[15]表明, ISL可通过上调Bax的表达, 激活线粒体凋亡通路, 实现对人卵巢癌细胞株SKOV3的凋亡诱导作用. 本研究结果显示, ISL可减少SGC7901细胞中P-Akt和增加Bax的蛋白表达水平, 但是, 各组间Akt蛋白表达未见明显差异, 提示甘草素仅对P-Akt的表达有影响, 而对非活化形式的Akt不起作用, 与既往研究[7]结果一致. 本研究结果显示ISL可能通过PI3K/Akt/Akt信号途径上调凋亡蛋白Bax的表达, 进而诱导SGC7901细胞凋亡, 这也可能是ISL抗肿瘤作用的主要机制之一, 可为其将来在临床上的应用提供有价值的参考.
异甘草素是甘草中的一种异黄酮化合物. 既往研究表明异甘草素有着较强的药理活性, 具有抗肿瘤、抗病毒、抗氧化、清除自由基、松弛血管、抑制脂质过氧化等生物活性, 随着研究的深入, 异甘草素抗肿瘤作用逐渐成为近年来的研究热点. 据研究报道, 异甘草素有杀伤胃肿瘤细胞的作用, 其作用机制尚不十分明确.
蒋敬庭, 教授, 常州市第一人民医院(苏州大学附属第三医院)肿瘤生物诊疗中心
异甘草素具有广泛的生物活性, 但在关于抗肿瘤的机制上, 尤其抑制人胃肿瘤细胞凋亡机制方面研究甚少.
有研究表明, ISL可通过上调Bax的表达, 激活线粒体凋亡通路, 实现对人卵巢癌细胞株SKOV3的凋亡诱导作用.
异甘草素在国内未见胃癌方面的报道, 该实验首次在人胃癌SGC7901细胞上做了凋亡及相关可能机制的研究.
本研究显示异甘草素对肿瘤细胞有一定的抑制作用, 在以后的研究中, 可以开发异甘草素或异甘草素类似物, 应用至肿瘤的治疗中, 可以减少西药化疗药物的剂量、减少不良反应、提高疗效.
磷脂酰肌醇3-激酶-蛋白质丝氨酸苏氨酸激酶(PI3K/Akt): 是在肿瘤信号转导中起着重要调节作用的信号转导通路, 活化的Akt通过影响下游多种效应分子的活化状态而发挥作用, 与多种肿瘤细胞增殖、凋亡、迁移、侵袭等方面关系密切.
该研究对指导异甘草素的临床应用提供了有价值的参考.
编辑: 于明茜 电编: 都珍珍
| 1. | Park I, Park KK, Park JH, Chung WY. Isoliquiritigenin induces G2 and M phase arrest by inducing DNA damage and by inhibiting the metaphase/anaphase transition. Cancer Lett. 2009;277:174-181. [PubMed] [DOI] |
| 2. | Zhou GS, Song LJ, Yang B. Isoliquiritigenin inhibits proliferation and induces apoptosis of U87 human glioma cells in vitro. Mol Med Rep. 2013;7:531-536. [PubMed] [DOI] |
| 3. | Chen G, Hu X, Zhang W, Xu N, Wang FQ, Jia J, Zhang WF, Sun ZJ, Zhao YF. Mammalian target of rapamycin regulates isoliquiritigenin-induced autophagic and apoptotic cell death in adenoid cystic carcinoma cells. Apoptosis. 2012;17:90-101. [PubMed] [DOI] |
| 4. | Kim DC, Choi SY, Kim SH, Yun BS, Yoo ID, Reddy NR, Yoon HS, Kim KT. Isoliquiritigenin selectively inhibits H(2) histamine receptor signaling. Mol Pharmacol. 2006;70:493-500. [PubMed] |
| 6. | Hernandez-Aya LF, Gonzalez-Angulo AM. Targeting the phosphatidylinositol 3-kinase signaling pathway in breast cancer. Oncologist. 2011;16:404-414. [PubMed] [DOI] |
| 7. | Lin H, Zheng C, Li J, Yang C, Hu L. Lentiviral shRNA against KCa3.1 inhibits allergic response in allergic rhinitis and suppresses mast cell activity via PI3K/AKT signaling pathway. Sci Rep. 2015;5:13127. [PubMed] [DOI] |
| 8. | Sun Y, Song W, Hou Q, Li J, Guo H. Gallbladder perforation: a rare complication of postoperative chemotherapy of gastric cancer. World J Surg Oncol. 2015;13:245. [PubMed] [DOI] |
| 9. | Wang N, Wang Z, Wang Y, Xie X, Shen J, Peng C, You J, Peng F, Tang H, Guan X. Dietary compound isoliquiritigenin prevents mammary carcinogenesis by inhibiting breast cancer stem cells through WIF1 demethylation. Oncotarget. 2015;6:9854-9876. [PubMed] |
| 10. | Wang Z, Wang N, Han S, Wang D, Mo S, Yu L, Huang H, Tsui K, Shen J, Chen J. Dietary compound isoliquiritigenin inhibits breast cancer neoangiogenesis via VEGF/VEGFR-2 signaling pathway. PLoS One. 2013;8:e68566. [PubMed] [DOI] |
| 11. | Yuan X, Zhang B, Gan L, Wang ZH, Yu BC, Liu LL, Zheng QS, Wang ZP. Involvement of the mitochondrion-dependent and the endoplasmic reticulum stress-signaling pathways in isoliquiritigenin-induced apoptosis of HeLa cell. Biomed Environ Sci. 2013;26:268-276. [PubMed] [DOI] |
| 12. | Liu DY, Xu R, Huang MF, Huang HY, Wang X, Zou Y, Yue HY, Zhao HM. Si Shen Wan Regulates Phospholipase Cγ-1 and PI3K/Akt Signal in Colonic Mucosa from Rats with Colitis. Evid Based Complement Alternat Med. 2015;2015:392405. [PubMed] [DOI] |