修回日期: 2015-10-06
接受日期: 2015-10-13
在线出版日期: 2015-11-18
目的: 通过Meta分析探讨幽门螺杆菌(Helicobacter pylori, H. pylori)感染与胰岛素抵抗(insulin resistance, IR)水平的关系.
方法: 检索国内外各大类型数据库自建库至2015-7发表的有关H. pylori感染与胰岛素抵抗关系的文献. 由2名研究人员独立提取资料并评价纳入文献的质量, 采用Revman5.3软件进行Meta分析.
结果: 纳入7篇参考文献共9项研究, 总样本量3097例, 其中H. pylori(+) 1718例. Meta分析结果: H. pylori(+)组与H. pylori(-)组胰岛素抵抗水平之间差异有统计学意义(WMD = 0.38, 95%CI: 0.13-0.64, P<0.05). 亚组分析显示: 在年龄均数<45岁人群中, H. pylori(+)组与H. pylori(-)组胰岛素抵抗水平之间差异有统计学意义(WMD = 0.63, 95%CI: 0.40-0.86, P<0.05), 在年龄均数≥45岁组, 则无统计学意义; 在胃组织活检组H. pylori(+)人群与H. pylori(-)人群胰岛素抵抗水平之间差异有统计学意义(WMD = 0.70, 95%CI: 0.46-0.94, P<0.05), 而在血清H. pylori-IgG抗体检测组差异无统计学意义; 在体质量指数(body mass index, BMI)<25 kg/m2组, H. pylori(+)人群与H. pylori(-)人群胰岛素抵抗水平之间差异有统计学意义(WMD = 0.72, 95%CI: 0.49-0.96, P<0.05), 而在BMI≥25 kg/m2组差异则无统计学意义; 在亚洲组, H. pylori(+)人群与H. pylori(-)人群胰岛素抵抗水平之间差异有统计学意义(WMD = 0.66, 95%CI: 0.44-0.87, P<0.05), 而在美洲组差异无统计学意义. 发表偏倚分析和敏感性分析结果证实上述Meta分析结果是稳定和可靠的.
结论: H. pylori感染和胰岛素抵抗水平升高具有相关性.
核心提示: 本研究对国内外各大数据库自建库至2015-07公开发表的关于幽门螺杆菌感染(Helicobacter pylori, H. pylori)与胰岛素抵抗指数关系的文献进行Meta分析, 结果表明H. pylori感染与胰岛素抵抗水平升高相关.
引文著录: 岳春艳, 杨彩哲, 刘朝阳, 杨殷. 幽门螺杆菌感染与胰岛素抵抗水平关系的Meta分析. 世界华人消化杂志 2015; 23(32): 5238-5249
Revised: October 6, 2015
Accepted: October 13, 2015
Published online: November 18, 2015
AIM: To investigate the association between Helicobacter pylori (H. pylori) infection and level of insulin resistance (IR).
METHODS: The articles on the association of H. pylori with IR level were retrieved by searching databases from the inception of each database to July 2015. Data extraction and quality assessment were completed by two authors. Meta-analysis was performed using RevMan 5.3 software.
RESULTS: Seven papers with nine studies were included for meta-analysis. A total of 3097 patients, including 1718 H. pylori (+) subjects, were involved. The results of Meta-analysis showed that there was a significant difference in insulin resistance levels between patients with H. pylori infection and those without in the overall population (WMD = 0.38, 95%CI: 0.13-0.64, P < 0.05). Subgroup analysis indicated that the significant difference in insulin resistance levels between patients with H. pylori infection and those without existed in patients aged < 45 years (WMD = 0.63, 95%CI: 0.40-0.86, P < 0.05), those who underwent endoscopic biopsy (WMD = 0.70, 95%CI: 0.46-0.94, P < 0.05), those who had a body mass index (BMI) < 25 kg/m2 (WMD = 0.72, 95%CI:0.49-0.96, P < 0.05), and Asian patients (WMD = 0.66, 95%CI: 0.44-0.87, P < 0.05), but not in patients aged ≥ 45 years, those who underwent serum H. pylori-IgG antibody testing, those who had a BMI ≥ 25 kg/m2, or American patients. The results of publication bias and sensitivity analysis confirmed the reliability and stability of this Meta-analysis.
CONCLUSION: H. pylori infection is associated with elevated insulin resistance.
- Citation: Yue CY, Yang CZ, Liu CY, Yang Y. Meta-analysis of relationship between Helicobacter pylori infection and level of insulin resistance. Shijie Huaren Xiaohua Zazhi 2015; 23(32): 5238-5249
- URL: https://www.wjgnet.com/1009-3079/full/v23/i32/5238.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i32.5238
胰岛素抵抗是指胰岛素分泌量在正常水平时其作用的靶器官或组织对胰岛素的生物效应反应性降低或丧失, 机体需要超过正常量的胰岛素才能在其效应器官产生正常的生理功能,即机体对胰岛素的敏感性降低[1]. 胰岛素抵抗不仅是2型糖尿病重要发病机制, 且加速其致病过程, 还与多种代谢性疾病相关, 严重威胁人类生命健康[2]. 研究导致胰岛素抵抗的危险因素对于防治糖尿病及其他代谢性疾病具有重要意义, 导致胰岛素抵抗的确切机制目前并不完全清楚[3]. 胰岛素抵抗是由多基因与多环境危险因素相互作用的结果[4-11], 已经确定年龄、体质量指数(body mass index, BMI)、糖毒性、脂毒性、糖尿病家族史、氧化应激、炎性反应等为胰岛素抵抗的重要危险因素[8-11]. 幽门螺杆菌(Helicobacter pylori, H. pylori)是一种微需氧革兰氏阴性弯曲杆菌, 可长期定植于人体胃黏膜, 与消化性溃疡、慢性胃炎、胃黏膜相关淋巴组织淋巴瘤和胃癌密切相关[12]. 越来越多的研究[13-18]表明H. pylori感染不仅可导致多种消化系统疾病, 还与糖尿病、缺铁性贫血、特发性血小板减少性紫癜、动脉粥样硬化性疾病、心血管疾病、非酒精性脂肪性肝病和其他代谢性疾病等胃肠外疾病密切相关. H. pylori感染与胰岛素抵抗的关系是当前研究热点, 有研究[19-21]发现: H. pylori感染与胰岛素抵抗水平升高相关. 还有研究表明[22-25]: H. pylori感染与胰岛素抵抗无明显相关性. 因此本研究采用Meta分析对国内外大型数据库自建库至2015-07公开发表的关于H. pylori感染与胰岛素抵抗指数关系的文献进行综合定量分析.
文献检索: (1)在Cochrane Library、Embase、PubMed、CNKI、万方、中国生物医学文献数据库、中国优秀博硕士学位论文全文数据库、维普资讯网中检索2015-07之前发表的关于H. pylori感染与胰岛素抵抗关系的文献. 英文检索词为: "Helicobacter pylori OR H. pylori OR HP"、"insulin resistence OR insulin sensitivity OR IR"; 中文检索词为: "幽门螺杆菌 OR HP"、"胰岛素抵抗 OR 胰岛素敏感"; (2)对所获文献题目、摘要、关键词以及主题词进行分析, 以进一步确定文献检索的关键词; (3)检索策略遵循Cochrane系统评价手册, 采用主题词与自由词结合的方式, 并手工追查已获文献的参考文献, 以获取以上检索未发现的研究资料.
1.2.1 文献纳入及排除标准: 纳入标准: (1)研究类型: 横断面研究或病例对照研究, 包括病例组和对照组,病例数量和匹配方式不限, 病例组和对照组有确切的样本量, 胰岛素抵抗指数均值及标准差; (2)研究对象: 研究对象为健康成年人, 性别、年龄、人种、国籍等不限; (3)发表语种不限. 排除标准: (1)文献类型为动物试验、综述、评论、病例报道、邮件、会议纪要等; (2)研究对象为年龄<18岁或糖尿病患者; (3)采用定性或半定量标准评估胰岛素抵抗; (4)无对照组研究; (5)未控制混杂因素的研究; (6)重复使用同一数据、信息较少及质量太差等无法利用的研究.
1.2.2 文献筛选与资料提取: 由2位研究人员独立筛选文献、提取数据, 并进行交叉核对, 如对结果意见不一致, 则共同讨论或由第三名高年资研究者判断解决, 对不采纳的研究说明排除理由. 本研究采用预先制定的数据提取表格从最终纳入Meta分析的文献中提取资料, 摘录内容包括第一作者、发表年份、研究对象特征(年龄、性别、BMI)、研究类型、研究地区、H. pylori感染诊断标准、病例组和对照组的样本量、胰岛素抵抗指数mean±SD.
1.2.3 文献质量评价: 选用Cochrane协作网推荐的横断面研究质量评价标准对纳入的文献进行质量评估[26]. 该量表共11个条目, 包括研究对象选择、研究质量控制和数据处理等方面, 用"是""否"和"不清楚"回答. 质量评价由2名研究人员同时独立进行, 产生分歧时经讨论后由第三方进行裁决.
统计学处理 应用Cochrane协作网提供的Revman 5.3软件进行系统分析. 采用加权均数差(weighted mean difference, WMD)及95%CI对计量资料进行定量分析. 采用I2对各研究间的异质性进行定量检验, 若I2≤50%, 认为异质性无统计学意义, 采用固定效应模型分析; 反之, I2>50%认为异质性有统计学意义, 采用随机效应模型分析, 并探索异质性来源,根据可能产生异质性的因素进行亚组分析. 为保证Meta分析结果的稳定性进行敏感性分析: 将纳入的研究逐个去除后, 重新进行合并分析, 比较合并前后效应值间有无显著性差异. 用Begg's检验和Egger's检验定量评估发表偏倚, 以P<0.05为差异有统计学意义, 提示不排除发表偏倚存在. 若纳入的研究数少于10个, 则加用剪补法消除发表偏倚后进一步评估结论的稳定性.
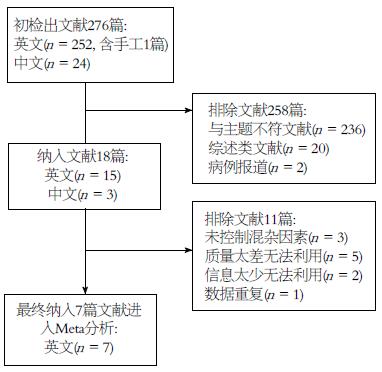
初检出相关文献276篇, 其中英文252篇, 中文24篇, 通过阅读文章题目和摘要, 纳入18篇文献. 进一步查找和阅读全文, 排除未控制混杂因素3篇、质量太差无法利用5篇、信息太少无法利用2篇及数据重复使用1篇, 最终纳入7篇文献进行Meta分析(图1). 7篇文献均可提取出H. pylori感染组和未感染组的样本量、胰岛素抵抗指数均值±标准差及其他信息(表1, 2). 其中6项为横断面研究, 1项为病例对照研究.7篇文献均以英文发表, 包括土耳其3篇、伊朗2篇、美国2篇. H. pylori感染者 1718人, 阴性者1379人. Malamug等[23]的研究按非西班牙裔白人(NHW)、非西班牙裔黑人(NHB)、墨西哥裔美国人(MA)分别评价H. pylori感染与胰岛素抵抗的关系, 遂将Malamug等[23]的研究作为3项研究分别纳入, 共9项研究进行Meta分析. 其中3项研究表明H. pylori感染与胰岛素抵抗水平相关, 6项研究表明H. pylori感染与胰岛素抵抗水平无明显相关性. 纳入标准虽包含多种定量评估胰岛素抵抗的方法, 但纳入的9项研究均采用稳态模型胰岛素抵抗指数(homestasis model assessment for insulin resistance, HOMA-IR)评估.
| 第一作者 | n | 年龄(岁) | 性别(男/女) | BMI(kg/m2) | HOMA-IR | |||||
| + | - | + | - | + | - | + | - | + | - | |
| Aydemir等[19] | 36 | 27 | 46.10± 10.1 | 48.50± 10.70 | 21/15 | 14/13 | 23.50± 3.00 | 24.40± 3.00 | 2.56± 1.54 | 1.73± 1.10 |
| Eshraghian等[20] | 43 | 28 | 32.20± 14.2 | 33.00± 8.05 | 22/21 | 15/13 | 23.15± 4.50 | 24.04± 3.20 | 3.54± 2.20 | 2.46± 1.9 |
| Aslan等[21] | 55 | 48 | 37.00± 12 | 35.00± 15.00 | 29/26 | 28/20 | 23.50± 1.60 | 22.50± 3.10 | 1.67± 0.99 | 0.89± 0.47 |
| Vafaeimanesh等[22] | 110 | 108 | 39.88± 12.5 | 39.18± 12.44 | 52/58 | 57/51 | 26.24± 4.33 | 26.25± 5.04 | 3.01± 2.12 | 2.74± 2.18 |
| Malamug等[23] | 183 | 687 | 60.00± 28.50 | 47.48± 15.06 | 90/93 | 329/358 | 27.61± 5.63 | 27.54± 5.99 | 3.11± 3.45 | 2.71± 2.33 |
| Malamug等[23] | 187 | 192 | 49.00± 18.53 | 39.12± 26.92 | 99/88 | 79/113 | 29.42± 7.73 | 29.35± 7.56 | 3.35± 2.94 | 3.41± 2.9 |
| Malamug等[23] | 361 | 211 | 45.48± 19.02 | 36.83± 19.05 | 173/188 | 86/125 | 28.34± 5.69 | 27.60± 5.80 | 3.32± 2.36 | 3.29± 2.51 |
| Jeon等[24] | 719 | 63 | 68.80± 6.81 | 66.80± 7.04 | 270/449 | 26/37 | 28.70± 4.81 | 28.90± 6.52 | 1.90± 1.41 | 1.80± 2.01 |
| Gokcel等[25] | 24 | 15 | 42.83± 1.79 | 44.53± 2.89 | 0/24 | 0/15 | 24.38± 0.7 | 23.23± 0.52 | 1.95± 0.93 | 1.66± 0.85 |
所有纳入的横断面研究人群资料来源、纳入排除标准均很明确, 混杂因素得到了合理控制. 但只有部分研究明确报告了排除分析任何患者的理由[20,23,24]和丢失数据的处理方法[24](表3).
| 第一作者 | 发表年份 | 质量评价 | ||||||||||
| (1) | (2) | (3)1 | (4) | (5) | (6) | (7) | (8) | (9) | (10) | (11)3 | ||
| Aydemir等[19] | 2005 | 是 | 是 | 是 | 是 | 不清楚 | 是 | 否 | 是 | 否 | 是 | 否 |
| Eshraghian等[20] | 2009 | 是 | 是 | 是 | 是 | 否 | 是 | 是 | 是 | 否 | 是 | 否 |
| Aslan等[21] | 2006 | 是 | 是 | 是 | 是 | 否 | 是 | 否 | 是 | 否 | 是 | 否 |
| Vafaeimanesh等[22] | 2014 | 是 | 是 | 是 | 是 | 否 | 是 | 否 | 是 | 否 | 是 | 否 |
| Malamug等[23] | 2014 | 是 | 是 | 是 | 是2 | 否 | 是 | 是 | 是 | 否 | 是 | 否 |
| Jeon等[24] | 2012 | 是 | 是 | 是 | 是2 | 否 | 是 | 是 | 是 | 是 | 是 | 否 |
| Gokcel等[25] | 2003 | 是 | 是 | 是 | 是 | 否 | 是 | 否 | 是 | 否 | 是 | 否 |
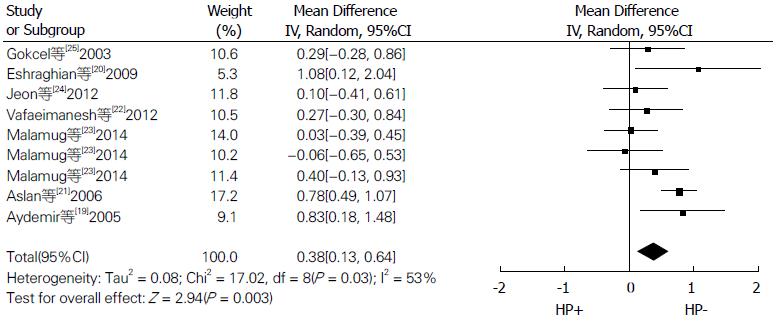
用Revman5.3软件进行异质性检验, I2 = 53%, P = 0.03, 表明纳入的9项研究异质性有统计学意义, 故应用随机效应模型进行合并分析. 9项研究WMD = 0.38, 95%CI: 0.13-0.64, 不包括0, 说明H. pylori感染人群与未感染人群胰岛素抵抗水平之间差异有统计学意义, H. pylori感染与胰岛素抵抗增加有相关性(图2).
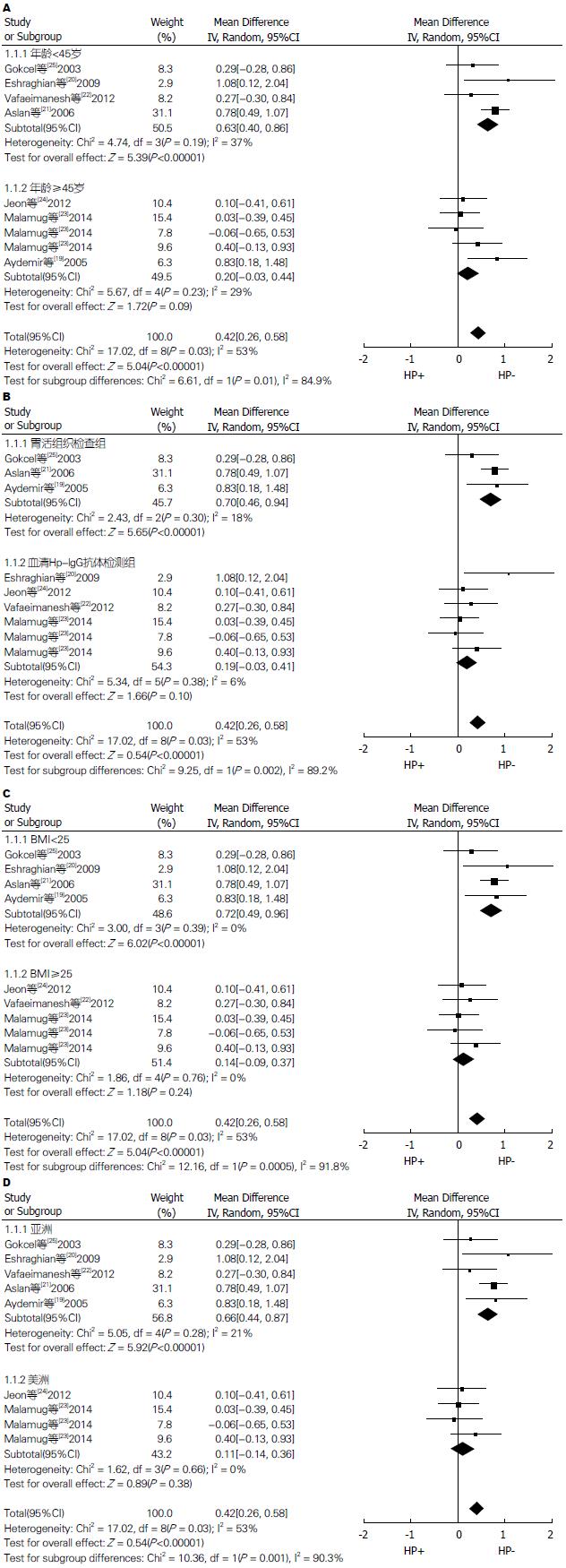
2.3.1 亚组分析: 因纳入的9项研究存在异质性, 故对可能影响研究结果同质的因素进行亚组分析. (1)按年龄分析: 按H. pylori感染组年龄均数<45岁和≥45岁分为青年和中老年2个亚组, 两亚组异质性检验均无统计学意义(P>0.05). 共有4项研究来自于青年组, 其中2项为阳性结果; 5项研究来自于中老年组, 其中1项为阳性结果. 在青年组, H. pylori(+)组与H. pylori(-)组胰岛素抵抗指数水平之间的差异有统计学意义(WMD = 0.63, 95%CI: 0.40-0.86, P<0.05); 在中老年组, 差异无统计学意义(WMD = 0.20, 95%CI: -0.03-0.44, P>0.05)(图3A); (2)按H. pylori感染诊断标准分析: 按H. pylori感染诊断标准分为胃活组织检查组和血清H. pylori-IgG抗体检测组, 两亚组异质性检验均无统计学意义(P>0.05). 胃活组织检查组共纳入3项研究, 2项为阳性结果; 血清H. pylori-IgG抗体检测组6项研究, 1项为阳性结果. 在胃活组织检查组, H. pylori感染人群与未感染人群胰岛素抵抗指数水平之间差异有统计学意义(WMD = 0.70, 95%CI: 0.46-0.94, P<0.05); 在血清HP-IgG抗体检测组, 差异无统计学意义(WMD = 0.19, 95%CI: -0.03-0.41, P>0.05)(图3B); (3)按BMI分析: 按H. pylori感染组BMI均数<25 kg/m2和≥25 kg/m2分为2个亚组进行分析, 两亚组异质性检验均无统计学意义(P>0.05). 共有4项研究来自于BMI<25 kg/m2组, 其中3项为阳性结果; 5项研究来自于BMI≥25 kg/m2组, 全部为阴性结果. 在BMI<25 kg/m2组, H. pylori感染人群与H. pylori未感染人群胰岛素抵抗指数水平之间差异有统计学意义(WMD = 0.72, 95%CI: 0.49-0.96, P<0.05); 在BMI≥25 kg/m2组, 差异无统计学意义(WMD = 0.14, 95%CI: -0.09-0.37, P>0.05)(图3C); (4)按地区分析: 分为亚洲和美洲2个亚组进行分析, 两亚组异质性检验均无统计学意义(P>0.05). 共有5项研究来自于亚洲组, 其中3项为阳性结果; 4项研究来自于美洲组, 全部为阴性结果.在亚洲组, H. pylori感染人群与H. pylori未感染人群胰岛素抵抗指数水平之间差异有统计学意义(WMD = 0.66, 95%CI: 0.44-0.87, P<0.05); 在美洲组, 二者之间差异无统计学意义(WMD = 0.11, 95%CI: -0.14-0.36, P>0.05)(图3D). 本次Meta分析共有8项研究为横断面研究, 1项研究为病例对照研究, 故不对研究类型进行亚组分析.
2.3.2 敏感性分析: 为保证结论的稳定性, 对Meta分析的结果进行敏感性分析. 采用逐个剔除各项研究的方法重新进行Meta分析, 估计合并效应量, 并与剔除前的合并效应量进行比较. 结果显示, 剔除每项研究前后的合并效应量均无明显变化, 提示本研究所得结果稳定可靠.
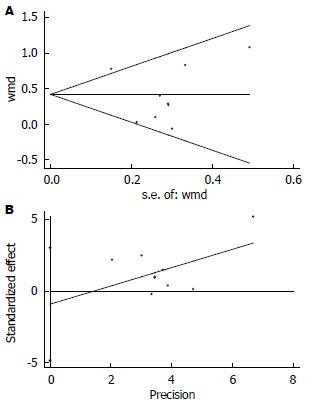
2.3.3 发表偏倚分析: 对纳入Meta分析的9项研究进行发表偏倚评价, Begg's检验漏斗图显示未见明显不对称分布(P>0.05); Egger's检验(P>0.05), Egger回归线通过0点, 表明无显著发表偏倚存在. 考虑本研究纳入文献数少于10个, 用剪补法进一步评估发表偏倚, 补充的研究数为0, 剪补前后固定效应模型及随机效应模型的结果无变化, 提示本次Meta分析无明显发表偏倚, 对最终H. pylori感染增加胰岛素抵抗的合并效应值无实质影响(图4).
H. pylori是世界范围内最常见的慢性感染细菌之一, 在发展中国家的感染率可达80%, 其相关危险因素主要包括: 地理区域、年龄、社会经济地位、教育程度、居住环境和职业等[27]. 目前诊断H. pylori感染的方法包括侵入性和非侵入性两类. 侵入性检查依赖胃镜, 包括快速尿素酶试验、组织学检测、细菌培养、基因方法检测.非侵入性检查不依赖胃镜, 包括13C或14C尿素呼气试验、血清H. pylori抗体检测和粪便H. pylori抗原检测等.目前国际并无诊断H. pylori感染的金标准[28]. 本次Meta分析9项研究中3项采用胃活组织检查诊断H. pylori感染, 其中2项采用组织学检测(敏感度: 66%-100%, 特异度: 94%-100%), 1项采用快速尿素酶试验+组织学检测(敏感度>95%, 特异度>95%)[29]. 胃镜下活组织检查诊断H. pylori感染的敏感度和特异度较高, 但该操作复杂、有创, 不宜在健康人群中推广. 6项采用血清H. pylori-IgG抗体检测, 该方法的敏感度和特异度分别为85%和79%[28]. 只需单次静脉采血, 可反映一段时间内H. pylori感染情况, 不同试剂盒检测的准确性差异较大, 且受机体免疫反应、营养状况、H. pylori感染暴露时间等影响, 与其他细菌抗原有一定交叉反应. H. pylori根除后血清抗体可以维持数月至数年, 不能区分现症感染或既往感染, 有一定假阳性率和假阴性率, 主要适用于临床实践和流行病学调查[30].
目前定量评估胰岛素抵抗的方法有两类: 动态评估法和静态评估法. 前者基于外源性葡萄糖和胰岛素的使用, 包括高胰岛素正常血糖钳夹试验、高葡萄糖钳夹试验、胰岛素抑制试验、口服糖耐量试验、间歇采样静脉葡萄糖耐量试验. 后者基于空腹血糖和胰岛素等指标的单次测量, 包括稳态模型评估胰岛素抵抗指数、定量胰岛素敏感性检测指数. 高胰岛素正常血糖钳夹试验为评估胰岛素抵抗的金标准, 但其操作复杂, 需要多次抽血, 且抽血间隔时间短, 费时, 对操作人员要求高, 需要床旁血糖分析仪, 价格昂贵, 只适用于小样本的科研工作, 用于大样本人群检测胰岛素抵抗有一定难度[31]. 本研究均采用HOMA-IR评估胰岛素抵抗, 该方法只需单次静脉采血测定空腹血糖和胰岛素, 通过公式HOMA-IR = 空腹血糖(mmol/L)×空腹胰岛素(mU/L)/22.5即可算出, 具有操作简单、无创、省时、省力等优点, 是临床实践和流行病学调查最常使用的评估胰岛素抵抗的方法[32]. 该指数可同时反映肝脏及外周胰岛素抵抗情况, 结果与高胰岛素正常血糖钳夹试验一致性最好[33]. 其缺点为测定的结果受胰岛细胞功能的干扰, 只能近似反映胰岛素抵抗水平. 目前国际并无关于HOMA-IR的正常范围, 在不同人群其上限值在2-3之间[34-36].
本次Meta分析计量资料研究表明, H. pylori阳性组胰岛素抵抗水平(HOMA-IR)较H. pylori阴性组有明显升高, 说明H. pylori感染和胰岛素抵抗加重有相关性. 通过亚组分析发现: (1)按H. pylori感染组年龄均数<45岁和≥45岁分为青年和中老年2个亚组, 青年组H. pylori感染与胰岛素抵抗增加具有相关性, 而中老年组差异无统计学意义. 有研究[37]表明: 胰岛素抵抗随年龄增长而增加. 本次研究在年龄≥45岁人群中H. pylori感染与胰岛素抵抗无明显相关性, 可能是因为5项研究中仅有1项表明H. pylori感染与胰岛素抵抗相关, 所占权重最小, 影响结果的评估[19]; 也可能是在年龄≥45岁人群中H. pylori感染与胰岛素抵抗无关. 为进一步探讨二者的关系在≥45岁人群中是否存在, 仍需大样本的研究进行更详细的年龄段分层来分析在中老年患者中H. pylori感染是否为胰岛素抵抗的危险因素; (2)按H. pylori感染诊断标准分为2个亚组后, 胃活组织检查组H. pylori感染与胰岛素抵抗水平相关, 而血清H. pylori-IgG抗体检测组差异无统计学意义. 这可能是因为H. pylori-IgG抗体检测组共纳入6项研究, 其中仅1项为阳性结果(H. pylori阳性43例, H. pylori阴性28例)[20], 与亚组总例数(H. pylori阳性1603例, H. pylori阴性1289例)相比所占比例太少, 可能影响到结果的评估. 也可能因为胃镜活组织检查诊断H. pylori感染的敏感度和特异度较高, 结果较为准确可靠, 血清H. pylori-IgG抗体检测有一定的假阳性率和假阴性率, 影响结果评估; (3)按H. pylori感染组BMI均数<25和BMI≥25分为2个亚组, BMI<25人群中H. pylori感染与胰岛素抵抗具有相关性, 而BMI≥25的人群差异无统计学意义. 本研究纳入BMI≥25的5项研究均显示H. pylori感染与胰岛素抵抗无明显相关性. 这可能是由于BMI为影响胰岛素抵抗的独立危险因素, 随BMI增加胰岛素抵抗明显增加[38], 可能掩盖了H. pylori感染增加胰岛素抵抗的作用. Gerig[39]等的研究亦表明在严重肥胖患者中H. pylori感染与胰岛素抵抗无明显相关性, 与本次亚组分析结果相一致. 为进一步论证H. pylori感染与胰岛素抵抗的相关性在BMI≥25的人群中是否存在, 还需更多BMI≥25的人群为研究对象的大样本原始研究来证实; (4)按地区分布分析, 亚洲H. pylori感染者胰岛素抵抗指数明显高于未感染者, 而在美洲却未发现. 来源于美洲的4项研究均表明H. pylori感染与胰岛素抵抗不相关, 这可能由于不同种族基因遗传以及不同地区人群生活方式的差异所致[40].
在解释结果时要考虑偏倚. 首先, H. pylori感染的错误分类可能影响结果的评估. 本次Meta分析9项研究中, 3项采用胃活组织检查, 6项采用血清H. pylori-IgG抗体检测, 敏感度和特异度均不能达到100%, 由H. pylori感染诊断错误造成的分组错误可能影响结果的评估. 其次, 本研究中胰岛素抵抗的评估均采用公式HOMA-IR = 空腹血糖(mmol/L)×空腹胰岛素(mU/L)/22.5计算得出, 该方法只需单次采血测空腹血糖和胰岛素即可. 但胰岛素释放呈脉冲式, 理想情况下应空腹每隔5 min采血1次共3次, 混匀后测量的胰岛素值才能用于HOMA-IR计算. 该公式基于上世纪80年代胰岛素测量方法下产生, 并根据当时试验技术条件进行了一定的校正. 现在使用的胰岛素测量方法更为精确, 排除了胰岛素原的干扰, 仍使用同样的公式, 可能会低估胰岛素抵抗, 不除外测量偏倚的可能. 统一H. pylori感染的诊断标准和寻找精确易行的胰岛素抵抗评价方法对结果的分析至关重要. 另外, 由于近年来公开发表的文献中有一些为研究结果不完整, 仅以H. pylori感染组HOMA-IR>2.5(或2.0)的发病率高于H. pylori阴性组作为评估H. pylori感染增加胰岛素抵抗的指标[8,35], 分析时不能利用, 造成信息量的丢失. 另外, 在某些研究中, 并不是以胰岛素抵抗或胰岛素敏感为研究目的[24,25], 所以阴性结果也得以发表, 发表偏倚在本研究中未得到体现. 9项研究中8项为横断面研究, 1项为病例对照研究. 横断面研究收集的信息只反映调查当时个体的H. pylori感染及胰岛素抵抗情况, 而不能推断是长期H. pylori感染诱发了胰岛素抵抗或是胰岛素抵抗改变机体免疫状态增加了H. pylori的感染. 病例对照研究难免受到选择性偏倚的影响, 其结果不如前瞻性研究真实可靠, 存在一定的局限性, 这不可避免的影响到研究结果的真实性. 但本次Meta分析对检索到的参考文献按照纳入标准严格筛选, 排除未控制混杂因素的研究, 根据主要影响因素: 年龄(以中年人45岁为界)、BMI(以超重BMI≥25为界)、H. pylori感染诊断标准(胃活组织检查和血清H. pylori-IgG抗体)、地区(亚洲和美洲)进行亚组分析, 尽量减少各研究结果间的异质性, 但每个亚组分析仅从一个角度加以分析, 且样本量减少, 可能影响到结果的评估. 如果同时有多个混杂因素存在, 目前方法尚无法解决.
从研究结果看, 各H. pylori感染组与未感染组HOMA-IR的差异均数在0.38-0.72之间, 具有统计学意义, 与临床意义评价相一致.目前认为H. pylori感染增加胰岛素抵抗的生物学机制尚不十分清楚[34], 可能包括: (1)释放大量炎性反应因子和血管活性物质, 诱发和加重胰岛素抵抗[41]; (2)改变胃黏膜环境, 影响胃肠激素分泌,增加糖异生, 降低糖利用, 导致糖毒性引起胰岛素抵抗[42]; (3)产生氧化应激, 参与胰岛素抵抗的发生发展[10]; (4)影响脂质代谢, 加重血管炎症反应, 触发胰岛素抵抗[43]; (5)增强血小板的活化和聚集功能, 引起胰岛素抵抗[44]; (6)导致慢性萎缩性胃炎从而减少维生素B12和叶酸的吸收, 导致血中同型半胱氨酸浓度升高, 参与胰岛素抵抗相关性疾病的发生发展[45]; (7)改变细胞凋亡过程, 在胰岛素抵抗相关性疾病的病理生理学机制中起重要作用[46]. H. pylori感染与胰岛素抵抗的关系是近几年研究的重点课题之一, 由于受到各种混杂因素的限制, 临床意义仍有待更高质量的临床研究证实, 如进一步扩大样本量, 统一H. pylori感染的诊断标准和胰岛素抵抗评价方法, 按不同地区、不同种族来分析H. pylori感染与胰岛素抵抗水平的关系.
总之, 本次Meta分析结果表明H. pylori感染与胰岛素抵抗水平升高相关, 样本量较大, 在一定程度上揭示了二者的关系, 结果可信. H. pylori感染是否为胰岛素抵抗的病因尚待大样本前瞻性队列研究证实, 以及需要进行设计周密的随机对照试验来研究根除H. pylori感染能否改善胰岛素抵抗. 虽然可能存在某些偏倚(选择偏倚、诊断偏倚、测量偏倚)影响本次Meta分析结果, 但还是可以提示H. pylori感染可能在胰岛素抵抗的发生发展中起一定作用, 对其防治有一定启示.
胰岛素抵抗不仅是2型糖尿病重要发病机制, 且加速其致病过程, 还与多种代谢性疾病相关. 幽门螺杆菌(Helicobacter pylori, H. pylori)是世界范围内最常见的慢性感染细菌之一, 在发展中国家的感染率可达80%. H. pylori感染与胰岛素抵抗水平关系是当前研究热点, 但二者是否相关目前尚存争议. 本文对各中心的横断面及对照研究进行系统评价.
陈国忠, 主任医师, 广西中医学院第一附属医院消化内科
胰岛素抵抗是由多基因与多环境危险因素相互作用的结果, 其确切机制目前并不完全清楚. H. pylori感染与胰岛素抵抗水平升高是否相关报道不一. 研究导致胰岛素抵抗的危险因素对于防治糖尿病及其他代谢性疾病具有重要意义.
2014年Vafaeimanesh等的一项横断面研究, 共纳入糖尿病患者211例, 其中H. pylori阳性139例, H. pylori阴性72例, H. pylori感染患者胰岛素抵抗指数明显高于对照组. 2012年Jeon等的一项前瞻性队列研究, 共纳入782例年龄>60岁的非糖尿病人群, 根据血清H. pylori抗体分为H. pylori阳性组和H. pylori阴性组, 追踪随访10年, H. pylori阳性组发生糖尿病的风险是阴性组的2.7倍.
目前尚未见有关研究H. pylori感染与胰岛素抵抗水平相关性的系统性综述, 本研究以Meta分析研究二者之间的相关关系.
胰岛素抵抗的发病机制目前并不完全清楚. 本次Meta分析发现H. pylori感染与胰岛素抵抗水平具有相关性, H. pylori感染患者胰岛素抵抗水平升高, 如能进一步通过前瞻性随机对照研究证实H. pylori感染是胰岛素抵抗的病因, 可从新的角度考虑胰岛素抵抗的治疗.
剪补法: 由Taylor和Tweedie提出, 其基本思想是首先剪掉初估后漏斗图中不对称的部分, 用剩余对称部分估计漏斗图的中心值, 然后沿中心两侧黏补上被剪切部分以及相应的遗漏部分, 最后基于贴补后的漏斗图估计合并效应值的真实值.
该文章通过对国内外已发表关于"H. pylori感染与胰岛素抵抗指数关系"的文献数据进行综合分析, 寻找H. pylori感染与胰岛素抵抗间的关系, 有一定科学意义. 该文献亚组分组合理, 分析详细, 调理清晰, 引用文献较新.
编辑: 郭鹏 电编: 闫晋利
| 1. | Chawla A, Nguyen KD, Goh YP. Macrophage-mediated inflammation in metabolic disease. Nat Rev Immunol. 2011;11:738-749. [PubMed] [DOI] |
| 2. | Polyzos SA, Kountouras J, Zavos C. Nonalcoholic fatty liver disease: the pathogenetic roles of insulin resistance and adipocytokines. Curr Mol Med. 2009;9:299-314. [PubMed] |
| 3. | Jung UJ, Choi MS. Obesity and its metabolic complications: the role of adipokines and the relationship between obesity, inflammation, insulin resistance, dyslipidemia and nonalcoholic fatty liver disease. Int J Mol Sci. 2014;15:6184-6223. [PubMed] [DOI] |
| 4. | Stefanowicz M, Strączkowski M, Karczewska-Kupczewska M. [The role of SIRT1 in the pathogenesis of insulin resistance in skeletal muscle]. Postepy Hig Med Dosw (Online). 2015;69:63-68. [PubMed] [DOI] |
| 5. | Iovino S, Burkart AM, Kriauciunas K, Warren L, Hughes KJ, Molla M, Lee YK, Patti ME, Kahn CR. Genetic insulin resistance is a potent regulator of gene expression and proliferation in human iPS cells. Diabetes. 2014;63:4130-4142. [PubMed] [DOI] |
| 6. | Arora A, Dey CS. SIRT2 negatively regulates insulin resistance in C2C12 skeletal muscle cells. Biochim Biophys Acta. 2014;1842:1372-1378. [PubMed] [DOI] |
| 7. | Tang Z, Zhang W, Wan C, Xu G, Nie X, Zhu X, Xia N, Zhao Y, Wang S, Cui S. TRAM1 protect HepG2 cells from palmitate induced insulin resistance through ER stress-JNK pathway. Biochem Biophys Res Commun. 2015;457:578-584. [PubMed] [DOI] |
| 8. | Chen LW, Chien CY, Yang KJ, Kuo SF, Chen CH, Chien RN. Helicobacter pylori Infection Increases Insulin Resistance and Metabolic Syndrome in Residents Younger than 50 Years Old: A Community-Based Study. PLoS One. 2015;10:e0128671. [PubMed] [DOI] |
| 9. | Gruzdeva O, Uchasova E, Dyleva Y, Belik E, Shurygina E, Barbarash O. Plasminogen activator inhibitor-1, free fatty acids, and insulin resistance in patients with myocardial infarction. Diabetes Metab Syndr Obes. 2013;6:293-301. [PubMed] [DOI] |
| 10. | Henriksen EJ, Diamond-Stanic MK, Marchionne EM. Oxidative stress and the etiology of insulin resistance and type 2 diabetes. Free Radic Biol Med. 2011;51:993-999. [PubMed] [DOI] |
| 11. | McNelis JC, Olefsky JM. Macrophages, immunity, and metabolic disease. Immunity. 2014;41:36-48. [PubMed] [DOI] |
| 12. | Marie MA. Relationship between Helicobacter pylori virulence genes and clinical outcomes in Saudi patients. J Korean Med Sci. 2012;27:190-193. [PubMed] [DOI] |
| 13. | Franceschi F, Tortora A, Gasbarrini G, Gasbarrini A. Helicobacter pylori and extragastric diseases. Helicobacter. 2014;19 Suppl 1:52-58. [PubMed] [DOI] |
| 14. | Monzón H, Forné M, Esteve M, Rosinach M, Loras C, Espinós JC, Viver JM, Salas A, Fernández-Bañares F. Helicobacter pylori infection as a cause of iron deficiency anaemia of unknown origin. World J Gastroenterol. 2013;19:4166-4171. [PubMed] [DOI] |
| 15. | Li X, Sheng G, Xing H. Relationships among HLA-DRB1 Alleles, Helicobacter pylori infection and idiopathic thrombocytopenic purpura in children. Minerva Pediatr. 2015;67:377-379. [PubMed] |
| 16. | Chmiela M, Gajewski A, Rudnicka K. Helicobacter pylori vs coronary heart disease - searching for connections. World J Cardiol. 2015;7:187-203. [PubMed] [DOI] |
| 17. | Polyzos SA, Kountouras J, Papatheodorou A, Patsiaoura K, Katsiki E, Zafeiriadou E, Zavos C, Anastasiadou K, Terpos E. Helicobacter pylori infection in patients with nonalcoholic fatty liver disease. Metabolism. 2013;62:121-126. [PubMed] [DOI] |
| 18. | Shin DW, Kwon HT, Kang JM, Park JH, Choi HC, Park MS, Park SM, Son KY, Cho B. Association between metabolic syndrome and Helicobacter pylori infection diagnosed by histologic status and serological status. J Clin Gastroenterol. 2012;46:840-845. [PubMed] [DOI] |
| 19. | Aydemir S, Bayraktaroglu T, Sert M, Sokmen C, Atmaca H, Mungan G, Gun BD, Borazan A, Ustundag Y. The effect of Helicobacter pylori on insulin resistance. Dig Dis Sci. 2005;50:2090-2093. [PubMed] |
| 20. | Eshraghian A, Hashemi SA, Hamidian Jahromi A, Eshraghian H, Masoompour SM, Davarpanah MA, Eshraghian K, Taghavi SA. Helicobacter pylori infection as a risk factor for insulin resistance. Dig Dis Sci. 2009;54:1966-1970. [PubMed] [DOI] |
| 21. | Aslan M, Horoz M, Nazligul Y, Bolukbas C, Bolukbas FF, Selek S, Celik H, Erel O. Insulin resistance in H pylori infection and its association with oxidative stress. World J Gastroenterol. 2006;12:6865-6868. [PubMed] |
| 22. | Vafaeimanesh J, Parham M, Seyyedmajidi M, Bagherzadeh M. Helicobacter pylori infection and insulin resistance in diabetic and nondiabetic population. ScientificWorldJournal. 2014;2014:391250. [PubMed] [DOI] |
| 23. | Malamug LR, Karnchanasorn R, Samoa R, Chiu KC. The Role of Helicobacter pylori Seropositivity in Insulin Sensitivity, Beta Cell Function, and Abnormal Glucose Tolerance. Scientifica (Cairo). 2014;2014:870165. [PubMed] [DOI] |
| 24. | Jeon CY, Haan MN, Cheng C, Clayton ER, Mayeda ER, Miller JW, Aiello AE. Helicobacter pylori infection is associated with an increased rate of diabetes. Diabetes Care. 2012;35:520-525. [PubMed] [DOI] |
| 25. | Gokcel A, Gumurdulu Y, Kayaselcuk F, Serin E, Ozer B, Ozsahin AK, Guvener N. Helicobacter pylori has no effect on plasma ghrelin levels. Eur J Endocrinol. 2003;148:423-426. [PubMed] |
| 26. | Guise JM, Chang C, Viswanathan M, Glick S, Treadwell J, Umscheid CA, Whitlock E, Fu R, Berliner E, Paynter R. Agency for Healthcare Research and Quality Evidence-based Practice Center methods for systematically reviewing complex multicomponent health care interventions. J Clin Epidemiol. 2014;67:1181-1191. [PubMed] [DOI] |
| 27. | Wang F, Meng W, Wang B, Qiao L. Helicobacter pylori-induced gastric inflammation and gastric cancer. Cancer Lett. 2014;345:196-202. [PubMed] [DOI] |
| 28. | Patel SK, Pratap CB, Jain AK, Gulati AK, Nath G. Diagnosis of Helicobacter pylori: what should be the gold standard? World J Gastroenterol. 2014;20:12847-12859. [PubMed] [DOI] |
| 29. | Bytzer P, Dahlerup JF, Eriksen JR, Jarbøl DE, Rosenstock S, Wildt S. Diagnosis and treatment of Helicobacter pylori infection. Dan Med Bull. 2011;58:C4271. [PubMed] |
| 31. | Gierach M, Gierach J, Junik R. Insulin resistance and thyroid disorders. Endokrynol Pol. 2014;65:70-76. [PubMed] [DOI] |
| 32. | Bonora E, Targher G, Alberiche M, Bonadonna RC, Saggiani F, Zenere MB, Monauni T, Muggeo M. Homeostasis model assessment closely mirrors the glucose clamp technique in the assessment of insulin sensitivity: studies in subjects with various degrees of glucose tolerance and insulin sensitivity. Diabetes Care. 2000;23:57-63. [PubMed] |
| 33. | Cersosimo E, Solis-Herrera C, Trautmann ME, Malloy J, Triplitt CL. Assessment of pancreatic β-cell function: review of methods and clinical applications. Curr Diabetes Rev. 2014;10:2-42. [PubMed] |
| 34. | Polyzos SA, Kountouras J, Zavos C, Deretzi G. The association between Helicobacter pylori infection and insulin resistance: a systematic review. Helicobacter. 2011;16:79-88. [PubMed] [DOI] |
| 35. | Naja F, Nasreddine L, Hwalla N, Moghames P, Shoaib H, Fatfat M, Sibai A, Gali-Muhtasib H. Association of H. pylori infection with insulin resistance and metabolic syndrome among Lebanese adults. Helicobacter. 2012;17:444-451. [PubMed] [DOI] |
| 36. | Singh Y, Garg MK, Tandon N, Marwaha RK. A study of insulin resistance by HOMA-IR and its cut-off value to identify metabolic syndrome in urban Indian adolescents. J Clin Res Pediatr Endocrinol. 2013;5:245-251. [PubMed] [DOI] |
| 37. | Oya J, Nakagami T, Yamamoto Y, Fukushima S, Takeda M, Endo Y, Uchigata Y. Effects of age on insulin resistance and secretion in subjects without diabetes. Intern Med. 2014;53:941-947. [PubMed] |
| 38. | Mendes LL, Gazzinelli A, Velásquez-Meléndez G. [Factors associated with insulin resistence in rural populations]. Arq Bras Endocrinol Metabol. 2009;53:332-339. [PubMed] |
| 39. | Gerig R, Ernst B, Wilms B, Thurnheer M, Schultes B. Gastric Helicobacter pylori infection is associated with adverse metabolic traits in severely obese subjects. Obesity (Silver Spring). 2013;21:535-537. [PubMed] [DOI] |
| 40. | Tan VM, Lee YS, Venkataraman K, Khoo EY, Tai ES, Chong YS, Gluckman P, Leow MK, Khoo CM. Ethnic differences in insulin sensitivity and beta-cell function among Asian men. Nutr Diabetes. 2015;5:e173. [PubMed] [DOI] |
| 41. | Semper RP, Mejías-Luque R, Groß C, Anderl F, Müller A, Vieth M, Busch DH, Prazeres da Costa C, Ruland J, Groß O. Helicobacter pylori-induced IL-1β secretion in innate immune cells is regulated by the NLRP3 inflammasome and requires the cag pathogenicity island. J Immunol. 2014;193:3566-3576. [PubMed] [DOI] |
| 42. | Hemmasi G, Zamani F, Khonsari M, Sohrabi M, Abdollahi N, Ajdarkosh H. Association between Helicobacter pylori and Serum Leptin in Iranian Dyspeptic Patients. Middle East J Dig Dis. 2013;5:158-162. [PubMed] |
| 43. | Aswad H, Forterre A, Wiklander OP, Vial G, Danty-Berger E, Jalabert A, Lamazière A, Meugnier E, Pesenti S, Ott C. Exosomes participate in the alteration of muscle homeostasis during lipid-induced insulin resistance in mice. Diabetologia. 2014;57:2155-2164. [PubMed] [DOI] |
| 44. | Rocha AM, Souza C, Melo FF, Clementino NC, Marino MC, Rocha GA, Queiroz DM. Cytokine profile of patients with chronic immune thrombocytopenia affects platelet count recovery after Helicobacter pylori eradication. Br J Haematol. 2015;168:421-428. [PubMed] [DOI] |
| 45. | Evrengul H, Tanriverdi H, Kuru O, Enli Y, Yuksel D, Kilic A, Kaftan A, Kirac S, Kilic M. Elevated homocysteine levels in patients with slow coronary flow: relationship with Helicobacter pylori infection. Helicobacter. 2007;12:298-305. [PubMed] |
| 46. | de Bernard M, Josenhans C. Pathogenesis of Helicobacter pylori infection. Helicobacter. 2014;19 Suppl 1:11-18. [PubMed] [DOI] |