修回日期: 2015-10-12
接受日期: 2015-10-19
在线出版日期: 2015-11-18
目的: 检测大肠癌及正常组织和细胞株中Wee1及其磷酸化形式的表达并探讨Wee1对大肠癌细胞株HCT116增殖的调控方式.
方法: 首先, 使用免疫组织化学的方法检测Wee1总蛋白及p-Wee1(ser53)和p-Wee1(ser642)的表达. 其次, 使用血清饥饿法大致停滞细胞周期后, 用Western blot法测定Wee1及p-Wee1(ser53)和p-Wee1(ser642)在HCT116细胞株中的表达. 最后, 将Wee1抑制剂PD 407824稀释成不同浓度, 用CCK8法测定不同时间点HCT116的增殖情况及用显微镜观察其形态变化.
结果: Wee1、p-Wee1(ser53)及p-Wee1(ser642)蛋白在大肠癌组织中的阳性表达率(68.00%、85.00%和91.00%)高于正常组织(9.62%、21.15%和42.31%), 有统计学意义(P<0.05, P<0.01). 细胞增殖过程中, 检测到Wee1及其磷酸化蛋白的表达主要在6、12、24 h升高. Wee1抑制剂PD 407824可以抑制HCT116细胞增殖(P<0.01).
结论: Wee1及其磷酸化蛋白的水平与大肠肿瘤的增殖有关, Wee1抑制剂有望作为一个新的选择性的肿瘤治疗手段.
核心提示: Wee1及其磷酸化蛋白的水平与大肠肿瘤的增殖有关. Wee1的ser642位点被磷酸化有利于Wee1从细胞核转入细胞浆中, 失去活性. Wee1的ser53位点被磷酸化, 才能与SCF结合从而被降解. 而Wee1抑制剂有望作为一个新的选择性的肿瘤治疗手段.
引文著录: 文玉, 李晓燕, 罗娟. Wee1及p-Wee1对大肠癌增殖的调控机制. 世界华人消化杂志 2015; 23(32): 5164-5170
Revised: October 12, 2015
Accepted: October 19, 2015
Published online: November 18, 2015
AIM: To investigate the expression of Wee1 and phosphorylated Wee1 protein in colorectal cancer and normal tissues, and analyze the regulatory effect of Wee1 on cell proliferation in the human colorectal cancer cell line HCT116.
METHODS: The expression of Wee1, p-Wee1 (Ser53) and p-Wee1 (Ser642) was detected by immunohistochemistry in colorectal cancer and normal tissues. The changes in Wee1, p-Wee1 (Ser53) and p-Wee1 (Ser642) expression were detected by Western blot in starved HCT116 cells. HCT116 cells were then cultured in medium containing different concentrations of Wee1 inhibitor PD407824. Cell proliferation was determined by Cell Counting Kit-8 (CCK-8) assay, and the morphology of the cells was observed by light microscopy.
RESULTS: The positive rates of Wee1, p-Wee1 (ser53), and p-Wee1 (ser642) expression (68.00%, 85.00% and 91.00%) in colorectal cancer were significantly higher than those in normal tissues (9.62%, 21.15% and 42.31%) (P < 0.05 or P < 0.01). The expression of the Wee1 and its phosphorylated forms rose mainly at 6, 12 and 24 h. The proliferation of HCT116 cells was inhibited by Wee1 inhibitor PD407824.
CONCLUSION: The levels of Wee1 and its phosphorylation forms closely relate to the proliferation of colorectal cancer cells. Wee1 inhibitor may be a potential new treatment for colorectal cancer in the future.
- Citation: Wen Y, Li XY, Luo J. Regulatory effect of Wee1 on proliferation of colorectal cancer cells. Shijie Huaren Xiaohua Zazhi 2015; 23(32): 5164-5170
- URL: https://www.wjgnet.com/1009-3079/full/v23/i32/5164.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i32.5164
大肠癌是目前常见的恶性肿瘤之一, 预后差, 发病率也呈明显上升的趋势. 故研究其发病机制对提高大肠肿瘤的早期诊断水平非常重要. 而肿瘤的发生与细胞周期失控有着密切关系. 细胞周期的调控主要是通过相应的细胞周期蛋白(cyclins)及细胞周期蛋白依赖性激酶(cyclin-dependent kinases, CDKs)和细胞周期蛋白依赖性激酶抑制物(cyclin -dependent kinase inhibitor, CDIs)复合物来进行. Wee1和Cdc25是作为2个具有相反作用的重要因子来调控G2/M期[1,2]. 其中, Wee1是一个属于丝氨酸和苏氨酸家族的激酶. 在人体细胞中, Wee1通过磷酸化CDK1的Tyr-15位点, 抑制其活性, 从而使细胞不能进入M期, 即有丝分裂期[3]. 如果Wee1表达升高, 则细胞将停滞于间期可能发生凋亡; 如果表达降低, 则可能是直接通过G2/M期, 具有变异的DNA的细胞继续分裂, 而导致癌变. 因此Wee1的激活和失活非常重要, 而其磷酸化在这一过程中又起着关键的作用.
而既然Wee1在G2/M检验点中起着重要的作用, 那抑制Wee1活性是否可以协同治疗肿瘤? 本研究中我们将检测Wee1及其磷酸化蛋白在大肠癌组织中的表达, 使用PD 407824(一种Wee1抑制剂)作用于大肠肿瘤细胞株, 观察其对细胞增殖的影响, 拟探讨Wee1及其磷酸化对大肠癌细胞株增殖的调控及相关机制, 为Wee1抑制剂联合抗肿瘤药物治疗大肠癌提供理论基础.
随机采用昆明医科大学第一附属医院普外科和肿瘤科经手术切除及术后病理确诊的大肠癌新鲜标本共100例. 所有大肠癌标本临床病理资料完整, 患者术前均未经任何放化疗. 同时随机选取距肿瘤边缘>10 cm的正常组织52例, 作为对照. 大肠癌患者病理组织学类型均为腺癌. 大肠肿瘤细胞株HCT116来源美国模式培养物保藏所, 由南方医科大学南方医院消化疾病研究所赠. HCT116细胞株为成年男性大肠腺癌患者的结肠癌部位来源; PD 407824购自美国Merck Biosciences公司; Wee1抗体及p-Wee1(ser53)购自美国Santa Cruz公司; p-Wee1(ser642)抗体购自美国Cell Signaling Technology美国. DHP-9162型电热恒温培养箱: 上海恒科技有限公司/上海恒科学仪器有限公司; SW-CJ-1FDA/SW-CJ-2FDA超净工作台: 江苏苏净集团安泰公司; MODEL5410研究级倒置万能材料显微镜: 蔡司光学仪器(上海)国际贸易有限公司; 高速冷冻离心机: Sigma公司; 垂直电泳仪、Mini Trans-Blot Ⅲ电转移槽、Mini-Protein Ⅲ电泳槽: Bio-Rad公司; 微孔板检测系统-酶标仪SpectraMax Plus384: Molecular Devices公司.
1.2.1 收集标本: 所有标本均为手术切除的新鲜标本. 标本切下后, 在原发灶和距大肠癌原发灶边缘10 cm两个部位分别切取0.5 cm×0.5 cm组织块, 除去坏死组织及周围结缔组织后, 用40 g/L甲醛溶液固定. 随后进行石蜡包埋、编号备用.
1.2.2 测定Wee1及其磷酸化形式在组织中的表达: 依次经过包埋组织、切片、脱蜡、水化、抗原修复、滴加一抗、滴加二抗、显色等步骤来测定Wee1总蛋白及p-Wee1(ser53)和p-Wee1(ser642)在组织细胞中的表达及位置. 其阳性结果判断参照Sinicrope的半定量积分法.
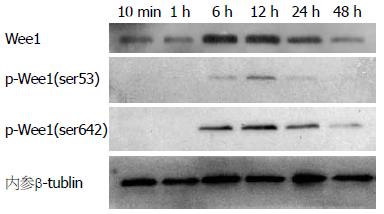
1.2.3 测定Wee1及其磷酸化形式在大肠癌细胞株中的表达: 首先, 采用血清饥饿法将HCT116细胞尽量同步化, 再加入含血清的培养基, 然后在不同时间点(10 min、1、6、12、24和48 h)收集细胞, 用Western blot法测定Wee1及p-Wee1(ser53)和p-Wee1(ser642)的表达.
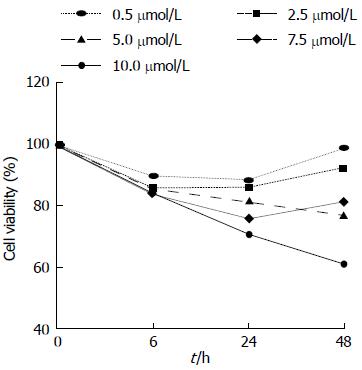
1.2.4 使用Wee1抑制剂PD 407824后, 测定Wee1在大肠癌细胞株中的表达: 使用96孔板培养细胞. 在培养基中分别加入1 μL DMSO和1 μL不同浓度PD 407824(稀释后抑制剂的浓度为: 0.5、2.5、5.0、7.5、10 μmol/L)后继续培养HCT116细胞, 并在6、24、48 h 3个时间点使用CCK-8法检测细胞增殖. 进行检测前在每孔中加入CCK-8溶液10 μL, 在培养箱内继续孵育1 h. 在450 nm波长下, 使用酶联免疫分析仪测定各孔光吸收值, 并记录下结果; 然后以时间为横轴, 光吸收值为纵轴绘制细胞生长曲线.
统计学处理 使用SPSS17.0专业统计软件进行数据分析, 采用χ2检验及校χ2检验对大肠癌组织和大肠正常组织中Wee1、p-Wee1(ser53)和p-Wee1(ser642)的表达进行分析, 并采用Spearman等级相关分析来检验3种蛋白表达的相关性. 各试验组与对照组间差异采用单因素方差分析.
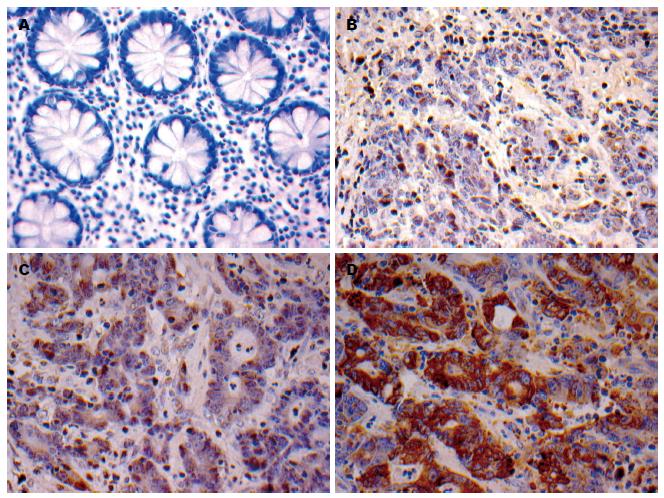
Wee1在正常组织和大肠癌组织中的阳性表达率分别为9.62%(5/52)和68.00%(68/100). Wee1阳性表达主要在细胞核, 胞浆可有少量着色, 而正常组织中几乎不着色(图1A); 在大肠癌高中分化标本中表现为着色较浅、棕黄色的颗粒, 低分化标本中则为胞核深染、棕褐色的颗粒(图1B). 统计学结果显示: Wee1在大肠癌组织中的表达要明显高于正常组织, 有统计学意义(P<0.01)(表1), 与大肠癌组织分化程度呈负相关(r = -0.241, P<0.05)(表2).
| 分组 | n | 阴性 | 阳性 | 阳性率(%) | P值 |
| Wee1 | <0.01 | ||||
| 正常组织 | 52 | 47 | 5 | 9.62 | |
| 大肠癌 | 100 | 32 | 68 | 68.00 | |
| p-Wee1(ser53) | <0.01 | ||||
| 正常组织 | 52 | 41 | 11 | 21.00 | |
| 大肠癌 | 100 | 15 | 85 | 85.00 | |
| p-Wee1(ser642) | <0.01 | ||||
| 正常组织 | 52 | 30 | 22 | 42.31 | |
| 大肠癌 | 100 | 9 | 91 | 91.00 |
| 分化程度 | n | 阴性 | 低表达 | 高表达 | r值 | P值 |
| Wee1 | -0.241 | <0.05 | ||||
| 高、中分化 | 72 | 18 | 30 | 24 | ||
| 低分化 | 28 | 14 | 4 | 10 | ||
| p-Wee1(ser53) | -0.299 | <0.05 | ||||
| 高、中分化 | 72 | 6 | 35 | 31 | ||
| 低分化 | 28 | 9 | 5 | 14 | ||
| p-Wee1(ser642) | -0.349 | <0.01 | ||||
| 高、中分化 | 72 | 2 | 54 | 16 | ||
| 低分化 | 28 | 7 | 3 | 19 |
p-Wee1(ser53)在正常组织和大肠癌组织中的阳性表达率分别为21.15%(11/52)和85.00%(85/100). p-Wee1(ser53)阳性表达主要在细胞核, 胞浆也有少量着色, 正常组织中也几乎不着色; 在大肠癌高中分化标本中表现为着色较浅、棕黄色的颗粒, 低分化病例中则为胞核深染、棕褐色的颗粒(图1C). 统计学结果显示: p-Wee1(ser53)在大肠癌组织中的表达要明显高于正常组织, 有统计学意义(P<0.01)(表1), 与大肠癌组织分化程度呈负相关(r = -0.241, P<0.05)(表2).
p-Wee1(ser642)在正常组织和大肠癌组织中的阳性表达率分别为42.31%(22/52)和91.00%(91/100). p-Wee1(ser642)阳性表达主要在细胞浆, 或胞浆、胞核两者均有着色, 正常的组织也几乎不着色; 在大肠癌高中分化标本中表现为着色较浅、棕黄色的颗粒, 低分化标本中则为胞核深染、棕褐色的颗粒(图1D). 统计学结果显示: p-Wee1(ser642)在大肠癌组织中的表达要明显高于正常组织, 有统计学意义(P<0.01)(表1), 与大肠癌组织分化程度呈负相关(r = -0.241, P<0.05)(表2).
统计结果表明Wee1与p-Wee1(ser53)蛋白在大肠癌中的表达呈正相关(r = 0.286, P<0.05), Wee1与p-Wee1(ser642)蛋白在大肠癌中的表达也呈正相关(r = 0.423, P<0.01), 而p-Wee1(ser53)与p-Wee1(ser642)蛋白在大肠癌中的表达则亦呈明显正相关(r = 0.426, P<0.01), 均具有统计学意义.
在不同的时间点(10 min、1、6、12、24和48 h)测定Wee1及其磷酸化形式的表达, 发现他们的表达成周期性变化, 在6、12、24 h出现表达升高; Wee1、p-Wee1(ser53)和p-Wee1(ser642)蛋白表达的高峰分别在6、12和24 h, 然后又逐渐下降(图2).
使用Wee1特异的抑制剂PD 407824后, HCT116细胞增殖得到抑制, 与PD 407824呈时间剂量依赖的关系, 有统计学意义(P<0.01)(图3). 显微镜下观察经抑制剂处理过的HCT116细胞: 在24 h后随着抑制剂浓度的增加, 细胞数目不仅明显减少, 而且形态发生变化, HCT116细胞体积收缩、染色质凝集, 出现凋亡.
在正常周期调控下, 细胞开始增殖、分化、衰老及凋亡等生命过程. 在人类的细胞周期中主要有G1/S和G2/M两个检验点. 在大肠肿瘤中, 调控G1/S期的p53基因通常出现突变, 失去活性[4]; 所以G2/M期检验点的调控更加重要[5,6]. 其中起重要作用的复合物CyclinB-CDK1就由Wee1和Cdc25作为两个重要的起相反作用的因子来调控.
本文中主要研究了Wee1在大肠癌中的表达. 研究[7]发现在不同种类的细胞周期中, Wee1在G2后期和M期中的表达并不稳定. 还有的研究表明Wee1的降解可能在M期, 也可能发生在细胞间期. 其他生物中的Wee1类似物, 如酵母菌中的Swe1, 也并不一定完全在M期发生降解[8,9]. 而Wee1在爪蟾蜍胚胎[10]和小鼠胚胎细胞[11]中M期的含量很稳定. 这些研究[12,13]都说明Wee1活性的调节是不一样的, 他的活性可能与许多蛋白相关, 与一个依赖磷酸化降解的机制关系密切. 比如在啤酒酵母中, SKP/Cull/F-box(SCF)E3遍在蛋白连接酶复合体识别Met30p(一种F-box蛋白), 从而使Swe1p(啤酒酵母中的Wee1类似物)被遍在蛋白化后降解[14]. 近期的一项研究[15]也发现, 使用一种小分子物质阻止Wee1的降解可以来阻滞细胞周期, 提示了Wee1的降解在细胞周期的重要性. 我们的研究也发现Wee1的蛋白水平是不断变化的, 提示其在细胞周期中的活性是与降解有关的.
Katayama等[16]发现Akt能够磷酸化Wee1的ser642位点, 才能让Wee1及14-3-3θ结合在一起, 从而使Wee1从细胞核转入细胞浆中, 失去活性. Wells等[17]也提出Wee1需要其ser53和ser123位点被磷酸化, 才能与SCF结合从而被降解. 在本研究中, 我们发现大肠癌组织中, Wee1及p-Wee1(ser53)存在于细胞核, 而p-Wee1(ser642)多存在于细胞浆中; 在细胞增殖中, Wee1及其磷酸化蛋白p-Wee1 ser53和ser642的水平是呈周期性变化的, 提示了Wee1的磷酸化可能与其活性及降解有关.
近来的研究[18-21]发现, Wee1是一个在肿瘤治疗中很有前景的分子靶标. 本研究也通过免疫组织化学染色法发现Wee1及其磷酸化蛋白的表达与大肠癌相关, 均在大肠癌中表达较高, 正常组织低表达或不表达; 而且肿瘤分化程度越低, 其表达越高. 其原因可能在于Wee1缺失或受到抑制后, 细胞周期检控点的调控上调, 细胞继续生长, 却因为DNA损伤等原因导致细胞周期进程受阻和细胞死亡等情况随之出现[22-24], 尤其是P53缺失的细胞中[6]. 关于细胞生长和增殖的研究发现, 转染miRNA后能够降低Wee1的表达, 从而能明显降低HeLa细胞(人类子宫颈癌细胞株)的增殖速度[25]. 目前的研究[26-28]发现, 联合使用Wee1抑制剂MK1775及Chk1/2抑制剂可以抑制乳腺癌、卵巢癌、前列腺癌、恶性黑色素瘤细胞等肿瘤的生长. 现在, Wee1抑制剂MK1775已进入Ⅰ期临床试验, 对有BRCA基因突变的肿瘤患者中具有比较肯定的疗效[29]. 而本研究中选择了PD 407824作为Wee1抑制剂, 证明了单独使用Wee1抑制剂对大肠肿瘤细胞的增殖也具有抑制作用. 因此, Wee1抑制剂应用于肿瘤治疗中是有着广阔的发展前景的.
在G2/M期, CDC25通过磷酸化Wee1减弱其活性, 同时SCFTome-1使Wee1降解, 进而激活CDKs/Cyclins激酶, 从而可使有丝分裂期快速启动. 而在接下来的G1期, Wee1在APCCDH1的辅助下恢复作用, 从而分别以Cyclins和Tome-1降解的方式调控CDKs/Cyclins和SCFTome-1的失活. 因此一直到S期都有Wee1的作用, 可阻止有丝分裂提前发生, 确保受损DNA修复完全, 从而保持DNA的完整性.
刘杰民, 主任医师, 贵州省人民医院消化内镜科
本文研究了在大肠肿瘤中Wee1及其磷酸化蛋白在核内及胞浆内的不同分布位置, 探讨了其对细胞周期的调控机制. 证明了在体外实验中使用Wee1抑制剂能够抑制肿瘤细胞的增殖, 提供了治疗肿瘤的可能性. 但是在临床实验中其疗效仍不足, 尚需进一步的研究.
另一种Wee1抑制剂MK-1775已行临床Ⅰ期研究, 对复发实体肿瘤有一定的抑制作用,但仅2例患者对其有部分应答. 其不良反应比较明显的为骨髓抑制及腹泻. 而同时也有相关研究将Wee1抑制剂与放疗或与其他化疗药物联合使用, 证明其对肿瘤细胞有抑制作用, 但暂时没有更多的临床研究.
本文明确了Wee1及其磷酸化蛋白的水平及位置与大肠肿瘤的增殖有关. 同时选择了PD 407824作为Wee1抑制剂, 证明了单独使用Wee1抑制剂对大肠肿瘤细胞的增殖也具有抑制作用.
证明了单独使用Wee1抑制剂对大肠肿瘤细胞的增殖也具有抑制作用, 因此可将PD 407824进一步在动物实验中验证, 探讨其有效剂量, 对比与其他Wee1抑制剂的区别, 尤其是安全性及不良反应方面.
磷酸化: 是将磷酸基团加在中间代谢产物上或加在蛋白质(protein)上的过程. 其中除去磷酸基团的酶称为磷酸酶. 磷酸基团的添加或除去(去磷酸化)对许多反应起着生物"开/关"作用. 磷酸基团的添加或除去能使酶(enzyme)活化或失活, 控制诸如细胞分裂这样的过程. 添加磷酸基团的酶称为激酶(kinases); 除去磷酸基团的酶称为磷酸酶.
本研究检测Wee1及其磷酸化蛋白在大肠癌组织中的表达, 使用PD 407824(一种Wee1抑制剂)作用于大肠肿瘤细胞株, 观察其对细胞增殖的影响,结果发现Wee1及其磷酸化蛋白的水平与大肠肿瘤的增殖有关. Wee1抑制剂有望作为一个新的选择性的肿瘤治疗手段.
编辑: 于明茜 电编: 闫晋利
| 2. | Vera J, Raatz Y, Wolkenhauer O, Kottek T, Bhattacharya A, Simon JC, Kunz M. Chk1 and Wee1 control genotoxic-stress induced G2-M arrest in melanoma cells. Cell Signal. 2015;27:951-960. [PubMed] [DOI] |
| 3. | Walworth NC. DNA damage: Chk1 and Cdc25, more than meets the eye. Curr Opin Genet Dev. 2001;11:78-82. [PubMed] |
| 4. | Russo A, Bazan V, Iacopetta B, Kerr D, Soussi T, Gebbia N. The TP53 colorectal cancer international collaborative study on the prognostic and predictive significance of p53 mutation: influence of tumor site, type of mutation, and adjuvant treatment. J Clin Oncol. 2005;23:7518-7528. [PubMed] |
| 5. | Wang Y, Li J, Booher RN, Kraker A, Lawrence T, Leopold WR, Sun Y. Radiosensitization of p53 mutant cells by PD0166285, a novel G(2) checkpoint abrogator. Cancer Res. 2001;61:8211-8217. [PubMed] |
| 6. | Pappano WN, Zhang Q, Tucker LA, Tse C, Wang J. Genetic inhibition of the atypical kinase Wee1 selectively drives apoptosis of p53 inactive tumor cells. BMC Cancer. 2014;14:430. [PubMed] [DOI] |
| 7. | Watanabe N, Broome M, Hunter T. Regulation of the human WEE1Hu CDK tyrosine 15-kinase during the cell cycle. EMBO J. 1995;14:1878-1891. [PubMed] |
| 8. | Sia RA, Bardes ES, Lew DJ. Control of Swe1p degradation by the morphogenesis checkpoint. EMBO J. 1998;17:6678-6688. [PubMed] |
| 9. | Asano S, Park JE, Sakchaisri K, Yu LR, Song S, Supavilai P, Veenstra TD, Lee KS. Concerted mechanism of Swe1/Wee1 regulation by multiple kinases in budding yeast. EMBO J. 2005;24:2194-2204. [PubMed] |
| 10. | Okamoto K, Nakajo N, Sagata N. The existence of two distinct Wee1 isoforms in Xenopus: implications for the developmental regulation of the cell cycle. EMBO J. 2002;21:2472-2484. [PubMed] |
| 11. | Han SJ, Conti M. New pathways from PKA to the Cdc2/cyclin B complex in oocytes: Wee1B as a potential PKA substrate. Cell Cycle. 2006;5:227-231. [PubMed] |
| 12. | Tang Z, Coleman TR, Dunphy WG. Two distinct mechanisms for negative regulation of the Wee1 protein kinase. EMBO J. 1993;12:3427-3436. [PubMed] |
| 13. | Watanabe N, Arai H, Nishihara Y, Taniguchi M, Watanabe N, Hunter T, Osada H. M-phase kinases induce phospho-dependent ubiquitination of somatic Wee1 by SCFbeta-TrCP. Proc Natl Acad Sci U S A. 2004;101:4419-4424. [PubMed] |
| 14. | McMillan JN, Theesfeld CL, Harrison JC, Bardes ES, Lew DJ. Determinants of Swe1p degradation in Saccharomyces cerevisiae. Mol Biol Cell. 2002;13:3560-3575. [PubMed] |
| 15. | Madoux F, Mishra J, Mercer BA, Ayad N, Roush W, Hodder P, Rosen HR. Small molecule inhibitors of Wee1 degradation and mitotic entry. Probe Reports from the NIH Molecular Libraries Program. Bethesda (MD): National Center for Biotechnology Information (US) 2010- 2009; Aug 14. [PubMed] |
| 16. | Katayama K, Fujita N, Tsuruo T. Akt/protein kinase B-dependent phosphorylation and inactivation of WEE1Hu promote cell cycle progression at G2/M transition. Mol Cell Biol. 2005;25:5725-5737. [PubMed] |
| 17. | Wells NJ, Watanabe N, Tokusumi T, Jiang W, Verdecia MA, Hunter T. The C-terminal domain of the Cdc2 inhibitory kinase Myt1 interacts with Cdc2 complexes and is required for inhibition of G(2)/M progression. J Cell Sci. 1999;112:3361-3371. [PubMed] |
| 18. | Benada J, Macurek L. Targeting the Checkpoint to Kill Cancer Cells. Biomolecules. 2015;5:1912-1937. [PubMed] [DOI] |
| 19. | Pokorny JL, Calligaris D, Gupta SK, Iyekegbe DO, Mueller D, Bakken KK, Carlson BL, Schroeder MA, Evans DL, Lou Z. The Efficacy of the Wee1 Inhibitor MK-1775 Combined with Temozolomide Is Limited by Heterogeneous Distribution across the Blood-Brain Barrier in Glioblastoma. Clin Cancer Res. 2015;21:1916-1924. [PubMed] [DOI] |
| 20. | Zhou L, Zhang Y, Chen S, Kmieciak M, Leng Y, Lin H, Rizzo KA, Dumur CI, Ferreira-Gonzalez A, Dai Y. A regimen combining the Wee1 inhibitor AZD1775 with HDAC inhibitors targets human acute myeloid leukemia cells harboring various genetic mutations. Leukemia. 2015;29:807-818. [PubMed] [DOI] |
| 21. | Moser R, Xu C, Kao M, Annis J, Lerma LA, Schaupp CM, Gurley KE, Jang IS, Biktasova A, Yarbrough WG. Functional kinomics identifies candidate therapeutic targets in head and neck cancer. Clin Cancer Res. 2014;20:4274-4288. [PubMed] [DOI] |
| 22. | Kogiso T, Nagahara H, Hashimoto E, Ariizumi S, Yamamoto M, Shiratori K. Efficient induction of apoptosis by wee1 kinase inhibition in hepatocellular carcinoma cells. PLoS One. 2014;9:e100495. [PubMed] |
| 23. | Indovina P, Marcelli E, Di Marzo D, Casini N, Forte IM, Giorgi F, Alfano L, Pentimalli F, Giordano A. Abrogating G₂/M checkpoint through WEE1 inhibition in combination with chemotherapy as a promising therapeutic approach for mesothelioma. Cancer Biol Ther. 2014;15:380-388. [PubMed] [DOI] |
| 24. | Aarts M, Sharpe R, Garcia-Murillas I, Gevensleben H, Hurd MS, Shumway SD, Toniatti C, Ashworth A, Turner NC. Forced mitotic entry of S-phase cells as a therapeutic strategy induced by inhibition of WEE1. Cancer Discov. 2012;2:524-539. [PubMed] [DOI] |
| 25. | Butz H, Likó I, Czirják S, Igaz P, Khan MM, Zivkovic V, Bálint K, Korbonits M, Rácz K, Patócs A. Down-regulation of Wee1 kinase by a specific subset of microRNA in human sporadic pituitary adenomas. J Clin Endocrinol Metab. 2010;95:E181-E191. [PubMed] [DOI] |
| 26. | Magnussen GI, Emilsen E, Giller Fleten K, Engesæter B, Nähse-Kumpf V, Fjær R, Slipicevic A, Flørenes VA. Combined inhibition of the cell cycle related proteins Wee1 and Chk1/2 induces synergistic anti-cancer effect in melanoma. BMC Cancer. 2015;15:462. [PubMed] [DOI] |
| 27. | Carrassa L, Chilà R, Lupi M, Ricci F, Celenza C, Mazzoletti M, Broggini M, Damia G. Combined inhibition of Chk1 and Wee1: in vitro synergistic effect translates to tumor growth inhibition in vivo. Cell Cycle. 2012;11:2507-2517. [PubMed] [DOI] |
| 28. | Davies KD, Cable PL, Garrus JE, Sullivan FX, von Carlowitz I, Huerou YL, Wallace E, Woessner RD, Gross S. Chk1 inhibition and Wee1 inhibition combine synergistically to impede cellular proliferation. Cancer Biol Ther. 2011;12:788-796. [PubMed] [DOI] |
| 29. | Do K, Wilsker D, Ji J, Zlott J, Freshwater T, Kinders RJ, Collins J, Chen AP. Doroshow JH1, Kummar S2.Phase I Study of Single-Agent AZD1775 (MK-1775), a Wee1 Kinase Inhibitor, in Patients With Refractory Solid Tumors. J Clin Oncol. 2015; May 11. [Epub ahead of print]. [PubMed] |