修回日期: 2015-10-10
接受日期: 2015-10-19
在线出版日期: 2015-11-18
目的: 检测原发性肝癌患者血清中miR-21和miR-1247-5p表达水平的变化, 探讨miR-21和miR-1247-5p在原发性肝癌中筛查以及诊断的意义.
方法: 收集临床确诊为原发性肝癌患者的血清样本41例, 并且收集同时期的健康体检人群血清样本41例, 提取血清中的miRNA,利用相应特异的颈环反转录引物, 反转录成cDNA, 同时构建内参U6, 以及miR-21、miR-1247-5p的T载体, 以此来绘制标准曲线, 运用双标准曲线法进行相对定量分析. 利用实时定量PCR(real-time quantitative PCR, qRT-PCR)检测miR-21和miR-1247-5p的表达量.
结果: qRT-PCR检测结果显示, 与健康对照组相比, 在原发性肝癌患者的血清中, miR-21表达量显著上调(P<0.05), miR-1247-5p表达量显著下调(P<0.05). 并且通过统计学软件分析, miR-21、miR-1247-5p与甲胎蛋白之间无相关性(P>0.05).
结论: 与健康对照人群相比, 原发性肝癌患者血清中miR-21和miR-1247-5p表达有显著性变化, 血清中的miR-21和miR-1247-5p可能为原发性肝癌的诊断提供种新的生化补充指标.
核心提示: 通过收集临床原发性肝癌以及同时期健康人群的血清样本, 提取样本中miRNA, 通过实时定量PCR的检测, 发现miR-1247-5p在肝癌中低表达, 联合已有在大肠癌和胰腺癌中的报道, 表明其可能起着抑癌基因的作用. 另检测发现miR-21在肝癌中高表达, 故miR-21可作为一个阳性参照miRNA, 与低表达的miR-1247-5p作为两种诊断标志物, 期望作为诊断肝癌的miRNA的组合. 联合现有的检测肝癌的血清学标志物甲胎蛋白等, 对肝癌患者进行联合辅助诊断.
引文著录: 张议心, 王利新, 李元杰, 徐广贤. 原发性肝癌患者血清中miR-21和miR-1247-5p的表达检测. 世界华人消化杂志 2015; 23(32): 5148-5156
Revised: October 10, 2015
Accepted: October 19, 2015
Published online: November 18, 2015
AIM: To detect serum miR-21 and miR-1247-5p expression levels in patients with primary liver cancer, and to assess their clinical and diagnostic value in primary liver cancer.
METHODS: Serum samples were collected from patients with primary liver cancer and healthy volunteers. The expression levels of miR-21 and miR-1247-5p in serum samples were measured by real-time quantitative PCR (qRT-PCR).
RESULTS: A total of 82 clinical samples were collected, including 41 from patients with primary liver cancer and 41 from healthy volunteers. qRT-PCR results showed that compared with healthy controls, miR-21 expression rose significantly and miR-1247-5p expression significantly declined in patients with primary liver cancer. Serum levels of miR-21 and miR-1247-5p had no correlation with alpha fetoprotein (P > 0.05).
CONCLUSION: Compared with healthy controls, patients with primary liver cancer have significant changes in serum miR-21 and miR-1247-5p expression. Detection of serum miR-21 and miR-1247-5p may be useful for the diagnosis of primary liver cancer.
- Citation: Zhang YX, Wang LX, Li YJ, Xu GX. Changes and significance of serum miR-21 and miR-1247-5p levels in patients with primary liver cancer. Shijie Huaren Xiaohua Zazhi 2015; 23(32): 5148-5156
- URL: https://www.wjgnet.com/1009-3079/full/v23/i32/5148.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i32.5148
肝细胞癌(hepatocellular carcinoma, HCC)是全球最常见的恶性肿瘤之一, 严重危害我国人民生命健康. 肝癌的发生是一个多因素参与, 多途径形成的复杂病理发展过程, 其在分子水平上涉及多个细胞因子以及多个调控通路. miRNA是一类广泛存在于真核生物, 长度为21-25 nt的单链非蛋白编码小RNA分子. 近年来对miRNA的研究发现, 其可表现出肿瘤抑制基因或癌基因的作用. 在肝癌发生中, miRNA参与着肝癌演进的各个阶段, 在肝癌发生的增殖、凋亡、侵袭和转移过程中扮演了关键作用. Liu等[1]发现miRNA-375可抑制肝癌细胞的侵袭和分化. Fornari等[2]发现miRNA-199a-3p能抑制细胞G1/S期转变并增加肝癌细胞对阿霉素的敏感性. 探究肝癌进展中重要miRNA的变化有望为肝癌治疗提供新的途径. miRNA广泛存在于组织, 血浆或血清以及其他体液中, 表现稳定且不易被内源性核糖核酸酶所降解. 组织中和体液中的miRNA的表达稳定性也已经被广泛认识到[3,4]. miRNA这一特性, 为我们能否通过检测血液中的miRNA表达水平来检测癌症的发生与预后提供了可能的依据. 目前已有报道指出miR-21在多种癌症中表达上调, miR-1247-5p在肝癌中表达情况尚未知晓. 我们通过收集原发性肝癌患者以及健康人群的血清样本, 运用实时定量PCR(real-time quantitative PCR, qRT-PCR)检测手段, 对循环血液中miR-1247-5p的表达量进行分析, 看其是否存在差异, 同时检测循环血液中miR-21的表达量以期作为阳性参照, 通过检测这两种miRNA, 期望建立一种临床上快速、微创的肝癌诊断, 检测及预后的生化指标.
质粒小提试剂盒(天根生化科技有限公司, 北京); 通用型DNA纯化回收试剂盒(天根生化科技有限公司, 北京); miRNA Purification Kit(康为世纪公司, 北京); EasyScript First-Strand cDNA Synthesis SuperMix(全式金生物技术有限公司, 北京); TransStart Top Green qPCR SuperMix(全式金生物技术有限公司, 北京); pEASY-T1 cloning Kit试剂盒(全式金生物技术有限公司, 北京); U6 T载体质粒由本实验保存; DNA测序由上海生工生物工程有限公司完成. 根据miRBase数据库中成熟的miRNA序列分别设计颈环特异性反转录引物以及real-time特异性检测引物(表1). 通用下游检测引物为CTCAACTGGTGTCGTGGA. 以U6基因作为内参基因, 根据NCBI数据库中的U6序列设计其特异性检测引物(表1). 所有引物均由上海生工生物工程有限公司合成. 临床样本的收集: 选取宁夏医科大学附属医院2014-04/2014-12期间确诊为原发性肝癌的患者41例作为实验组, 这些患者均未实行手术且均有详细的肝功血清学检测指标记录, 以及根据TNM标准的肝癌临床分期记录, 其中3人发生肝外转移; 4人并发糖尿病, 9人并发高血压, 1人患有银屑病, 选取同时期的健康体检人群(肝功化验指标均在正常范围, 无其他并发疾病)41例作为对照组(表2). 以上样本的收集均获患者及医院伦理委员会同意. 将收集的确立为研究对象的血清样本, 装于1.5 mL EP管中, 存放于-80 ℃冰箱中.
| 引物名称 | 序列(5'-3') | |
| 颈环反转录引物 | Hsa-miR-21 | CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGTCAACATC |
| Hsa-miR-1247-5p | CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGTCCGGGGAC | |
| qRT-PCR引物 | Hsa-miR-21 | F: ACACTCCAGCTGGCTAGCTTATCAGACTGATG |
| Hsa-miR-1247-5p | F: ACACTCCAGCTGGGACCCGTCCCGTTCGTCC | |
| U6 | F: CTCGCTTCGGCAGCACA | |
| R: AACGCTTCACGAATTTGCGT |
| 分组 | HCC组 | 健康对照组 |
| 性别(男/女) | 27/14 | 25/16 |
| 年龄(岁) | 51(37-69) | 42(29-60) |
| AFP(ng/mL) | 447(4.6-1210) | 2.7(1.48-6.28) |
| GLB(ng/mL) | 31.87(18.1-59.4) | 31.1(23.3-38.4) |
| A/G(ng/mL) | 1.14(0.4-1.95) | 1.47(1.03-1.84) |
| AST(ng/mL) | 79(14.2-239) | 21.78(12-42.3) |
| ALT(ng/mL) | 39.4(9.3-113.3) | 12.9(10.3-121) |
| TP(ng/mL) | 62(50.7-86) | 73(66-85) |
| ALB(ng/mL) | 34(21.-49) | 44.3(39.2-48.4) |
| TBIL(ng/mL) | 42.68(7.2-585) | |
| DBIL(ng/mL) | 22.5(2.8-4 35) | |
| IBIL(ng/mL) | 19.25(4.8-55.9) | |
| ALP(ng/mL) | 155.83(46-609.3) | |
| GGT(ng/mL) | 140.84(23.7-878.7) | |
| CHE(ng/mL) | 4712(1060-9672) | |
| Positive HBsAg[n(%)] | 35(85) | |
| HBsAg(ng/mL) | 4913.5(0.01-8732) | |
| HBsAb(μ/mL) | 19.9(2-588.1) | |
| HBcAb(PEI U/mL) | 0.007(0.004-0.06) | |
| HBeAb(PEI U/mL) | 0.6(0.003-3.2) | |
| HBeAg(PEI U/mL) | 290(0.018-224.4) | |
| TNM分期[n(%)] | ||
| Ⅰ期 | 4(9) | |
| Ⅱ期 | 20(49) | |
| Ⅲ期 | 14(34) | |
| Ⅳ期 | 3(7) | |
| 并发症[n(%)] | ||
| 有肝外转移 | 3(7) | |
| 并发糖尿病 | 4(9) | |
| 并发银屑病 | 1(2) | |
| 并发高血压 | 9(22) |
1.2.1 miRNA的提取与cDNA的合成: 从-80 ℃冰箱中取出血清样本, 按照试剂盒说明书提取miRNA, 将提取的miRNA进行反转录合成cDNA, 按照反转录试剂盒的说明书, 反应体系为RNA 8 μL, 茎环引物1 μL, 2×ES Reaction Mix 10 μL, EasyScript RT/RI Enzyme Mix 1 μL; 反转录条件为42 ℃ 40 min, 85 ℃ 5 min. 合成的cDNA置于-20 ℃保存.
1.2.2 qRT-PCR检测miR-21、miR-1247-5p的表达水平: (1)标准曲线的构建: miR-21、miR-1247-5p的基因扩增与T载体的构建: 以cDNA为模板, 以通用下游引物, 特异性上游引物进行PCR, 2.5%琼脂糖电泳, 将大小正确的片段进行胶回收, 按pEASY-T1 cloning Kit试剂说明书进行T载体的构建. 将已测序成功的质粒进行浓度测定后, 按照10倍稀释法倍比稀释, 倍比稀释7管, 各取2 μL做模板, 构建标准曲线. 利用双标准曲线法进行相对定量分析, 即病例组血清中miRNA拷贝数/病例组血清中U6拷贝数与对照组血清中miRNA拷贝数/对照组血清中U6拷贝数的比值; (2)miR-21、miR-1247-5p的表达检测: 应用罗氏lightcycler 480 qRT-PCR仪, 按照试剂盒说明书, 反应体系为cDNA 2 μL, Forward Primer 1 μL, Reverse Primer 1 μL, Top Green qPCR SuperMix 10 μL, Rnase-Free Water 6 μL. qRT-PCR反应条件为预变性94 ℃ 30 s、94 ℃ 5 s、60 ℃ 15 s、72 ℃ 10 s, 共40个循环; 实验设置3个平行复孔, 取平均值; (3)miR-21、miR-1247-5p与甲胎蛋白(α-fetoprotein, AFP)相关性的分析结果: 将HCC患者的血清中miR-21、miR-1247-5p的表达相对定量值与其对应血清测得的AFP值之间采用Speasman相关性分析.
统计学处理 所有数据分析采用SPSS17.0医学统计分析软件分析, P<0.05视为差异具有统计学意义.
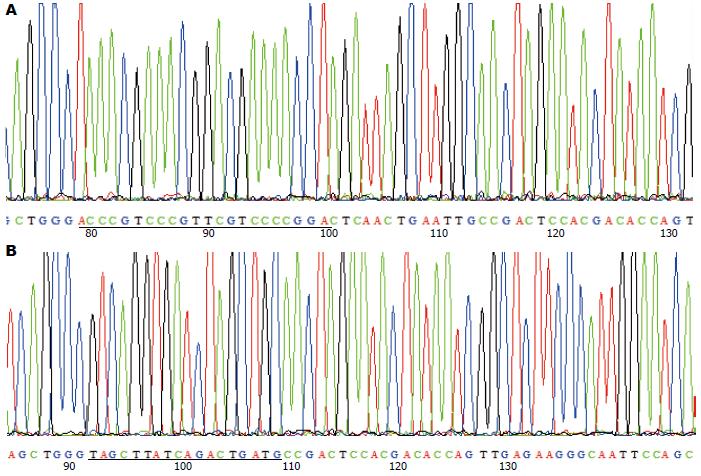
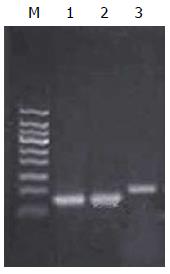
血清中提取的miRNA经PCR扩增, 产物用2.5%琼脂糖凝胶电泳, 获得大约60 bp左右的目的条带, 内参U6获得大约100 bp左右的目的条带(图1). 测序结果表明, 构建的miR-21、miR-1247-5p T载体序列正确(图2). 检测结果表明: 提取样品中的miRNA以及反转录的cDNA质量较好, 完全可以用于后续的qRT-PCR分析.
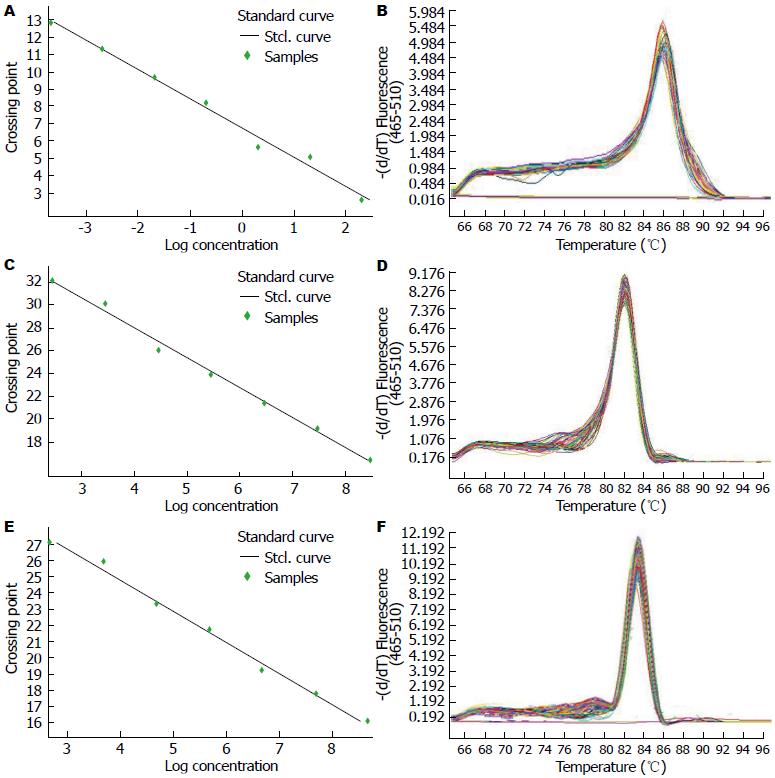
对miR-21、miR-1247-5p、U6 T载体进行qRT-PCR扩增并构建标准曲线, 结果呈良好的均一性, 可用于定量检测. 同时进行溶解曲线分析, 为单一的峰值, 扩增产物的退火温度Tm值均一性良好, 说明产物特异性良好, 可用于后续检测(图3).
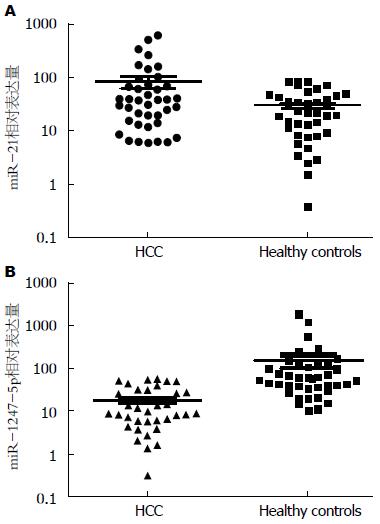
利用双标准曲线相对定量法计算后发现, 与健康人群相比, 原发性肝癌患者血清中miR-21表达量显著上调3倍(P<0.05), miR-1247-5p表达量显著下调8倍(P<0.05)(表3). 将2个实验组测得的miR-21和miR-1247-5p的拷贝数以10为底作纵坐标作散点图, 发现趋势明显, 有统计学意义(图4).
| miRNA | HCC组 | 健康对照组 | P值 |
| miR-21 | 85.33±21.62 | 29.88±3.95 | 0.0137 |
| miR-1247-5p | 17.82±2.59 | 152.9±51.69 | 0.0108 |
经Spearman相关性分析miR-21与AFP的Spearman系数为0.191(P = 0.238>0.05); miR-1247-5p与AFP的Spearman系数为0.153(P = 0.345>0.05), 按所取的检验水准α = 0.05, 无统计学意义. 因此我们认为, HCC患者血清中miR-21、miR-1247-5p的表达水平与AFP值之间无相关性.
HCC在全世界的肿瘤发病率排第6位, 死亡率排第3位[5]. 被称之为"癌中之王". 肝癌起病极为隐匿, 生存率低, 且有半数以上患者在首次就诊就已进入晚期. 肝癌最主要的危险因素是慢性乙型肝炎病毒感染、慢性丙型肝炎病毒感染. 据报道[6,7], 世界范围内80%-90%的肝癌患者是由这2种病毒感染引发的. 目前用于肝癌的筛查及监测的手段主要包括腹部B超、计算机断层扫描(computed tomography, CT)技术、核磁共振成像(nuclear magnetic resonance imaging, MRI)技术等影像学方法及AFP在内的许多实验室检查指标. AFP作为肝癌患者筛查的手段,其敏感度欠缺[8]. 血清AFP在肝炎患者及肝硬化患者中表达也是升高的[9,10]. CT和MRI等大型检查设备由于成本等问题并不适合筛选和早期诊断. 且在诊断直径<1 cm的肝癌时也有较大困难.
miRNA是一种非编码RNA, 长度约22 nt, 其于转录后调节基因表达. 迄今为止, 已在人体内发现超过1400的miRNA, 这些基因大约占在人类基因组中的1%-3%[11]. 据估计, 30%-60%的蛋白质编码基因由miRNA来调节[12,13]. miRNA调节多个细胞增殖、凋亡相关基因的表达, 从而多种病理生理学过程. 建立和维护多种细胞类型的分化状态[14]. miRNA的生成是一个复杂的过程, 首先生成miRNA前体输送至细胞质, 再被Dicer酶等加工成含有21-25 nt的双链miRNA[15]. 成熟的miRNA, 其双链被Dicer酶加载至RNA诱导沉默复合物(RISC)内, 保留其不太稳定的5'末端链, 并随即启动转录后基因沉默. 然而, 剩余未使用的miRNA链可被纳入细胞中特异外来内, 并从细胞中排出[16], 其作用尚不完全清楚. 这可导致细胞外的miRNA于体液主要是血清中出现. 因此, 使用血清miRNA对癌症的诊断以及预后的可能性已引起广泛关注. Jackson[17]将血清中的miRNA作为今后肿瘤诊断和治疗靶点是一种精确和有前景的方法. 有研究[18]表明miRNA能够稳定的在血浆中存在, 并证实肿瘤衍生的miRNA存在血浆中并可以用来作为肿瘤诊断的生化指标. Chang等[19]发现let-7a、miR-16、miR-26a、miR-345、miR-425和miR-454表达稳定, 可以做组织miRNA内参基因. Li等[20]发现血清miR-200a与miR-200b可以用于胰腺癌的诊断. Zheng等[21]应用miRNA芯片技术筛选并应用qRT-PCR验证后, 发现血浆miR-155、miR-197、miR-182在肺癌患者中表达上调, 联合3种miRNA作为诊断标志物敏感度和特异度均高达80%以上. 诸如此类的研究充分展示了循环miRNA在肿瘤等疾病诊断标志物中的巨大实用价值. 在肝癌中也有报道, Shen等[22]研究发现miR-106b在肝癌细胞系及肝癌组织中相对于正常肝细胞及正常肝组织表达均显著升高, 并可以抑制APC基因表达促进肝癌细胞的增殖. 而Yau等[23]不仅发现miR-106b在肝癌组织中表达升高, 并发现其与肿瘤分化程度相关.
miRNAs作为原癌基因或抑癌因子, 能够抑制靶基因的表达与功能, 从而进一步调节肿瘤的生物学特性. miR-21作为研究较多的一类miRNA, 是一种致癌miRNA, 在多种恶性肿瘤中过度表达. miR-21具有调节癌症的程序性细胞死亡、增殖、迁徙和侵袭能力的特点, 已经作为癌症诊断和预后的标志物, Resnick等[24]应用qRT-PCR等技术对28例卵巢癌患者的血清检查, 研究发现卵巢癌血清中miRNAs-21、92、93、126和29a较健康对照组明显上调, 表明血清miR-21作为卵巢癌早期诊断指标是可行的. 血中miR-21的升高与胰腺癌和肺癌的结局及化疗耐药有关[25,26]. miR-21可以激活RAS加速肺癌进展, 而且转基因调节miR-21和针对性的给药可以改变肺癌小鼠模型中肿瘤的进展[27]. 有研究[28]表明miR-21在乳腺癌组织中呈低表达水平. 在肝癌中, 也有关于miR-21的报道, 有研究[29]发现在肝癌组织和癌旁组织中16个miRNA, 包括miR-223、miR-150、miR-199a和miR-21的表达显著不同, 其中7个上调, 5个下调. miR-1247-5p目前仅知来源于DLK1-DIO3结构域, 定位于人14号染色体远端[30]. Benetatos等[31]通过对DLK1-DIO3基因簇研究发现, DLK1-DIO3可以调控包括miR-1247在内的53个miRNA表达. 有报道[32-34]miR-1247-5p在一些生物学模型, 如软骨组织的发育, 乳腺癌[33], 肝癌组织甲基化异常[34]等中存在差异性. Yan等[35]发现, miR-1247-5p在大肠癌细胞中表达量降低. 也有研究[36]表明高表达的miR-1247-5p抑制胰腺癌细胞的增殖与分化. miR-1247-5p与癌症的关系研究较少, 仅有报道其在大肠癌与胰腺癌中表达异常. 未见其与肝癌关系的报道. 而肝癌的发生与多种miRNA的异常表达有着密切关系. 因此, 我们猜想肝癌是否与miR-1247-5p存在着某种关系. 通过收集原发性肝癌以及同时期健康人群的血清样本, 提取样本中miRNA, 通过qRT-PCR的检测, 我们发现miR-1247-5p在肝癌中低表达, 联合已有在大肠癌和胰腺癌中的报道, 表明其可能起着抑癌基因的作用. 我们检测发现miR-21在肝癌中高表达, 再一次验证了miR-21为致癌基因. 癌症中往往不是一种miRNA起着作用, 而是多种miRNA构成复杂的调控网络来发挥作用. 与正常人相比, miR-21在原发性肝癌血清中高表达, 故miR-21可作为一个阳性参照miRNA, 与低表达的miR-1247-5p作为2种诊断标志物, 同现有的检测肝癌的血清学标志物AFP等, 对肝癌患者进行联合辅助诊断. 本文首次揭示了miR-1247-5p在原发性肝癌中表达下调, miR-1247-5p在肝癌患者的血清中存在表达差异. 通过本次实验研究, miR-21和miR-1247-5p有望与常规的检测肝癌的生化指标联合应用, 为诊断肝癌提供新的血清学方法. 今后研究方向考虑来探讨miR-1247-5p在肝癌中下调这种现象是通过何种机制来作用, 期望通过对miR-1247-5p在肝癌中作用机制的研究, 明确miR-1247-5p在肝癌中下调的原因, 使得miR-1247-5p成为今后新的治疗肝癌的靶点. 结合在肝癌患者血清中上调表达的miR-21, 作为诊断肝癌的miRNA的组合. 为临床筛查和诊断原发性肝癌提供一个新的思路.
肝细胞癌(hepatocellular carcinoma, HCC)在全世界的肿瘤发病率排第6位, 死亡率排第3位. 目前用于肝癌的筛查及监测的甲胎蛋白(α-fetoprotein, AFP), 其敏感度欠缺, 而计算机断层扫描和核磁共振成像等大型检查设备由于成本等问题并不适合筛选和早期诊断. miRNA广泛存在于组织, 血浆或血清以及其他体液中, 表现稳定. 因此, 使用血清miRNA对癌症进行诊断以及预后的可能性已引起广泛关注. 有研究表明miRNA能够稳定的在血浆中存在, 并证实肿瘤衍生的miRNA存在血浆中并可以用来作为肿瘤诊断的生化指标.
朱争艳, 研究员, 天津市第三中心医院
目前, 已发现多种miRNA在包括癌症, 自身免疫系统疾病, 炎症等多个人体生理病理过程中表达量异常. miRNA往往不是单一起着作用, 更多情况下多种miRNA构成复杂的调控网络来发挥作用. 目前有学者通过基因芯片, 筛查出大量在疾病中表达异常的miRNA. 发现多种miRNA在人体的表达差异的同时, 人们已经开始探究miRNA作用于机体的更深层抑制, 通过研究miRNA与信号通路的作用、抑癌基因或致癌基因的作用, 来了解miRNA在病理生理过程中发挥的具体机制.
很多报道miRNA在不同组织的表达差异, miR-21作为报道较多的一类miRNA, 在多种生理病理过程中起着调控作用. miR-1247-5p与癌症的关系研究较少, 目前知其来源于DLK1-DIO3结构域, 定位于人14号染色体, 未见其与肝癌关系的报道. 最近才有报道其在大肠癌与胰腺癌中表达异常.
本文收集了临床原发性肝癌患者的血清, 首次发现了miR-1247-5p在肝癌患者中的表达差异性, 其在肝癌中的低表达可能起着抑癌基因的作用. 结合检测得到的高表达miR-21, 作为miRNA组合, 在运用诊断肝癌的血清学金标准AFP的同时, 起到辅助诊断的作用, 为临床诊断肝癌提供一个新思路.
本文通过检测原发性肝癌患者血清中2种miRNA, 发现了其差异性表达, 为今后研究原发性肝癌中miRNA的差异性表达提供了借鉴与参考, 为miR-1247-5p可能发挥抑癌基因的作用提供了佐证, 为今后辅助AFP诊断肝癌提供了思路.
miRNA: 广泛存在于真核生物, 长度21-25 nt的单链非蛋白编码小RNA分子. miRNA占生物体内总蛋白编码基因数量的1%-5%, 能调控人类基因组中10%-30%的基因在进化中具有高度的保守性. 成熟的miRNA通过和其靶基因3'非翻译区(3'-UTR)结合, 导致RNA诱导的沉默复合体降解其靶mRNA或阻碍其靶mRNA的翻译; miRNA能够作用于多个靶标调控基因表达, 发挥多效性功能. 在生物的整个发育过程中, miRNA可能有调节细胞早期发育, 参与固有免疫细胞生长分化和免疫应答, 调节基因表达的生物学功能.
本文立意新颖, 采用技术有一定难度, 实验设置严谨; 通过检测原发性肝癌中miRNA的表达差异, 提供了监测和筛查肝癌的另一种思路, 对临床上检测肝癌有一定参考价值.
编辑: 于明茜 电编: 闫晋利
| 1. | Liu AM, Poon RT, Luk JM. MicroRNA-375 targets Hippo-signaling effector YAP in liver cancer and inhibits tumor properties. Biochem Biophys Res Commun. 2010;394:623-627. [PubMed] [DOI] |
| 2. | Fornari F, Milazzo M, Chieco P, Negrini M, Calin GA, Grazi GL, Pollutri D, Croce CM, Bolondi L, Gramantieri L. MiR-199a-3p regulates mTOR and c-Met to influence the doxorubicin sensitivity of human hepatocarcinoma cells. Cancer Res. 2010;70:5184-5193. [PubMed] [DOI] |
| 3. | Osaki M, Takeshita F, Ochiya T. MicroRNAs as biomarkers and therapeutic drugs in human cancer. Biomarkers. 2008;13:658-670. [PubMed] [DOI] |
| 4. | Kosaka N, Iguchi H, Ochiya T. Circulating microRNA in body fluid: a new potential biomarker for cancer diagnosis and prognosis. Cancer Sci. 2010;101:2087-2092. [PubMed] [DOI] |
| 5. | Ferlay J, Shin HR, Bray F, Forman D, Mathers C, Parkin DM. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008. Int J Cancer. 2010;127:2893-2917. [PubMed] [DOI] |
| 6. | Borel F, Konstantinova P, Jansen PL. Diagnostic and therapeutic potential of miRNA signatures in patients with hepatocellular carcinoma. J Hepatol. 2012;56:1371-1383. [PubMed] [DOI] |
| 7. | Bosch FX, Ribes J, Cléries R, Díaz M. Epidemiology of hepatocellular carcinoma. Clin Liver Dis. 2005;9:191-211, v. [PubMed] |
| 8. | Giannelli G, Antonaci S. New frontiers in biomarkers for hepatocellular carcinoma. Dig Liver Dis. 2006;38:854-859. [PubMed] |
| 9. | Oka H, Tamori A, Kuroki T, Kobayashi K, Yamamoto S. Prospective study of alpha-fetoprotein in cirrhotic patients monitored for development of hepatocellular carcinoma. Hepatology. 1994;19:61-66. [PubMed] |
| 10. | Abdalla MA, Haj-Ahmad Y. Promising Candidate Urinary MicroRNA Biomarkers for the Early Detection of Hepatocellular Carcinoma among High-Risk Hepatitis C Virus Egyptian Patients. J Cancer. 2012;3:19-31. [PubMed] |
| 11. | Zhao Y, Srivastava D. A developmental view of microRNA function. Trends Biochem Sci. 2007;32:189-197. [PubMed] |
| 12. | Bartel DP. MicroRNAs: genomics, biogenesis, mechanism, and function. Cell. 2004;116:281-297. [PubMed] |
| 13. | Friedman RC, Farh KK, Burge CB, Bartel DP. Most mammalian mRNAs are conserved targets of microRNAs. Genome Res. 2009;19:92-105. [PubMed] [DOI] |
| 14. | Bushati N, Cohen SM. microRNA functions. Annu Rev Cell Dev Biol. 2007;23:175-205. [PubMed] |
| 15. | Zhang H, Kolb FA, Brondani V, Billy E, Filipowicz W. Human Dicer preferentially cleaves dsRNAs at their termini without a requirement for ATP. EMBO J. 2002;21:5875-5885. [PubMed] |
| 16. | Etheridge A, Lee I, Hood L, Galas D, Wang K. Extracellular microRNA: a new source of biomarkers. Mutat Res. 2011;717:85-90. [PubMed] [DOI] |
| 17. | Jackson DB. Serum-based microRNAs: are we blinded by potential? Proc Natl Acad Sci U S A. 2009;106:E5. [PubMed] [DOI] |
| 18. | Mitchell PS, Parkin RK, Kroh EM, Fritz BR, Wyman SK, Pogosova-Agadjanyan EL, Peterson A, Noteboom J, O'Briant KC, Allen A. Circulating microRNAs as stable blood-based markers for cancer detection. Proc Natl Acad Sci U S A. 2008;105:10513-10518. [PubMed] [DOI] |
| 19. | Chang KH, Mestdagh P, Vandesompele J, Kerin MJ, Miller N. MicroRNA expression profiling to identify and validate reference genes for relative quantification in colorectal cancer. BMC Cancer. 2010;10:173. [PubMed] [DOI] |
| 20. | Li A, Omura N, Hong SM, Vincent A, Walter K, Griffith M, Borges M, Goggins M. Pancreatic cancers epigenetically silence SIP1 and hypomethylate and overexpress miR-200a/200b in association with elevated circulating miR-200a and miR-200b levels. Cancer Res. 2010;70:5226-5237. [PubMed] [DOI] |
| 21. | Zheng D, Haddadin S, Wang Y, Gu LQ, Perry MC, Freter CE, Wang MX. Plasma microRNAs as novel biomarkers for early detection of lung cancer. Int J Clin Exp Pathol. 2011;4:575-586. [PubMed] |
| 22. | Shen G, Jia H, Tai Q, Li Y, Chen D. miR-106b downregulates adenomatous polyposis coli and promotes cell proliferation in human hepatocellular carcinoma. Carcinogenesis. 2013;34:211-219. [PubMed] [DOI] |
| 23. | Yau WL, Lam CS, Ng L, Chow AK, Chan ST, Chan JY, Wo JY, Ng KT, Man K, Poon RT. Over-expression of miR-106b promotes cell migration and metastasis in hepatocellular carcinoma by activating epithelial-mesenchymal transition process. PLoS One. 2013;8:e57882. [PubMed] [DOI] |
| 24. | Resnick KE, Alder H, Hagan JP, Richardson DL, Croce CM, Cohn DE. The detection of differentially expressed microRNAs from the serum of ovarian cancer patients using a novel real-time PCR platform. Gynecol Oncol. 2009;112:55-59. [PubMed] [DOI] |
| 25. | Liu R, Chen X, Du Y, Yao W, Shen L, Wang C, Hu Z, Zhuang R, Ning G, Zhang C. Serum microRNA expression profile as a biomarker in the diagnosis and prognosis of pancreatic cancer. Clin Chem. 2012;58:610-618. [PubMed] [DOI] |
| 26. | Gao W, Lu X, Liu L, Xu J, Feng D, Shu Y. MiRNA-21: a biomarker predictive for platinum-based adjuvant chemotherapy response in patients with non-small cell lung cancer. Cancer Biol Ther. 2012;13:330-340. [PubMed] [DOI] |
| 27. | Hatley ME, Patrick DM, Garcia MR, Richardson JA, Bassel-Duby R, van Rooij E, Olson EN. Modulation of K-Ras-dependent lung tumorigenesis by MicroRNA-21. Cancer Cell. 2010;18:282-293. [PubMed] [DOI] |
| 29. | Jiang J, Gusev Y, Aderca I, Mettler TA, Nagorney DM, Brackett DJ, Roberts LR, Schmittgen TD. Association of MicroRNA expression in hepatocellular carcinomas with hepatitis infection, cirrhosis, and patient survival. Clin Cancer Res. 2008;14:419-427. [PubMed] [DOI] |
| 30. | Morin RD, O'Connor MD, Griffith M, Kuchenbauer F, Delaney A, Prabhu AL, Zhao Y, McDonald H, Zeng T, Hirst M. Application of massively parallel sequencing to microRNA profiling and discovery in human embryonic stem cells. Genome Res. 2008;18:610-621. [PubMed] [DOI] |
| 31. | Benetatos L, Hatzimichael E, Londin E, Vartholomatos G, Loher P, Rigoutsos I, Briasoulis E. The microRNAs within the DLK1-DIO3 genomic region: involvement in disease pathogenesis. Cell Mol Life Sci. 2013;70:795-814. [PubMed] [DOI] |
| 32. | Martinez-Sanchez A, Murphy CL. miR-1247 functions by targeting cartilage transcription factor SOX9. J Biol Chem. 2013;288:30802-30814. [PubMed] [DOI] |
| 33. | Wu Y, Ginther C, Kim J, Mosher N, Chung S, Slamon D, Vadgama JV. Expression of Wnt3 activates Wnt/β-catenin pathway and promotes EMT-like phenotype in trastuzumab-resistant HER2-overexpressing breast cancer cells. Mol Cancer Res. 2012;10:1597-1606. [PubMed] [DOI] |
| 34. | Voloshanenko O, Erdmann G, Dubash TD, Augustin I, Metzig M, Moffa G, Hundsrucker C, Kerr G, Sandmann T, Anchang B. Wnt secretion is required to maintain high levels of Wnt activity in colon cancer cells. Nat Commun. 2013;4:2610. [PubMed] [DOI] |
| 35. | Yan H, Choi AJ, Lee BH, Ting AH. Identification and functional analysis of epigenetically silenced microRNAs in colorectal cancer cells. PLoS One. 2011;6:e20628. [PubMed] [DOI] |
| 36. | Shi S, Lu Y, Qin Y, Li W, Cheng H, Xu Y, Xu J, Long J, Liu L, Liu C. miR-1247 is correlated with prognosis of pancreatic cancer and inhibits cell proliferation by targeting neuropilins. Curr Mol Med. 2014;14:316-327. [PubMed] |