修回日期: 2015-09-17
接受日期: 2015-10-13
在线出版日期: 2015-11-18
目的: 探讨谷氨酸-酰胺酸-tRNA合成酶(glutamyl-prolyl-tRNA synthetase, EPRS) mRNA及其蛋白在重症急性胰腺炎(sever acute pancreatitis, SAP)起病早期肝脏中的表达及其作用.
方法: 96只SD大鼠随机分为SAP组、假手术组(SO组)、地塞米松(dexamethasone, DEX)组, 于2、6、12、24 h时间点分别处死8只. 用牛黄胆酸钠诱导大鼠建立SAP模型, DEX组大鼠下肢肌注0.5 mg/100 g地塞米松治疗, 其余两组不干预. HE染色观察肝脏病理损伤, 碘比色法测血清淀粉酶(serum amylase, AMS)含量, ELISA法检测肝脏组织核因子κB(nuclear factor κB, NF-κB)、干扰素-γ(interferon-γ, IFN-γ)表达量, RT-PCR法检测肝小叶中EPRS mRNA表达量, 免疫组织化学SP法半定量检测EPRS蛋白表达量. 比较3组大鼠不同时段上述指标的差异.
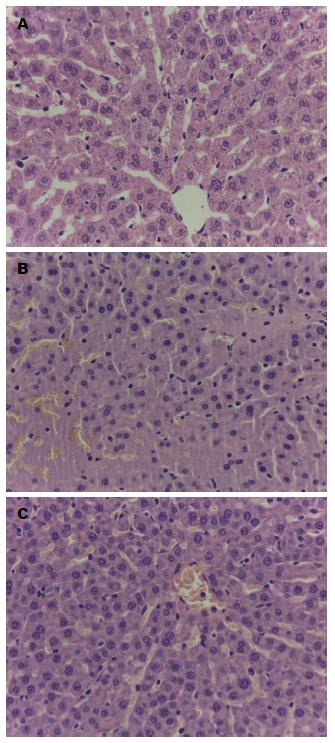
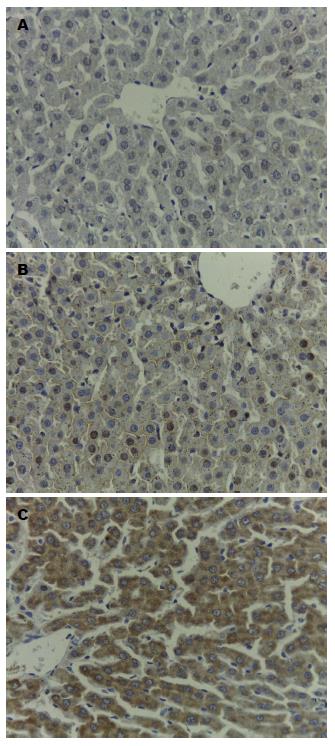
结果: 肝脏HE染色结果见SAP组较SO组炎症渗出严重, DEX组较SAP组出血、渗出有所改善, 病理评分下降(P = 0.025); DEX组较SAP组降低(P = 0.0013); 各组肝脏NF-κB在6 h时间点相应升高, 但6 h DEX组较6 h SAP组低(P = 0.047); 而肝脏IFN-γ含量在6 h DEX组较6 h SAP组增加(P = 0.038); 6 h SAP组血清肿瘤坏死因子-α、白介素-1β较6 h SO组升高, 而6 h DEX组较6 h SAP组降低(P<0.05); 免疫组织化学结果示6 h SAP组较SO组高(P = 0.007), 6 h DEX组较6 h SAP组升高明显(P = 0.007).
结论: SAP大鼠经地塞米松治疗后EPRS升高, 提示EPRS在SAP并发肝损伤过程中可能有重要作用.
核心提示: 目前国内外研究中仍无研究证明谷氨酸-酰胺酸-tRNA合成酶(glutamyl-prolyl-tRNA synthetase, EPRS)蛋白及mRNA在重症急性胰腺炎(sever acute pancreatitis, SAP)模型大鼠肝脏中有表达, 且地塞米松(dexamethasone)在临床治疗SAP仍是重要的手段, 但机制复杂, 故本实验欲证明EPRS途径可能是多通路中的其中之一且可能存在抑制作用.
引文著录: 陈丽舒, 杨元生, 陈垦, 陈杏苑, 谢文瑞, 王晖. 地塞米松对重症急性胰腺炎肝损伤大鼠EPRS的影响. 世界华人消化杂志 2015; 23(32): 5133-5140
Revised: September 17, 2015
Accepted: October 13, 2015
Published online: November 18, 2015
AIM: To investigate the effect of dexamethasone (DEX) on the expression of glutamyl prolyl tRNA synthetase (EPRS) in liver tissue of rats with severe acute pancreatitis (SAP)-associated liver injury.
METHODS: Ninety-six SD rats were randomly divided into an SAP model group, a sham operation (SO) group, and a DEX treatment group. Sodium taurocholate was used to induce SAP in rats of the model group and DEX group. Dexamethasone was given by intramuscular injection at 0.5 mg/100 g in the DEX group. Rats in each group were killed at different points (2, 6, 12, and 24 h) after treatment for further analysis. HE staining was used to observe liver damage. Serum amylase (AMS) content was measured by iodine colorimetric method. ELISA was used to detect the expression of liver nuclear factor κB (NF-κB) and interferon-γ (IFN-γ). The expression of EPRS was detected by immunohistochemical staining.
RESULTS: The SAP group suffered more severe inflammatory exudation than the SO group as revealed by liver HE staining. The DEX group had a decreased pathological score compared with the SAP group (P = 0.025). Serum AMS was significantly lower in the DEX group than in the SAP group (P = 0.0013). NF-κB expression at 6 h was significantly lower (P = 0.047), but IFN-γ expression at 6 h was significantly higher in the DEX group than in the SAP group (P = 0.038). The DEX group had significantly increased EPRS expression at 6 h as shown by immunohistochemistry (P < 0.01).
CONCLUSION: Hepatic EPRS expression is increased at 6 h after dexamethasone treatment in SAP rats.
- Citation: Chen LS, Yang YS, Chen K, Chen XY, Xie WR, Wang H. Dexamethasone treatment upregulates glutamyl prolyl tRNA synthetase expression in liver tissue of rats with severe acute pancreatitis-associated liver injury. Shijie Huaren Xiaohua Zazhi 2015; 23(32): 5133-5140
- URL: https://www.wjgnet.com/1009-3079/full/v23/i32/5133.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i32.5133
重症急性胰腺炎(sever acute pancreatitis, SAP)起病急, 病变累及多器官严重损害[1], 其起病机制涉及广泛[2], 在人体肝脏中, 干扰素-γ(interferon-γ, IFN-γ)由淋巴细胞、自然杀伤细胞等产生, 且具有Th1/Th2应答调制的作用[3], 炎症因子促谷氨酸-酰胺酸-tRNA合成酶(glutamyl-prolyl-tRNA synthetase, EPRS)磷酸化[4], 抑制炎症相关蛋白翻译的非经典功能, 不阻断mRNA转录情况下抑制EPRS基因表达[5]. 本研究旨在探究经过地塞米松(dexamethasone, DEX)治疗后大鼠SAP早期肝脏EPRS mRNA及其蛋白的表达情况及DEX对EPRS mRNA及其蛋白的影响.
SPF级♀SD大鼠96只, 8周龄, 体质量180 g±220 g, 购自广东省医学实验动物中心, 动物许可证号: SCXL(粤)2013-0002, 清洁级动物房饲养, 自由摄食饮水. 96只SD大鼠按随机数字表法分为假手术组(SO组)、SAP组、DEX组, 每组分为2、6、12、24 h 4个时间点组, 每时间点每组8只, 适应性饲养1 wk. 牛黄胆酸钠(sigma In.), 地塞米松(sigma In.), 752紫外分光光度计(上海凌光公司), 大鼠核因子κB(nuclear factor κB, NF-κB) ELISA试剂盒(邦奕生物技术公司), 大鼠IFN-γ ELISA试剂盒(邦奕生物技术公司), 大鼠肿瘤坏死因子-α(tumor necrosis factor α, TNF-α) ELISA试剂盒(邦奕生物技术公司)、大鼠白介素(interleukin, IL)-1β ELISA试剂盒(邦奕生物技术公司), 淀粉酶试剂盒(南京建成生物工程研究所), 戊巴比妥钠(鼎国生物技术公司). 酶标仪iMark(BIO-RAD In.), 低温离心机Scanspeed 1730R(Labogene In.), 电热恒温培养箱DNP-9162(上海精宏公司), 普通PCR仪C1000 Thermal cycler(BIO-RAD In.), 荧光定量仪7300(ABI In.), 凝聚成像系统UV Transilluminator M-26(UVP In.), 电泳仪EPS-300(Tanon In.), EPRS兔抗大鼠抗体(Santa Cruz In.), 显微数码照相机(Leica In.), 二抗山羊抗兔(中杉金桥公司), DAB显色剂(Novolink In.).
1.2.1 SAP模型建立及标本采集: 应用5%牛黄胆酸钠(sodium taurocholate, STC)逆向胰胆管静推诱导大鼠SAP模型, 用微泵缓慢泵入5%STC(0.1 mL/100 g, 0.3 mL/min), 注射完2-3 min后观察到胰腺充血、肿胀、胰胆管均扩张. SO组仅开腹有翻动肠管和胰腺之后关腹. 两组大鼠均于术后在大腿皮下注射生理盐水(2 mL/100 g), 于2、6、12、24 h等时间点用3%戊巴比妥钠液麻醉大鼠后心脏取血(4 mL)处死大鼠, 血液室温放置2 h, 1000 r/min离心10 min, 取上层血清分装入EP管内-70 ℃冻存备用, 留取肝脏组织标本后冻存于液氮.
1.2.2 病理切片: 所有大鼠均取相同部位的肝脏组织大小约1.0 cm×1.0 cm×0.5 cm, 生理盐水洗净后, 4%多聚甲醛溶液固定24 h、脱水、脱脂、石蜡包埋、切片及HE染色.
1.2.3 血清淀粉酶检测: 取备用血清采用碘-淀粉比色法检测血清淀粉酶(serum amylase, AMS)的含量, 按照说明书配好待测溶液, 利用752紫外分光光度计于波长606 nm下测量样本吸光度(A)值, 用标准品绘制A值曲线, 根据公式计算出样本AMS含量.
1.2.4 ELISA法检测肝脏NF-κB、IFN-γ含量: 将组织剪成细小碎片, 溶解裂解液RIPA使用前加入1 mmol/L PMSF, 以每20 mg组织200 mL裂解液比例加入裂解液, 50 mg组织用玻璃匀浆器充分匀浆裂解, 2000-3000 r/min, 离心20 min收集上清. 采用间接夹心ELISA法, 按照说明书进行包被, 加样, 加酶标抗体, 显色, 终止反应等步骤后得出A值, 利用标准品绘制的A值曲线得出样本的最终浓度.
1.2.5 RT-PCR法检测肝脏中EPRS mRNA: (1)引物设计: GenBank上查找目的基因mRNA序列, 在CDS区设计特异性引物, 运用Primer express 2.0软件进行引物设计: Sequence Name: R-EPRS(扩增片段长度103 bp), 上游引物: 5'-AGCAGGCCTTCCGTTCAGTT-3', 下游引物: 5'-GGAAGCTCGACGAATTTCCC-3'; Sequence Name: R-GAPDH(扩增片段长度110 bp)内参基因: 上游引物: 5'-AGGGCTGCCTTCTCTTGTGA-3', 下游引物: 5'-AACTTGCCGTGGGTAGAGTCA-3'; (2)组织总RNA提取: 在超净台内, 取约0.5 g组织于1.5 mL EP管内, 用剪刀剪碎, 加TRIzol 1.0 mL再用玻璃棒研磨匀浆, 充分振荡混匀, 室温放置5 min, 加入氯仿0.2 mL, 盖紧盖子, 用振荡器振荡15 s, 室温孵育2-3 min, 4 ℃ 12000 r/min离心15 min, 取上清液至新的1.5 mL EP管. 加与上清液等体积的异丙醇, 轻轻混匀, -20 ℃孵育样品20-30 min, 4 ℃12000 r/min 离心10 min, 弃上清液. 750 mL/L乙醇(含DEPC水) 800 μL洗涤沉淀1次, 4 ℃ 7500 r/min 离心5 min, 弃乙醇. 空气或真空干燥5-10 min(不要完全干燥), 加DEPC处理水20-50 μL溶解RNA, -80 ℃保存备用; (3)PCR反应: 待测样本PCR反应体系为H2O 18 μL, 10×PCR Buffer 2.5 μL, dNTPS 0.5 μL, TAQ 0.5 μL, 上游引物(10 pmol/μL) 0.5 μL, 下游引物(10 pmol/μL) 0.5 μL, cDNA 2 μL, 总体积25 μL. 扩增条件为93 ℃ 2 min, 然后93 ℃ 15 s, 55 ℃ 25 s, 72 ℃ 25 s, 共40循环.
1.2.6 SP法免疫组织化学检测: 取材组织块, 经固定后, 常规石蜡包埋, 3 μm切片. 脱蜡: 烤箱中80 ℃ 2 h. 烤箱中取出玻片, 立即放入二甲苯10 min×2次. 脱水: 梯度乙醇100 mL/L(浓度梯度: 1000 mL/L→1000 mL/L→950 mL/L→950 mL/L→900 mL/L→800 mL/L→700 mL/L)2 min/次. 将切片浸泡于3%H2O2中, 10 min. PBS洗2 min×3次. 抗原修复, 微波处理: 0.01 mol/L(pH 7.8)柠檬酸缓冲溶液中, 大火煮沸5 min, 中火煮5 min(自然冷却至室温), PBS洗2 min×3次, 免疫组织化学笔画圈. 滴加封闭工作液, 37 ℃孵育15-20 min, PBS洗2 min×3次. 切片上滴加1:50稀释的兔抗大鼠一抗EPRS, 37 ℃孵育60-120 min, 或放4 ℃冰箱过夜, PBS洗2 min×3次. 滴加1:50稀释的山羊抗兔二抗工作液, 37 ℃孵育15-20 min, PBS洗2 min×3次. DAB显色2-5 min, 显微镜下控制, 自来水冲终止反应. 苏木素复染约30 s, 自来水冲蓝化5 min, 脱水: 梯度乙醇(700 mL/L→800 mL/L→900 mL/L→950 mL/L→1000 mL/L→1000 mL/L)2 min/次, 二甲苯30 s, 晾干切片, 中性树胶封片. 结果判定: 免疫组织化学以包浆和包膜棕黄色颗粒沉淀为阳性, 在高倍视野(10×40)下随机选取5个视野, 计算每个阳性细胞数取其均数代表该样本的阳性表达数n1, 总细胞数为n, 阳性率 = n1/n×100%.
统计学处理 计量资料采用mean±SD表示, 应用SPSS22.0统计软件对组内时间点变量进行单因素方差分析, 两组之间运用LSD法比较, 等级资料间用非参数检验, P<0.05表示差异有统计学意义.
SAP组大鼠肝脏组织2、6 h时间点仅有少量渗出、出血. 12 h呈不同程度肝窦扩张, 肝细胞排列紊乱, 肝索结构破坏, 中央静脉出血变形, 大量中性粒细胞浸润、渗出. 24 h见肝脏大片渗出、坏死. 6 h DEX组较6 h SAP组肝索结构较明显, 细胞排列较整齐, 根据Camargo分级标准进行评分, 6 h时间点SO组、SAP组和DEX组各分组间进行非参数检验(Kruskal Wallis), 3组具有差异(P = 0.048), 6 h时间点SO组与DEX组和SAP组进行两独立样本检验(Manm-Whitney U)均有显著性差异(P<0.05, 表1, 图1).
SAP组、DEX组血清AMS均较SO组血清升高(P<0.01), 且随时间点推移呈递增趋势, 经过地塞米松治疗后DEX组血清AMS较SAP组降低(P = 0.0013, 表2).
SAP组NF-κB随时间推移逐渐升高至6 h后达到峰值后下降且与SO组差异明显(P = 0.003), 经过地塞米松治疗后, 6 h时间点DEX组较SAP组肝脏NF-κB含量降低(P = 0.047), 且与SO组无明显差异(P = 0.188), 其余时间点各组之间NF-κB含量无明显差异. IFN-γ含量在SAP组、DEX组于6 h时间点升高到达峰值, 且较SO组升高显著(P = 0.028, P = 0.013), 经地塞米松治疗后DEX组IFN-γ含量较SAP组升高(P = 0.038). 6 h DEX组血清TNF-α、IL-1β均较SO组降低, 6 h SAP组较SO组升高(P<0.05)(表3).
| 指标 | 时间 | SO组 | SAP组 | DEX组 |
| NF-κB(ng/L) | 2 h | 136.025±11.827 | 133.507±12.274 | 173.579±37.654 |
| 6 h | 138.550±6.328 | 163.875±18.023a | 228.908±13.934a | |
| 12 h | 142.925±1.788 | 133.508±2.644 | 160.035±38.021 | |
| 24 h | 135.258±12.842 | 136.231±17.239 | 162.559±3.560 | |
| IFN-γ(ng/L) | 2 h | 33.759±2.944 | 34.781±4.896 | 37.114±3.503 |
| 6 h | 32.505±4.476 | 77.458±11.280a | 60.791±7.943a | |
| 12 h | 31.808±4.692 | 38.393±5.853 | 35.060±2.564 | |
| 24 h | 32.505±4.475 | 32.745±1.966 | 34.412±2.463 | |
| TNF-α(ng/mL) | 6 h | 0.273±0.914 | 0.531±0.092a | 0.404±0.083a |
| IL-1β(ng/mL) | 6 h | 0.163±0.553 | 0.455±0.048a | 0.357±0.067a |
6 h时间点, DEX组EPRS mRNA表达为3组间最高, SAP组次之, SO组表达最低, P = 0.0439; 6 h DEX组EPRS mRNA表达量较6 h SAP组明显升高, P = 0.019; 而6 h SAP组与6 h SO组EPRS mRNA无明显变化, 各组其余时间点EPRS mRNA表达无明显差异(表4).
6 h时间点SO组大鼠EPRS蛋白表达大多数为弱表达, 而SAP组则为几乎为弱表达与强表达参半, DEX组则绝大多数为强表达. 6 h时间点SO组、SAP组和DEX组3组间进行非参数检验(Kruskal Wallis), 3组差异明显(P<0.01); 6 h时间点SO组、SAP组和DEX组3组进行两两独立样本检验(Manm-Whitney U), SAP组与SO组比较, P = 0.078; SAP组与SO组比较, P = 0.007; DEX组与SO组比较, P = 0.007, 可见SO组与SAP组EPRS蛋白含量无明显差异, 而SO组与DEX组, SAP组与DEX组差异具有显著性, 由图2可知6 h DEX组EPRS蛋白表达较6 h SAP组表达增加.
SAP治疗迄今仍无特效药、且易并发全身性炎症反应综合征, 死亡率较高[6,7], 我们课题组前期研究表明, 急性胰腺炎细胞经免疫印迹证明NF-κB p65蛋白升高明显[8,9], 而赵立新等[10]实验结果示SAP组NF-κB p65肝脏表达明显高于SO组并与炎症发展成正比与本文表1中NF-κB的变化相符. 虽然SAP发病机制研究多围绕NF-κB信号通路展开[11], 但未能找到特效靶点抑制剂, 近年则着眼于炎症基因转录靶点、蛋白翻译等研究. 在人体单核/巨噬细胞存在EPRS蛋白介导的特异性炎症相关基因沉默的非经典功能可抑制炎症相关蛋白翻译[12], 在不阻断JAK、STAT、MAPK、ERK等炎症基因mRNA转录的前提下抑制炎症因子表达. DEX具有抑制炎症细胞集聚、抑制吞噬作用及溶酶体释放等功能, 可通过体液免疫来抑制SAP患者的炎症发展[13]. 陆伟等[14]对在哮喘小鼠体内注射地塞米松能促进IFN-γ释放, 其机制可能是促进IFN-γ基因的转录及蛋白表达和合成; 增加IFN-γ的稳定性, 减少其降解; 上调IFN-γ的靶细胞和信号传导通路的功能来上调IFN-γ[15]. IFN-γ具有刺激中性粒细胞, 增强其吞噬能力; 活化NK细胞, 增强其细胞毒作用; 使静脉内皮细胞对中性粒细胞的黏附能力更强[16]. EPRS是哺乳动物细胞内的一种双功能氨基酰-tRNA合成酶, 其可能通过以下两个途径调节炎症反应: (1)通过基因选择性沉默机制阻遏血浆铜蓝蛋白(ceruloplasmin, CP)的表达而止炎症反应. Qiu等[17]证明血浆铜蓝蛋白与肝损伤的程度呈正比, 而Fax实验室于Cell报道EPRS是沉默血浆铜蓝蛋白翻的必要组成蛋白, 在炎症相关基因沉默上发挥重要作用[18]; (2)EPRS于IFN-γ刺激后发生磷酸化并由aaRS复合物上解离下来后结合NSAP1形成无活性的前体IFN-γ激活/翻译抑制(gamma-interferon-activated inhibitor of translation, GAIT)复合物[19], 受IFN-γ刺激后核糖体蛋白L13a被磷酸化并从核糖体60S亚基上解离下来[20], 结合GAPDH和前体GAIT复合物形成有功能活性完整的GAIT复合物从而抑制炎症发展[21]. 故EPRS对抑制SAP肝损伤炎症反应可能有一定作用.
本研究拟运用DEX治疗SAP大鼠, 以探究EPRS蛋白及其mRNA是否参与SAP早期并发肝损伤过程, 研究发现6 h点SAP大鼠肝脏组织中发现IFN-γ和EPRS蛋白及其mRNA表达量较SO组明显升高, 而DEX组则较SAP组升高更显著(表3, 4), 但12 h和24 h时间点二者在SAP组与DEX组间表达均无明显差异. 我们研究[22]发现SAP大鼠肝脏IFN-γ、EPRS较正常大鼠升高, 经DEX治疗后SAP大鼠肝脏IFN-γ、EPRS均较SAP大鼠升高. 可能由于地塞米松诱导IFN-γ表达增加后, IFN-γ进一步诱导调节蛋白CDK5-R1(p35)激活依赖Cyclin的激酶5磷酸化Ser886位点, 并活化AGC激酶使Ser999磷酸化, 导致EPRS的链接EPRS蛋白转录翻译形成GAIT结合靶标Mrna3'-UTR上识别原件(GAIT element)抑制炎症相关蛋白质翻译[23], 或可能通过降低血浆铜蓝蛋白以减轻炎症反应[24]. DEX可能通过刺激IFN-γ合成和EPRS蛋白表达使得DEX干预大鼠炎症相关指标降低, 但IFN-γ与EPRS之间的相关性尚需进一步研究.
总之, 在SAP大鼠肝脏组织中EPRS mRNA受到IFN-γ刺激后表达增加, 而后EPRS mRNA经过转录翻译形成EPRS蛋白以抑制炎症发生发展[25], DEX组地塞米松干预后肝脏炎症减轻, 肝脏IFN-γ增加, EPRS蛋白及其mRNA表达明显升高, NF-κB表达及肝脏病理评分减低. 可见, DEX能有效减少炎症因子产生, 并上调EPRS mRNA及蛋白表达; 而EPRS可能通过调控炎症相关蛋白如: JAK、STAT、MAPK、ERK等多靶点表达来调控SAP炎症的发展[26-30]. EPRS蛋白及其mRNA在SAP早期即升高, 提示EPRS可能在SAP发病过程中有重要作用, SAP早期联合应用DEX及EPRS重组蛋白可能对SAP炎症反应有一定抑制作用.
重症急性胰腺炎(sever acute pancreatitis, SAP)是一种由各种炎症因子释放引起的急性炎症, 其致死原因多为多器官功能不全, 而合并肝损伤是最常见的并发症. 而谷氨酸-酰胺酸-tRNA合成酶(glutamyl-prolyl-tRNA synthetase, EPRS)蛋白多于哺乳类动物单核巨噬细胞中表达, 其可能通过干扰素-γ(interferon-γ, IFN-γ)/EPRS途径来影响SAP肝脏炎症的发展.
王刚, 副研究员, 哈尔滨医科大学附属第一医院胰胆外科(普外二科); 王蒙, 副教授, 中国人民解放军第二军医大学附属东方肝胆外科医院肝外综合治疗一科
SAP治疗手段较为多样, 但降低死亡率仍需要运用地塞米松, 目前研究着眼于核因子κB(nuclear factor κB, NF-κB)、JAK/STAT等炎症通路等研究, 无IFN-γ/EPRS途径在SAP相关研究的报道, IFN-γ/EPRS途径可能成为炎症途径的热点.
杨波等证明血浆铜蓝蛋白与肝损伤的程度呈正比, Fax实验室于Cell报道EPRS是沉默血浆铜蓝蛋白翻的必要组成蛋白, 在炎症相关基因沉默上发挥重要作用. Sampath等证明IFN-γ能导致EPRS磷酸化而抑制炎症发展, 故DEX存在一定间接增强EPRS的作用.
目前国内外研究中仍无研究证明EPRS蛋白及mRNA在SAP模型大鼠肝脏中表达, 本文期待证明(1)EPRS在SAP肝脏中是否表达; (2)DEX治疗SAP过程中EPRS途径可能存在促进抑制炎症作用.
目前地塞米松作为临床上治疗SAP常用药, 其机制复杂, 而本文提出了IFN-γ/EPRS途径在地塞米松治疗过程中可能发挥促进作用, 对SAP的研究以及临床应用提供了一定的理论基础, 为SAP治疗提供了新的思路.
本文探讨了地塞米松对SAP肝损伤大鼠EPRS的影响, 为SAP的深入研究提供了新的靶点, 构思严谨, 科学性较强, 研究组合好.
编辑: 郭鹏 电编: 闫晋利
| 1. | Rizos E, Tournikioti K, Alevyzakis E, Peppa M, Papazaxos K, Zorbas G, Michopoulos I, Liappas I, Papageorgiou C, Douzenis A. Acute necrotizing pancreatitis following olanzapine treatment and 759C/T polymorphism of HTR2C gene: A case report. In Vivo. 2015;29:529-531. [PubMed] |
| 2. | Meher S, Mishra TS, Sasmal PK, Rath S, Sharma R, Rout B, Sahu MK. Role of Biomarkers in Diagnosis and Prognostic Evaluation of Acute Pancreatitis. J Biomark. 2015;2015:519534. [PubMed] [DOI] |
| 3. | Fireman-Klein E, Man A, Schwartz Y, Fireman E. Interferon gamma release assay-guided latent tuberculosis prophylaxis in israel. Isr Med Assoc J. 2015;17:405-409. [PubMed] |
| 4. | Yao P, Potdar AA, Arif A, Ray PS, Mukhopadhyay R, Willard B, Xu Y, Yan J, Saidel GM, Fox PL. Coding region polyadenylation generates a truncated tRNA synthetase that counters translation repression. Cell. 2012;149:88-100. [PubMed] [DOI] |
| 5. | Jia J, Arif A, Ray PS, Fox PL. WHEP domains direct noncanonical function of glutamyl-Prolyl tRNA synthetase in translational control of gene expression. Mol Cell. 2008;29:679-690. [PubMed] [DOI] |
| 6. | Horibe M, Egi M, Sasaki M, Sanui M. Continuous regional arterial infusion of protease inhibitors for treatment of severe acute pancreatitis: Systematic review and meta-analysis. Pancreas. 2015;44:1017-1023. [PubMed] [DOI] |
| 7. | Dong LH, Liu ZM, Wang SJ, Zhao SJ, Zhang D, Chen Y, Wang YS. Corticosteroid therapy for severe acute pancreatitis: a meta-analysis of randomized, controlled trials. Int J Clin Exp Pathol. 2015;8:7654-7660. [PubMed] |
| 8. | Rao CY, Fu LY, Hu CL, Chen DX, Gan T, Wang YC, Zhao XY. H2S mitigates severe acute pancreatitis through the PI3K/AKT-NF-κB pathway in vivo. World J Gastroenterol. 2015;21:4555-4563. [PubMed] [DOI] |
| 9. | 谢 文瑞, 杨 元生, 杨 新魁, 陈 垦, 陈 婧华, 崔 淑兰, 王 晖. PTD-NBD多肽对大鼠胰腺腺泡细胞炎症损伤中NF-κB表达的影响. 世界华人消化杂志. 2013;21:2136-2142. |
| 11. | Zhu T, Wu XL, Zhang W, Xiao M. Glucagon like peptide-1 (GLP-1) modulates ova-induced airway inflammation and mucus secretion involving a protein kinase A (PKA)-dependent nuclear factor-κB (NF-κB) signaling pathway in mice. Int J Mol Sci. 2015;16:20195-20211. [PubMed] [DOI] |
| 12. | Arif A, Chatterjee P, Moodt RA, Fox PL. Heterotrimeric GAIT complex drives transcript-selective translation inhibition in murine macrophages. Mol Cell Biol. 2012;32:5046-5055. [PubMed] [DOI] |
| 13. | 张 喜平, 张 玲, 王 英, 姜 益玉, 程 琪辉, 陆 贝, 居 同法, 方 欣, 沈 海萍. 地塞米松对重症急性胰腺炎大鼠多脏器损伤的保护作用. 医学研究杂志. 2006;35:19-23. |
| 16. | Magaña D, Aguilar G, Linares M, Ayala-Balboa J, Santacruz C, Chávez R, Estrada-Parra S, Garfias Y, Lascurain R, Jiménez-Martínez MC. Intracellular IL-4, IL-5, and IFN-γ as the main characteristic of CD4+CD30+ T cells after allergen stimulation in patients with vernal keratoconjunctivitis. Mol Vis. 2015;21:443-450. [PubMed] |
| 17. | Qiu Y, Wang Y, Lin N, Huang M, Tan Y, Wang Q, Jiang Y, Liu H, Liu J, Zhang J. Multicenter clinical evaluation of three commercial reagent kits based on the interferon-gamma release assay for the rapid diagnosis of tuberculosis in China. Int J Infect Dis. 2015; Sep 7. [Epub ahead of print]. [PubMed] [DOI] |
| 18. | Sampath P, Mazumder B, Seshadri V, Gerber CA, Chavatte L, Kinter M, Ting SM, Dignam JD, Kim S, Driscoll DM. Noncanonical function of glutamyl-prolyl-tRNA synthetase: gene-specific silencing of translation. Cell. 2004;119:195-208. [PubMed] |
| 19. | 杨 波, 吴 元凯, 曹 红, 陈 忠诚, 高 志良, 柯 伟民. 血浆铜蓝蛋白在乙型肝炎不同肝功能状态的水平及意义. 胃肠病学和肝病学杂志. 2012;21:841-843. |
| 20. | Arif A, Jia J, Moodt RA, DiCorleto PE, Fox PL. Phosphorylation of glutamyl-prolyl tRNA synthetase by cyclin-dependent kinase 5 dictates transcript-selective translational control. Proc Natl Acad Sci U S A. 2011;108:1415-1420. [PubMed] [DOI] |
| 22. | Ray PS, Sullivan JC, Jia J, Francis J, Finnerty JR, Fox PL. Evolution of function of a fused metazoan tRNA synthetase. Mol Biol Evol. 2011;28:437-447. [PubMed] [DOI] |
| 23. | Marquez-Jurado S, Nogales A, Zuñiga S, Enjuanes L, Almazán F. Identification of a gamma interferon-activated inhibitor of translation-like RNA motif at the 3' end of the transmissible gastroenteritis coronavirus genome modulating innate immune response. MBio. 2015;6:e00105. [PubMed] [DOI] |
| 24. | Kida Y, Taira J, Yamamoto T, Higashimoto Y, Kuwano K. EprS, an autotransporter protein of Pseudomonas aeruginosa, possessing serine protease activity induces inflammatory responses through protease-activated receptors. Cell Microbiol. 2013;15:1168-1181. [PubMed] [DOI] |
| 25. | Mukhopadhyay R, Jia J, Arif A, Ray PS, Fox PL. The GAIT system: a gatekeeper of inflammatory gene expression. Trends Biochem Sci. 2009;34:324-331. [PubMed] [DOI] |
| 26. | Shin C, Hwang GS, Ahn HC, Kim S, Kim KS. (1)H, (13)C and (15)N resonance assignment of WHEP domains of human glutamyl-prolyl tRNA synthetase. Biomol NMR Assign. 2015;9:25-30. [PubMed] [DOI] |
| 27. | Liu F, Pawliwec A, Feng Z, Yasruel Z, Lebrun JJ, Ali S. Prolactin/Jak2 directs apical/basal polarization and luminal linage maturation of mammary epithelial cells through regulation of the Erk1/2 pathway. Stem Cell Res. 2015;15:376-383. [PubMed] [DOI] |
| 28. | Thomas S, Fisher KH, Snowden JA, Danson SJ, Brown S, Zeidler MP. Methotrexate is a JAK/STAT pathway inhibitor. PLoS One. 2015;10:e0130078. [PubMed] [DOI] |
| 29. | Wu S, Xue J, Yang Y, Zhu H, Chen F, Wang J, Lou G, Liu Y, Shi Y, Yu Y. Isoliquiritigenin inhibits interferon-x03B3; -inducible genes expression in hepatocytes through down-regulating activation of JAK1/STAT1, IRF3/MyD88, ERK/MAPK, JNK/MAPK and PI3K/Akt signaling pathways. Cell Physiol Biochem. 2015;37:501-514. [PubMed] [DOI] |
| 30. | Liu M, Kay JC, Shen S, Qiao LY. Endogenous BDNF augments NMDA receptor phosphorylation in the spinal cord via PLCγ, PKC, and PI3K/Akt pathways during colitis. J Neuroinflammation. 2015;12:151. [PubMed] [DOI] |