修回日期: 2015-09-17
接受日期: 2015-10-13
在线出版日期: 2015-11-08
目的: 探究桦褐孔菌多糖对利福平和异烟肼导致的肝损伤的保护机制.
方法: 将100只小鼠随机分为对照组; 研究组, 研究组分为高剂量组, 中剂量组和低剂量组; 空白组, 每组小鼠20只. 除空白组小鼠外, 每组小鼠每天灌服异烟肼及利福平, 灌服2 h后, 研究组小鼠分别被灌服不同剂量的桦褐孔菌多糖, 对照组小鼠灌服生理盐水, 持续4 wk. 4 wk后处死各组小鼠, 分别测量各组小鼠血清转氨酶、胆红素、肝组织丙二醛(malondialdehyde, MDA)、超氧化物歧化酶(superoxide dismutase, SOD)含量, 谷胱甘肽过氧化物酶活性(glutathione peroxidase, GPx)、肝细胞膜转运体多药耐药相关蛋白2(multidrug resistance associated protein 2, MRP2)、胆盐输出泵(bile salt export pump, BSEP)、P-糖蛋白(P-glycoprotein, P-GP)、Na+-牛磺酸钠共转运体(sodium taurocholate cotransporting polypeptide, NTCP)、核因子相关因子2(nuclear factor related factor 2, NRF-2)、谷胱甘肽-S-转移酶A1(glutathione-S-transfer enzyme A1, GSTA1)mRNA含量, 肝细胞线粒体8-羟基脱氧鸟苷(8-hydroxy-2 deoxyguanosine, 8-OHDG)含量和细胞内活性氧(reactive oxygen species, ROS). 对小鼠肝脏进行HE染色后, 观察肝脏病理变化.
结果: 对照组小鼠血清转氨酶、胆红素、肝组织MDA、MRP2、BSEP、P-GP、NRF-2、GSTA1 mRNA、ROS、8-OHDG显著高于空白组小鼠(P<0.05), NTCP、SOD、GPx显著低于空白组小鼠(P<0.05). 研究组小鼠血清转氨酶、胆红素, 肝组织MDA、MRP2、BSEP、P-GP、NRF-2、GSTA1 mRNA、ROS、8-OHDG显著低于对照组小鼠(P<0.05), NTCP、SOD、GPx显著高于对照组小鼠(P<0.05), 且各剂量组间存在显著差异(P<0.05). 病理切片提示对照组小鼠肝脏病理改变情况明显严重于空白组和各实验组小鼠.
结论: 桦褐孔菌多糖可以通过降低MRP2、BSEP、P-GP、肿瘤坏死因子-α(tumor necrosis factor alpha)、NRF-2、GSTA1 mRNA、ROS、8-OHDG, 升高NTCP、SOD、GPx活性来保护由于抗结核化疗导致的肝损伤.
核心提示: 桦褐孔菌多糖通过提高肝细胞内核因子相关因子2(nuclear factor related factor 2)和谷胱甘肽-S-转移酶A1(glutathione-S-transfer enzyme A1)转录活性, 保护线粒体DNA, 降低肝细胞膜上转运蛋白含量, 从而起到了保护肝细胞内抗氧化系统活性, 保护肝细胞, 减少抗结核药物对肝细胞损伤.
引文著录: 尹琬凌, 韩造木, 徐丹. 桦褐孔菌多糖对抗结核化疗所致肝脏损伤的保护机制. 世界华人消化杂志 2015; 23(31): 4961-4967
Revised: September 17, 2015
Accepted: October 13, 2015
Published online: November 8, 2015
AIM: To explore the mechanism underlying the protective effect of Inonotus obliquus polysaccharide (IOP) on liver injury induced by isoniazid and rifampicin.
METHODS: One hundred mice were randomly divided into a normal control group, a model group, and high-, medium- and low-dose IOP groups, with 20 mice in each group. Except the control group, the other groups were intragastrically administered with isoniazid and rifampicin. Two hours later, the mice of the IOP groups were given different doses of IOP, and the mice in the control group were given normal saline. The intervention lasted 4 wk. After that, the mice were killed. Serum levels of transaminase and bilirubin, hepatic contents of malondialdehyde (MDA), superoxide dismutase (SOD), and glutathione peroxidase (GPX), expression levels of multidrug resistance associated protein 2 (MRP2), bile salt export pump (BSEP), P-glycoprotein (P-GP), sodium taurocholate cotransporting polypeptide (NTCP), nuclear factor related factor 2 (NRF-2), glutathione-s-transferase A1 (GSTA1), as well as reactive oxygen species (ROS) and 8-hydroxy-2deoxyguanosine (8-OHDG) levels were detected. Hepatic pathological changes were evaluated by HE staining.
RESULTS: Serum levels of transaminase and bilirubin as well as hepatic levels of MDA, MRP2, BSEP, P-GP, NRF-2 and GSTA1were significantly higher, and the levels of NTCP, SOD, and GPX were significantly lower in the normal control group than in the model group (P < 0.05). Serum levels of transaminase and bilirubin, hepatic levels of MDA, MRP2, BSEP, P-GP, NRF-2 and GSTA1, as well as ROS and 8-OHDG were significantly lower, and the levels of NTCP, SOD, and GPX were significantly higher in mice treated with IOP than in model mice (P < 0.05). The above parameters were significantly different among mice treated with different doses of IOP (P < 0.05). Hepatic pathological changes were obviously more serious in the model group than in the normal control group and IOP treated groups.
CONCLUSION: IOP can reduce the levels of MRP2, BSEP, P-GP, NRF-2, GSTA1, ROS, and 8-OHDG, and increase NTCP, SOD and GPX to protect against liver injury caused by antituberculosis drugs.
- Citation: Yin WL, Han ZM, Xu D. Mechanism underlying protective effect of Inonotus obliquus polysaccharide on anti-tuberculosis drug induced liver injury. Shijie Huaren Xiaohua Zazhi 2015; 23(31): 4961-4967
- URL: https://www.wjgnet.com/1009-3079/full/v23/i31/4961.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i31.4961
由于结核杆菌耐药情况的加重以及糖尿病、艾滋病等疾病的患者增多, 越来越多的结核患者出现在我们的社会中. 同时, 由于结核患者数量的增多, 使用抗结核药物而导致肝损伤的患者也越来越多[1,2]. 所以找到一种有效的缓解抗结核化疗导致的肝脏损伤的药物显得意义重大. 桦褐孔菌多糖是源自于桦褐孔菌的一种多糖类物质. 桦褐孔菌属于真菌, 是一种具有药用价值的真菌. 桦褐孔菌多糖具有抗脂质过氧化作用, 已经被证实具有对于药物性肝损伤具有一定的保护作用[3], 因此我们做了该研究希望证实其对于由于抗结核化疗导致的肝损伤具有保护作用. 桦褐孔菌所含化学成分主要有木质素, 黑色素, 三萜类化合物和鞘氨磷脂等. 而桦褐孔菌多糖含有多种生物活性. 主要包括抗肿瘤、抗感染、抗炎以及治疗糖尿病等作用[4,5]. 进来还有研究[6]证明桦褐孔菌多糖还具有抑制艾滋病病毒活性、抗有丝分裂[7]、抑制蛋白生物合成[8]的作用, 并且还具有清除自由基的独特功效[9].
实验小鼠为100只♀清洁级昆明小鼠, 体质量20-22 g, 实验动物合格证号码为SCXK(鄂)2013-2015, No.00000465, 饲养于武汉市中心医院动物实验中心. 异烟肼购自山西太原药业有限公司; 利福平购自沈阳红旗制药有限公司; 桦褐孔菌多糖由河南大学药学院提供. 全自动生化分析仪购自OLYMPUS光学株式会社; 丙二醛(malondialdehyde, MDA)、超氧化物歧化酶(superoxide dismutase, SOD)、谷胱甘肽过氧化物酶活性(glutathione peroxidase, GPx)试剂盒购自南京建成生物工程研究所. 肝细胞膜转运体多药耐药相关蛋白2(multidrug resistance associated protein 2, MRP2)、胆盐输出泵(bile salt export pump, BSEP)、P-糖蛋白(P-glycoprotein, P-GP)、Na+-牛磺酸钠共转运体(sodium taurocholate cotransporting polypeptide, NTCP)抗体购自Abcam公司.
1.2.1 动物处理及分组: 将100只♀清洁级昆明小鼠按照随机分组的方法分为空白组、对照组、研究组(低剂量组、中剂量组及高剂量组). 每组小鼠20只. 首先对所有小鼠进行适应性饲养, 为期1 wk. 1 wk后进行实验处理. 除空白组小鼠外, 其余小鼠每天用利福平和异烟肼灌胃, 剂量为75 mg/(kg•d), 体积为20 mL/kg[10]. 空白组小鼠使用同等体积的生理盐水灌胃. 在灌胃3 h后, 对低剂量组、中剂量组及高剂量组小鼠分别用100、200、400 mg/kg桦褐孔菌多糖灌胃, 体积为20 mL/kg, 对照组及空白组小鼠分别用同等体积生理盐水灌胃, 连续处理4 wk. 在末次处理结束后, 所有小鼠禁食水24 h, 摘除眼球, 取小鼠血液约2 mL. 脱颈处死小鼠, 取小鼠肝脏. 50%肝脏用-80 ℃冻存, 剩下肝脏用40 g/L甲醛固定[11].
1.2.2 血清检验: 将小鼠血液在3000 r/min下离心5 min, 取上层血清, 然后利用全自动生化分析仪检测血清谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate transaminase, AST)和总胆红素.
1.2.3 肝组织病理检验: 将利用甲醛固定后的肝脏组织使用石蜡包埋, 切片, 然后利用HE染色, 然后光镜下观察肝脏病例变化情况.
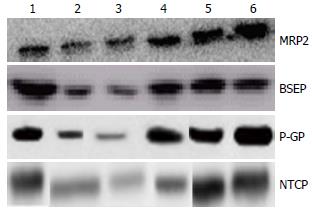
1.2.4 免疫印迹检验: 将一部分冻存的肝脏组织放入匀浆器中, 按每40 mg肝组织300 µL加入预冷裂解液及PMSF(使用前数分钟调整浓度为1 mmol/L), 然后将肝组织磨为匀浆, 12000 r/min离心10 min, 取上清. 然后于SDS-聚丙烯酰胺凝胶电泳分离蛋白, 转膜, 抗体孵育, 保管显影. 分析各蛋白条带, 使用β-actin作为内参. 检测MRP2、BSEP、P-GP、NTCP蛋白含量.
1.2.5 肝组织GSH、MDA及GPx含量检测: 我们将制得的肝组织匀浆按照GSH、MDA、GPx、ROS检测试剂盒的操作说明进行操作, 检测其含量及活性.
1.2.6 肝组织NRF-2及GSTA1 mRNA表达情况检测: 利用TRIzol抽取肝组织总RNA, 然后利用qRT-cPCR进行逆转录合成cDNA, 根据查阅基因库中NRF-2及GSTA1基因序列, 利用Primer premier5.0设计引物, 进行实时荧光定量PCR扩增, 条件为50 ℃, 5 min, 进行40循环, 95 ℃ 15 s, 60 ℃ 1 min, 再95 ℃ 15 s, 60 ℃ 1 min. 利用GAPDH作为内标物, 检测NRF-2及GSTA1含量. 各引物序列及扩增片段如表1[12].
| 名称 | 引物序列 | 扩增长度(bp) |
| NRF-2 | 正向引物5'-CACATTCCCAAACAAGATGC-3' | 374 |
| 反向引物5'-TCTTTTTCCAGCGAGGAGAT-3' | ||
| GSTA1 | 正向引物5'-GACTGCTTTCTTCAGGGTTCAAG-3' | 111 |
| 反向引物5'-TCTGTGTAATTCATGGCTGATTCC-3' | ||
| GAPDH | 正向引物5'-ACCACAGTCCATGCCATCAC-3' | 452 |
| 反向引物5'-TCCACCACCCTGTTGCTGTA-3' |
1.2.7 肝细胞线粒体DNA的6-羟基脱氧鸟苷检测: 将浓度为5×104个的肝细胞均匀接种于无菌状态的盖玻片上, 干燥后用冷丙酮固定. 取出盖玻片浸洗, DNA变性液4 ℃作用5 min, PBS浸洗, 胎牛血清室温封闭, PBS浸洗, 滴加50 µL释过的抗8-OHdG单克隆体, 置于湿盒中4 ℃过夜. 取出室温放置, PBS浸洗2次, 滴加生物素标记的第二抗体, PBS浸洗2次, 滴加标记有辣根过氧化物酶的S-P试剂. 各步骤浸洗后吸干液体. 滴加DAB显色液, 显微镜下观察, 显色后自来水冲洗, 乙醇脱水后固定载玻片上, 将盖玻细胞生长面向下. 最后显微镜下阅片, 应用Imgae-ProPlus4.5.1图像分析系统进行图像定量分析, 观察50个随机选择的细胞, 用测得的光密度表示8-OHdG阳性表达的相对强弱.
统计学处理 本研究所有研究数据均采用SPSS13.0统计学软件包进行分析. 所有数据采用mean±SD表示, 对计数资料采用t检验, P<0.05为差异存在统计学意义.
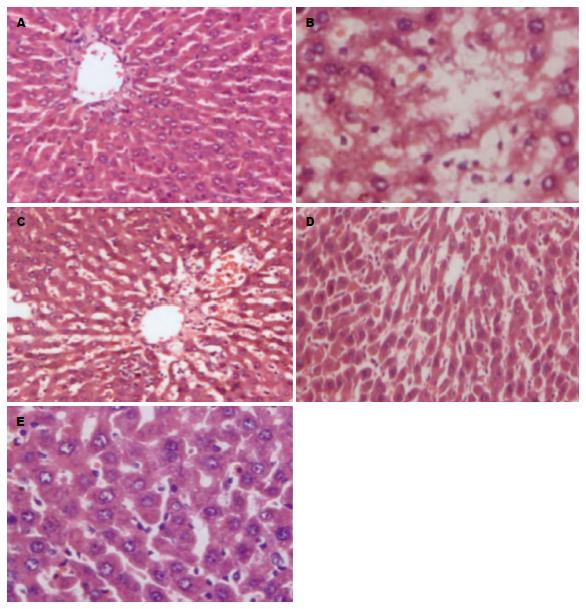
从图1中我们可以看出对照组小鼠肝细胞出现了细胞水肿及嗜酸性变和点状坏死, 而空白组小鼠肝脏细胞结构正常, 未见炎症细胞浸润, 未见肝细胞损失. 而各个实验组小鼠的肝脏细胞出现的病理损伤情况显著轻于对照组, 而剂量较低组的细胞水肿情况重于剂量较高的组.
从表2中我们可以发现, 对照组AST和ALT以及总胆红素显著高于空白组(P<0.01), 各剂量研究组上述指标低于对照组(P<0.05), 且各个剂量组小鼠血清AST和ALT以及总胆红素情况均存在显著差异(P<0.05). 并且随着剂量的增高, AST、ALT和胆红素均在降低.
从表3中我们可以看出, 对照组小鼠的肝脏MDA、ROS显著高于空白组小鼠, 而GPx和SOD含量均显著低于空白组小鼠(P<0.01). 而各剂量研究组小鼠的肝脏MDA、ROS、8-OHDG含量均低于对照组小鼠, 而GPx和SOD含量均显著高于空白组小鼠(P<0.05). 且各剂量组之间MDA、SOD、GPx、ROS含量也存在着显著差异(P<0.05). 随着剂量的增高, MDA、ROS含量降低而SOD及GPx含量则增加.
从表4中我们可以看出对照组小鼠肝脏MRP2、BSEP、P-GP显著高于空白组小鼠NTCP显著低于空白组小鼠(P<0.01). 而各剂量研究组小鼠的肝脏MRP2、BSEP、P-GP显著低于对照组小鼠, 而NTCP显著高于对照组小鼠(P<0.05). 且各剂量组之间MRP2、BSEP、P-GP和NTCP也存在着显著差异(P<0.05). 随着剂量的增高MRP2、BSEP、P-GP也随之升高, NTCP随之降低(图2).
从表5中我们可以发现对照组小鼠肝脏细胞内NRF-2和GSTA1的mRNA和8-OHDG显著高于空白组小鼠(P<0.01). 而各剂量研究组小鼠肝细胞内NRF-2和GSTA1的mRNA和8-OHDG显著低于对照组小鼠(P<0.05). 且各剂量组之间NRF-2和GSTA1的mRNA和8-OHDG含量存在着显著差异(P<0.05). 随着桦褐孔菌多糖剂量的增高NRF-2和GSTA1的mRNA和8-OHDG含量呈现下降趋势.
异烟肼和利福平是目前一线的抗结核化疗药物, 但是这两种药物都存在一个显著的不良反应, 就是对肝脏的损伤作用[13]. 这两种药物都有可能导致肝细胞出现坏死, 炎症细胞浸润, 脂肪变性, 导致肝脏功能受损. 从而使得血清的ALT、AST及胆红素升高.
我们在研究中发现抗结核化疗药物会导致小鼠血清ALT、AST和胆红素升高, 肝脏组织内MDA和ROS升高, SOD和GPx降低, 肝细胞MRP2、BSEP、P-GP升高, NTCP降低, 同时导致小鼠肝细胞内NRF-2和GSTA1 mRNA和8-OHDG升高.
我们知道ALT和AST以及血清胆红素是临床上常用的检测肝功能及肝细胞状态的检测指标, 其升高提示肝功能受到了损坏. 而MDA和ROS是提示肝细胞内氧自由基显著升高的指标, 而氧自由基会对肝细胞造成较大的损伤, 引起后续的肝功能受损, 甚至可能引起肝细胞DNA受损导致肝细胞内癌基因激活导致肝癌的发生[14]. 而SOD和GPx时清除氧自由基的重要物质, 我们发现由于使用抗结核药物, 小鼠体内的这两种物质含量显著降低, 因此我们可以认为引起肝细胞内氧自由基升高的原理主要是由于GPx和SOD含量下降引起. 为了进一步检测其是否导致肝细胞的DNA损伤, 我们检测了肝细胞线粒体内DNA受损情况, 我们通过8-OHDG检测其线粒体DNA受损情况, 我们检测后发现使用抗结核化疗后的小鼠肝细胞内8-OHDG含量显著增高. 提示其线粒体DNA受损情况显著增高. 同时我们还检测了NRF-2及GSTA1 mRNA. GSTA1是一种肝脏表达较多的一种生物酶[15-17], 可以诱导许多卤代化合物和环氧化合物结合, 并且可以生产还原性谷胱甘肽[18], 起到抗氧化应激的作用, 而NRF-2也是一种抗氧化应激的重要调节因子, 其表达升高可以有效地启动下游多种抗氧化应激的基因表达增加[19], 从而帮助机体有效地抵抗氧化应激反应.
我们的研究发现桦褐孔菌多糖通过提高小鼠肝细胞内NRF-2及GSTA1mRNA表达, 降低线粒体DNA损伤情况, 并且调节肝细胞多种转运蛋白的表达从而有效地提高肝细胞的抗氧化应激能力, 降低细胞内氧自由基数量保护肝脏功能, 从而减轻由于抗结核化疗导致的肝损伤. 不仅如此我们还发现, 桦褐孔菌多糖的这种保护作用有剂量依赖, 随着桦褐孔菌多糖剂量的升高, 其保护作用也相应地加强.
虽然我们的研究对于桦褐孔菌多糖保护由于结核化疗药物导致的肝脏损伤的机制研究较多, 但是对于其是否能够对其他原因导致的肝损伤起到保护作用未做探究, 这是我们下一步研究的方向.
目前, 随着抗结核药物的应用增多, 出现越来越多的抗结核化疗导致的肝损伤患者. 桦褐孔菌多糖是一种具有降低血糖, 调节免疫, 抗氧化和抑制肿瘤细胞生长等多种作用的物质. 桦褐孔菌多糖可以通过保护肝细胞表面转运体蛋白, 提高肝细胞抗氧化能力, 保护肝脏细胞.
李瀚旻, 教授, 主任医师, 湖北省中医院, 湖北中医药大学附属医院
桦褐孔菌多糖不仅仅可以起到保护肝脏的作用, 而且已经有研究发现他还对小鼠S180肉瘤具有强大的抑制生长作用, 可以通过影响肿瘤内一氧化氮合成酶和一氧化氮的含量发生作用.
桦褐孔菌所含化学成分主要有木质素, 黑色素, 三萜类化合物和鞘氨磷脂等. 而桦褐孔菌多糖含有多种生物活性. 具有抗肿瘤、抗感染、抗炎以及治疗糖尿病等作用. 近来还有研究证明桦褐孔菌多糖还具有抑制艾滋病病毒活性, 抗有丝分裂, 抑制蛋白生物合成的作用, 并且还具有清除自由基的独特功效.
桦褐孔菌多糖是从菌核菌丝中提取出来的一类多糖类物质. 这种物质存在多种功能, 如降低血糖, 调节免疫, 抗氧化和抑制肿瘤细胞生长等. 本文不仅研究了桦褐孔菌多糖对于血清转氨酶和胆红素的影响, 还研究了该种药物对于肝细胞细胞膜上多种转运体、核因子相关因子2和谷胱甘肽-S-转移酶A1 mRNA的影响.
桦褐孔菌多糖可以保护由于抗结核导致的肝损伤. 可以降低肝组织中血清转氨酶, 胆红素, 提高肝组织内超氧化物歧化酶、谷胱甘肽过氧化物酶活性, 降低丙二醛, 同时可以升高肝细胞摄入转运体, 降低外排转运体.
抗结核化疗导致的肝损伤: 是由于使用抗结核化疗药物例如利福平、异烟肼、乙胺丁醇等药物导致的肝损伤. 导致这种损伤的机制由于药物的种类不同而各不相同, 例如利福平主要是干扰胆红素和葡萄糖醛酸结合, 异烟肼则主要是由于诱导肝脏脂质过氧化引起自由基增多.
本研究实验结果可信, 为相关领域研究提供了较大支持.
编辑: 郭鹏 电编: 都珍珍
| 6. | 茅 益民, 陆 伦根, 蔡 雄, 巫 善明, 陈 成伟, 傅 青春, 曹 爱平, 陈 红专, 曾 民德. 异甘草酸镁治疗ALT升高的慢性肝病的多中心、随机、双盲、多剂量、阳性药物平行对照临床研究. 中华肝脏病杂志. 2009;17:847-851. |
| 11. | Ko SK, Jin M, Pyo MY. Inonotus obliquus extracts suppress antigen-specific IgE production through the modulation of Th1/Th2 cytokines in ovalbumin-sensitized mice. J Ethnopharmacol. 2011;137:1077-1082. [PubMed] |
| 12. | Giridharan VV, Thandavarayan RA, Konishi T. Amelioration of scopolamine induced cognitive dysfunction and oxidative stress by Inonotus obliquus - a medicinal mushroom. Food Funct. 2011;2:320-327. [PubMed] [DOI] |
| 14. | Tolosa L, Pinto S, Donato MT, Lahoz A, Castell JV, O'Connor JE, Gómez-Lechón MJ. Development of a multiparametric cell-based protocol to screen and classify the hepatotoxicity potential of drugs. Toxicol Sci. 2012;127:187-198. [PubMed] [DOI] |
| 15. | Hunt CM. Mitochondrial and immunoallergic injury increase risk of positive drug rechallenge after drug-induced liver injury: a systematic review. Hepatology. 2010;52:2216-2222. [PubMed] [DOI] |
| 16. | Tayal V, Kalra BS, Agarwal S, Khurana N, Gupta U. Hepatoprotective effect of tocopherol against isoniazid and rifampicin induced hepatotoxicity in albino rabbits. Indian J Exp Biol. 2007;45:1031-1036. [PubMed] |
| 17. | Srivastava RK, Sharma S, Verma S, Arora B, Lal H. Influence of diabetes on liver injury induced by antitubercular drugs and on silymarin hepatoprotection in rats. Methods Find Exp Clin Pharmacol. 2008;30:731-737. [PubMed] [DOI] |
| 18. | Zhong XH, Ren K, Lu SJ, Yang SY, Sun DZ. Progress of research on Inonotus obliquus. Chin J Integr Med. 2009;15:156-160. [PubMed] |
| 19. | Zhao FQ, Yan L, Cui XH, Lin S, Wang C, Zhang H, Kang XY, Ji BS. [Triterpenoids from Inonotus obliquus protect mice against oxidative damage induced by CCl4]. Yao Xue Xue Bao. 2012;47:680-684. [PubMed] |