修回日期: 2015-09-15
接受日期: 2015-09-18
在线出版日期: 2015-10-18
目的: 探讨动态增强计算机断层扫描(computed tomography, CT)的影像特征对肝内胆管细胞癌和低分化肝细胞癌的鉴别价值.
方法: 回顾性分析68例行动态增强CT扫描并经病理证实为肝内胆管细胞癌患者28例、低分化肝细胞癌患者40例的临床资料及影像学资料.
结果: 单因素分析显示分叶征(P = 0.010)、肝内胆管扩张(P = 0.031)、肿瘤内肝动脉(P = 0.020)、环形强化(P = 0.002)、延迟强化(P = 0.021)、迅速廓清(P<0.001)征象在肝内胆管细胞癌组和低分化肝细胞癌组较差异有统计学意义(P<0.05). Logistic回归多因素分析显示肿瘤内肝动脉征象是肝内胆管细胞癌重要的独立预测因素(P = 0.026), 13例(46.43%)病例显示此征象. 迅速廓清征象在低分化肝细胞癌的重要识别征象(P = 0.015), 25例(62.5%)病例显示此征象.
结论: 动态增强CT中瘤内动脉征象是肝内胆管细胞癌的重要识别因素, 而迅速廓清则支持低分化肝细胞癌的诊断. 准确的影像学诊断为及时制定合理的治疗方案提供客观依据.
核心提示: 瘤内动脉指包埋于肿瘤内的肝动脉及其分支, 而非新生肿瘤血管. 尽管此征象较常见, 但其在肝内胆管细胞癌(intrahepatic cholangiocarcinoma, ICC)和低分化肝细胞癌(poorly differentiated hepatocellular carcinoma, p-HCC)之间的差异性报道较少见. 通过分析动态增强计算机断层扫描(computed tomography, CT)影像特点对ICC与p-HCC进行鉴别, 得出瘤内动脉征象是增强CT中鉴别ICC和p-HCC的独立因素, 同时对比剂的迅速廓清是诊断p-HCC的重要征象.
引文著录: 杨翠翠, 杨慧, 郭沐洁, 李万湖, 吴玉芬. 增强CT瘤内动脉鉴别肝内胆管细胞癌和低分化肝细胞癌的价值. 世界华人消化杂志 2015; 23(29): 4725-4732
Revised: September 15, 2015
Accepted: September 18, 2015
Published online: October 18, 2015
AIM: To evaluate the contrast-enhanced computed tomography (CT) features in differentiating intrahepatic cholangiocarcinoma (ICC) from poorly differentiated hepatocellular carcinoma (p-HCC).
METHODS: Sixty-eight patients with pathologically confirmed ICC (n = 28) or p-HCC (n = 40) were enrolled. The clinical and imaging features were investigated retrospectively.
RESULTS: Univariate analysis showed that lobulated shape (P = 0.010), bile duct dilation (P = 0.031), intratumoral artery (P = 0.020), rim enhancement (P = 0.002), delayed enhancement (P = 0.021) and quick washout (P < 0.001) were associated with the differences between ICC and p-HCC. Multivariate logistic regression analysis revealed that intratumoral artery was a significant, independent predictive factor of ICC (P = 0.026), with 13 (46.43%) ICCs showing this feature. Quick washout significantly favored p-HCC (P = 0.015), and 25 p-HCCs (62.5%) showed this feature.
CONCLUSION: The presence of an intratumoral artery in the arterial phase on contrast-enhanced dynamic CT is an important factor for predicting ICC, while a quick washout is a predictable finding for p-HCC. Accurate imaging diagnosis between ICC and p-HCC can provide an objective basis for making reasonable, timely treatment.
- Citation: Yang CC, Yang H, Guo MJ, Li WH, Wu YF. Contrast-enhanced CT imaging in distinguishing intrahepatic cholangiocarcinoma from poorly differentiated hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2015; 23(29): 4725-4732
- URL: https://www.wjgnet.com/1009-3079/full/v23/i29/4725.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i29.4725
肝内胆管细胞癌(intrahepatic cholangiocarcinoma, ICC)起源于肝内胆管的上皮组织, 是第二常见的肝脏原发恶性肿瘤, 发病率仅次于肝细胞癌(hepatocellular carcinoma, HCC). 有报道显示, 近几年ICC和HCC发病率有上升趋势[1,2]. ICC缺乏有效的非手术治疗方法, 手术治疗预后效果较其他方法预后好, 而HCC合理的治疗包括手术、射频消融、肝动脉化疗栓塞等, 两者治疗方式的差异对影像学早期准确诊断提出了更高要求. 根据典型的影像学特征, HCC与ICC的鉴别并不困难[3-5]. 然而, 由于低分化肝细胞癌(poorly differentiated hepatocellular carcinoma, p-HCC)动脉血供降低, 可表现为乏血供表现, 在计算机断层扫描(computed tomography, CT)图像上与ICC鉴别困难[6]. 动态增强CT影像中, 肿瘤内肝动脉显影是ICC常见的征象. 然而, 借此征象对ICC和HCC进行鉴别的报道却少见. 本研究旨在通过分析CT影像特点及增强方式来鉴别ICC与p-HCC. 同时评价肿瘤内动脉是否可以作为两者鉴别的独立预测因素.
收集2013-01/2015-06行动态增强CT腹部三期扫描且经病理证实为ICC患者28例、p-HCC患者40例的临床及影像学资料. 28例肝内胆管细胞癌, 男17例, 女11例, 41-79岁, 平均年龄57.85岁, 中位年龄58岁. 40例低分化肝细胞癌, 男24例, 女16例, 37-72岁, 平均年龄57.35岁, 中位年龄57岁. 肿瘤确诊依据术后组织病理. 混合型肝癌除外.
1.2.1 扫描: 应用Philips Brilliance 128层螺旋CT扫描. 扫描参数: 管电压120 kV, 管电流250 mA, 螺距1.015 mm, 矩阵512×512, 层厚5.0 mm, 重建层厚1.5 mm. 患者在扫描时取仰卧位, 平静呼吸, 扫描范围从膈顶到肝下极层面. 获得肝脏平扫及三期增强图像, 动脉期、门脉期及延迟期分别在注入造影剂(注射速率为2.5 mL/s)后30、50、180 s进行扫描. 两名高年资影像科医师在对患者病史、肿瘤标志物及病理结果不知晓的情况下对CT图像进行分析, 意见相左时经协调一致确定.
1.2.2 临床及影像评价指标: 慢性病毒性肝炎病史、血清甲胎蛋白(α-fetoprotein, AFP)、总胆红素(total bilirubin)、癌胚抗原(carcino-embryonic antigen, CEA)、糖链抗原19-9(carbohydrate antigen 19-9, CA19-9)被评价. 以下CT征象被评价: (1)部位: 以肿瘤最大截面所在叶为准分为左叶和右叶; (2)肿瘤大小: 最大直径; (3)边缘分叶; (4)肝叶萎缩; (5)卫星灶; (6)肝包膜内陷; (7)肿瘤周围肝内胆管扩张; (8)胆系结石; (9)动脉期强化; (10)动脉期环形强化; (11)动脉期肿瘤内动脉: 肝动脉进入肿瘤内并在其内延伸; (12)廓清迅速; (13)肿瘤内门静脉; (14)肿瘤内肝静脉; (15)门静脉栓子; (16)延迟强化; (17)淋巴结大小: 最大淋巴结短径.
统计学处理 运用SPSS17.0软件对统计数据进行分析. 计量资料采用独立样本t检验或非参数Mann-Whitney检验, 计数资料采用χ2检验. 将单因素分析差异有统计学意义的变量应用Logistic回归多因素分析进行检验, 得出有显著差异的因素. 检验水准α = 0.05, 以P<0.05为差异具有统计学意义.
因腹痛、胀痛就诊者23例, 无临床症状、体检无意发现者21例, 腹部不适、厌食、乏力、体质量减轻14例, 皮肤、巩膜黄染、尿黄8例, 发热2例. ICC 28例, p-HCC 40例. 慢性病毒性肝炎、血清AFP、CA19-9在两组间比较差异有统计学意义(P<0.05), 性别、年龄、总胆红素水平、血清CEA差异无统计学意义(表1).
| 资料 | ICC(n = 28) | p-HCC(n = 40) | P值 |
| 性别(男/女) | 17/11 | 24/16 | 0.953 |
| 年龄(岁) | 57.85(41-79) | 57.35(37-72) | 0.112 |
| 慢性病毒性肝炎(%) | 8(28.57) | 27(67.50) | 0.002 |
| AFP升高[>10 ng/mL, n(%)] | 6(21.43) | 29(72.50) | <0.001 |
| 总胆红素升高[>17.1 μmol/L, n(%)] | 9(32.14) | 10(25.00) | 0.642 |
| CEA升高[>5 ng/mL, n(%)] | 16(57.14) | 27(67.50) | 0.109 |
| CA19-9升高[>37 U/mL, n(%)] | 20(71.43) | 15(37.50) | 0.018 |
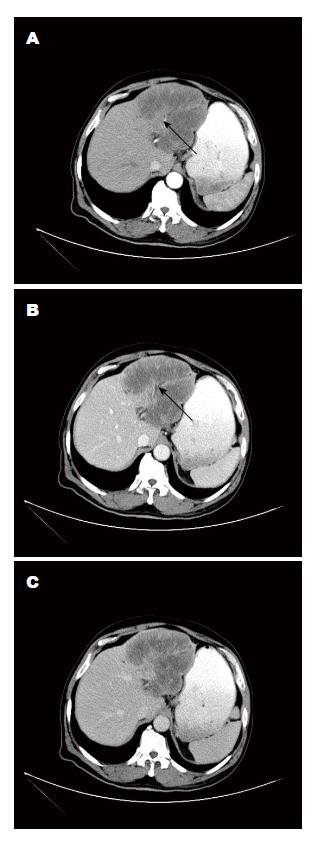
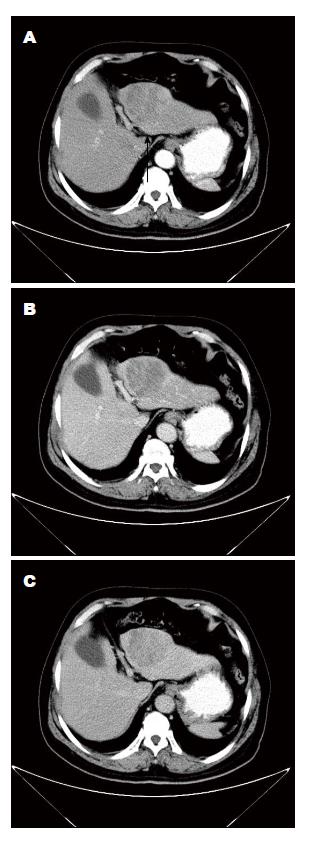
单因素分析提示分叶征、肝内胆管扩张、肿瘤内肝动脉、环形强化、延迟强化、廓清迅速在ICC和p-HCC间有显著差异. 分叶征在ICC显示较p-HCC更为常见(78.57% vs 47.57%, P = 0.01). 肝内胆管扩张在ICC的发生率较p-HCC高(71.43% vs 45.00%, P = 0.031). 瘤内动脉征象在ICC较p-HCC多见(46.43% vs 20.00%, P = 0.02), 13例ICC影像中显示此征象. 环形强化及延迟强化在ICC中较多见(分别为P = 0.021和P = 0.002). 迅速廓清在p-HCC较ICC常见(62.50% vs 10.71%, P<0.001), 25例p-HCC影像中显示此征象. 多因素分析中, 去除混杂因素, 瘤内动脉征象在ICC组与p-HCC组比较差异有统计学意义(P = 0.026, OR = 8.864), 是ICC影像学的独立预测因素. 迅速廓清征象在p-HCC组显示较ICC组常见, 差异有统计学意义(P = 0.015, OR = 0.055), 是识别p-HCC的重要征象. 而病灶位置、大小、肝叶萎缩、卫星灶、肝包膜内陷、胆系结石、肿瘤内门静脉及肝静脉及门静脉癌栓、淋巴结大小等征象在两组间比较差异均无统计学意义(P>0.05)(表2, 表3, 图1, 图2).
| 因素 | ICC(n = 28) | p-HCC(n = 40) | P值 |
| 肿瘤部位(左/右) | 17/11 | 17/23 | 0.139 |
| 肿瘤平均大小(平均, 范围, cm) | 5.77(2.4-10.7) | 5.82(2.9-13.6) | 0.321 |
| 分叶征n(%) | 22(78.57) | 19(47.57) | 0.010 |
| 肝叶萎缩n(%) | 15(53.57) | 14(35.00) | 0.128 |
| 卫星灶n(%) | 8(28.57) | 10(25.00) | 0.743 |
| 肝包膜内陷n(%) | 14(50.00) | 17(42.50) | 0.541 |
| 肝内胆管扩张n(%) | 20(71.43) | 18(45.00) | 0.031 |
| 胆管结石n(%) | 4(14.29) | 3(7.50) | 0.616 |
| 动脉期 | |||
| 有强化n(%) | 10(35.71) | 19(47.50) | 0.333 |
| 环形强化n(%) | 16(57.14) | 8(20.00) | 0.002 |
| 肿瘤内肝动脉n(%) | 13(46.43) | 8(20.00) | 0.020 |
| 迅速廓清n(%) | 3(10.71) | 25(62.50) | <0.001 |
| 肿瘤内门静脉n(%) | 3(10.71) | 2(5.00) | 0.677 |
| 肿瘤内肝静脉n(%) | 7(25.00) | 4(10.00) | 0.187 |
| 门静脉栓子n(%) | 1(3.57) | 3(7.50) | 0.878 |
| 延迟强化n(%) | 17(60.71) | 13(32.50) | 0.021 |
| 淋巴结大小(平均, 范围, cm) | 1.07(0.0-2.3) | 0.90(0.0-2.1) | 0.168 |
| 观察指标 | 回归系数 | 标准误 | Wald卡方值 | P值 | OR值 |
| 分叶征 | -0.357 | 1.046 | 0.117 | 0.733 | 0.700 |
| 肝内胆管扩张 | 1.653 | 1.034 | 2.556 | 0.110 | 5.224 |
| 肿瘤内肝动脉 | 2.182 | 0.980 | 4.962 | 0.026 | 8.864 |
| 延迟强化 | 0.522 | 1.109 | 0.222 | 0.637 | 1.686 |
| 环形强化 | 0.736 | 0.793 | 0.862 | 0.353 | 2.088 |
| 迅速廓清 | -2.899 | 1.196 | 5.872 | 0.015 | 0.055 |
ICC在CT图像上为乏血供表现, 动脉期薄环状或厚带状强化、门脉或延迟期渐进向心性强化为常见影像特点, 或伴有肝内胆管扩张、肝包膜内陷、肝叶萎缩、卫星灶及淋巴结转移等征象. 动脉期显著强化及"快进快出"的强化模式是HCC较典型的表现[3-5,7,8]. 但是HCC强化程度随其分化程度降低而降低, 分化程度越低, 强化越不明显. 故p-HCC与ICC在CT图像上的表现有类似之处, 而两者的治疗方式却差别较大. HCC的合理治疗方法包括外科治疗(肝部分切除及肝移植术)、局部治疗(射频消融、肝动脉化疗栓塞)、全身治疗(全身系统化疗、动脉内化疗)等[9,10]. ICC有效的外科治疗方式通常为手术切除加淋巴结清扫[2,11]. 因此, 在选择适当治疗方式时影像诊断显得尤为重要.
本研究中分叶征在ICC较p-HCC更常见, 与以前的研究较一致[5,12-14]. ICC生长方式多为浸润性, 边缘较模糊, 易侵犯周围小门静脉分支并沿其累及周围组织, 形成卫星灶, 继而融合成分叶状的肿块[15]. 而HCC多为膨胀性生长, 周围反应性增生形成纤维包膜, 境界较清, CT扫描多为类圆形, 少有分叶[16]. 但有报道[17]称, p-HCC分化程度低, 恶性程度高, 侵袭性随之增加, 可为膨胀与侵袭性混合生长方式, 因而CT表现可呈分叶状. 肝内胆管扩张在ICC组较p-HCC组更为常见(71.43% vs 45.00%), 差异有统计学意义. ICC肝内胆管扩张是由于肿瘤沿邻近胆管浸润生长致管壁增厚、管腔狭窄、胆管内癌栓形成, 远端胆管扩张明显. 而 p-HCC呈膨胀性生长, 扩张胆管多位于肿瘤主体周围, 管壁较光滑[18]. 病灶位置、大小、肝叶萎缩、肝包膜内陷、胆系结石、瘤内门静脉、门脉瘤栓等在ICC和p-HCC组差异无统计学意义. ICC由于其侵袭性较HCC易发生淋巴结转移. 本研究中, 淋巴结大小在ICC组和p-HCC组差异无统计学意义(P = 0.168), 与Tsunematsu等[12]研究结果一致. 赵一珺等[13]对ICC组和p-HCC组淋巴结大小及强化程度做了对比研究, 结果显示ICC组淋巴结强化程度和平均淋巴结大小明显高于或大于p-HCC组. 研究[15,19,20]认为HCC增大淋巴结多为慢性肝炎、肝硬化等基础病变所致的反应性增生, 多非肿瘤转移.
本研究中Logistic回归多因素分析显示对比剂迅速廓清在ICC和p-HCC之间差异有统计学意义, 可作为ICC和p-HCC鉴别的重要影像征象. 美国肝病研究协会(American Associationfor the Study of Liver Disease)指南表示对于肝硬化患者>1 cm的肝结节, 只有在CT和磁共振成像(magnetic resonance imaging, MRI)都表现为迅速廓清才可诊断为肝癌. 肿瘤强化方式与其组织成分关系密切[21]. ICC外围多为肿瘤细胞, 中心富含纤维组织, 对比剂在肿瘤内滞留时间延长, 动脉期显著环形强化及延迟期强化. HCC由肝动脉供血, 动脉期强化迅速且显著, 瘤体内及周围门静脉小分支将造影剂快速排出至周围肝实质, 周边肝组织迅速强化, 瘤体在门脉期或延迟期密度相对减低, 形成典型的"快进快出"强化方式. p-HCC肝动脉血供随肿瘤分化程度降低而减少, 瘤体内易形成缺血坏死灶, 动脉期轻度强化且多不均匀, 但是门脉期廓清征象仍较高、中分化 HCC更为常见[22-24].
本研究中13(46.43%)例ICC在动脉期显示肿瘤内肝动脉征象, 差异有统计学意义. 肿瘤内动脉指包埋于肿瘤内的肝动脉及分支, 而非新生肿瘤血管. 尽管此征象较常见, 但其在ICC和p-HCC之间的差异性报道较少. 本研究多因素分析中提示, 瘤内动脉征象是鉴别ICC和p-HCC的独立因素(OR = 8.864, P = 0.026). 动态增强CT中, 肿瘤内肝动脉征象在ICC较p-HCC更为多见(46.43% vs 20%). Tsunematsu等[12]认为, 动脉期瘤内肝动脉是鉴别ICC和p-HCC的可靠征象. 肿瘤内动脉表现不同与其肿瘤的生长方式密切相关. 浸润生长为ICC固有生长方式, 在肿瘤生长过程中, 周围正常肝组织逐步被包埋入瘤体. 由于动脉血管壁的弹性, 动脉仅被包埋而未受侵犯. HCC膨胀性生长推压血管于肿瘤外缘[2,16]. 赵一珺等[13]研究显示肿瘤内动脉在ICC和p-HCC间差异无统计学意义. p-HCC恶性程度高, 是膨胀性和浸润性的混合型生长方式, 也可以出现肿瘤内动脉. 周平安等[25]研究发现, 原发性肝癌供血动脉主要为肝动脉及肿瘤异生血管, 镜下可分辨的动脉绝大多数分布于肿瘤边缘处, 而肿瘤内由于动脉分支细小或肿瘤液化坏死明显, 镜下无法分辨. 提示肝癌供血动脉多被推压到肿瘤边缘, 瘤内动脉显示少见. 目前尚缺乏关于肿瘤内肝动脉征象对ICC和p-HCC鉴别的研究报道, 所以对其进行深入研究具有较大的临床价值.
本研究血清肿瘤标志物AFP、CA19-9、慢性肝炎在ICC组与p-HCC组中存在差异. p-HCC血清AFP升高的比例、慢性肝炎比例高于ICC组, 而ICC组血清CA19-9升高的比例较p-HCC组更显著, 支持以往的研究[12,26]. 而Tsunematsu等[12]研究结果显示血清中慢性病毒性肝炎表面抗体、血小板计数及AFP水平在ICC和p-HCC两组差异有统计学意义, 而血清肿瘤标志物CEA和CA199检测在两组差异无统计学意义. 肿瘤标志物及慢性肝炎可作为辅助鉴别诊断的指标, 尤其肿瘤在增强CT上表现不典型时更有鉴别价值.
本研究尚有欠缺之处: (1)只回顾性分析了行动态增强CT 扫描并行外科手术的p-HCC与ICC资料, 从而存在一定的入组偏倚; (2)只分析了p-HCC的资料, 而没有将高、中分化HCC包括在内; (3)收集的病例肿瘤体积相对较大, 分析结果没有关注小病灶.
总之, 肿瘤内肝动脉征象是增强CT中鉴别ICC和p-HCC的独立因素, 同时对比剂的迅速廓清是p-HCC的重要识别征象. 准确的鉴别诊断在及时制定出合适的治疗措施, 避免不恰当的治疗引起的创伤及并发症的发生, 提高疾病根治度及患者生存质量方面有重要价值.
肝内胆管细胞癌(intrahepatic cholangiocarcinoma, ICC)及肝细胞癌(hepatocellular carcinoma, HCC)发病率有上升趋势. 但两者治疗方式不同, 对影像学早期准确诊断提出了更高要求. 根据典型的影像学特征, HCC与ICC的鉴别并不困难. 然而, 由于低分化肝细胞癌(poorly differentiated hepatocellular carcinoma, p-HCC)可表现为乏血供表现, 在计算机断层扫描(computed tomography, CT)图像上与ICC鉴别困难. 动态增强CT影像中, 肿瘤内肝动脉显影是ICC常见的征象. 然而, 借此征象对ICC和HCC进行鉴别的报道却少见.
康春博, 副主任医师, 北京大学航天临床医院普通外科; 陈汝福, 教授, 中山大学第二附属医院肝胆胰外科
本研究通过分析CT影像特点及增强方式来鉴别ICC与p-HCC. 同时评价肿瘤内动脉是否可以作为两者鉴别的独立预测因素. 本研究只分析了p-HCC的临床及影像资料, 而没有将高、中分化HCC包括在内; 收集的病例肿瘤体积相对较大, 没有关注小病灶.
Tsunematsu等认为, 动脉期瘤内肝动脉是鉴别ICC和p-HCC的可靠征象, 而迅速廓清征象在两者鉴别中差异无统计学意义. 赵一珺等研究显示p-HCC恶性程度较高, 是膨胀性和浸润性的混合型生长方式, 所以也可以出现肿瘤内动脉征象, 此征象在ICC和p-HCC间差异无统计学意义.
本研究通过对ICC和p-HCC的临床及影像资料进行对比性分析, 得出瘤内动脉及迅速廓清征象在两者的鉴别有重要价值.
ICC和p-HCC在治疗方式及预后方面差异较大, 影像学早期准确诊断显得尤为重要. 准确的鉴别诊断在及时制定出合适的治疗措施, 避免不恰当的治疗引起的创伤及并发症的发生, 提高疾病根治度及患者生存质量方面有重要价值.
瘤内动脉: 指包埋于肿瘤内的肝动脉及其分支, 而非新生肿瘤血管, 在CT上表现为肝动脉进入肿瘤内并在其内延伸.
实用性较强, 具有较好地临床意义, 有助于指导手术方案的制定.
编辑: 郭鹏 电编:都珍珍
| 1. | Khan SA, Thomas HC, Davidson BR, Taylor-Robinson SD. Cholangiocarcinoma. Lancet. 2005;366:1303-1314. [PubMed] |
| 2. | Singh P, Patel T. Advances in the diagnosis, evaluation and management of cholangiocarcinoma. Curr Opin Gastroenterol. 2006;22:294-299. [PubMed] |
| 3. | Kim SA, Lee JM, Lee KB, Kim SH, Yoon SH, Han JK, Choi BI. Intrahepatic mass-forming cholangiocarcinomas: enhancement patterns at multiphasic CT, with special emphasis on arterial enhancement pattern--correlation with clinicopathologic findings. Radiology. 2011;260:148-157. [PubMed] |
| 4. | Loyer EM, Chin H, DuBrow RA, David CL, Eftekhari F, Charnsangavej C. Hepatocellular carcinoma and intrahepatic peripheral cholangiocarcinoma: enhancement patterns with quadruple phase helical CT--a comparative study. Radiology. 1999;212:866-875. [PubMed] |
| 5. | Valls C, Gumà A, Puig I, Sanchez A, Andía E, Serrano T, Figueras J. Intrahepatic peripheral cholangiocarcinoma: CT evaluation. Abdom Imaging. 2000;25:490-496. [PubMed] |
| 6. | Asayama Y, Yoshimitsu K, Nishihara Y, Irie H, Aishima S, Taketomi A, Honda H. Arterial blood supply of hepatocellular carcinoma and histologic grading: radiologic-pathologic correlation. AJR Am J Roentgenol. 2008;190:W28-W34. [PubMed] |
| 7. | Han JK, Choi BI, Kim AY, An SK, Lee JW, Kim TK, Kim SW. Cholangiocarcinoma: pictorial essay of CT and cholangiographic findings. Radiographics. 2002;22:173-187. [PubMed] |
| 8. | Baheti AD, Tirumani SH, Rosenthal MH, Shinagare AB, Ramaiya NH. Diagnosis and management of intrahepatic cholangiocarcinoma: a comprehensive update for the radiologist. Clin Radiol. 2014;69:e463-e470. [PubMed] [DOI] |
| 9. | Bruix J, Sherman M, Llovet JM, Beaugrand M, Lencioni R, Burroughs AK, Christensen E, Pagliaro L, Colombo M, Rodés J. Clinical management of hepatocellular carcinoma. Conclusions of the Barcelona-2000 EASL conference. European Association for the Study of the Liver. J Hepatol. 2001;35:421-430. [PubMed] |
| 10. | Hertl M, Cosimi AB. Liver transplantation for malignancy. Oncologist. 2005;10:269-281. [PubMed] |
| 11. | Jarnagin WR, Shoup M. Surgical management of cholangiocarcinoma. Semin Liver Dis. 2004;24:189-199. [PubMed] |
| 12. | Tsunematsu S, Chuma M, Kamiyama T, Miyamoto N, Yabusaki S, Hatanaka K, Mitsuhashi T, Kamachi H, Yokoo H, Kakisaka T. Intratumoral artery on contrast-enhanced computed tomography imaging: differentiating intrahepatic cholangiocarcinoma from poorly differentiated hepatocellular carcinoma. Abdom Imaging. 2015;40:1492-1499. [PubMed] [DOI] |
| 13. | 赵 一珺, 郑 丽荣, 杨 帆, 张 蔚, 陈 卫霞. 肿块型肝内胆管细胞癌与低分化肝细胞癌的CT影像学特征分析. 中国普外基础与临床杂志. 2015;22:628-632. |
| 14. | Kim KJ, Hong SW, Lee YS, Kim BW, Lee SC, Chang HS, Park CS. Tumor margin histology predicts tumor aggressiveness in papillary thyroid carcinoma: a study of 514 consecutive patients. J Korean Med Sci. 2011;26:346-351. [PubMed] [DOI] |
| 15. | Ko YL, Sun CS, Chung KM, Lin YM, Feng IC, Sheu MJ, Koay LB, Lin CY, Ho CH, Kuo HT. Manifestations of perihepatic lymph nodes in acute flare of chronic hepatitis B: association with HBeAg status and with HBeAg seroconversion. PLoS One. 2015;10:e0117590. [PubMed] [DOI] |
| 16. | Kozaka K, Sasaki M, Fujii T, Harada K, Zen Y, Sato Y, Sawada S, Minato H, Matsui O, Nakanuma Y. A subgroup of intrahepatic cholangiocarcinoma with an infiltrating replacement growth pattern and a resemblance to reactive proliferating bile ductules: 'bile ductular carcinoma'. Histopathology. 2007;51:390-400. [PubMed] [DOI] |
| 17. | Chong YS, Kim YK, Lee MW, Kim SH, Lee WJ, Rhim HC, Lee SJ. Differentiating mass-forming intrahepatic cholangiocarcinoma from atypical hepatocellular carcinoma using gadoxetic acid-enhanced MRI. Clin Radiol. 2012;67:766-773. [PubMed] [DOI] |
| 18. | 阳 宁静, 宋 彬, 吴 苾, 徐 隽, 赵 黎明. 胆管细胞性肝癌与肝细胞性肝癌侵犯胆管的CT及MRI影像学特征分析. 四川大学学报: 医学版. 2009;40:525-528. |
| 19. | Sato M, Hikita H, Hagiwara S, Sato M, Soroida Y, Suzuki A, Gotoh H, Iwai T, Kojima S, Matsuura T. Potential associations between perihepatic lymph node enlargement and liver fibrosis, hepatocellular injury or hepatocarcinogenesis in chronic hepatitis B virus infection. Hepatol Res. 2015;45:397-404. [PubMed] [DOI] |
| 20. | Soresi M, Bonfissuto G, Magliarisi C, Riili A, Terranova A, Di Giovanni G, Bascone F, Carroccio A, Tripi S, Montalto G. Ultrasound detection of abdominal lymph nodes in chronic liver diseases. A retrospective analysis. Clin Radiol. 2003;58:372-377. [PubMed] |
| 21. | Ros PR, Buck JL, Goodman ZD, Ros AM, Olmsted WW. Intrahepatic cholangiocarcinoma: radiologic-pathologic correlation. Radiology. 1988;167:689-693. [PubMed] |
| 22. | Lee JH, Lee JM, Kim SJ, Baek JH, Yun SH, Kim KW, Han JK, Choi BI. Enhancement patterns of hepatocellular carcinomas on multiphasicmultidetector row CT: comparison with pathological differentiation. Br J Radiol. 2012;85:e573-e583. [PubMed] [DOI] |
| 23. | Nakachi K, Tamai H, Mori Y, Shingaki N, Moribata K, Deguchi H, Ueda K, Inoue I, Maekita T, Iguchi M. Prediction of poorly differentiated hepatocellular carcinoma using contrast computed tomography. Cancer Imaging. 2014;14:7. [PubMed] [DOI] |
| 24. | Kawamura Y, Ikeda K, Hirakawa M, Yatsuji H, Sezaki H, Hosaka T, Akuta N, Kobayashi M, Saitoh S, Suzuki F. New classification of dynamic computed tomography images predictive of malignant characteristics of hepatocellular carcinoma. Hepatol Res. 2010;40:1006-1014. [PubMed] [DOI] |
| 25. | 周 平安, 林 礼务, 薛 恩生, 何 以敉, 高 上达, 林 晓东, 林 学英. 原发性肝细胞癌超声造影峰值时间与肿瘤动脉密度相关性研究. 中国医学影像技术. 2007;23:881-883. |
| 26. | Zhou XD, Tang ZY, Fan J, Zhou J, Wu ZQ, Qin LX, Ma ZC, Sun HC, Qiu SJ, Yu Y. Intrahepatic cholangiocarcinoma: report of 272 patients compared with 5,829 patients with hepatocellular carcinoma. J Cancer Res Clin Oncol. 2009;135:1073-1080. [PubMed] [DOI] |