修回日期: 2015-09-04
接受日期: 2015-09-11
在线出版日期: 2015-10-08
目的: 建立一种敏感性高、特异性强的检测肝螺杆菌(Helicobacter hepaticus, H. hepaticus)的套式PCR方法并对其临床应用进行探讨.
方法: 本研究基于9种H. hepaticus亚种的16S rRNA基因设计筛选出1套套式引物(2条内引物、2条外引物), 优化反应条件后, 通过模拟粪便和胆汁标本、相关细菌、动物模型标本和临床标本的检测对该套式PCR方法的敏感性、特异性进行评估.
结果: 在模拟粪便和胆汁标本中, 该方法检测H. hepaticus的最低检出浓度达到102 CFU/mL. 幽门螺杆菌、胆螺杆菌、空肠弯曲菌、大肠埃希菌、粪肠球菌、铜绿假单胞菌、金黄色葡萄球菌检测结果均为阴性. 本研究建立了3例感染肝螺杆菌的SPF级Balb/c小鼠模型. 该方法在3例模型的粪便和盲肠标本及2例模型的肝脏标本中检测出H. hepaticus. 10例胆石病患者中, 该法在2例患者的胆囊胆汁、胆囊黏膜和粪便标本中检测出有H. hepaticus临床标本的检测中, PCR检测方法、医疗干预和标本的类型及处理可能都会影响检测的结果.
结论: 本研究建立的套式PCR方法, 敏感性高、特异性强, 可以用于小鼠和人的H. hepaticus感染. H. hepaticus感染可能和人胆石病有关. PCR检测方法、医疗干预和标本的类型及处理可能都会影响临床标本的检测结果.
核心提示: 本文的创新有3点: (1)建立了一条不断建立PCR新方法的途径(综合利用RDP数据库、DNAMAN8.0、Primer Primier 6.0和OLIGOU7.0软件设计引物、动物模型及临床标本检测该方法); (2)建立了一种新的检测肝螺杆菌的套式PCR方法; (3)对该法的临床应用进行了初步研究.
引文著录: 秦和平, 毕丽红, 韦碧柳, 潘信义, 叶安丽, 易平. 一种检测肝螺杆菌套式PCR方法的建立及临床应用. 世界华人消化杂志 2015; 23(28): 4507-4514
Revised: September 4, 2015
Accepted: September 11, 2015
Published online: October 8, 2015
AIM: To develop a nested-PCR assay for the detection of Helicobacter hepaticus (H. hepaticus) with a high sensitivity and specificity and to analyze its clinical application.
METHODS: The nested primers were designed based on the sequences of 16S rRNA gene of nine subtypes of H. hepaticus. After optimizing reaction condition, the sensitivity and specificity of the assay were examined using simulated feces and bile samples, related bacteria, mouse infection model and clinical inpatients samples.
RESULTS: The detection limit for H. hepaticus strain in simulated feces and bile samples was 102 CFU/mL. No specific PCR product was detected with DNA from Helicobacter pylori, Helicobacter bilis, Campylobacter jejuni, Escherichia coli, Enterococcus faecalis, Pseudomonas aeruginosa and Staphylococcus aureus. H. hepaticus was successfully detected in the liver, caecum and feces of experimentally infected mice. Moreover, H. hepaticus was successfully detected in the gallbladder bile, gallbladder mucosa and fecal samples from two of ten patients with cholelithiasis. PCR methods, medical intervention, sample type and management may all influence the detection.
CONCLUSION: Due to the high sensitivity and specificity of the PCR assay, it may be used to detect H. hepaticus infection. H. hepaticus may be associated with the pathogenesis of human cholelithiasis. PCR methods, medical intervention, sample type and management may all influence the detection of clinical samples.
- Citation: Qin HP, Bi LH, Wei BL, Pan XY, Ye AL, Yi P. Development and clinical application of a nested-PCR assay for Helicobacter hepaticus detection. Shijie Huaren Xiaohua Zazhi 2015; 23(28): 4507-4514
- URL: https://www.wjgnet.com/1009-3079/full/v23/i28/4507.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i28.4507
1994年, Fox等[1]在有慢性活动性肝炎的SCID/NCr小鼠肝组织中发现并鉴定了一种肠肝螺杆菌-肝螺杆菌(Helicobacter hepaticus, H. hepaticus). 此后, 在大鼠、豚鼠、兔及犬中也检测出了H. hepaticus[2,3]. 他的感染会因影响动物实验的结果. 1998年以后Fox等[4-8]的研究发现, H. hepaticus和人类的胆石病、慢性胆囊炎、肝病可能相关, 可能是一种重要的人兽共患病病原菌. 但是, H. hepaticus是苛养菌, 难于从人体标本分离培养. 目前, PCR检测及测序因其简便和可靠, 是公认的检测H. hepaticus的金标准[1]. 2009年, Poynter等[9]把含有H. hepaticus不同拷贝数的9份阳性标本和1份阴性标本分别送去全世界6个实验室, 结果有3个实验室检测全部为阴性, 分析原因可能和引物有关. 国内也有专家也对H. hepaticus的PCR检测方法进行了许多的研究[10,11], 但我们应用到临床标本的检测中不是很理想. 目前, 核糖体数据库RDP(http://rdp.cme.msu.edu/)提供了9种H. hepaticus亚种的16S rRNA. 本研究基于此建立一种检测H. hepaticus高敏感性和特异性的套式PCR方法, 并探讨其在临床标本检测中的应用.
H. hepaticus(ATCC51448)、幽门螺杆菌(Helicobacter pylori, H. pylori)ATCC43504、胆螺旋杆菌(Helicobacter bilis, H. bilis)ATCC43879、空肠弯曲菌(Campylobacter jejuni, C. jejuni)、大肠埃希菌(Escherichia coli, E. coli)、粪肠球菌(Enterococcus faecalis, E. faecalis)、铜绿假单胞菌(Pseudomonas aeruginosa, P. aeruginosa)、金黄色葡萄球菌(Staphylococcus aureus, S. aureus)来自南方医院消化内科.
动物试验: 我们选取3只SPF级的Balb/c小鼠经胃灌入200 μL含有H. hepaticus的磷酸盐缓冲液(phosphate buffer saline, PBS)液(107-109 CFU/只), 建立感染H. hepaticus的动物模型后处死(1-6 wk), 取其肝脏、盲肠及粪便标本[12]. 造模前, 我们提前收集Balb/c小鼠粪便标本, 用文献[4,13]中检测方法(C97-C05、C97-C98)明确没有H. hepaticus的感染. 整个过程经过了南方医科大学动物管理及使用委员会的同意.
本研究纳入10例因胆石症拟行胆囊切除术的患者, 患者近4 wk未服用以下药物: H2组胺受体阻断剂、抗生素、质子泵抑制剂、铋剂. 术前留取粪便标本, 术后取胆囊胆汁、胆囊黏膜标本, 均保存于-80 ℃冰箱内. 用于胆汁模拟标本检测的胆汁检测H. hepaticus为阴性. -80 ℃保存1位健康人粪便标本用于模拟粪便标本. 健康人指无胆石病、胆囊炎、胆囊癌、肝炎及肝癌, 检测粪便标本H. hepaticus阴性.
用DNAMAN8.0序列分析比对9种H. hepaticus亚种的16S rRNA(表1), 确定保守区和可变区. Primer Primier6.0(引物设计软件)设计引物, OLIGOU7.0分析、评估, 选取最优引物. H. hepaticus、H. bilis和C. jejuni菌株密集划线接种在空肠弯曲菌选择性琼脂培养基, 添加5%-l0%冻融脱纤维羊血, 微需氧条件下(50 mL/L O2、850 mL/L N2和100 mL/L CO2)37 ℃培养3-7 d. H. pylori菌株进行密集划线接种在布氏琼脂培养基上, 微需氧条件下(50 mL/L O2、850 mL/L N2和100 mL/L CO2)37 ℃培养3-7 d. 其余细菌在哥伦比亚培养基中37 ℃过夜培养.
| Strain | RDP No. | 16S rRNA index No. |
| Helicobacter hepaticus; ATCC51449 | S000628343 | AE017125 |
| Helicobacter hepaticus; ATCC51448 | S000390965 | AF302103 |
| Helicobacter hepaticus; FRED1 | S000435927 | L39122 |
| Helicobacter hepaticus; Hh-1 | S000334524 | U07573 |
| Helicobacter hepaticus (T); Hh-2 | S000334525 | U07574 |
| Helicobacter hepaticus; Hh-3 | S000334526 | U07575 |
| Helicobacter hepaticus; MIT 96-284 | S000573920 | AY631952 |
| Helicobacter hepaticus; MIT 96-1809 | S000573919 | AY631950 |
| Helicobacter hepaticus | S000089425 | AJ007931 |
细菌基因组DNA的提取使用Qiagen RNA/DNA Mini Kit(Qiagen Inc.), 粪便、胆汁及组织DNA的提取使用QIAamp DNA Stool Mini Kit(Qiagen Inc.). PCR扩增引物(如表2所示)由华大基因公司合成. 两轮反应的预变性条件均为94 ℃ 3 min, 终止反应条件均为72 ℃ 7 min. 第一轮反应: PCR反应体系为50 μL, 2×Premix Taq 25 μL, 上、下游引物各1 μL(0.2 mmol/L), 模板5 μL, 无菌去离子水补足至50 μL, 30个循环; 第二轮反应: PCR反应体系为50 μL, 2×Premix Taq 25 μL, 上、下游引物各1 μL(0.2 mmol/L), 第一步PCR产物稀释100倍后取1 μL作为模板, 无菌去离子水补足至50 μL, 30个循环, 最后PCR产物琼脂糖凝胶电泳. PCR产物测序由华大基因公司负责(美国ABI的3730XL测序分析仪, Bigdye V3.1 Mix kit, POP7测序胶, PCR产物原液经柱纯化后单向测序). 为避免假阳性和假阴性条带, 我们从提取DNA到PCR扩增都设置阳性对照(H. hepaticus)和阴性对照(双蒸水).
| Primer | Sequences(5'→3') | Product size(bp) | Reaction condition | ||
| Denaturation | Annealing | Extension | |||
| Outer | ATCAGCCTATGTCCTATCAG | 935 | 94.0 ℃ | 57.0 ℃ | 72.0 ℃ |
| forward | 30 s | 30 s | 5 min | ||
| Ouer reverse | CTCACCTTCCTCCTCCTT | ||||
| Inner forward | AGCGTTACTCGGAATCAC | 300 | 94.0 ℃ | 56.0 ℃ | 72.0 ℃ |
| Inner reverse | GACAAGCAAGGCAACAAC | 30 s | 30 s | 3 min | |
模拟粪便和胆汁标本的最低检出浓度检测使用比浊仪调整菌液至0.5麦氏单位, 约相当于1.5×108 CFU/mL, 用无菌PBS进行稀释, 称取健康人粪便0.2 g/管或胆汁200 mL/管, 加入0.7 mL PBS, 加入各稀释度的菌液0.1 mL混匀, 制备成一定的菌悬液模拟标本, 最终菌液浓度分别为107、106、105、104、103、102、10 CFU/mL, 上述的各稀释度与粪便或胆囊胆汁标本混匀1000 r/min离心10 min(有些胆汁标本里有泥沙样结石也需离心去除), 把上清液转入另一个离心管中, 12000 r/min离心10 min, 离心后弃上清, 用试剂盒提取DNA, 用建立好的套式PCR方法检测各稀释度的标本.
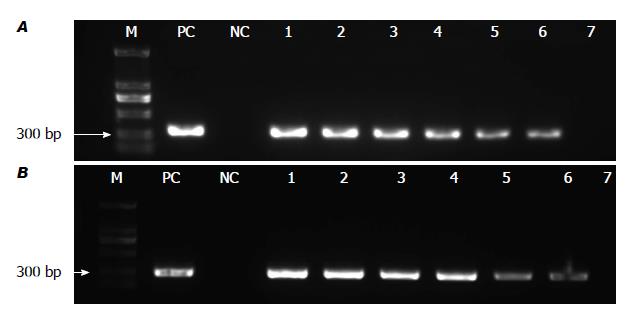
以10倍梯度稀释制备的粪便模拟标本, 提取DNA后用套式引物PCR扩增, 可以检测的最低菌液浓度为102 CFU/mL(图1A). 为了检测不同人体标本是否影响PCR扩增, 同时以10倍梯度稀释制备的胆汁模拟标本, 提取DNA后进行PCR扩增, 可以检测的最低菌液浓度也为102 CFU/mL(图1B). 特异性检测中, 含有H. hepaticus DNA的反应管可见阳性条带, 其他含有H. pylori、H. bilis、空肠弯曲菌、大肠埃希菌、粪肠球菌、铜绿假单胞菌、金黄色葡萄球菌DNA的反应管以及阴性对照管均为阴性(图2).
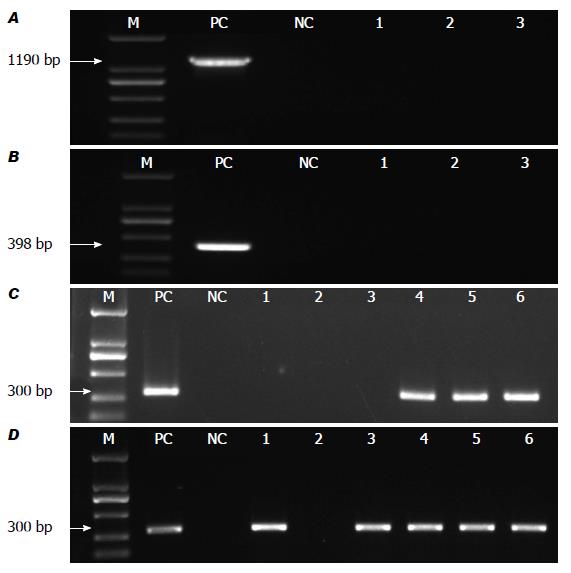
3只SPF级Balb/c小鼠造模前粪便标本用3种PCR方法(C97/C05PCR法、C97-C98PCR法和套式PCR法)均未检测到特异条带(图3A-C), 造模后3只小鼠粪便用套式引物均检测到约300 bp的特异条带, 测序后比对为H. hepaticus的16S rDNA部分片段(图3C). 3只SPF级Balb/c小鼠造模后, 2例肝脏标本和3例盲肠标本用套式引物检测到约300 bp的特异条带, PCR产物测序后比对为H. hepaticus的16S rDNA部分片段(图3D).
早在1992年, Ward等[14]就在美国国立癌症研究中心实验室的小鼠肝脏内发现了H. hepaticus. 1994年, FOX等[1]发表文章正式确认这是一种新的螺杆菌. 经过20年的研究, 目前发现H. hepaticus有9个亚种. 他们可引起免疫功能健全的多种品系的小鼠发生胆石病、慢性活动性肝炎、原发性肝癌[15-18], 也可以诱导免疫功能缺陷品系小鼠的发生炎症性肠病[19-23]. 因此, H. hepaticus的感染对于动物实验的质量控制和一些动物实验模型的建立具有重要意义. 而且, 多项研究[5,24-26]发现在人体的胆汁、肝脏和肠道内也存在H. hepaticus. 基于原代肝癌细胞系的研究[8]也提示他能引起细胞系的炎症反应. 因此, H. hepaticus和人胆囊炎、肝癌、肠炎的发生可能相关, 可能让我们对这些疾病的发生有新的认识.
H. hepaticus是苛养菌, 培养条件和设备要求高, 培养法敏感性差. 血清学检查要在培养法基础上取得抗原, 而且多是基于多克隆抗体, 假阳性率高. PCR扩增及测序是目前检测H. hepaticus的金标准. 16S rDNA因其序列高度保守, 长度适宜, 被大多数研究人员作为首选靶序列[27]. 23S rDNA也是重要的靶序列. 此外, H. hepaticus的一些毒力基因, 如cdtB也是常见的靶序列, 可用于致病性研究和辅助的鉴定检测[28]. 组织或体液标本提取的模板混有其他细菌和人类DNA, PCR检测的特异性和敏感性受到影响. 我们也曾经使用高正琴等设计的引物来检测H. hepaticus. 小鼠、大鼠各种标本的检测结果和文献中[10,11]一致, 但在应用于人临床标本中的H. hepaticus检测时, 结果不是很理想. 国内黄燕等[29,30]用PCR方法检测肝癌或其他肝肿瘤切片或新鲜标本中是否有H. hepaticus, 结果都为阴性. 我们也曾经收集过10余例肝癌手术切除的肝脏标本进行PCR检测和螺杆菌的培养, 不管是肿瘤组织, 还是癌旁组织, 都未检测出H. hepaticus, 和国内专家的研究结果一致. 我们在人体中检测到的第一例H. hepaticus是在胆石病患者的胆囊胆汁中, 随后在胆石病患者的胆囊黏膜中也检测出了H. hepaticus, 但在胆石中未检测出H. hepaticus. 高正琴等[11]也曾在一例肝硬化患者的腹水中检测到H. hepaticus和胆汁都是体液标本, 这提示我们体液标本更容易检测到H. hepaticus. 但粪便标本的检测始终是阴性的, 直到我们应用套式PCR法.
套式PCR由于进行两重特异性的PCR扩增, 特异性更强, 敏感性更高, 受到越来越多研究者的重视. 本文根据最新的数据库, 设计了一套新的套式PCR引物. 该引物不仅与同属同科的幽门螺旋杆菌、胆螺旋杆菌、空肠弯曲菌, 而且与常见的肠道定植菌大肠埃希菌、粪肠球菌和肠道致病菌铜绿假单胞菌、金黄色葡萄球菌均无交叉反应, 特异性强. 模拟粪便标本的检测是在富含肠道细菌和少量人体DNA的复杂环境下, 最低检测浓度可达到102 CFU/mL. 另外, 在感染H. hepaticus的3例SPF级的Balb/c小鼠模型中, 我们用套式PCR法在小鼠肝脏标本、盲肠及粪便标本中也能检测出H. hepaticus. Balb/c小鼠是H. hepaticus的自然宿主, 因此, 建立H. hepaticus模型的关键就是明确建模前小鼠未被感染H. hepaticus. 我们用了3种不同的PCR方法来检测备选小鼠的粪便标本, 以确定小鼠建模前未感染H. hepaticus. 图1结果提示对于套式PCR法来说, 不论粪便模拟标本, 还是胆汁模拟标本, 最低检测浓度都是102 CFU/mL. 也就是说, 两种标本的复杂成分并没有影响该方法检测H. hepaticus的敏感性. 前期的实验中, 我们曾用普通PCR法检测过约30例胆石病患者的粪便标本, 没有检测到一例H. hepaticus感染. 因此, 我们推测PCR检测方法对不同标本的敏感性不一样.
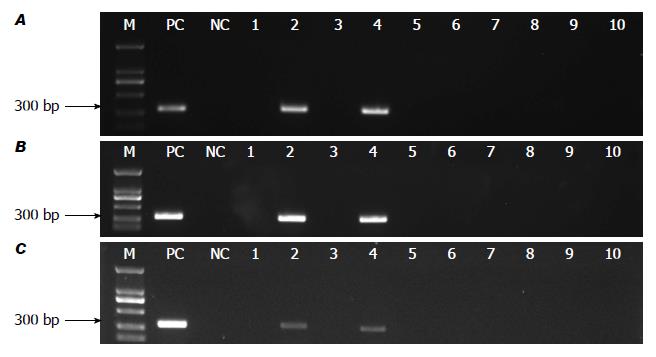
我们用这种方法检测了10例胆石病患者的手术标本. 2例患者的胆囊胆汁、胆囊黏膜及粪便中检测出了H. hepaticus的存在, 提示H. hepaticus感染可能和胆石病有关. 另外, 结合一些前期的预实验, 我们还发现, 胆汁、胆囊黏膜及粪便中检测H. hepaticus的难度不同: 胆汁标本最容易检出H. hepaticus; 粪便标本的检测更容易受到医疗干预因素和PCR方法的影响; 胆囊黏膜标本的检测难度居中. 胆汁中容易检测到H. hepaticus可能是因为胆汁的环境可能更利于H. hepaticus生长, 即使使用抗生素或其他药物, H. hepaticus仍能继续生存. 肠道有微生态系统, 不适于H. hepaticus生长, 一旦使用抗生素或其他药物, H. hepaticus可能就会被杀灭. 因此, 标本的类型会影响检测的结果. 在选择患者时, 我们设定了严格的纳入标准, 减少抗生素、质子泵抑制剂等对结果的影响. 小鼠等动物的各种标本之所以更容易检测到H. hepaticus, 和没有各种医疗因素的干预有很大关系. 关于免疫缺陷人群或长期使用免疫抑制剂的患者是否更容易感染H. hepaticus这个问题上, 我们也不能把免疫缺陷小鼠模型的结论简单推到人身上. 免疫力低下的患者不仅有利于H. hepaticus增殖, 也有利于其他细菌和微生物的增殖, 他们之间可能形成竞争, 除非在不利其他细菌而有利于H. hepaticus生长环境, 如胆汁才可能出现H. hepaticus的优势增殖. 临床标本的处理也非常重要, 胆囊黏膜标本在冻融两次以上后H. hepaticus就很难检出了, 因此我们尽量选择第一时间提取DNA模板. 通过以上研究, 我们认为, 套式PCR检测方法在人临床标本的检测中, 尤其是粪便标本的检测中可能更有优势. 另外, 医疗干预、标本的类型及处理都会影响到临床检测的结果. 我们希望通过我们的研究, 为H. hepaticus研究者提供一些有益的经验和方法. 也许, H. hepaticus和人疾病的关系比我们现在看到的更为密切.
目前, 国内关于肝螺杆菌的临床研究比较少, 原因在于缺乏有效的检测方法及临床应用的研究.
吴军, 研究员, 中国人民解放军军事医学科学院生物工程研究所
目前国内外关于肝螺杆菌的研究处于低谷期. 研究的方向大致分为两方面: (1)动物及动物模型的研究; (2)关于人类致病性的研究(主要是细胞系基础上的研究, 临床标本比较少, 多为个例)及流行病学 调查研究.
Fox是肝螺杆菌的发现和命名者, 从上世纪90年代开始20余年间陆续发表了一系列的文章, 反映了肝螺杆菌的发展历程.
国内高正琴教授关于肝螺杆菌检测方法的研究有2篇文章, 主要是基于对动物的检疫检验为目的. 本研究不同于高正琴教授研究成果的地方在于: (1)建立了一种系统设计肝螺杆菌PCR检测方法的途径; (2)临床应用的研究.
本文为H. hepaticus的临床研究提供了一个很好的平台并且总结了一些宝贵检测经验.
16S rRNA: 本文从RDP数据库中得到的序列是16S rRNA, 是含有稀有碱基的, 设计的引物中最好不要含有稀有碱基; 16S rDNA: 是16S rRNA的编码序列, 也是PCR检测的靶序列. 因为是细菌, 不含有内含子, 所以16S rRNA和16S rDNA大小是一样的.
该研究建立了一种嵌套PCR检测H. hepaticus的方法, 并对方法的特异性、灵敏度等进行了研究. 研究结果可为该菌的检测和感染研究提供方法.
编辑: 于明茜 电编:闫晋利
| 1. | Fox JG, Dewhirst FE, Tully JG, Paster BJ, Yan L, Taylor NS, Collins MJ, Gorelick PL, Ward JM. Helicobacter hepaticus sp. nov., a microaerophilic bacterium isolated from livers and intestinal mucosal scrapings from mice. J Clin Microbiol. 1994;32:1238-1245. [PubMed] |
| 2. | Ge Z, Feng Y, Woods SE, Fox JG. Spatial and temporal colonization dynamics of segmented filamentous bacteria is influenced by gender, age and experimental infection with Helicobacter hepaticus in Swiss Webster mice. Microbes Infect. 2015;17:16-22. [PubMed] [DOI] |
| 3. | Goto K, Ohashi H, Takakura A, Itoh T. Current status of Helicobacter contamination of laboratory mice, rats, gerbils, and house musk shrews in Japan. Curr Microbiol. 2000;41:161-166. [PubMed] [DOI] |
| 4. | Fox JG, Dewhirst FE, Shen Z, Feng Y, Taylor NS, Paster BJ, Ericson RL, Lau CN, Correa P, Araya JC. Hepatic Helicobacter species identified in bile and gallbladder tissue from Chileans with chronic cholecystitis. Gastroenterology. 1998;114:755-763. [PubMed] [DOI] |
| 5. | Ananieva O, Nilsson I, Vorobjova T, Uibo R, Wadström T. Immune responses to bile-tolerant helicobacter species in patients with chronic liver diseases, a randomized population group, and healthy blood donors. Clin Diagn Lab Immunol. 2002;9:1160-1164. [PubMed] [DOI] |
| 6. | Nilsson I, Kornilovs'ka I, Lindgren S, Ljungh A, Wadström T. Increased prevalence of seropositivity for non-gastric Helicobacter species in patients with autoimmune liver disease. J Med Microbiol. 2003;52:949-953. [PubMed] [DOI] |
| 7. | Yang J, Ji S, Zhang Y, Wang J. Helicobacter hepaticus infection in primary hepatocellular carcinoma tissue. Singapore Med J. 2013;54:451-457. [PubMed] [DOI] |
| 8. | Kleine M, Worbs T, Schrem H, Vondran FW, Kaltenborn A, Klempnauer J, Förster R, Josenhans C, Suerbaum S, Bektas H. Helicobacter hepaticus induces an inflammatory response in primary human hepatocytes. PLoS One. 2014;9:e99713. [PubMed] [DOI] |
| 9. | Poynter S, Phipps JD, Naranjo-Pino A, Sanchez-Morgado JM. Difficulties in the molecular diagnosis of Helicobacter rodent infections. Vet Microbiol. 2009;134:272-278. [PubMed] [DOI] |
| 11. | 高 正琴, 邢 进, 冯 育芳, 岳 秉飞, 贺 争鸣. 肝螺杆菌TaqMan MGB探针实时荧光定量PCR快速检测方法的建立及应用研究. 中华微生物学和免疫学杂志. 2011;31:833-838. |
| 12. | Jeong ES, Lee KS, Heo SH, Seo JH, Choi YK. Triplex PCR for the simultaneous detection of Pseudomonas aeruginosa, Helicobacter hepaticus, and Salmonella typhimurium. Exp Anim. 2011;60:65-70. [PubMed] [DOI] |
| 13. | Rocha M, Avenaud P, Ménard A, Le Bail B, Balabaud C, Bioulac-Sage P, de Magalhães Queiroz DM, Mégraud F. Association of Helicobacter species with hepatitis C cirrhosis with or without hepatocellular carcinoma. Gut. 2005;54:396-401. [PubMed] [DOI] |
| 14. | Ward JM, Anver MR, Haines DC, Benveniste RE. Chronic active hepatitis in mice caused by Helicobacter hepaticus. Am J Pathol. 1994;145:959-968. [PubMed] |
| 15. | Fox JG, Li X, Yan L, Cahill RJ, Hurley R, Lewis R, Murphy JC. Chronic proliferative hepatitis in A/JCr mice associated with persistent Helicobacter hepaticus infection: a model of helicobacter-induced carcinogenesis. Infect Immun. 1996;64:1548-1558. [PubMed] |
| 16. | Fox JG, Yan L, Shames B, Campbell J, Murphy JC, Li X. Persistent hepatitis and enterocolitis in germfree mice infected with Helicobacter hepaticus. Infect Immun. 1996;64:3673-3681. [PubMed] |
| 17. | Maurer KJ, Ihrig MM, Rogers AB, Ng V, Bouchard G, Leonard MR, Carey MC, Fox JG. Identification of cholelithogenic enterohepatic helicobacter species and their role in murine cholesterol gallstone formation. Gastroenterology. 2005;128:1023-1033. [PubMed] [DOI] |
| 18. | Ward JM, Fox JG, Anver MR, Haines DC, George CV, Collins MJ, Gorelick PL, Nagashima K, Gonda MA, Gilden RV. Chronic active hepatitis and associated liver tumors in mice caused by a persistent bacterial infection with a novel Helicobacter species. J Natl Cancer Inst. 1994;86:1222-1227. [PubMed] |
| 19. | Zhang L, Danon SJ, Grehan M, Chan V, Lee A, Mitchell H. Natural colonization with Helicobacter species and the development of inflammatory bowel disease in interleukin-10-deficient mice. Helicobacter. 2005;10:223-230. [PubMed] [DOI] |
| 20. | Nagalingam NA, Robinson CJ, Bergin IL, Eaton KA, Huffnagle GB, Young VB. The effects of intestinal microbial community structure on disease manifestation in IL-10-/- mice infected with Helicobacter hepaticus. Microbiome. 2013;1:15. [PubMed] [DOI] |
| 21. | Cook LC, Hillhouse AE, Myles MH, Lubahn DB, Bryda EC, Davis JW, Franklin CL. The role of estrogen signaling in a mouse model of inflammatory bowel disease: a Helicobacter hepaticus model. PLoS One. 2014;9:e94209. [PubMed] [DOI] |
| 22. | Swennes AG, Sheh A, Parry NM, Muthupalani S, Lertpiriyapong K, García A, Fox JG. Helicobacter hepaticus infection promotes hepatitis and preneoplastic foci in farnesoid X receptor (FXR) deficient mice. PLoS One. 2014;9:e106764. [PubMed] [DOI] |
| 23. | Morrison PJ, Bending D, Fouser LA, Wright JF, Stockinger B, Cooke A, Kullberg MC. Th17-cell plasticity in Helicobacter hepaticus-induced intestinal inflammation. Mucosal Immunol. 2013;6:1143-1156. [PubMed] [DOI] |
| 25. | Laharie D, Asencio C, Asselineau J, Bulois P, Bourreille A, Moreau J, Bonjean P, Lamarque D, Pariente A, Soulé JC. Association between entero-hepatic Helicobacter species and Crohn's disease: a prospective cross-sectional study. Aliment Pharmacol Ther. 2009;30:283-293. [PubMed] [DOI] |
| 26. | Hamada T, Yokota K, Ayada K, Hirai K, Kamada T, Haruma K, Chayama K, Oguma K. Detection of Helicobacter hepaticus in human bile samples of patients with biliary disease. Helicobacter. 2009;14:545-551. [PubMed] [DOI] |
| 27. | Battles JK, Williamson JC, Pike KM, Gorelick PL, Ward JM, Gonda MA. Diagnostic assay for Helicobacter hepaticus based on nucleotide sequence of its 16S rRNA gene. J Clin Microbiol. 1995;33:1344-1347. [PubMed] |
| 28. | Moyaert H, Pasmans F, Ducatelle R, Haesebrouck F, Baele M. Evaluation of 16S rRNA gene-based PCR assays for genus-level identification of Helicobacter species. J Clin Microbiol. 2008;46:1867-1869. [PubMed] [DOI] |