修回日期: 2015-08-12
接受日期: 2015-08-21
在线出版日期: 2015-09-28
目的: 探讨血清肿瘤标志物角化素蛋白片段19(Cyfra21-1)和鳞状细胞癌抗原(squamous cell carcinoma antigen, SCC)对食管鳞状细胞癌(esophageal squamous cell carcinoma, ESCC)早期诊断和临床意义的影响.
方法: 应用酶联免疫吸附法(enzyme-linked immunosorbent assay, ELISA)检测了食管鳞癌、不典型增生和健康对照血清中Cyfra21-1及SCC水平; 应用电发光免疫测定法(electrochemiluminescence immunoassay, ECLIA)和微粒酶联免疫测定法(microparticle enzyme immunoassay, MEIA)检测了50例食管鳞癌和139例健康对照血清中SCC水平.
结果: 与健康对照组相比, Cyfra21-1在食管不典型增生和食管癌患者血清中高表达(P<0.05). SCC在食管不典型增生和食管癌患者血清中表达升高, 与健康对照相比差异具有显著性(P<0.05). 伴有淋巴结转移的食管癌患者血清Cyfra21-1水平显著高于无转移组(P = 0.005). 而血清Cyfra21-1和SCC水平与患者年龄、性别、肿瘤部位、分化程度、肿瘤大小和TNM分期等特征无关. 化学发光法定量检测Cyfra21-1和SCC表达水平并计算曲线下面积(area under curve, AUC), 结果提示联合检测Cyfra21-1和SCC血清标志诊断食管癌效果(AUC = 0.777)优于单独检测Cyfra21-1(AUC = 0.757)或SCC(AUC = 0.661)的效果. 化学发光与ELISA法检测血清Cyfra21-1和SCC表达水平结果一致.
结论: 血清Cyfra21-1和SCC定量检测可用于食管鳞癌的辅助诊断, 联合检测可提高诊断的敏感性.
核心提示: 本研究探讨血清角化素蛋白片段19(Cyfra21-1)和鳞状细胞癌抗原(squamous cell carcinoma antigen, SCC)对食管鳞癌的临床诊断价值, 应用ELISA和电化学发光免疫分析检测食管鳞癌和食管不典型增生患者及健康个体血清Cyfra21-1和SCC水平, 并探讨血清Cyfra21-1和SCC水平对食管鳞癌早期诊断和临床分期的意义.
引文著录: 贾坤, 李薇, 蔡梦, 周兰萍, 刘芳, 赵晓航. Cyfra21-1和鳞状细胞癌抗原对食管鳞状细胞癌的诊断和临床意义. 世界华人消化杂志 2015; 23(27): 4342-4349
Revised: August 12, 2015
Accepted: August 21, 2015
Published online: September 28, 2015
AIM: To measure serum levels of Cyfra21-1 and squamous cell carcinoma antigen (SCC) in patients with esophageal squamous cell carcinoma (ESCC) and to analyze their significance in ESCC diagnosis and their correlations with clinicopathological parameters.
METHODS: Serum levels of Cyfra21-1 were measured by enzyme-linked immunosorbent assay (ELISA) in 48 ESCC patients, 30 atypical hyperplasia patients, and 31 healthy individuals. Serum levels of SCC were measured by ELISA in 22 ESCC patients, 30 atypical hyperplasia patients, and 31 healthy individuals. Serum levels of Cyfra21-1 and SCC were also measured by electrochemiluminescence immunoassay (ECLIA) and microparticle enzyme immunoassay (MEIA) in another 50 patients with ESCC and 139 healthy individuals.
RESULTS: Serum levels of Cyfra21-1 and SCC in ESCC and atypical hyperplasia patients were both significantly higher than those in healthy controls. Serum levels of Cyfra21-1 were higher in patients with lymph node metastasis than in those without (P = 0.005). Serum Cyfra21-1 levels had no significant correlation with other histopathological features such as age, gender, tumor location, pathological grade, tumor size and TNM stage. Serum SCC levels showed no correlation with histopathological features. According to receiver operating characteristic (ROC) curve, combined detection of Cyfra21-1 and SCC in serum was much better than detection of either of them alone. The results of ECLIA and MEIA were similar to the ELISA results.
CONCLUSION: Measurement of serum Cyfra21-1 and SCC is helpful in the diagnosis of ESCC, and joint detection of multiple tumor markers can improve the sensitivity of clinical diagnosis.
- Citation: Jia K, Li W, Cai M, Zhou LP, Liu F, Zhao XH. Clinical significance of serum Cyfra21-1 and squamous cell carcinoma antigen levels in esophageal squamous cell carcinoma. Shijie Huaren Xiaohua Zazhi 2015; 23(27): 4342-4349
- URL: https://www.wjgnet.com/1009-3079/full/v23/i27/4342.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i27.4342
食管癌是常见的恶性肿瘤之一, 其发病率居全球第8位, 死亡率居第6位[1], 其中食管鳞状细胞癌(esophageal squamous cell carcinoma, ESCC)接近90%发生在亚洲国家[2]. 近年来ESCC的年生存率仅为30%-40%, 而早期发现的ESCC生存率则高达90%[3,4]. 由于缺乏有效的早期诊断, 70%的ESCC患者发现时已为中晚期[3,5]. 临床迫切需要辅助食管癌诊断的新方法. 细胞角蛋白片段19(Cyfra21-1)是一种分子量为40 kDa的角蛋白CK19片段, 作为细胞骨架成分广泛分布于正常组织中. 当细胞发生癌变时, 激活的蛋白酶加速降解角蛋白, 产生大量细胞角蛋白片段并释放进入血液系统[6,7]. 鳞状细胞癌抗原(squamous cell carcinoma antigen, SCC)是鳞状上皮细胞膜产生的一种肿瘤相关蛋白, 参与细胞凋亡及肿瘤的浸润与转移[8,9]. 这两种蛋白均为分泌蛋白且在多种肿瘤存在表达异常. 本研究探讨血清Cyfra21-1和SCC辅助食管鳞癌诊断的价值, ELISA检测48例食管鳞癌和30例食管不典型增生患者以及31例正常人血清Cyfra21-1和SCC水平, 分析血清Cyfra21-1和SCC水平患者与临床参数的相关性. 采用全自动化学发光免疫分析定量检测50例食管癌患者和139例健康对照个体血清Cyfra21-1和SCC水平, 探讨该血清标志分子对食管鳞癌早期诊断和临床分期的意义.
实验所用血清样本取自北京协和医学院中国医学科学院肿瘤医院, 食管鳞癌患者经病理证实. 其中, 用于ELISA分析的ESCC血清样本48例(男性39例, 女性9例, 平均年龄59.6岁±1.3岁), 健康对照血清样本31例(男性21例, 女性10例, 平均年龄62.2岁±2.7岁)和食管不典型增生患者血清样本30例(男性15例, 女性15例, 平均年龄60.0岁±1.1岁). ESCC诊断按照2007年世界卫生组织(World Health Organization, WHO)分类标准分为高分化12例、中分化19例、低分化15例及信息不详2例. ESCC临床分期按照2013美国国家综合癌症网络(National Comprehensive Cancer Network, NCCN)指南分为Ⅰ期7例, Ⅱ期20例和Ⅲ期20例及信息不详1例; 不同于ELISA检测的ESCC样本50例(男性40例, 女性10例, 平均年龄61.7岁±1.3岁)和健康对照血清样本139例(男性107例, 女性32例, 平均年龄58.7岁±0.6岁), 分别进行ECLIA和MEIA检测. 所有受试者均获得知情同意. ELISA试剂盒(货号: SEB246 Hu和SEB545 Hu)购自美国Cloud-Clone公司. 化学发光试剂盒购自美国罗氏(Roche)公司, 经罗氏Cobas-601全自动化学发光免疫分析系统检测.
1.2.1 ELISA检测血清Cyfra21-1和SCC浓度: 血清取材后迅速离心, 冰上分离, 干冰上分装后转入-80 ℃冰箱保存备用. 血清样本各100 μL用于Cyfra21-1和SCC检测, 按照说明操作. 血清样品和标准品分别稀释后加至反应孔, 37 ℃孵育2 h. 去除孔板中液体, 每孔加入100 μL反应液A的工作液, 37 ℃孵育1 h后吸出液体, 清洗3次. 每孔加入100 μL反应液B, 封膜后37 ℃孵育30 min后清洗5次. 每孔加入底物溶液90 μL, 避光37 ℃孵育20 min. 每孔加入50 μL的终止液, 混合均匀, 液体由蓝变黄. 酶标仪(Bio-rad公司)上读取A450. 根据试剂盒标准品的浓度和A值绘制标准曲线. 根据样品A450值, 计算血清样品中Cyfra21-1和SCC浓度并进行统计学分析. 每个样本重复3次, 取平均值作为该样本的血清Cyfra21-1和SCC浓度.
1.2.2 化学发光法检测血清Cyfra21-1和SCC浓度: 实验步骤严格按说明书进行, 将血清加入相应的样品杯中, 设定程序后仪器自动进行定量检测. 按试剂盒提供的参考值, 确定Cyfra21-1和SCC阳性界值分别为3.3 ng/mL和1.5 ng/mL.
统计学处理 应用SPSS16.0统计软件对计量资料采用秩和检验, 计量资料选择Student's t检验、Kruskal-Wallis nonparametric检验和Mann-Whitney检验, P<0.05为差异有统计学意义.
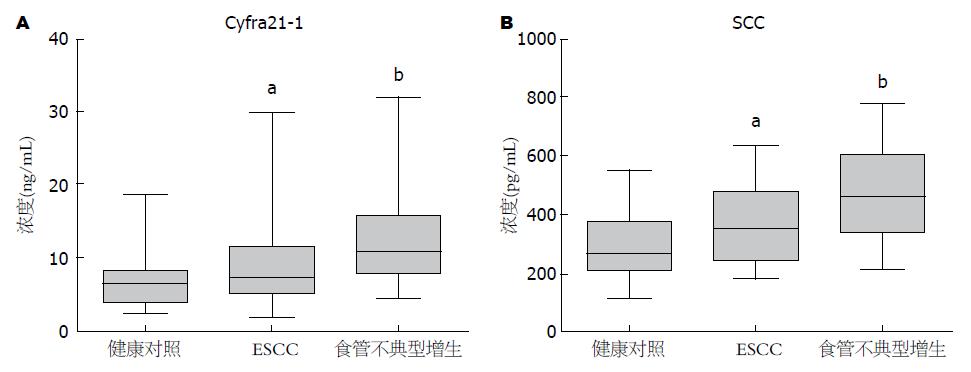
通过ELISA检测了48例ESCC和30例食管不典型增生患者及31例健康对照血清Cyfra21-1的含量, 结果显示ESCC、食管不典型增生和健康对照血清Cyfra21-1中位值分别为9.85、12.2和6.89 ng/mL, 与健康对照相比, 食管不典型增生和食管癌血清Cyfra21-1含量升高(P<0.05). 而食管不典型增生与食管癌之间血清Cyfra21-1水平无统计学差异(表1, 图1A).
| 临床病理参数 | n | Cyfra21-1血清浓度(ng/mL) | P值 | n | SCC血清浓度(pg/mL) | P值 | ||
| mean±SD | 范围 | mean±SD | 范围 | |||||
| 年龄(岁) | 0.027 | 0.743 | ||||||
| <50 | 6 | 7.34±1.12 | 2.56-10.16 | 4 | 325.2±71.57 | 191.2-520.5 | ||
| ≥50 | 42 | 10.21±1.21 | 2.06-30.18 | 18 | 371.5±31.98 | 182.9-632.7 | ||
| 性别 | 0.936 | 0.659 | ||||||
| 男 | 39 | 9.54±1.21 | 2.06-30.18 | 17 | 356.7±34.80 | 182.9-632.7 | ||
| 女 | 9 | 11.22±2.39 | 3.82-25.64 | 5 | 384.8±49.54 | 258.0-520.5 | ||
| 部位 | 0.238 | 0.641 | ||||||
| 中上段 | 29 | 10.93±1.50 | 2.06-29.92 | 16 | 393.9±33.49 | 188.1-632.7 | ||
| 下段 | 19 | 8.22±1.42 | 2.56-30.18 | 6 | 280.9±43.42 | 182.9-399.1 | ||
| 分化程度 | 0.167 | 0.580 | ||||||
| 高分化 | 12 | 11.98±2.56 | 3.42-30.18 | 4 | 273.7±47.17 | 191.2-398.0 | ||
| 中低分化 | 34 | 8.68±1.12 | 2.06-28.20 | 17 | 377.2±33.53 | 182.9-632.7 | ||
| 未知 | 2 | 17.04±8.60 | 8.43-25.64 | 1 | 480.40 | |||
| 肿瘤大小(cm) | 0.400 | 0.635 | ||||||
| <5 | 14 | 10.03±1.72 | 2.06-28.20 | 7 | 349.9±57.00 | 182.9-632.7 | ||
| ≥5 | 33 | 9.82±1.40 | 2.09-30.18 | 15 | 369.2±34.00 | 186.0-557.5 | ||
| 未手术 | 1 | 8.43 | ||||||
| 淋巴结转移 | 0.005 | 0.973 | ||||||
| 是 | 24 | 12.58±1.79 | 2.56-30.18 | 11 | 345.0±41.50 | 186.0-557.5 | ||
| 否 | 23 | 7.06±0.98 | 2.06-25.64 | 11 | 381.2±41.00 | 182.9-632.7 | ||
| 未手术 | 1 | 8.43 | ||||||
| TNM分期 | 0.121 | 0.916 | ||||||
| Ⅰ-Ⅱ | 27 | 8.20±1.20 | 2.06-30.18 | 12 | 359.6±40.59 | 186.0-557.5 | ||
| Ⅲ-Ⅳ | 20 | 12.16±1.93 | 2.56-29.92 | 10 | 367.2±42.65 | 182.9-632.7 | ||
| ESCC患者 | 48 | 9.85±1.08 | 2.06-30.18 | 22 | 363.1±28.70 | 182.9-632.7 | ||
| 不典型增生 | 30 | 12.20±1.19 | 4.55-32.18 | 30 | 477.3±29.77 | 209.7-779.9 | ||
| 健康对照 | 31 | 6.89±0.64 | 2.63-18.73 | 31 | 284.9±19.34 | 120.1-555.5 | ||
进一步对检测过Cyfra21-1含量的48例食管癌中的22例, 30例不典型增生和31例健康对照血清样本同时检测了SCC水平. 结果显示ESCC和食管不典型增生及健康对照血清样本SCC中位值分别为363.1、477.3和284.9 pg/mL, 与健康对照相比食管癌和食管不典型增生血清SCC含量升高(P<0.05)(表1, 图1B).
分析48例食管鳞癌病例, 其中24例伴有淋巴结转移, 23例无淋巴结转移, 1例未手术. 伴有淋巴结转移的食管癌血清Cyfra21-1浓度平均值为12.58 ng/mL, 而无淋巴结转移样本Cyfra21-1浓度平均值为7.06 ng/mL, 伴有淋巴结转移食管癌患者血清Cyfra21-1水平显著高于无淋巴结转移组(P = 0.005), 提示血清Cyfra21-1浓度与食管癌淋巴结转移相关.
同时比较了血清Cyfra21-1及SCC表达水平与其他临床参数的相关性, 结果提示食管鳞癌患者血清Cyfra21-1、SCC浓度与年龄、性别、肿瘤部位、分化程度、肿瘤大小及TNM分期等因素无关(表1).
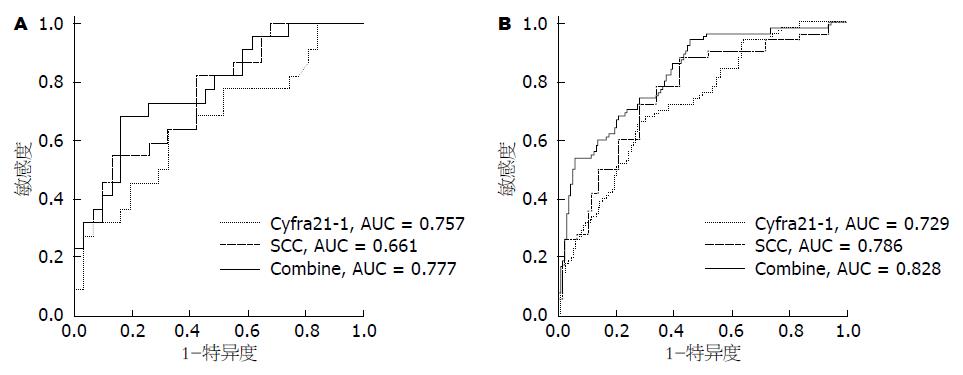
对同时检测了Cyfra21-1和SCC水平的22例食管鳞癌和31例健康对照样本进行血清Cyfra21-1和SCC含量辅助诊断食管癌效果的受试者工作特征(receiver operating characteristic, ROC)曲线分析, 结果显示Cyfra21-1和SCC的曲线下面积(area under curve, AUC)分别0.757和0.661, 而两者联用后的曲线下面积提升至0.777, 提示联合检测血清Cyfra21-1和SCC含量辅助诊断食管癌的效果优于二者单独检测(图2A).
应用罗氏Cobas-601全自动化学发光免疫分析系统, 进一步在50例食管癌患者和年龄性别匹配的139例健康对照血清样本等新病例上验证上述发现. 定量分析结果表明, 健康对照和ESCC血清Cyfra21-1浓度平均值分别为2.18 ng/mL和3.43 ng/mL, ESCC患者血清Cyfra21-1水平显著高于健康对照组(P = 0.001); 同时, 健康对照和ESCC血清SCC浓度平均值分别为0.77 ng/mL和1.54 ng/mL, 表明ESCC患者血清SCC水平也是显著高于健康对照组(P = 0.001). 血清标志含量的ROC曲线分析发现Cyfra21-1的曲线下面积为0.73(95%CI: 0.65-0.81), SCC的曲线下面积为0.78(95%CI: 0.71-0.86), 二者联合的曲线下面积提升为0.83(95%CI: 0.76-0.89)(图2B).
目前ESCC临床确诊主要依靠内窥镜和钡餐造影, 对于约95%晚期ESCC钡餐造影简单易行且相对便宜[10]. 但这两种检测手段对于小的早期ESCC并不非常适用. 内窥镜活检是筛查和确诊ESCC的金标准. 但是内窥镜活检对于患者来说较为痛苦且操作相对复杂, 难以普遍应用[10,11]. 血液中包含超过10000种不同的蛋白质和多肽片段, 是最常用的生物检测材料, 血液中的这些蛋白和多肽片段有成为肿瘤标志物的潜力[12-14].
特异性血清肿瘤标志物在肿瘤患者的诊断、疗效评价、预后判断和术后随访中具有重要作用, 但与ESCC相关的特异性肿瘤标志物还较为匮乏[15]. 肿瘤标志物对ESCC的诊断敏感性均呈低水平, 本组实验联合Cyfra21-1和SCC检测来提高检测敏感性, 联合检测结果优于二者单独检测效果. 在本次实验中我们加入了一组早期不典型增生的样本进行比较, 结果发现Cyfra21-1和SCC在不典型增生样本中均表达升高, 均高于健康对照和ESCC组. 这一结果提示Cyfra21-1和SCC具有辅助早期诊断ESCC的作用.
Cyfra21-1是角蛋白CK19的片段, 相对分子量为40 kDa, 作为细胞骨架成分广泛分布于正常组织中. 当细胞发生癌变时, 激活的蛋白酶加速降解角蛋白, 产生大量细胞角蛋白片段并释放进入血液系统. Yi等[6]在ESCC检测中发现Cyfra21-1的阳性率为35.7%(30/84). Cyfra21-1在非小细胞肺癌研究中灵敏度达到66.7%, 另有研究[7,16]报道术前Cyfra21-1低表达患者放化疗效果显著优于高水平患者组, 可能对肺癌的诊断及判断预后等方面存在一定提示作用. 在鼻咽癌的报道中Cyfra21-1阳性率为60%[17], 此外血清Cyfra21-1浓度随着肿瘤的消退明显降低, 同时血清Cyfra21-1浓度也与鼻咽癌预后及远处转移相关[18-20]. 此外血清Cyfra21-1水平在乳腺癌[21]、膀胱癌[22,23]、肝癌[24,25]等多种恶性肿瘤中都有所升高[26-29].
SCC最初是由Kato等[8]于1977年从宫颈鳞癌组织中分离得到, 也称为TA-4抗原, 由SCCAl和SCCA2抗原组成, 是鳞状上皮细胞膜产生的一种肿瘤相关蛋白, 分子量约为42-48 kDa. SCC参与细胞凋亡调控, 表达增加可使癌细胞通过抑制细胞凋亡途径对机体几种细胞自杀机制产生抗性, 另外还参与细胞外基质的降解以及肿瘤的浸润和转移[9]. Duffy[30]发现SCC在宫颈鳞癌治疗前检出率为87.7%, 且术前SCC值高的患者肿瘤复发几率增加3倍. Ohara等[31]研究发现宫颈癌肿瘤体积越大, SCC水平越高, 但是在我们的ESCC实验中未发现SCC与肿瘤大小之间的关系. SCC还存在于头颈[32]、肺[33]、食管[34,35]等多部位肿瘤中, 特别是鳞状细胞癌[36].
本研究发现, 血清Cyfra21-1和SCC在食管不典型增生和食管癌中表达升高, 而且联合检测血清Cyfra21-1和SCC诊断食管癌的效果优于二者单独检测, 提示血清Cyfra21-1和SCC含量对ESCC的诊断有一定的辅助作用. 在ELISA检测血清SCC实验中我们发现食管不典型增生样本血清SCC含量高于食管癌样本, 查阅SCC相关文献未见有关食管不典型增生患者血清SCC表达水平的报道, 推测SCC可能是ESCC早期食管不典型增生的相关标志, 可能是肿瘤早期特定酶切后的代谢产物, 但由于本次实验样本数量有限, 还需扩大样本量进一步验证. 同时我们还发现食管癌血清Cyfra21-1水平与肿瘤伴随淋巴结转移相关. 此外, 化学发光法联合检测血清Cyfra21-1和SCC表达水平判断食管癌效果也优于单一标志检测, 与ELISA法结果一致. 总之, 检测血清Cyfra21-1和SCC水平对ESCC的诊断、转移和预后均有一定的参考价值.
食管鳞癌是我国常见的消化系肿瘤, 其早期症状不明显, 大部分食管癌患者确诊时已属中晚期, 手术后5年生存率较低, 临床迫切需要用于食管癌的诊断、治疗效果评价和术后随访的生物标志物.
崔杰峰, 副研究员, 复旦大学附属中山医院肝癌研究所
细胞角蛋白片段19(Cyfra21-1)和鳞状细胞癌抗原(squamous cell carcinoma antigen, SCC)这两种蛋白均为分泌蛋白且在多种肿瘤存在表达异常, 但Cyfra21-1和SCC在食管癌患者血清水平及与临床参数的相关性研究较少, 特别是在早期不典型增生阶段尚无深入研究.
前期研究发现Cyfra21-1作为细胞骨架成分广泛分布于正常组织中. 当细胞发生癌变时, 激活的蛋白酶加速降解角蛋白, 产生大量细胞角蛋白片段并释放进入血液系统. SCC是鳞状上皮细胞膜产生的一种肿瘤相关蛋白, 参与细胞凋亡及肿瘤的浸润与转移.
本研究应用ELISA和电化学发光定量免疫分析两种检测方法发现, 与健康对照相比, 血清Cyfra21-1和SCC含量在食管不典型增生和食管癌中表达升高, 且Cyfra21-1水平与淋巴结转移相关, 提示血清Cyfra21-1和SCC定量检测可用于食管鳞癌的辅助诊断.
食管鳞癌患者和早期不典型增生患者血清Cyfra21-1和SCC均高于健康对照人群, 且Cyfra21-1在淋巴结转移组中表达高于未转移组. 因此, 通过检测血清Cyfra21-1和SCC水平, 可以有助于食管鳞癌的诊断和预后判断.
本文通过对食管鳞癌患者、不典型增生患者以及正常人血清中Cyfra21-1和SCC的水平进行检测分析, 探讨血清Cyfra21-1和SCC水平在食管鳞癌早期诊断和临床分期中的意义, 研究获得了一些有意义的结果, 对临床食管癌诊治有一定的参考指导价值.
编辑: 郭鹏 电编: 都珍珍
| 1. | Matsuda A, Katanoda K. Estimated disability-adjusted life year (DALY) in all cancers in GLOBOCAN 2008, in Asia by the country. Jpn J Clin Oncol. 2013;43:943-944. [PubMed] [DOI] |
| 2. | Chen LQ, Hu CY, Ghadirian P, Duranceau A. Early detection of esophageal squamous cell carcinoma and its effects on therapy: an overview. Dis Esophagus. 1999;12:161-167. [PubMed] |
| 3. | van Hagen P, Hulshof MC, van Lanschot JJ, Steyerberg EW, van Berge Henegouwen MI, Wijnhoven BP, Richel DJ, Nieuwenhuijzen GA, Hospers GA, Bonenkamp JJ. Preoperative chemoradiotherapy for esophageal or junctional cancer. N Engl J Med. 2012;366:2074-2084. [PubMed] [DOI] |
| 4. | Zhou ZQ, Cao WH, Xie JJ, Lin J, Shen ZY, Zhang QY, Shen JH, Xu LY, Li EM. Expression and prognostic significance of THBS1, Cyr61 and CTGF in esophageal squamous cell carcinoma. BMC Cancer. 2009;9:291. [PubMed] [DOI] |
| 5. | Lambert R, Hainaut P. The multidisciplinary management of gastrointestinal cancer. Epidemiology of oesophagogastric cancer. Best Pract Res Clin Gastroenterol. 2007;21:921-945. [PubMed] |
| 6. | Yi Y, Li B, Wang Z, Sun H, Gong H, Zhang Z. CYFRA21-1 and CEA are useful markers for predicting the sensitivity to chemoradiotherapy of esophageal squamous cell carcinoma. Biomarkers. 2009;14:480-485. [PubMed] [DOI] |
| 7. | Trapé J, Buxo J, Pérez de Olaguer J, Vidal C. Tumor markers as prognostic factors in treated non-small cell lung cancer. Anticancer Res. 2003;23:4277-4281. [PubMed] |
| 8. | Kato H, Torigoe T. Radioimmunoassay for tumor antigen of human cervical squamous cell carcinoma. Cancer. 1977;40:1621-1628. [PubMed] |
| 9. | de Bruijn HW, Duk JM, van der Zee AG, Pras E, Willemse PH, Boonstra H, Hollema H, Mourits MJ, de Vries EG, Aalders JG. The clinical value of squamous cell carcinoma antigen in cancer of the uterine cervix. Tumour Biol. 1998;19:505-516. [PubMed] |
| 10. | Omenn GS. THE HUPO Human Plasma Proteome Project. Proteomics Clin Appl. 2007;1:769-779. [PubMed] [DOI] |
| 11. | Farrah T, Deutsch EW, Omenn GS, Campbell DS, Sun Z, Bletz JA, Mallick P, Katz JE, Malmström J, Ossola R. A high-confidence human plasma proteome reference set with estimated concentrations in PeptideAtlas. Mol Cell Proteomics. 2011;10:M110.006353. [PubMed] [DOI] |
| 12. | Hortin GL. The MALDI-TOF mass spectrometric view of the plasma proteome and peptidome. Clin Chem. 2006;52:1223-1237. [PubMed] |
| 13. | Lai ZW, Petrera A, Schilling O. The emerging role of the peptidome in biomarker discovery and degradome profiling. Biol Chem. 2015;396:185-192. [PubMed] [DOI] |
| 14. | Smith CR, Batruch I, Bauça JM, Kosanam H, Ridley J, Bernardini MQ, Leung F, Diamandis EP, Kulasingam V. Deciphering the peptidome of urine from ovarian cancer patients and healthy controls. Clin Proteomics. 2014;11:23. [PubMed] [DOI] |
| 15. | Zhou G, Li H, DeCamp D, Chen S, Shu H, Gong Y, Flaig M, Gillespie JW, Hu N, Taylor PR. 2D differential in-gel electrophoresis for the identification of esophageal scans cell cancer-specific protein markers. Mol Cell Proteomics. 2002;1:117-124. [PubMed] |
| 16. | Wang J, Zhang N, Li B, Wang Z, Sun H, Yi Y, Huang W. Decline of serum CYFRA21-1 during chemoradiotherapy of NSCLC: a probable predictive factor for tumor response. Tumour Biol. 2011;32:689-695. [PubMed] [DOI] |
| 17. | Tai CJ, Liu FY, Liang JA, Yang SN, Tsai MH, Kao CH. Comparison of CYFRA 21-1 and tissue polypeptide specific antigen (TPS) for detecting nasopharyngeal carcinoma. Anticancer Res. 2002;22:3793-3796. [PubMed] |
| 18. | Jmal A, Boussen H, Abdennebi M, Gara S, Harzallah L, Gritli S, Ladgham A, Guemira F, Ghanem A. [Contribution of serum Cyfra 21-1 in nasopharyngeal carcinoma in Tunisia]. Bull Cancer. 2004;91:369-372. [PubMed] |
| 19. | Ma BB, Leungm SF, Hui EP, Mo F, Kwan WH, Zee B, Yuen J, Chan AT. Prospective validation of serum CYFRA 21-1, beta-2-microglobulin, and ferritin levels as prognostic markers in patients with nonmetastatic nasopharyngeal carcinoma undergoing radiotherapy. Cancer. 2004;101:776-781. [PubMed] |
| 20. | Ho S, Leung WT, Yuen J, Johnson PJ. Serum levels of CYFRA 21-1 in nasopharyngeal carcinoma and its possible role in monitoring of therapy. Eur J Cancer B Oral Oncol. 1996;32B:377-380. [PubMed] |
| 21. | Marrakchi R, Ouerhani S, Benammar S, Rouissi K, Bouhaha R, Bougatef K, Messai Y, Khadimallah I, Rahal K, Ben Ammar-Elgaaied A. Detection of cytokeratin 19 mRNA and CYFRA 21-1 (cytokeratin 19 fragments) in blood of Tunisian women with breast cancer. Int J Biol Markers. 2008;23:238-243. [PubMed] |
| 22. | Gkialas I, Papadopoulos G, Iordanidou L, Stathouros G, Tzavara C, Gregorakis A, Lykourinas M. Evaluation of urine tumor-associated trypsin inhibitor, CYFRA 21-1, and urinary bladder cancer antigen for detection of high-grade bladder carcinoma. Urology. 2008;72:1159-1163. [PubMed] [DOI] |
| 23. | Andreadis C, Touloupidis S, Galaktidou G, Kortsaris AH, Boutis A, Mouratidou D. Serum CYFRA 21-1 in patients with invasive bladder cancer and its relevance as a tumor marker during chemotherapy. J Urol. 2005;174:1771-1775; discussion 1775-1776. [PubMed] |
| 24. | Uenishi T, Yamazaki O, Yamamoto T, Hirohashi K, Tanaka H, Tanaka S, Hai S, Ono K, Kubo S. Clinical significance of serum cytokeratin-19 fragment (CYFRA 21-1) in hepatocellular carcinoma. J Hepatobiliary Pancreat Surg. 2006;13:239-244. [PubMed] |
| 25. | Uenishi T, Yamazaki O, Tanaka H, Takemura S, Yamamoto T, Tanaka S, Nishiguchi S, Kubo S. Serum cytokeratin 19 fragment (CYFRA21-1) as a prognostic factor in intrahepatic cholangiocarcinoma. Ann Surg Oncol. 2008;15:583-589. [PubMed] |
| 26. | Stieber P, Hasholzner U, Bodenmüller H, Nagel D, Sunder-Plassmann L, Dienemann H, Meier W, Fateh-Moghadam A. CYFRA 21-1. A new marker in lung cancer. Cancer. 1993;72:707-713. [PubMed] |
| 27. | Dohmoto K, Hojo S, Fujita J, Ueda Y, Bandoh S, Yamaji Y, Ohtsuki Y, Dobashi N, Takahara J. Mechanisms of the release of CYFRA21-1 in human lung cancer cell lines. Lung Cancer. 2000;30:55-63. [PubMed] |
| 28. | Sheard MA, Vojtesek B, Simickova M, Valik D. Release of cytokeratin-18 and -19 fragments (TPS and CYFRA 21-1) into the extracellular space during apoptosis. J Cell Biochem. 2002;85:670-677. [PubMed] |
| 29. | Edelman MJ, Hodgson L, Rosenblatt PY, Christenson RH, Vokes EE, Wang X, Kratzke R. CYFRA 21-1 as a prognostic and predictive marker in advanced non-small-cell lung cancer in a prospective trial: CALGB 150304. J Thorac Oncol. 2012;7:649-654. [PubMed] [DOI] |
| 30. | Duffy MJ. Evidence for the clinical use of tumour markers. Ann Clin Biochem. 2004;41:370-377. [PubMed] |
| 31. | Ohara K, Tanaka Y, Tsunoda H, Nishida M, Sugahara S, Itai Y. Assessment of cervical cancer radioresponse by serum squamous cell carcinoma antigen and magnetic resonance imaging. Obstet Gynecol. 2002;100:781-787. [PubMed] |
| 32. | Ayude D, Gacio G, Páez de la Cadena M, Pallas E, Martínez-Zorzano VS, de Carlos A, Rodríguez-Berrocal FJ. Combined use of established and novel tumour markers in the diagnosis of head and neck squamous cell carcinoma. Oncol Rep. 2003;10:1345-1350. [PubMed] |
| 33. | Molina R, Filella X, Augé JM, Fuentes R, Bover I, Rifa J, Moreno V, Canals E, Viñolas N, Marquez A. Tumor markers (CEA, CA 125, CYFRA 21-1, SCC and NSE) in patients with non-small cell lung cancer as an aid in histological diagnosis and prognosis. Comparison with the main clinical and pathological prognostic factors. Tumour Biol. 2003;24:209-218. [PubMed] |
| 34. | Shimada Y, Watanabe G, Kawamura J, Soma T, Okabe M, Ito T, Inoue H, Kondo M, Mori Y, Tanaka E. Clinical significance of osteopontin in esophageal squamous cell carcinoma: comparison with common tumor markers. Oncology. 2005;68:285-292. [PubMed] |
| 35. | Cao X, Zhang L, Feng GR, Yang J, Wang RY, Li J, Zheng XM, Han YJ. Preoperative Cyfra21-1 and SCC-Ag serum titers predict survival in patients with stage II esophageal squamous cell carcinoma. J Transl Med. 2012;10:197. [PubMed] [DOI] |