修回日期: 2015-08-23
接受日期: 2015-08-26
在线出版日期: 2015-09-28
目的: 探讨过表达microRNA-486-5p(miR-486-5p)对人大肠癌细胞系SW620体内生长的作用及其作用机制的研究.
方法: 构建miR-486-5p的过表达质粒, 体外脂质体法瞬时转染人大肠癌细胞SW620; 建立人大肠癌裸鼠皮下移植瘤模型, 实验组每3 d瘤周注射miR-486-5p过表达质粒, 对照组注射等量的空白载体. 每天观察肿瘤的生长情况并每3 d测量肿瘤的体积; 实时荧光定量-PCR(Real-time PCR)检测各组肿瘤组织中miR-486-5p的表达水平; 免疫组织化学技术检测移植瘤内神经纤毛蛋白-2(neuropilin-2, NRP2)及微淋巴管的的分布情况; Western blot技术检测各组移植瘤中NRP2蛋白的表达.
结果: 转染后, 实验组中miR-486-5p的相对表达量较对照组提高12.57±2.31倍, 过表达miR-486-5p后实验组裸鼠皮下移植瘤的生长速度较对照组明显减缓(P<0.05), 瘤体质量明显减轻(P<0.05). 过表达miR-486-5p可明显抑制NRP2蛋白的表达(P<0.05), 此外, miR-486-5p组微淋巴管密度降低.
结论: 过表达miR-486-5p可明显抑制大肠癌细胞的生长, 抑制微淋巴管的生成, 这可能与下调NRP2蛋白的表达有关.
核心提示: 本研究通过裸鼠皮下移植瘤模型的建立, 探讨miRNA-486-5p在大肠癌的发展及转移过程中的作用, 上调miRNA-486-5p的表达量后, Western blot及免疫组织化学均表明miR-486-5p可抑制神经纤毛蛋白-2(neuropilin-2)的表达, 同时, miR-486-5p表达上调可以抑制微淋巴管的生成从而抑制大肠癌的淋巴结转移.
引文著录: 刘成霞, 马锋振, 王健, 李锟, 李琼, 连海峰. MicroRNA-486-5p通过下调Neuropilin-2的表达抑制人大肠癌中微淋巴管的生成. 世界华人消化杂志 2015; 23(27): 4335-4341
Revised: August 23, 2015
Accepted: August 26, 2015
Published online: September 28, 2015
AIM: To investigate the effect of microRNA-486-5p (miRNA-486-5p) overexpression on tumor lymphangiogenesis in colorectal carcinoma cells and to explore the underlying mechanism.
METHODS: A eukaryotic expression vector of miRNA-486-5p was transiently transfected into human colorectal carcinoma SW620 cells to induce miRNA-486-5p overexpression. A human colorectal carcinoma model in nude mice was then established, and the miRNA-486-5p vector was directly injected into local tumor tissue. Then, tumor size was measured every three days. The expression level of miRNA-486-5p in tumor tissue was determined by real-time PCR (RT-PCR). Meanwhile, the expression level of Neuropilin-2 (NRP2) and the number of lymphatic microvessels were detected by immunohistochemistry. The expression of NRP2 was measured by Western blot.
RESULTS: The expression of miRNA-486-5p increased significantly in the miRNA-486-5 transfected SW620 cells, and the mean expression level of miRNA-486-5p increased by 12.57 times ± 2.31 times after transfection. The growth speed of tumor in the miRNA-486-5p vector injected group was significantly slower than that in the control group (P < 0.05). The mass of tumor in the miRNA-486-5p vector injected group was significantly lower than that in the control group (P < 0.05). The expression of NRP2 and the number of lymphatic microvessels in the tumor tissue were also remarkably decreased in the miRNA-486-5p vector injected group (P < 0.05).
CONCLUSION: Overexpression of miRNA-486-5p could significantly inhibit the growth and lymphangiogenesis in colorectal carcinoma cells in vivo, and this might be related to the down-regulated expression of NRP2.
- Citation: Liu CX, Ma FZ, Wang J, Li K, Li Q, Lian HF. Overexpression of miR-486-5p suppresses tumor lymphangiogenesis in colorectal carcinoma by targeting neuropilin-2. Shijie Huaren Xiaohua Zazhi 2015; 23(27): 4335-4341
- URL: https://www.wjgnet.com/1009-3079/full/v23/i27/4335.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i27.4335
大肠癌是最常见的恶性肿瘤之一, 其死亡率位于世界上肿瘤相关性死亡的前4位[1,2]. 虽然诊断和治疗技术在不断发展, 但大肠癌患者的预后仍然不容乐观. 大肠癌死亡率高的最常见的原因就是肿瘤的复发及淋巴结转移[3,4]. 临床上我们通常把是否有淋巴结转移作为评估患者预后的一个重要指标[5,6]. 但肿瘤中微淋巴生成的机制目前研究尚不明确.
MicroRNA(miR)是一组非编码的核苷酸序列[7], 他可以在转录后水平抑制其靶基因的表达[8]. 最近研究[9-11]表明, miR表达失调在肿瘤发生、发展的各个阶段发挥重要作用, 尤其是肿瘤的转移. miRNA-486-5p作为目前研究较为成熟的一个miR, 研究[12]发现, 其表达下调与肺癌的发生及淋巴结转移密切相关. 此外, Oh等[13]发现在胃癌中miR-486-5p表达明显下调. 但miRNA-486-5p在大肠癌的发生及淋巴结转移中的作用目前尚无研究. 本实验通过大肠癌裸鼠皮下移植瘤模型的建立, 进一步研究miR-486-5p在大肠癌的发展及淋巴结转移中的作用及其作用机制, 从而探索大肠癌治疗的新的靶点.
人大肠癌细胞SW620购自武汉博士德公司; ♂BALB/c裸鼠12只, 4周龄, 裸鼠体质量在14 g左右, 购自北京华阜康生物科技有限公司[许可证号: SCXK(京)2014-0004]; miR-486-5p过表达质粒由上海吉玛公司构建; PCR试剂和Premix Taq Plus购自日本TaKaRa公司; 质粒提取试剂盒购自天根生化科技有限公司; Lipofectamine™ 2000购自美国Invitrogen公司; 细胞培养基RPMI 1640、胎牛血清均购自HyClone公司; miR-486-5p引物及内参U6均购自广州锐博生物科技有限公司; 兔抗人神经纤毛蛋白-2(neuropilin-2, NRP2)多克隆抗体、兔抗鼠LYVE-1抗体均购自英国Abcam公司.
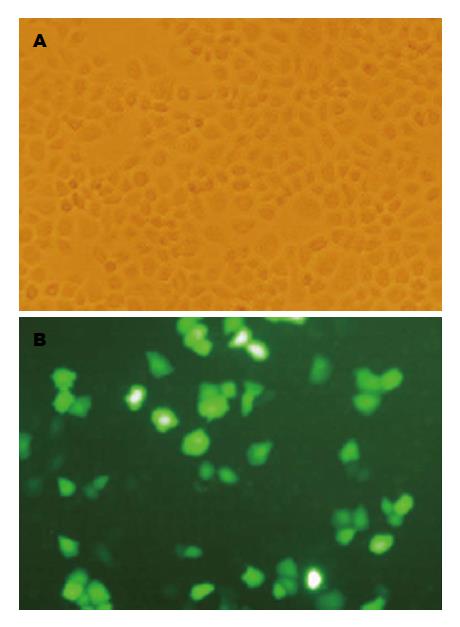
1.2.1 细胞培养和转染: 人大肠癌细胞SW620在含10%胎牛血清的RPMI 1640培养基中, 于37 ℃、50 mL/L CO2培养箱中培养, 当细胞贴壁达70%时接种到6孔板中. 细胞转染分组: 对照组转染空白载体质粒, 实验组转染miR-486-5p的过表达质粒. 转染方法按照Lipofectamine™ 2000转染试剂说明书进行. 质粒与脂质体的转染比例分别为0.5:1、1:1、1:2, 荧光显微镜下筛选转染效率最高的转染比例进行下一步实验.
1.2.2 人大肠癌裸鼠皮下移植瘤模型的建立并观察肿瘤生长情况: 将12只裸鼠在无特定病原体环境下适应性饲养1 wk, 随机分为2组, 即实验组和对照组, 每组6只. 将对数生长期的大肠癌细胞SW620细胞悬液200 μL(细胞数为1×107个)接种于裸鼠右侧腋窝中部的外侧皮下, 接种过程完全遵循无菌原则, 每天观察两组裸鼠接种点有无红肿、破溃情况并记录肿瘤长出时间. 肿瘤长出后两组分别进行如下处理: 实验组每3 d于瘤体周围注射200 μL的miR-486-5p过表达质粒与脂质体的混合物, 并测量瘤体的最长径(L)和最短径(W), 根据公式: 肿瘤体积(V, mm3) = 1/2×L×W2计算肿瘤体积. 对照组注射等量的空白载体. 实验组中脂质体与质粒的混合比例按上一步中筛选的转染效率最高的比例进行. 通过生长曲线的绘制比较裸鼠皮下移植瘤的生长速度. 3 wk后处死裸鼠, 取出皮下肿瘤组织, 一部分固定于4%多聚甲醛中用于石蜡包埋, 另一部分储存于-80 ℃冰箱中用于RNA和蛋白质的提取.
1.2.3 RT-PCR检测各组肿瘤组织中miR-486-5p的表达: 用TRIzol试剂提取各组肿瘤组织中的总RNA, 当RNA的纯度在1.8-2.0之间时可用于下一步逆转录, 使用miR-486-5p的逆转录引物进行逆转录, 使用RT-PCR方法对各样本中的miR-486-5p的表达量进行检测, miR-486-5p的表达量以U6为内参, 用2-△△Ct方法计算, 比较两组中miR-486-5p的相对表达量.
1.2.4 免疫组织化学染色和Western blot检测肿瘤组织中NRP2蛋白的表达: 将石蜡切片经二甲苯和梯度乙醇脱蜡、水化. 3%的H2O2室温孵育10 min, PBS洗5 min, 枸橼酸钠微波下修复10 min, 5%BSA封闭40 min后弃去血清, 加入1:100稀释的兔抗人NRP2抗体. 4 ℃湿盒中过夜; PBS洗3次, 加入辣根过氧化物酶(horseradish peroxidase, HRP)标记的山羊抗兔的免疫球蛋白G(immunoglobulin G)二抗, 孵育20 min, PBS洗3次, DAB显色、苏木紫复染, 中性树胶封片, 显微镜观察. NRP2蛋白阳性细胞内出现棕黄色颗粒, 计数5个高倍视野中(×200)的阳性细胞数, 计数平均阳性细胞数, 计算IHS评分. 评分标准[14]: A为阳性细胞数分级<1% = 0、1%-10% = 1、11%-50% = 2、51%-80% = 3、81%-100% = 4, B为阳性细胞显色强度分级0(阴性)、l(弱阳性)、2(阳性)、3(强阳性), IHS = A×B.
从组织中提取蛋白, 用组织裂解液裂解肿瘤组织并提取总蛋白. BCA法检测蛋白浓度并计算上样量, 8%聚丙烯凝胶电泳, PVDF膜转膜, 7%脱脂奶粉封闭2 h, 加入NRP2一抗(1:800), 4 ℃封闭过夜, 加入HRP标记的羊抗兔二抗(1:5000)室温封闭1 h, 洗膜, ECL放射自显影并计算灰度值.
1.2.5 免疫组织化学染色观察两组中微淋巴管生成情况: 免疫组织化学染色技术步骤同前. LYVE-1能够特异性的标记淋巴管内皮细胞, 使内皮细胞胞浆染色呈棕黄色, 细胞膜也可轻度着色. 先在低倍镜下全面观察整张切片, 随机选择5个区域分别在高倍视野(×200)下计数微淋巴管数, 求其平均值为微淋巴管密度(micro lymphatic vessel density, MLVD)的计数值[15].
统计学处理 实验数据以mean±SD表示. 所有实验数据均需重复3次, 通过SPSS13.0软件进行统计学分析, 组间比较采用t检验, 以P<0.05为差异具有统计学意义.
瞬时转染SW620细胞, 转染72 h后荧光显微镜下观察转染效率, 结果发现, 当质粒与脂质体比值为1:2时转染效率最高(图1).
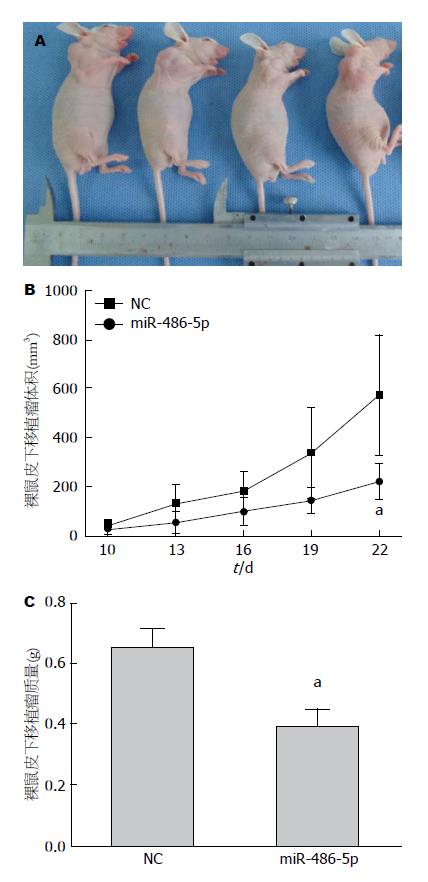
建立人大肠癌裸鼠皮下移植瘤模型, 观察过表达miR-486-5p对人大肠癌裸鼠皮下移植瘤体内生长的作用. 观察发现, 接种后10 d左右裸鼠皮下均可成瘤(图2A). 结果显示: 与空白载体对照组相比, miR-486-5p组裸鼠肿瘤生长速度缓慢(P<0.05)(图2B). 且miR-486-5p组肿瘤质量明显小于空白载体对照组(P<0.05)(图2C).
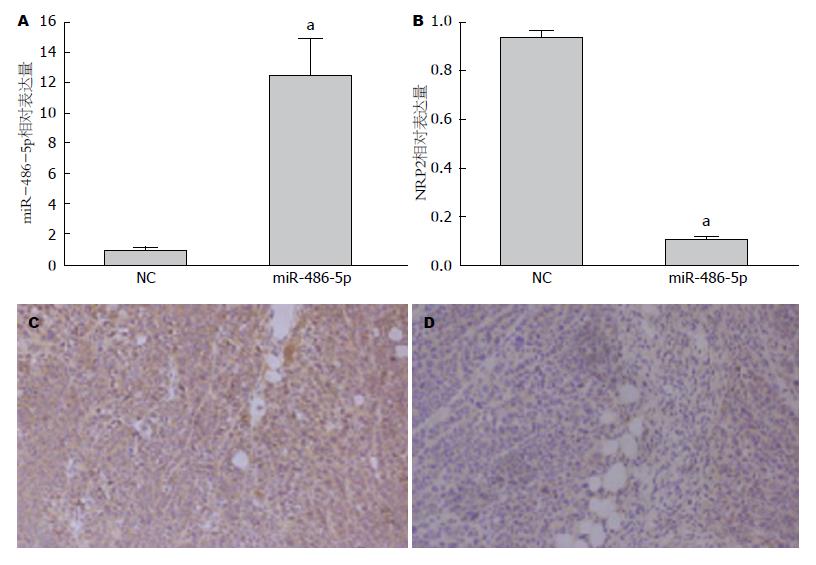
结果显示, 与空白载体对照组相比, miR-486-5p组肿瘤组织中miR-486-5p的表达水平显著增高, 约提高12.57倍±2.31倍(图3A). 该数据表明, 瘤体周围局部注射miR-486-5p过表达质粒载体可使皮下移植瘤中的miR-486-5p的表达水平显著提高. Western blot结果显示, miR-486-5p组中NRP2表达量比空白载体对照组显著减少(P<0.05)(图3B). 显微镜下观察免疫组织化学结果显示, 与空白载体对照组相比, miR-486-5p组中NRP2表达量显著减少, 差异有统计学意义(图3C, D).
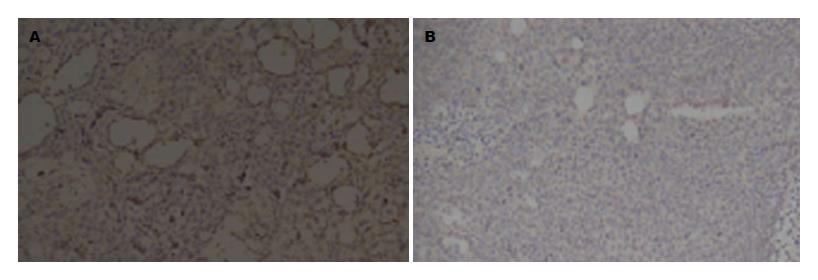
免疫组织化学结果显示, 与空白载体对照组相比, miR-486-5p组中的微淋巴管数目明显减少, 约为1.80±0.84, 而空白对照组约为7.20±0.84(P<0.05)(图4).
随着人类对分子生物学研究的不断深入, miRNA在肿瘤发生、发展中的作用逐渐被人们所发现、了解. 以miRNA作为肿瘤学标志物及治疗靶点的新思路、新方法已成为当前的研究热点. 既往研究[16]发现, miRNA-486-5p在肿瘤的发生、发展中发挥重要作用. 过表达miRNA-486-5p可以抑制肝癌细胞及胃癌细胞的增殖、迁移及侵袭能力[17,18]. 此外, Zhang等[19]发现在乳腺癌中miRNA-486-5p可以通过对PIM-1的调节从而发挥抑癌基因的作用. 此外, 亦有实验证实, miRNA-486-5p的表达量与胃癌患者的预后及临床病理类型密切相关[20]. 本课题组既往研究[21]发现, miRNA-486-5p转染人大肠癌细胞SW620后, 细胞的侵袭、迁移能力均降低. 在本研究中, 我们的体内实验进一步发现, miR-486-5p过表达质粒组裸鼠皮下移植瘤的生长速度较对照组明显缓慢, 肿瘤质量明显下降.
NRP2是一类酪氨酸激酶跨膜糖蛋白, 他的受体主要分布于内皮细胞及肿瘤细胞中[22,23]. 研究[24-26]发现, NRP2可以抑制胰腺癌细胞及骨肉瘤细胞的增殖、迁移、侵袭、转移能力. 而我们课题组既往通过双荧光素酶实验[27]证明, 在人大肠癌细胞SW620中, miRN-486-5p可以直接与NRP2的3端非转录区结合来抑制NRP2蛋白的表达. NRP2可以通过VEGFD[28]、Integrinα9β1/FAK/Erk[29]、GATA2/Lmo2[30]等多条信号通路抑制肿瘤的发生及转移. 本实验中我们通过Western blot及免疫组织化学实验方法发现, miR-486-5p过表达质粒组中NRP2的表达量较其他组中明显减少. 同时, 免疫组织化学染色发现, 裸鼠皮下移植瘤中新生微淋巴管的密度明显小于对照组.
本实验通过大肠癌裸鼠移植瘤模型的建立研究miR-486-5p在大肠癌细胞生长、增殖中的影响. 实验组我们注射miR-486-5p的过表达质粒, 对照组采用空白载体对照, 注射空白载体质粒有效地排除了miRNA-486-5p载体对实验的影响, 这样, 实验组各组之间的差异我们可以归结于是miR-486-5p对肿瘤的影响.
总之, 本研究证明miR-486-5p可以抑制大肠癌肿瘤的生长及微淋巴管的生成, 而这一作用可能与抑制Neuropilin-2蛋白的表达有关, 因此, miR-486-5p有望成为大肠癌淋巴结转移治疗的新的靶点.
肿瘤的复发及淋巴结转移是大肠癌死亡率高的常见原因, microRNA(miR)表达失调在肿瘤发生、发展的各个阶段发挥重要作用, 尤其是肿瘤的转移. 有研究发现在胃癌中miR-486-5p表达明显下调, 但miRNA-486-5p在大肠癌的发生及淋巴结转移中的作用目前尚无研究.
李兆申, 教授, 主任医师, 上海长海医院消化科
本研究首次通过裸鼠皮下移植瘤的建立在体内水平研究miRNA-486-5p在大肠癌中的作用及可能的作用机制, 通过转染、Western blot及免疫组织化学等实验技术证实了其对神经纤毛蛋白-2(neuropilin-2, NRP2)的调控作用, 丰富了NRP2调控的理论体系, 为结直肠癌的靶向治疗提供新的研究方向.
Gray等研究发现NRP2在结直肠癌组织高表达, 并在体外实验证实抑制NRP2的表达可促进细胞凋亡, 抑制其增殖和迁移. 既往研究发现miR-486-5p在胰腺癌、肺癌、肝癌、骨肉瘤中均表达下调.
本文将转染、Western blot、裸鼠皮下移植瘤模型的建立及免疫组织化学染色等实验技术结合起来, 首次通过体内实验验证了miR-486-5p与NRP2之间的调控关系, 为结直肠的基因诊断及基因治疗的研究提供了新的理论依据和治疗靶点.
本文发现miR-486-5p在结直肠癌中参与NRP2的调控, 说明其在结直肠癌发展及淋巴结转移中的重要临床意义, 提示miR-486-5p可作为NRP2潜在的治疗靶位, 并可作为结直肠癌诊断及预后的判断的分子标志, 对于结肠癌的早期诊断和治疗具有重要意义.
NRP2: 是一类酪氨酸激酶跨膜糖蛋白, 他的受体主要分布于内皮细胞及肿瘤细胞中. 研究发现, NRP2可以抑制胰腺癌细胞及骨肉瘤细胞的增殖、迁移、侵袭、转移能力.
本研究创新性好, 思路清晰, 方法恰当, 图表清楚.
编辑: 于明茜 电编: 都珍珍
| 1. | Wang F, Wong SC, Chan LW, Cho WC, Yip SP, Yung BY. Multiple regression analysis of mRNA-miRNA associations in colorectal cancer pathway. Biomed Res Int. 2014;2014:676724. [PubMed] [DOI] |
| 2. | Ferlay J, Soerjomataram I, Dikshit R, Eser S, Mathers C, Rebelo M, Parkin DM, Forman D, Bray F. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. Int J Cancer. 2015;136:E359-E386. [PubMed] [DOI] |
| 3. | Markowitz SD, Dawson DM, Willis J, Willson JK. Focus on colon cancer. Cancer Cell. 2002;1:233-236. [PubMed] |
| 4. | Labianca R, Nordlinger B, Beretta GD, Brouquet A, Cervantes A. Primary colon cancer: ESMO Clinical Practice Guidelines for diagnosis, adjuvant treatment and follow-up. Ann Oncol. 2010;21 Suppl 5:v70-v77. [PubMed] [DOI] |
| 5. | Stacker SA, Achen MG, Jussila L, Baldwin ME, Alitalo K. Lymphangiogenesis and cancer metastasis. Nat Rev Cancer. 2002;2:573-583. [PubMed] [DOI] |
| 6. | Stacker SA, Baldwin ME, Achen MG. The role of tumor lymphangiogenesis in metastatic spread. FASEB J. 2002;16:922-934. [PubMed] [DOI] |
| 8. | Bartel DP. MicroRNAs: genomics, biogenesis, mechanism, and function. Cell. 2004;116:281-297. [PubMed] [DOI] |
| 9. | Ma L, Teruya-Feldstein J, Weinberg RA. Tumour invasion and metastasis initiated by microRNA-10b in breast cancer. Nature. 2007;449:682-688. [PubMed] [DOI] |
| 10. | Valastyan S, Reinhardt F, Benaich N, Calogrias D, Szász AM, Wang ZC, Brock JE, Richardson AL, Weinberg RA. A pleiotropically acting microRNA, miR-31, inhibits breast cancer metastasis. Cell. 2009;137:1032-1046. [PubMed] [DOI] |
| 11. | Tavazoie SF, Alarcón C, Oskarsson T, Padua D, Wang Q, Bos PD, Gerald WL, Massagué J. Endogenous human microRNAs that suppress breast cancer metastasis. Nature. 2008;451:147-152. [PubMed] [DOI] |
| 12. | Wang J, Tian X, Han R, Zhang X, Wang X, Shen H, Xue L, Liu Y, Yan X, Shen J. Downregulation of miR-486-5p contributes to tumor progression and metastasis by targeting protumorigenic ARHGAP5 in lung cancer. Oncogene. 2014;33:1181-1189. [PubMed] [DOI] |
| 13. | Oh HK, Tan AL, Das K, Ooi CH, Deng NT, Tan IB, Beillard E, Lee J, Ramnarayanan K, Rha SY. Genomic loss of miR-486 regulates tumor progression and the OLFM4 antiapoptotic factor in gastric cancer. Clin Cancer Res. 2011;17:2657-2667. [PubMed] [DOI] |
| 14. | Soslow RA, Dannenberg AJ, Rush D, Woerner BM, Khan KN, Masferrer J, Koki AT. COX-2 is expressed in human pulmonary, colonic, and mammary tumors. Cancer. 2000;89:2637-2645. [PubMed] |
| 15. | Yan Q, Yuan Y, Yankui L, Jingjie F, Linfang J, Yong P, Dong H, Xiaowei Q. The Expression and Significance of CXCR5 and MMP-13 in Colorectal Cancer. Cell Biochem Biophys. 2015; Mar 1. [Epub ahead of print]. [PubMed] [DOI] |
| 17. | Huang XP, Hou J, Shen XY, Huang CY, Zhang XH, Xie YA, Luo XL. MicroRNA-486-5p, which is downregulated in hepatocellular carcinoma, suppresses tumor growth by targeting PIK3R1. FEBS J. 2015;282:579-594. [PubMed] [DOI] |
| 19. | Zhang G, Liu Z, Cui G, Wang X, Yang Z. MicroRNA-486-5p targeting PIM-1 suppresses cell proliferation in breast cancer cells. Tumour Biol. 2014;35:11137-11145. [PubMed] [DOI] |
| 20. | Chen H, Ren C, Han C, Wang D, Chen Y, Fu D. Expression and prognostic value of miR-486-5p in patients with gastric adenocarcinoma. PLoS One. 2015;10:e0119384. [PubMed] [DOI] |
| 21. | 刘 成霞, 李 明, 连 海峰, 史 宁. miRNA-486-5p对结肠癌细胞株SW620生物学行为的影响. 山东大学学报(医学版). 2015;53:16-20. |
| 22. | Staton CA, Kumar I, Reed MW, Brown NJ. Neuropilins in physiological and pathological angiogenesis. J Pathol. 2007;212:237-248. [PubMed] |
| 23. | Dallas NA, Fan F, Gray MJ, Van Buren G, Lim SJ, Xia L, Ellis LM. Functional significance of vascular endothelial growth factor receptors on gastrointestinal cancer cells. Cancer Metastasis Rev. 2007;26:433-441. [PubMed] [DOI] |
| 24. | Timoshenko AV, Rastogi S, Lala PK. Migration-promoting role of VEGF-C and VEGF-C binding receptors in human breast cancer cells. Br J Cancer. 2007;97:1090-1098. [PubMed] [DOI] |
| 25. | Dallas NA, Gray MJ, Xia L, Fan F, van Buren G, Gaur P, Samuel S, Lim SJ, Arumugam T, Ramachandran V. Neuropilin-2-mediated tumor growth and angiogenesis in pancreatic adenocarcinoma. Clin Cancer Res. 2008;14:8052-8060. [PubMed] [DOI] |
| 26. | Ji T, Guo Y, Kim K, McQueen P, Ghaffar S, Christ A, Lin C, Eskander R, Zi X, Hoang BH. Neuropilin-2 expression is inhibited by secreted Wnt antagonists and its down-regulation is associated with reduced tumor growth and metastasis in osteosarcoma. Mol Cancer. 2015;14:86. [PubMed] [DOI] |
| 28. | Yasuoka H, Kodama R, Hirokawa M, Takamura Y, Miyauchi A, Inagaki M, Sanke T, Nakamura Y. Neuropilin-2 expression in papillary thyroid carcinoma: correlation with VEGF-D expression, lymph node metastasis, and VEGF-D-induced aggressive cancer cell phenotype. J Clin Endocrinol Metab. 2011;96:E1857-E1861. [PubMed] [DOI] |
| 29. | Ou JJ, Wei X, Peng Y, Zha L, Zhou RB, Shi H, Zhou Q, Liang HJ. Neuropilin-2 mediates lymphangiogenesis of colorectal carcinoma via a VEGFC/VEGFR3 independent signaling. Cancer Lett. 2015;358:200-209. [PubMed] [DOI] |
| 30. | Coma S, Allard-Ratick M, Akino T, van Meeteren LA, Mammoto A, Klagsbrun M. GATA2 and Lmo2 control angiogenesis and lymphangiogenesis via direct transcriptional regulation of neuropilin-2. Angiogenesis. 2013;16:939-952. [PubMed] [DOI] |