修回日期: 2015-06-08
接受日期: 2015-06-15
在线出版日期: 2015-09-28
目的: 通过慢病毒转染UE7T-13细胞, 构建Tet-on基因开关调控稳定表达肝细胞生长因子(hepatocyte growth factor, HGF)、成纤维细胞生长因子-4(fibroblast growth factor 4, FGF4)的人类骨髓间充质干细胞株.
方法: 全基因合成HGF和FGF4序列, 通过酶切、重组分别构建包含目的基因HGF、FGF4的两个慢病毒载体plenti6.3/TO-HGF和plenti6.3/TO-FGF4, 包装并计算其滴度. 以UE7T-13细胞最适MOI值稀释慢病毒Lenti3.3/TR, 并转染UE7T-13细胞, 加入抗生素Zeocin筛选, 获得带有Tet-on基因调控开关的UE7T-13-TR细胞株. 采用已构建好的慢病毒plenti6.3/TO-HGF和plenti6.3/TO-FGF4分别转染UE7T-13-TR细胞并经过抗生素Blasticidin筛选, 构建Tet-on调控稳定表达HGF的UE7T-13-TR-HGF细胞株和Tet-on调控稳定表达FGF4的UE7T-13-TR-FGF4细胞株. 通过Q-PCR、Western blot及ELISA在基因、蛋白及蛋白分泌水平检测目的基因HGF、FGF4的表达情况.
结果: 成功构建UE7T-13-TR-HGF和UE7T-13-TR-FGF4细胞株. 经Q-PCR检测, 当Tet存在时, HGF基因在UE7T-13-TR-HGF中的表达为无Tet时的78倍; FGF4基因则超过2万倍, 且1 μg/mL的Tet为较佳浓度. Western blot及ELISA结果在蛋白表达水平及蛋白分泌水平验证了以上结果, 证明已合成的HGF及FGF4能成功分泌到细胞外.
结论: 通过慢病毒转染UE7T-13细胞, 我们成功构建出Tet可调控稳定表达HGF、FGF4细胞株(UE7T-13-TR-HGF和UE7T-13-TR-FGF4细胞株), 为进一步的研究奠定了良好的实验基础.
核心提示: 通过慢病毒转染UE7T-13细胞, 构建四环素调控基因表达系统, 达成可调控诱导干细胞定向分化的目的.
引文著录: 肖江强, 施晓雷, 袁献温, 丁义涛. 构建Tet-on调控稳定表达肝细胞生长因子、成纤维细胞生长因子-4的人类MSCs细胞株. 世界华人消化杂志 2015; 23(27): 4317-4325
Revised: June 8, 2015
Accepted: June 15, 2015
Published online: September 28, 2015
AIM: To develop human bone marrow derived cells lines stably expressing Tet regulated hepatocyte growth factor (HGF) or fibroblast growth factor 4 (FGF4) gene.
METHODS: HGF and FGF4 genes were synthesized and then cloned into a lentiviral vector to result in plenti6.3/TO-HGF and plenti6.3/TO-FGF4, respectively. Lenti3.3/TR was transfected into UE7T-13 cells to develop a UE7T-13-TR cell line possessing Tet-on gene swift. Then, plenti6.3/TO-HGF and plenti6.3/TO-FGF4 were used to transfect UE7T-13-TR cell to result in UE7T-13-TR-HGF cell line that could stably express Tet regulated HGF and UE7T-13-TR-FGF4 cell line that could stably express Tet regulated FGF4. The expression of target genes was detected by Q-PCR, and the levels and secretion of proteins were detected by Western blot and ELISA.
RESULTS: We successfully developed UE7T-13-TR-HGF and UE7T-13-TR-FGF4 cell lines. Q-PCR analysis verified that the expression of the HGF gene in UE7T-13-TR-HGF in the presence of Tet was 78-fold higher than that in the absence of Tet, and the fold change for FGF4 was more than 20 thousand folds. Western blot and ELISA analyses verified that HGF and FGF4 proteins could be synthesized and secreted outside the cell membrane.
CONCLUSION: We have successfully developed UE7T-13-TR-HGF and UE7T-13-TR-FGF4 cell lines through lentiviral transfection, which lays a foundation for further study.
- Citation: Xiao JQ, Shi XL, Yuan XW, Ding YT. Development of human bone marrow derived cells lines stably expressing Tet regulated hepatocyte growth factor or fibroblast growth factor 4 gene. Shijie Huaren Xiaohua Zazhi 2015; 23(27): 4317-4325
- URL: https://www.wjgnet.com/1009-3079/full/v23/i27/4317.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i27.4317
在我国, 尤其是中东部地区, 肝病发生率高, 肝功能衰竭是各种肝病患者死亡的主要原因. 近些年发展起来的生物人工肝(bioartificial liver, BAL)除了具有毒素清除、过滤能力, 还能发挥肝细胞的合成、代谢及分泌功能, 有望成为继肝移植后, 治疗肝功能衰竭、终末期肝病和代谢障碍性疾病的替代治疗手段, 具有广阔的临床应用前景. BAL主要组成部件有生物反应器及细胞材料, 其中细胞材料的来源缺乏在很大程度上限制了BAL进一步的发展, 本实验拟构建定向诱导分化为肝细胞的骨髓间充质干细胞株来解决这一难题.
UE7T-13人类骨髓间充质干细胞购自日本人类科学研究资源库(Human Science Research Resources Bank, HSRRB), 通过病毒DNA检测(CMV-、EBV-、HHV6-、HHV7-、BKV-、JCV-、ADV-、HBV-、parvoB19-、HTLV1-、HTLV2-、HIV1-、HIV2-以及HPV18-)证明其无传染性、安全性可. PL-GFP慢病毒原液、pCDNA3.1(+)载体、pDONR221载体、plenti6.3/TO/V5-Dest载体、慢病毒表达载体pLenti、包装质粒pLP1、pLP2、pLP/VSVG均购自上海Invitrogen公司; EcoRⅠ、HindⅢ、XhoⅠ、BamHⅠ限制性内切酶, NheⅠ FastDigest、BamHⅠ FastDigest限制性内切酶购自加拿大富酶泰斯Fermentas(MBI Fermentas)公司; T4 DNA Ligase购自美国纽英伦生物公司(NEB); 人类肝细胞生长因子(hepatocyte growth factor, HGF)ELISA试剂盒购自Invitrogen公司; 人类成纤维细胞生长因子-4(fibroblast growth factor 4, FGF4) ELISA试剂盒购自美国ABcam公司; 人类HGF抗体、人类FGF4抗体均购自美国ABcam公司.
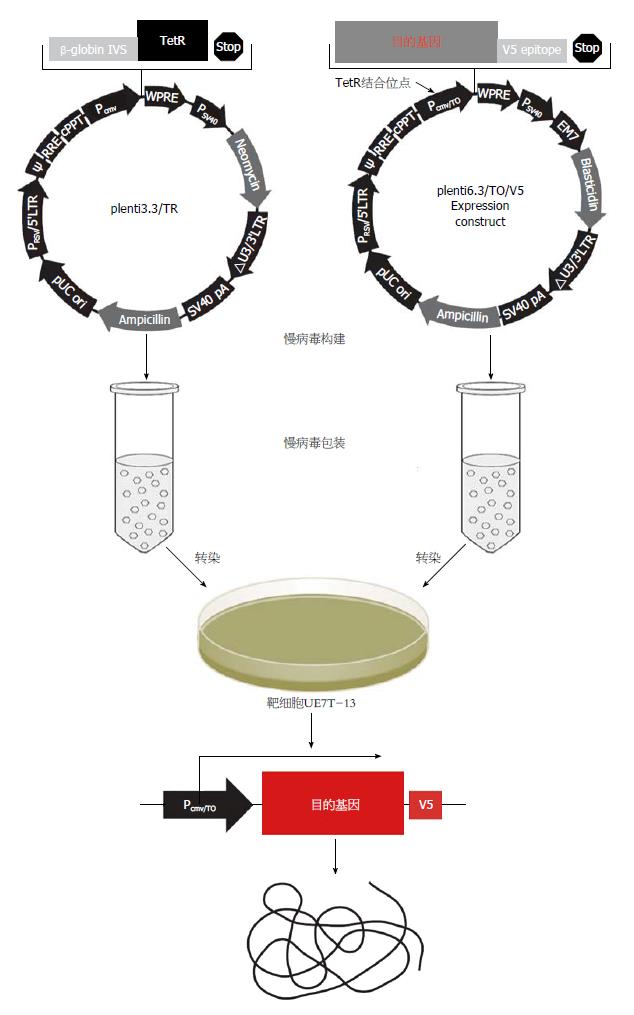
1.2.1 目的基因合成及高表达载体构建: 对所需合成的FGF4和HGF基因序列进行分析, 设计、合成单链oligo, 并在FGF4序列两端分别添加限制性酶切位点HindⅢ和EcoRⅠ, 在HGF基因的两端分别添加限制性酶切位点NheⅠ和BamHⅠ; 利用PCR将合成的oligo拼接成完整的基因; 测序验证重组克隆中的目的序列是否与要求相符; 通过pCDNA3.1(+)质粒载体构建程序获得pCDNA3.1(+)-FGF4及pCDNA3.1(+)-HGF载体质粒(图1).
1.2.2 构建慢病毒载体: 构建慢病毒载体plenti6.3/TO-FGF4: 设计1对PCR扩增引物, 以含有FGF4基因的质粒为模板, 扩增带有酶切位点的XhoⅠ-FGF4-BamHⅠ序列, 经扩增、酶切、重组, 构建正确的pEGFP-N1-FGF4载体质粒, 并以之为模板, 扩增带有重组位点的attB1-FGF4-EGFP-attB2序列, 经重组构建成功的plenti6.3/TO/FGF4-EGFP慢病毒载体(图1).
构建慢病毒载体plenti6.3/TO-HGF: 设计1对PCR扩增引物, 扩增带有重组位点的attB1-HGF-attB2序列, 经重组构建质粒; 并使用LR重组系统将目的序列重组到慢病毒载体plenti6.3/TO/V5-DEST上, 测序验证重组质粒的正确性, 构建成功的plenti6.3/TO/HGF慢病毒载体(图1).
1.2.3 慢病毒包装、侵染靶细胞构建稳转株: Lenti3.3/TR感染细胞UE7T-13细胞: UE7T-13细胞经胰酶消化, 细胞计数后, 按照每孔1.5×105细胞接种至六孔板中. 培养箱中过夜培养. 将稀释好的慢病毒液分别加入各细胞孔中, 同时设定空白的靶细胞作为对照, 细胞放置培养箱中继续培养. 48 h后, 按照1:30稀释至10 cm皿中, 加入Zeocin 500 ng/μL(根据kill curves结果获得最佳筛选浓度), 3 d后观察细胞情况, 后续每2-3 d换1次含有抗生素Zeocin 500 ng/μL的完全培养基. 待空白孔细胞完全死亡后, 扩增细胞, 继续培养并冻存. 同时收集部分细胞(UE7T-13-TR)抽提RNA和蛋白检测目的基因和蛋白的表达情况(图1). Lenti6.3/TO/FGF4感染细胞UE7T-13-TR: 步骤同1.2.3. Lenti6.3-HGF感染细胞UE7T-13-TR: 步骤同1.2.3.
Q-PCR检测靶基因的表达量: 提取细胞样品总RNA. 然后将RNA溶于水中, 55 ℃-60 ℃水溶10 min. 再反转录获得cDNA, 保存在-20 ℃备用. 通过Q-PCR检测细胞样品中目的基因和内参基因的表达量, 根据Q-PCR反应曲线得到各样品目的基因和内参基因Ct值, 计算△△Ct进行相对定量. 使用UE7T-13+TR组作为对照样品, 检测感染慢病毒筛选得到的稳转株细胞的目的基因表达量. △△Ct = (待测样品中目的基因的Ct平均值-待测样本中内参基因Ct的平均值)-(对照样品重目的基因的Ct平均值-对照样本中内参基因Ct的平均值), 基因的表达量F = 2-△△Ct. 目的基因的检测用引物序列(5'-3')如表1.
| 目的基因 | 引物序列(5' to 3') |
| FGF4 | F: GGGCGTGGTGAGCATCTT |
| R: TTGTAGGACTCGTAGGCGTTG | |
| HGF | F: GGCCATGGTGCTATACTCTT |
| R: TCTCGTAGGTCCTTGCACTT | |
| GAPDH | F: GAAGGTCGGAGTCAACGGATT |
| R: CGCTCCTGGAAGATGGTGAT |
Western blot检测目的蛋白的表达: 裂解细胞获得总蛋白, 测完蛋白含量后, 根据蛋白含量上样体积. 上样顺序按照UE7T-13, UE7T-13-TR, UE7T-13-TR-HGF, UE7T-13-TR-FGF4的顺序. 通过100 V电泳90 min, 转膜, 封闭加一抗, 曝光等步骤获得结果.
ELISA检测上清中目的蛋白的表达情况: 接种UE7T-13、UE7T-13-TR、UE7T-13-TR-FGF4及UE7T-13-TR-HGF细胞, 每孔5000个细胞至6孔板中, 加入四环素(tetracycline, Tet) 1 μg/mL, 每天收集细胞上清用于ELISA检测目的蛋白的分泌表达情况.
统计学处理 实验结果用mean±SD表示. 采用SPSS16.0统计学软件进行数据处理, 组间比较应用独立样本t检验, P<0.05为差异有统计学意义.
2.1.1 全基因合成FGF4和HGF序列: 经测序验证, 重组克隆中的目的序列与要求相符; 并获得含有正确FGF4基因的T载体质粒编号为649mu-1, 含有正确HGF基因的T载体质粒编号为650-1F/1R-3.
2.1.2 HGF/FGF4高表达载体测序验证结果: 649F-3对应的pCDNA3.1(+)-FGF4载体, 649-1F-1RF-6对应的pEGFP-N1-FGF4载体, 649BP-1对应的pDONR221-FGF4-EGFP载体, 649LR-1对应的plenti6.3/TO/FGF4-EGFP载体, 650-1F/1R-3对应pMD18T-HGF载体, 10510-1对应pCDNA3.1(+)-HGF载体, 650BP-1对应的pDONR221-HGF载体以及10628-4对应的plenti6.3/TO/HGF载体, 经测序验证, 序列正确.
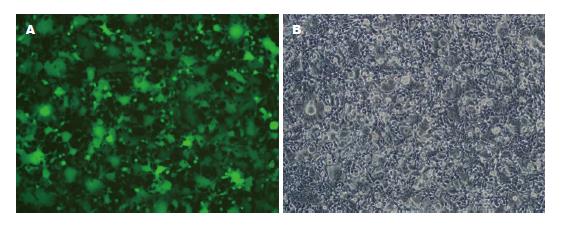
2.2.1 慢病毒包装: 转染实验24 h后, Lenti6.3/TO/FGF-4-EGFP在荧光显微镜下可看到蛋白的表达(图2).
2.2.2 慢病毒液活性滴度测定: Lenti6.3/TO/FGF-4-EGFP感染HEK293细胞96 h后, 通过观察测得其活性滴度为: 3×108 TU/mL.
2.2.3 慢病毒液物理滴度测定: Lenti6.3/TO/FGF-4-EGFP的物理滴度为: 1.9×1010 VP/mL; Lenti3.3/TR的物理滴度为: 2.78×1010 VP/mL.
Lenti3.3/TR侵染后, 抗生素Zeocin 500 ng/μL筛选获得UE7T-13-TR细胞; UE7T-13-TR细胞再分别经Lenti6.3/TO/FGF-4-EGFP及Lenti6-HGF侵染, Blasticidin 8 ng/μL筛选获得UE7T-13-TR-FGF4及UE7T-13-TR-HGF细胞.
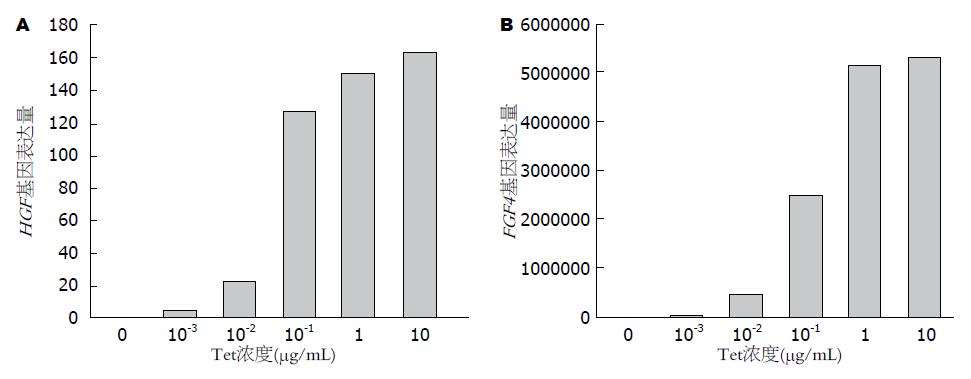
2.3.1 加入不同浓度Tet, 验证Tet浓度与目的基因表达关系: 由图3可知, UE7T+HGF细胞中HGF目的基因高表达, UE7T+FGF4细胞中FGF4目的基因高表达, 从基因层面上看稳转株构建成功, 且UE7T-13-TR-HGF及UE7T-13-TR-FGF4细胞仅在Tet存在条件下会高表达, 基因开关调控效果良好. 且目的基因的表达与Tet浓度直接相关, 当Tet浓度为1 μg/mL时, 细胞即已高表达目的基因.
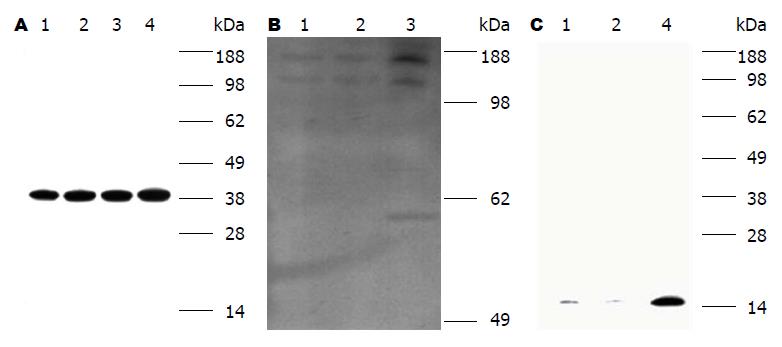
2.3.2 目的蛋白表达情况: 由Western blot结果可知, UE7T-13-TR-HGF细胞在Tet存在条件下, HGF目的蛋白高表达; UE7T-13-TR-FGF4细胞中FGF4目的蛋白在Tet存在条件下, 高表达, 说明在蛋白表达层面上, 稳转株构建成功, 且两种细胞中Tet-on基因开关调控效果良好(图4).
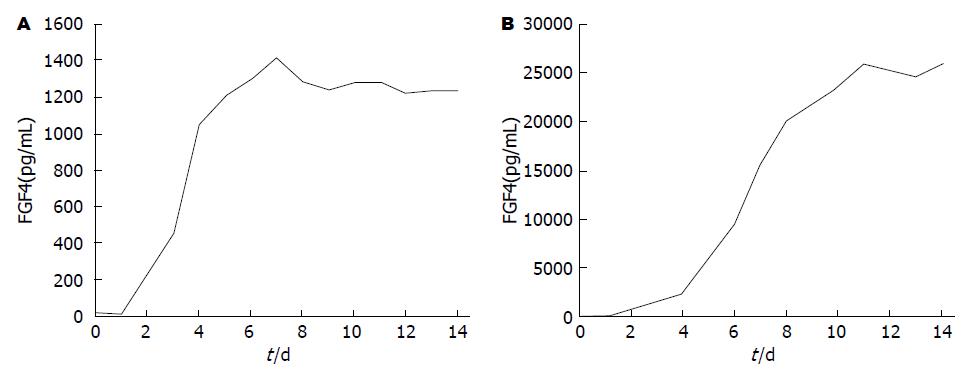
2.3.3 ELISA检测细胞上清液, 验证HGF/FGF4目的蛋白分泌表达情况: 待检样品中HGF含量(因6 d后细胞密度已完全长满, 故细胞消化后按照每孔5000个细胞重新接种, 仍每天收集细胞上清): 由ELISA数据可知, UE7T-FGF细胞能成功的表达分泌型HGF蛋白, 且细胞中Tet-on基因开关调控效果良好(图5A).
待检样品中FGF4含量(因6 d后细胞密度已完全长满, 故细胞消化后按照每孔5000个细胞重新接种, 仍每天收集细胞上清): 由ELISA数据可知, UE7T-FGF细胞能成功的表达分泌型FGF4蛋白, 且细胞中Tet-on基因开关调控效果良好(图5B).
广泛意义上讲, 基因转染技术是指将重组载体(含目的基因的质粒或慢病毒等), 通过特定方式转导入真核受体细胞这一过程. Szybalska等[1]在20世纪60年代, 通过将人类的次黄嘌呤磷酰核糖转移酶(hypoxanthine phospho-ribosyl transferase, HPRT)基因转染入HPRT基因缺陷突变的细胞内, 并使得该突变细胞成功表达HPRT, 首次完成了第1例动物细胞的基因转染. 随着研究的深入, 利用各种不同载体来携带外源基因序列转染、显微直接注射技术、转化细胞的筛选等技术的发展都很大程度的促进了基因转染技术的发展以及外源基因在受体细胞中的表达调控的研究[2-5].
目前, 基因转染方法有化学法、物理法及逆转录病毒载体技术等方法[6-11], 其中逆转录病毒载体基因转移法具有细胞透过性好、基因转移率高的优势[12-14], 在基因治疗的实验研究中备受关注; 另一方面, 当目的基因具有细胞毒性或者可能会导致细胞死亡及分化等负面因素, 直接导入这些基因进入靶细胞, 直接整合到染色体并表达, 极可能会导致细胞凋亡、分化[15,16], 导致进一步的研究无法展开. 因此, 建立有"基因调控开关"的载体转染细胞构建可调控稳定表达细胞株, 通过药物或者其他激动剂调控目的基因的表达[17-21], 是研究这类基因可采取的最好办法. 在"基因调控开关"的研究领域中, 有很多诱导载体的启动子来源真核细胞, 并可能会受到真核细胞内一些内源性因子的影响, 从而对目的基因的表达调控作用呈现出非特异性; 另外, 调控"基因调控开关"的激动剂(如皮质激素), 有可能早已存在于细胞内, 导致其调节作用不显著, 或者其本身具有某些不良反应, 使得其不具备针对性或者安全性, 无法应用于临床研究或进一步的基因治疗研究中.
Tet介导的基因调控表达系统, 是目前运用最为成熟, 技术最先进的"基因调控开关", 非常适用于具有负面因素的目的基因的研究[22-25]. 他所利用的是改良后的大肠杆菌(Escherichia coli, E. coli)的基因调节表达系统, 受Tet及其衍生物doxycycline的精确调控诱导, 相对于真核细胞来说, Tet是外源性因子, 且毒性低, 因此其具有相当高的特异性和敏感性, 且不影响细胞内的其他基因活性, 使得该系统具有广泛的应用研究价值. Tet介导的基因调控表达系统可分为Tet介导的基因关闭系统Tet-off以及Tet介导基因表达系统Tet-on. Tet-off基因表达系统是Gossen等[26,27]在1992年提出的一种可调控的高效表达系统, 并于1995年提出Tet-on基因表达系统. 在Tet-off基因表达系统中, 随着细胞培养基中Tet减少, 外源基因表达逐渐增加. 相反, 在Tet-on基因表达系统中, 当Tet浓度增加时, 外源基因表达逐渐增加. 在这2个系统中, 外源基因的表达按照一种剂量依赖方式受Tet高效调控. Tet-on基因表达系统被认为是目前最理想的真核生物基因表达系统, 该系统主要包括2个部分, 即调节元件和反应元件. 调节元件可以表达Tet反应转录活化因子(reverse tetracycline-controlled transactivator, tTA), 反应元件含有Tet反应因子(Tet-response element, TRE). 在初始无Tet存在条件下, Tet-on基因开关下游的目的基因并不表达, 而当Tet存在时, 调节元件会表达tTA, 可与反应元件的TRE部位结合, 并高效表达插入反应元件附近启动子下游的目的基因. 反应元件由报告基因、外源目的基因的及抗生素筛选基因组成, 用于对构建的含有外源基因的反应元件稳定转染后细胞的筛选. 该系统具有高效、特异、且较严密等特点, 而目的基因的表达也与Tet剂量直接相关, 受其精确且特异性的调控, 因而其在基因功能研究和基因治疗研究领域已被广泛应用. 基因开关两大元件一般是由质粒载体转染, 但质粒转染入细胞胞浆后会因细胞分裂而产生分布不均或丢失的情况, 导致表达不稳定, 因此不适用于前期需大量细胞扩增的实验. 采用plenti6/TR慢病毒构建的Tet-on表达系统能整合到细胞染色体上, 从而随细胞的复制而复制, 具有稳定表达的优势[28]. 在该构建方式中, Lenti3.3/TR慢病毒包含TetR(Tet repressor)基因, 能与含有目的基因序列的pLenti6.3/TO/V5-DEST慢病毒上TO(tetracycline operator)序列结合, 从而使得Tet能调控目的基因的表达.
在本研究中, 我们通过将Lenti3.3/TR慢病毒转染入UE7T-13细胞, 构建出具备表达TetR的UE7T-13-TR细胞, 再分别通过包含HGF基因的pLenti6.3/TO/HGF以及包含FGF4基因的pLenti6.3/TO/FGF4转染UE7T-13-TR细胞, 并经过抗性分离培养获得UE7T-13-TR-HGF细胞和UE7T-13-TR-FGF4细胞. 经过基因水平、蛋白表达水平以及分泌水平验证, 在这两种细胞中, 转染入的目的基因HGF、FGF4已整合到人UE7T-13细胞中, 但处于不表达状态, 直到加入Tet开启"基因调控开关", 才分别表达HGF、FGF4. 实验结果说明, 在构建出的两种细胞株中, HGF、FGF4基因表达受到Tet精确调节, 证明Tet可调控稳定表达HGF、FGF4细胞株构建成功, 为进一步的研究奠定了良好的实验基础.
目前肝细胞材料广泛应用于生物人工肝、肝脏组织工程等研究, 但面临着细胞来源缺乏的难题, 本研究拟通过干细胞定向诱导分化来简单、高效地制备肝细胞材料.
戴朝六, 教授, 中国医科大学第二临床学院(盛京医院)肝胆外科; 孔静, 副教授, 副主任医师, 中国医科大学附属盛京医院胆道、血管外科、微创外科
肝细胞材料应用广泛, 但来源匮乏, 目前相关研究如永生化肝细胞、肝肿瘤细胞株、异种肝细胞等均尚有一定的局限, 本研究建立一种稳定表达细胞株, 可为解决这一问题提供线索.
Tet-on系统具有高效、特异、且较严密等特点, 而目的基因的表达也与Tet剂量直接相关, 受其精确且特异性的调控, 因而其在基因功能研究和基因治疗研究领域已被广泛应用.
本研究将Tet-on系统应用于干细胞诱导分化中, 实现可调控的诱导分化, 为其他细胞材料来源提供一定的思路.
本研究提供了一个简单高效的干细胞向肝细胞诱导分化的方法, 以期望实现肝细胞材料的大规模制备, 为以肝细胞材料为核心的组织工程提供坚实的发展基础.
基因开关元件: 一般是由质粒载体转染, 但质粒转染入细胞胞浆后会因细胞分裂而产生分布不均或丢失的情况, 导致表达不稳定, 因此不适用于前期需大量细胞扩增的实验. 采用plenti6/TR慢病毒构建的Tet-on表达系统能整合到细胞染色体上, 从而随细胞的复制而复制, 具有稳定表达的优势.
该研究通过慢病毒转染UE7T-13细胞, 成功构建Tet-on基因开关调控稳定表达HGF、FGF4的人类骨髓间充质干细胞株, 有较为重要的理论与实际意义.
编辑: 韦元涛 电编: 都珍珍
| 1. | Szybalska EH, Szybalski W. Genetics of human cess line. IV. DNA-mediated heritable transformation of a biochemical trait. Proc Natl Acad Sci USA. 1962;48:2026-2034. [PubMed] [DOI] |
| 2. | Sandbichler AM, Aschberger T, Pelster B. A method to evaluate the efficiency of transfection reagents in an adherent zebrafish cell line. Biores Open Access. 2013;2:20-27. [PubMed] [DOI] |
| 3. | Yoshida D, Kim K, Takumi I, Yamaguchi F, Adachi K, Teramoto A. A transfection method for short interfering RNA with the lipid-like self-assembling nanotube, A6K. Med Mol Morphol. 2013;46:86-91. [PubMed] [DOI] |
| 4. | Ferreira E, Potier E, Logeart-Avramoglou D, Salomskaite-Davalgiene S, Mir LM, Petite H. Optimization of a gene electrotransfer method for mesenchymal stem cell transfection. Gene Ther. 2008;15:537-544. [PubMed] [DOI] |
| 5. | Markowicz S, Niedzielska J, Kruszewski M, Ołdak T, Gajkowska A, Machaj EK, Skurzak H, Pojda Z. Nonviral transfection of human umbilical cord blood dendritic cells is feasible, but the yield of dendritic cells with transgene expression limits the application of this method in cancer immunotherapy. Acta Biochim Pol. 2006;53:203-212. [PubMed] |
| 6. | Kim BK, Kang H, Doh KO, Lee SH, Park JW, Lee SJ, Lee TJ. Homodimeric SV40 NLS peptide formed by disulfide bond as enhancer for gene delivery. Bioorg Med Chem Lett. 2012;22:5415-5418. [PubMed] [DOI] |
| 7. | Noor F, Kinscherf R, Bonaterra GA, Walczak S, Wölfl S, Metzler-Nolte N. Enhanced cellular uptake and cytotoxicity studies of organometallic bioconjugates of the NLS peptide in Hep G2 cells. Chembiochem. 2009;10:493-502. [PubMed] [DOI] |
| 8. | van der Aa MA, Koning GA, d'Oliveira C, Oosting RS, Wilschut KJ, Hennink WE, Crommelin DJ. An NLS peptide covalently linked to linear DNA does not enhance transfection efficiency of cationic polymer based gene delivery systems. J Gene Med. 2005;7:208-217. [PubMed] [DOI] |
| 9. | Alanazi F, Fu ZF, Lu DR. Effective transfection of rabies DNA vaccine in cell culture using an artificial lipoprotein carrier system. Pharm Res. 2004;21:675-682. [PubMed] [DOI] |
| 10. | Koul S, Johnson T, Pramanik S, Koul H. Cellular transfection to deliver alanine-glyoxylate aminotransferase to hepatocytes: a rational gene therapy for primary hyperoxaluria-1 (PH-1). Am J Nephrol. 2005;25:176-182. [PubMed] [DOI] |
| 11. | Grönniger E, Wessel S, Kühn SC, Söhle J, Wenck H, Stäb F, Winnefeld M. A new protocol for functional analysis of adipogenesis using reverse transfection technology and time-lapse video microscopy. Cell Biol Int. 2010;34:737-746. [PubMed] [DOI] |
| 12. | Okazaki A, Jo J, Tabata Y. A reverse transfection technology to genetically engineer adult stem cells. Tissue Eng. 2007;13:245-251. [PubMed] [DOI] |
| 13. | Mannherz O, Mertens D, Hahn M, Lichter P. Functional screening for proapoptotic genes by reverse transfection cell array technology. Genomics. 2006;87:665-672. [PubMed] [DOI] |
| 14. | Høgset A, Prasmickaite L, Hellum M, Engesaeter BO, Olsen VM, Tjelle TE, Wheeler CJ, Berg K. Photochemical transfection: a technology for efficient light-directed gene delivery. Somat Cell Mol Genet. 2002;27:97-113. [PubMed] [DOI] |
| 15. | Crabb BS. Transfection technology and the study of drug resistance in the malaria parasite Plasmodium falciparum. Drug Resist Updat. 2002;5:126-130. [PubMed] [DOI] |
| 16. | Davis WC, Yilma T, Perryman LE, McGuire TC. Perspectives on the application of monoclonal antibody and transfection technology in veterinary microbiology. Prog Vet Microbiol Immunol. 1985;1:1-24. [PubMed] |
| 17. | Ligi I, Simoncini S, Tellier E, Vassallo PF, Sabatier F, Guillet B, Lamy E, Sarlon G, Quemener C, Bikfalvi A. A switch toward angiostatic gene expression impairs the angiogenic properties of endothelial progenitor cells in low birth weight preterm infants. Blood. 2011;118:1699-1709. [PubMed] [DOI] |
| 18. | Sun J, Smith L, Armento A, Deng WM. Regulation of the endocycle/gene amplification switch by Notch and ecdysone signaling. J Cell Biol. 2008;182:885-896. [PubMed] [DOI] |
| 19. | Farley DC, Brown JL, Leppard KN. Activation of the early-late switch in adenovirus type 5 major late transcription unit expression by L4 gene products. J Virol. 2004;78:1782-1791. [PubMed] [DOI] |
| 20. | Bradley D. Gene therapy dimmer switch. Pharm Sci Technolo Today. 1999;4:128. [PubMed] [DOI] |
| 21. | Paillard F. "Tet-on": a gene switch for the exogenous regulation of transgene expression. Hum Gene Ther. 1998;9:983-985. [PubMed] [DOI] |
| 22. | Xu Z, Liu E, Peng C, Li Y, He Z, Zhao C, Niu J. Role of hypoxia-inducible-1α in hepatocellular carcinoma cells using a Tet-on inducible system to regulate its expression in vitro. Oncol Rep. 2012;27:573-578. [PubMed] [DOI] |
| 23. | Zhang H, Dong H, Jiang B, Wang Z, Chen R, Zhang Z, Zhang Z. Hypoxic response elements and Tet-On advanced double-controlled systems regulate hVEGF 165 and angiopoietin-1 gene expression in vitro. J Biomed Res. 2011;25:204-212. [PubMed] [DOI] |
| 24. | Zabala M, Wang L, Hernandez-Alcoceba R, Hillen W, Qian C, Prieto J, Kramer MG. Optimization of the Tet-on system to regulate interleukin 12 expression in the liver for the treatment of hepatic tumors. Cancer Res. 2004;64:2799-2804. [PubMed] [DOI] |
| 25. | Gatz C, Quail PH. Tn10-encoded tet repressor can regulate an operator-containing plant promoter. Proc Natl Acad Sci USA. 1988;85:1394-1397. [PubMed] [DOI] |
| 26. | Gossen M, Bujard H. Efficacy of tetracycline-controlled gene expression is influenced by cell type: commentary. Biotechniques. 1995;19:213-216; discussion 213-216. [PubMed] |
| 27. | Gossen M, Bujard H. Tight control of gene expression in mammalian cells by tetracycline-responsive promoters. Proc Natl Acad Sci USA. 1992;89:5547-5551. [PubMed] [DOI] |
| 28. | Liu Y, Xue M. [Recombinant human insulin gene lentivirus transfecting human umbilical cord mesenchymal stem cells in vitro]. Zhongguo Xiufu Chongjian Waike Zazhi. 2010;24:822-827. [PubMed] |