修回日期: 2015-08-02
接受日期: 2015-08-10
在线出版日期: 2015-09-08
目的: 本研究旨在探讨第二线粒体源的半胱天冬酶激活物(second mitochondria-derived activator of Caspase, Smac)及半胱氨酸天冬氨酸蛋白酶9(cysteinyl asparate specific proteinase 9, Caspase9)蛋白表达水平与直肠癌术前放化疗后病理反应程度的关系, 单独评价及两者联合后评价其表达水平对预测直肠癌术前放化疗敏感性的价值.
方法: 收集昆明医科大学第一附属医院肿瘤放疗科2008-07/2013-06接受术前放化疗并行手术的直肠腺癌患者43例, 免疫组织化学方法检测放化疗前活检标本及手术后切除标本中Smac及Caspase9蛋白的表达水平, 分析其放化疗前、后表达水平的变化, 以及活检组织中Smac及Caspase9蛋白表达水平与术后病理反应程度的关系.
结果: 直肠癌术前放化疗后病理反应良好, 有效率达72.1%, 其中, 病理完全缓解率达30.2%. 放化疗前、后直肠癌组织中Smac及Caspase9蛋白表达均有差异, 放化疗后Smac及Caspase9蛋白的染色得分均下降(P<0.001). 放化疗前Caspase9表达阳性的患者(染色得分1-8分)放化疗有效的比例显著增加, 差异有统计学意义(P<0.05). 当Smac及Caspase9均为阳性时, 放化疗有效的比例显著提高(P = 0.0002). 生存分析显示, 放化疗反应结果与患者总生存相关, 放化疗有效组的生存时间较放化疗无效组明显延长(P = 0.0193).
结论: 放化疗前活检组织中Caspase9的阳性表达是直肠癌患者对放化疗敏感的标志, 联合检测放化疗前Smac及Caspase9的表达可更好地预测直肠癌细胞对放化疗的敏感性. 在诸多因素中, 直肠癌患者对放化疗的有效性是决定患者预后的重要因素, 联合检测活检组织中Smac及Caspase9的表达有可能筛选出对放化疗敏感的患者, 从而使其获得更好的预后.
核心提示: 放化疗前癌组织中半胱氨酸天冬氨酸蛋白酶9(cysteinyl asparate specific proteinase 9)的阳性表达是直肠癌患者对放化疗敏感的标志, 联合检测放化疗前第二线粒体源的半胱天冬酶激活物(second mitochondria-derived activator of Caspase)及的表达可更好地预测直肠癌细胞对放化疗的敏感性, 从而筛选出对放化疗敏感的患者, 使其获得更好的预后.
引文著录: 熊伟, 艾毅钦, 汪勇, 叶岚, 吴星娆, 杨军, 马丽菊, 张静. 联合检测Smac及Caspase9在预测直肠癌术前放化疗敏感性的临床价值. 世界华人消化杂志 2015; 23(25): 4041-4050
Revised: August 2, 2015
Accepted: August 10, 2015
Published online: September 8, 2015
AIM: To evaluate the role of second mitochondria-derived activator of Caspase (Smac) and cysteinyl asparate specific proteinase 9 (Caspase9), alone and in combination, in predicting preoperative chemoradiotherapy sensitivity in patients with rectal carcinoma by investigating the relationship between the expression of Smac and Caspase9 and the pathologic response in patients who have received preoperative chemoradiotherapy.
METHODS: The biopsy specimens before chemoradiotherapy and surgical specimens were obtained from 43 cases of rectal adenocarcinoma who received preoperative chemoradiotherapy from July 2008 to June 2013. Immunohistochemical staining was used to test the protein expression levels of Smac and Caspase9, and the relationship between Smac and Caspase9 protein expression levels and postoperative pathological response was analyzed.
RESULTS: The effective rate of preoperative chemoradiotherapy was as high as 72.1%, and the pathological complete response rate was 30.2%. The expression of Smac and Caspase9 was altered after chemoradiotherapy (P < 0.001 for both). Their expression levels were significantly downregulated after chemoradiotherapy. The effective rate of preoperative chemoradiotherapy was significantly increased in patients who were positive for Caspase9 protein expression (staining score range, 1 to 8) before chemoradiotherapy (P < 0.05). And the effective rate was further increased when Smac and Caspase9 proteins were both positive (P = 0.0002). The survival analysis indicated that chemoradiotherapy response was correlated with the overall survival, and the survival was significantly longer in the response arm than in the non-response arm (P = 0.0193).
CONCLUSION: The positive expression of Caspase9 protein in biopsy specimens before chemoradiotherapy can be a marker for sensitivity to radiation and chemotherapy in patients with rectal cancer. Joint detection of Smac and Caspase9 proteins can be more reliable in predicting the sensitivity to preoperative chemoradiotherapy in rectal cancer patients. The response to chemoradiotherapy is a key factor responsible for patients' prognosis. The joint detection of Smac and Caspase9 can be helpful in screening out patients who are sensitive to preoperative chemoradiation.
- Citation: Xiong W, Ai YQ, Wang Y, Ye L, Wu XR, Yang J, Ma LJ, Zhang J. Clinical significance of joint detection of Smac and Caspase9 protein levels in predicting preoperative chemoradiotherapy sensitivity in patients with rectal cancer. Shijie Huaren Xiaohua Zazhi 2015; 23(25): 4041-4050
- URL: https://www.wjgnet.com/1009-3079/full/v23/i25/4041.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i25.4041
直肠癌术前放化疗能够使肿瘤缩小, 提高肿瘤切除率, 减少术后复发, 已逐渐成为直肠癌综合治疗的重要部分[1,2]. 但是, 临床上发现, 直肠癌患者术前放化疗的治疗效果个体差异较大, 其病理反应从肿瘤完全消失到无反应, 相差甚多. 哪些患者能从术前放化疗中获益? 能否从分子生物学水平在放化疗前筛选出方便、准确、快捷的预测指标, 避免无效、过度的治疗, 成为临床急需解决的问题.
辐射诱导细胞凋亡是放疗杀灭肿瘤的主要形式, 细胞凋亡有两条途径: 死亡受体介导途径(内源性通路)、线粒体依赖途径(外源性通路), 电离辐射引起的细胞凋亡主要是后者. 第二线粒体源的半胱天冬酶激活物(second mitochondria-derived activator of Caspase, Smac)[3,4], 第二个线粒体来源的胱氨酸酶激活剂, 是2000年由Du等[5]发现的一种从线粒体内释放到细胞质中的重要凋亡调节蛋白, 通过解除细胞凋亡抑制蛋白(inhibitor of apoptosis proteins, IAPs)家族的抑制作用, 增强半胱氨酸天冬氨酸蛋白酶9(cysteinyl asparate specific proteinase 9, Caspase9)及Caspase3的活性. Caspase是1996年由Alnemri等[6]统一命名的一类人源的白细胞介素1β转换酶/Ced同源性半胱氨酸蛋白酶, Caspase在组织中含量的改变直接调控着凋亡发生的整个动态过程, 决定着细胞凋亡的进展方向及细胞的最后归宿. Smac是细胞凋亡通路中重要的调控因子, 与肿瘤的发生、发展及辐射诱导细胞凋亡途径密切相关. Caspase9是线粒体依赖途径的启动分子, 启动线粒体依赖途径的细胞凋亡. 有研究[7]发现, 电离辐射诱导表达Smac的细胞对辐射诱导的细胞凋亡更为敏感. Smac模拟物可通过Caspases和肿瘤坏死因子-α(tumor necrosis factor α, TNF-α)调节细胞放疗敏感性[8]. 此外, Smac小分子类似物可拮抗凋亡抑制蛋白, 提高Caspase2、Caspase3、Caspase8和Caspase9活性, 显著增强辐射诱导的肿瘤细胞凋亡[9], 以上研究表明Smac和Caspase9可能与肿瘤细胞的放化疗敏感性存在密切关系, 但他们与直肠癌患者术前放化疗敏感性之间的关系尚不完全清楚.
本实验通过研究Smac及Caspase9在直肠腺癌组织中放化疗前后的表达, 探讨治疗前活检组织中Smac及Caspase9蛋白表达与放疗后组织病理反应程度的关系, 评价其对预测直肠腺癌术前放化疗敏感性的临床意义, 为直肠腺癌术前个体化治疗提供分子生物学依据.
标本来源: 昆明医科大学第一附属医院肿瘤放疗科2008-07/2013-06接受术前放化疗并行放化疗后手术的直肠腺癌患者43例. 其中男性33例(76.7%), 女性10例(23.3%); 年龄最小39岁, 最大72岁, 其中60岁以下(含60岁)患者20例(46.5%), 60岁以上患者23例(53.3%), 中位年龄63岁; 所有患者治疗前均经直肠肿物活检, 经病理证实为直肠腺癌; 肿瘤下极距肛缘≤10 cm; 治疗前未接受过直肠手术或放化疗; 术前分期采用盆腔计算机断层扫描(computed tomography, CT)和/或核磁共振成像(nuclear magnetic resonance imaging, MRI), 证实肿瘤穿透固有肌层达浆膜下层(T3)/肿瘤穿透脏层腹膜或侵及直肠周围组织与周围黏连固定(T4)/周围淋巴结转移(N+); 经胸片、骨扫描、腹盆B超或CT检查排除远处转移(M0). 生存随访至2013-12-31, 全部患者均被随访. 试剂: 鼠单克隆抗体Smac试剂盒(工作浓度1:200); 鼠单克隆抗体Caspase9试剂盒(工作浓度1:100), 试剂盒均购自美国Lifespan公司.
1.2.1 术前取材: 所有患者治疗前均于肠镜下或直接经肛门钳取直径约2 mm的肿瘤组织, 40 g/L甲醛固定24 h, 常规石蜡包埋、切片, 常规苏木精-伊红(HE)染色, 阅片证实为直肠腺癌或腺瘤癌变. 选取石蜡切片数片留存, 与手术后切除标本同时进行Smac及Caspase9免疫组织化学染色.
1.2.2 治疗方案: 所有患者均接受术前放化疗及手术治疗. 具体方案为所有确诊为直肠腺癌或腺瘤癌变患者完成治疗前评估后先行术前放疗: 采用直线加速器X线照射, 靶区包括直肠原发灶及区域淋巴引流. 采取二维等中心三野照射(后野:左侧野:右侧野 = 2:1:1)或三维调强照射, 放射总剂量为50.4 Gy(1.8 Gy×28次, 5次/wk). 放疗期间同步行XELOX方案化疗: 卡培他滨1600 mg/(m2•d) bid, d1-14, 口服, 第21天重复; 奥沙利铂130 mg/m2, 静脉滴注, d1, 第21天重复. 患者放化疗完成后4-6 wk行手术治疗, 手术切除标本制作石蜡切片数片. 所有患者手术均由接受过严格全直肠系膜切除术(totalmesorectalexcision, TME)技术培训的医师完成.
1.2.3 免疫组织化学检测: 将术前留存的石蜡切片, 与手术后切除标本制作的石蜡切片同时进行Smac及Caspase9免疫组织化学染色. 免疫组织化学染色操作(链霉卵白素-过氧化物酶连结法, S-P法)严格按试剂盒说明书进行. 二氨基联苯胺(DAB)显色, 苏木精复染, 抗原修复. 以已知阳性标本作为阳性对照, 磷酸盐缓冲液(PBS)代替一抗作为阴性对照.
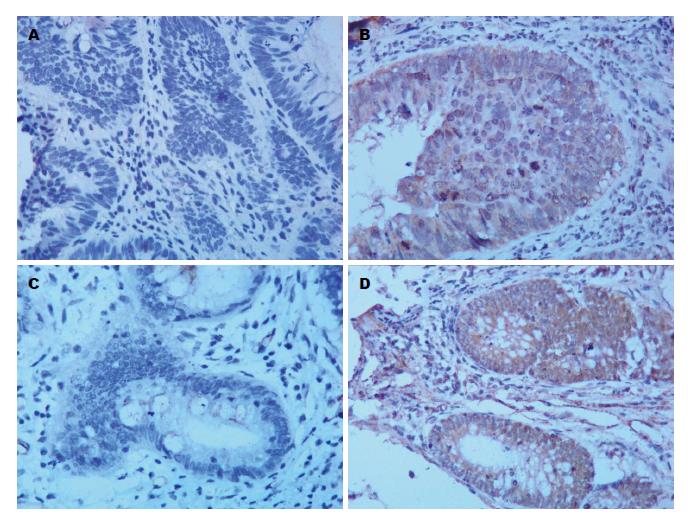
1.2.4 免疫组织化学结果判断: Smac及Caspase9蛋白均表达于细胞浆. 根据阳性细胞比例评分, 阳性细胞数: <5%为0分; ≥5%为1分; ≥25%为2分; ≥50%为3分; ≥75%为4分. 根据染色深度评分: 阴性: 无棕色颗粒(0分); 弱阳性: 散在浅µ或细小棕色颗粒(1分); 中等阳性: 可见大的棕黄颗粒(2分); 强阳性: 棕黄色颗粒较密集分布(3分). 将细胞染色比例和染色深度的乘积作为每例标本的最后得分: 0分为阴性(-); l-4分为弱阳性(+); 5-8分为中度阳性(++), >8分为强阳性(+++)[10,11].
1.2.5 放疗敏感性评价标准: 由有经验的病理科医师根据Wheeler等[12]的直肠癌消退分级(rectal cancer regression grade, RCRG)评价标准进行评价, RCRGl: 肿瘤放疗后反应好, 癌细胞被消灭或仅剩少量镜下癌灶; RCRG2: 明显的纤维化, 但仍有可见的肿瘤存在; RCRG3: 肿瘤放疗后反应差, 仍可见到大量的肿瘤而极少纤维化或无纤维化. RCRG1或RCRG2即认为放疗敏感(有效), RCRG3则认为放疗不敏感(无效).
统计学处理 采用SPSS17.0统计软件, 分别采用χ2检验, Fisher精确检验, Logistic多因素回归分析, Kaplan-Meier分析, Log-rank法等统计学方法对数据进行统计分析. P<0.05为差异有统计学意义.
43例患者患者中位年龄63岁, 60岁以下(含60岁)20例(46.5%), 60岁以上23例(53.3%), 具体临床及治疗特征如表1: 其中Smac和Caspase9蛋白阴性在原始数据中为(-), 阳性在原始数据中为(+)、(++)和(+++). 放化疗反应有效在原始数据中为G1和G2, 无效为G3. 结果显示: 放化疗前Smac蛋白阴性、阳性表达率分别为41.9%、58.1%, Caspase9阴性、阳性表达率分别为46.5%、53.5%; 放化疗后Smac和Caspase9蛋白阴性、阳性表达率均为86.0%、14.0%. 放化疗有效率达72.1%.
| 患者特征 | n | 放化疗反应 | χ2值 | P值 | |
| 有效(n = 31) | 无效(n = 12) | ||||
| 年龄(岁) | 0.9350 | 0.3336 | |||
| ≤60 | 20(46.5) | 13(41.9) | 7(58.3) | ||
| >60 | 23(53.5) | 18(58.1) | 5(41.7) | ||
| 放化疗前Smac | 2.9135 | 0.0878 | |||
| 阴性 | 18(41.9) | 10(32.3) | 8(66.7) | ||
| 阳性 | 25(58.1) | 21(67.7) | 4(33.3) | ||
| 放化疗前Caspase9 | 3.9578 | 0.0467 | |||
| 阴性 | 20(46.5) | 11(35.5) | 9(75.0) | ||
| 阳性 | 23(53.5) | 20(64.5) | 3(25.0) | ||
| 放化疗后Smac | |||||
| 阴性 | 37(86.0) | ||||
| 阳性 | 6(14.0) | ||||
| 放化疗后Caspase9 | |||||
| 阴性 | 37(86.0) | ||||
| 阳性 | 6(14.0) | ||||
以免疫组织化学染色阴性(染色得分0分)(图1A、C)或阳性(染色得分1-8分)(图1B、D)作为标准, 分析43例患者放化疗前、后直肠癌组织中Smac和Caspase9的表达的差异. 结果显示: 放化疗前Smac蛋白表达阴性18例, 阳性25例, 放化疗后Smac蛋白阴性、阳性表达分别为37例、6例(P = 1.0000); 放化疗前Caspase9蛋白表达阴性20例, 阳性23例, 放化疗后Caspase9蛋白阴性、阳性表达分别为37例、6例(P = 0.3929). 即以免疫组织化学染色阴性或阳性为标准分析时, Smac和Caspase9蛋白在放化疗前、后的表达无显著差异.
将Smac和Caspase9染色得分分为低表达(0-4分)和高表达(5-8分)分析放化疗前、后直肠癌组织中Smac和Caspase9表达的差异. 结果显示, Smac蛋白放化疗后(Z = -3.704, P<0.001)和Caspase9蛋白放化疗后(Z = -3.990, P<0.001)染色得分均显著降低 (表2).
| 放化疗前染色得分 | 放化疗后Smac蛋白染色得分 | 放化疗后Caspase9蛋白染色得分 | ||||
| 0-4 | 5-8 | 合计 | 0-4 | 5-8 | 合计 | |
| 0-4 | 27 | 2 | 29 | 18 | 3 | 21 |
| 5-8 | 14 | 0 | 14 | 22 | 0 | 22 |
| 合计 | 41 | 2 | 43 | 40 | 3 | 43 |
入组患者43例, 经术前放化疗后, 术后病理反应达G1(有效)者19例, G2(有效)者12例, G3(无效)者12例, 放化疗有效(G1, G2)31例, 有效率达72.1%. 其中, 放化疗后达到病理完全缓解13例, 病理完全缓解率30.2%(表1).
2.3.1 单因素分析各因素与放化疗反应的关系: 将年龄、放化疗前Smac、放化疗前Caspase9表达情况与手术后病理反应关系进行单因素分析(表1). 单因素分析显示, 放化疗有效组中放化疗前Caspase9蛋白阳性患者所占比例20/31(64.5%), 两组有显著差异(P<0.05); 放化疗有效组中放化疗前Smac蛋白阳性患者所占比例21/31(67.7%), 分析显示两组差异无统计学意义(P = 0.0878), 年龄与放化疗反应差异无统计学意义(P>0.05).
2.3.2 放化疗前Smac与Caspase9联合分组分析: 将两个蛋白均为阴性的患者分为A组, 有任一个蛋白为阳性的患者分为B组, 两个蛋白都是阳性的患者分为C组, 分析联合检测Smac和Caspase9与放化疗反应的相关性. A组放化疗有效7例、无效5例, B组放化疗有效、无效均为7例, C组放化疗有效17例, 无效0例. 因数据中出现0, 故P值采用Fisher精确检验. 分析结果显示, 3组总体有显著差异(P = 0.0002), A组和B组间放化疗反应有效的比值基本相同, 但C组放化疗反应有效的比值明显高于A组和B组, 说明在放化疗前Smac及Caspase9蛋白均为阳性的患者, 放化疗反应有效的可能性显著高于其他患者.
2.3.3 放化疗前Smac与Caspase9 Logistic回归分析: 进一步将放化疗前Smac、Caspase9两个因素纳入Logistic模型做多因素Logistic回归分析, 以明确放化疗前Smac和Caspase9蛋白是否为独立影响放化疗反应的因素. 结果显示, 在矫正了其他因素的影响后P>0.05, 说明Smac和Caspase9不是相互独立的影响放化疗反应的因素(表3).
| 变量 | B | S. E. | Wald | P值 | OR | 95%CI | |
| Lower | Upper | ||||||
| 术前Smac | -1.0576 | 0.7698 | 1.8878 | 0.1695 | 0.347 | 0.077 | 1.570 |
| 术前Caspase9 | -1.4034 | 0.7993 | 3.0824 | 0.0791 | 0.246 | 0.051 | 1.177 |
| Constant | 2.6652 | 1.4258 | 3.4940 | 0.0616 | |||
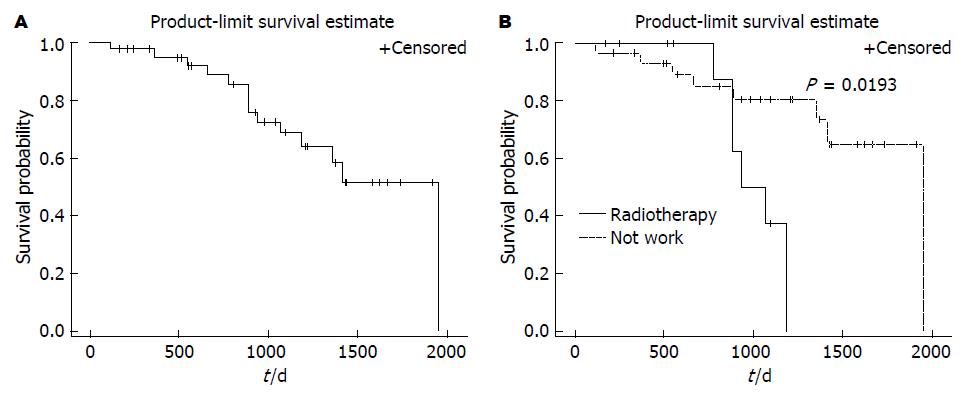
43例患者均随访至2013-12-31, 其中14例患者死亡. 全组患者中位生存期为1949.00 d(118.00-1949.00 d), 总生存曲线(Kaplan-Meier分析)(图2A); 放化疗反应对总生存的影响(图2B). 结果显示: 放化疗反应影响患者总生存, 放化疗有效的患者, 总生存明显延长(P = 0.0193).
对年龄、放化疗前后Smac、Caspase9蛋白表达及放化疗反应进行生存的单因素分析(表4). 单因素分析生存显示: 新辅助放化疗后, 肿瘤组织的反应与患者总生存相关(P = 0.0193). 放化疗反应有效组的中位生存时间约1949.00 d, 平均生存时间为1589.82 d; 放疗反应无效组的中位生存时间约1005.50 d, 平均生存时间为1012.50 d. 放化疗后组织反应有效与患者的总生存相关; 其他因素(年龄、放化疗前后Smac、Caspase9蛋白表达)与患者总生存无关(P>0.05).
| 影响因素 | n | mOS(d) | P值 |
| 年龄 | 0.6658 | ||
| ≤60 | 20 | 1418.0 | |
| >60 | 23 | 1949.0 | |
| 放化疗前Smac | 0.9418 | ||
| 阴性 | 18 | 1356.0 | |
| 阳性 | 25 | NA | |
| 放化疗前Caspase9 | 0.9881 | ||
| 阴性 | 20 | 1356.0 | |
| 阳性 | 23 | NA | |
| 放化疗后Smac | NA | ||
| 阴性 | 37 | NA | |
| 阳性 | 6 | NA | |
| 放化疗后Caspase9 | 0.5302 | ||
| 阴性 | 37 | 1418.0 | |
| 阳性 | 6 | NA | |
| 放疗反应 | 0.0193 | ||
| 有效 | 31 | 1949.0 | |
| 无效 | 12 | 1005.5 |
直肠癌术前放化疗能够使肿瘤缩小, 提高肿瘤切除率, 减少术后复发, 是直肠癌综合治疗的重要部分, 新辅助放化疗联合手术已成为局部进展期直肠癌的标准治疗方案[13,14]. 但是, 临床上发现, 直肠癌患者术前放化疗的治疗效果个体差异较大, 其病理反应从肿瘤完全消失到无反应(RCRGl-RCRG3)相差甚多, 各家报道不一, 大致各占1/3[15,16], 显然RCRG3在术前放化疗中无获益, 反而增加了治疗的不良反应. 因此, 寻找直肠癌术前放化疗敏感性生物学预测指标, 以期对病例进行筛选, 使直肠癌的治疗更具针对性, 避免无效或过度治疗, 显得尤其重要.
目前关于直肠癌术前放化疗敏感性的研究较少. Wu等[17]以病理完全缓解(pathological complete response, pCR)及T降期为研究终点, 对79例直肠癌患者的临床病理学特征进行分析发现, 术前放化疗使12.7%患者达到pCR, 癌胚抗原(carcinoembryonic antigen, CEA)<5 ng/mL病例58.7%获得T降期. Lin等[18]对47例T3-T4期直肠腺癌接受46 Gy/23 f并同步XELOX方案(卡培他滨1000 mg/m2, bid, d1-14, d22-35, 餐后半小时口服; 奥沙利铂130 mg/m2, 静脉滴注, d1, d22)化疗的患者进行分析, 治疗前CEA正常(CEA≤5 ng/mL)的患者中治疗后34.8%达到pCR. 窦雪[19]通过检测88例Ⅱ、Ⅲ期术前同步放化疗后行TME术的直肠癌患者治疗前血清CEA水平(pre-CEA)、治疗期间CEA的变化率(RRCEA)及程序性细胞死亡因子4(programmed cell death 4, PDCD4)的水平, 发现pre-CEA<2.81、RRCEA<52.8%和PDCD4表达水平高的患者有着更高的病理缓解率(P<0.05), 提示治疗前血清CEA、治疗期间的CEA变化、PDCD4表达水平可作为直肠癌放化疗敏感性的预测因子. 以上均提示血清CEA水平可作为术前放化疗应答的预测指标. Zlobec等[20]检测了59例拟行术前放疗直肠癌患者活检标本中血管内皮生长因子(vascular endothelial growth factor, VEGF)水平, 发现放疗后肿瘤完全消退的30例患者中约50%VEGF表达低于10%, 11例VEGF不表达者肿瘤完全消退. 该学者认为, 直肠癌组织缺氧致放疗抵抗, 同时缺氧刺激肿瘤新生血管生成, VEGF水平上调, VEGF水平可能是反映直肠癌组织放疗敏感性的重要指标. Giralt等[21,22]和Richter等[23]的研究则表明, 表皮生长因子受体(epidermal growth factor receptor, EGFR)表达与直肠癌术前放疗敏感性密切相关, EGFR高表达者放疗不敏感且预后也差. 徐昶等[24]检测45例新辅助放化疗前活检组织标本中低氧诱导因子-1α(hypoxia inducible factor-1α, HIF-1α)和COX-2蛋白的表达, 发现活检组织中HIF-1α低表达组有50.0%患者在放化疗后肿瘤消退达到mRCRG Ⅰ级, 高表达组仅有16.0%, 两者差异有统计学意义(P<0.05). 活检组织中HIF-1α低表达组在放化疗后T分期降期率为70.0%, 高表达组为32.0%, 两者相比差异有统计学意义(P<0.05), 提示直肠癌组织中HIF-1α表达水平可作为预测直肠癌新辅助放化疗的敏感性指标之一. Yan等[25,26]发现治疗前肿瘤组织中Smac、VEGF、Ki-67水平与新辅助治疗肿瘤组织反应相关(P = 0.011、0.010、0.034). 肿瘤组织中高表达Smac, 低表达Ki-67或VEGF者对新辅助治疗更敏感. 进一步扩大样本通过免疫组织化学方法检测Smac发现, 98例临床Ⅱ、Ⅲ期术前同步放化疗后行TME的直肠癌患者, 治疗前Smac高表达者对放化疗应答佳(P = 0.007), 并在放疗后降低(P = 0.016). 潘志忠等[27]对42例直肠癌用免疫组织化学方法检测手术前活检标本和手术后切除标本中Smac蛋白的表达水平, 发现Smac蛋白有望成为直肠癌术前放疗敏感性的预测因子. 本研究所选取病例的统计结果表明, 直肠癌术前放化疗后病理反应良好, 有效率达72.1%, 其中, 病理完全缓解率达30.2%. 该研究结论与国际上报道的直肠癌新辅助放化疗疗效较为接近(病理完全缓解率8%-29%)[28-30], 表明本研究所采用的放化疗方案是合理、有效的.
放化疗前Caspase9阳性的患者放化疗有效的比例显著增加, Smac表达的检测结果也出现了类似的趋势(统计学无意义可能与检测样本数量有关), 结合放化疗后Smac及Caspase9表达均显著降低的结果(可能是肿瘤细胞抵抗放化疗采取的保护机制), 表明Smac及Caspase9的高表达可能是直肠癌细胞对放化疗有效的重要指标. 当Smac及Caspase9均为阳性时, 放化疗有效的比例显著提高(P = 0.0002). 多因素Logistic回归分析结果表明, Smac及Caspase9并不是相互独立的影响放化疗反应的因素(P>0.05). 因此, 联合检测Smac及Caspase9比单独检测任一指标对于预测直肠癌放化疗的敏感性更可靠, 也是更为合理的方法.
对所统计病例的各影响因素与患者生存的相关性进行单因素分析, 结果显示, 放化疗反应结果与患者总生存相关, 放化疗有效组的生存时间较放化疗无效组明显延长(P = 0.0193). 该研究结论与国际权威杂志报道的研究[29,31]结果吻合: 直肠癌患者接受新辅助放化疗序贯手术治疗的预后与患者对放化疗的反应, 特别是病理完全缓解率密切相关. 这一结论提示, 只有对放化疗有效的直肠癌患者才能从新辅助治疗中获益, 因此, 在放化疗前评估患者对放化疗有效的可能性显得尤为重要. 如前已述, 放化疗前Smac和Caspase9均为阳性的患者对放化疗有效的可能性显著增加, 因此选择这类患者接受新辅助治疗有可能使他们的长期生存获益.
总之, 本研究所采用的放化疗方案合理、有效, 放化疗后的有效率和病理完全缓解率均接近国际权威杂志所报道的治疗效果. Smac及Caspase9的阳性表达是直肠癌患者对放化疗敏感的标志, 联合检测放化疗前直肠癌活检标本中Smac及Caspase9的表达情况可更好地预测直肠癌细胞对放化疗的敏感性. 在诸多因素中, 直肠癌患者对放化疗的敏感性是决定患者预后的重要因素, 联合检测活检组织中Smac及Caspase9的表达有可能筛选出对放化疗敏感的患者, 从而使其获得更好的预后.
直肠癌患者术前放化疗疗效的个体差异较大, 寻找有效的预测指标显得尤其重要. 第二线粒体源的半胱天冬酶激活物(second mitochondria-derived activator of Caspase, Smac)是细胞凋亡通路中重要的调控因子以及半胱氨酸天冬氨酸蛋白酶9(cysteinyl asparate specific proteinase 9, Caspase9)是线粒体依赖途径的启动分子, 启动线粒体依赖途径的细胞凋亡. Smac和Caspase9与直肠癌放化疗敏感性的关系尚不完全清楚.
郑建勇, 副教授, 副主任医师, 中国人民解放军第四军医大学西京消化病医院消化外科
直肠癌患者术前放化疗的反应从肿瘤完全消失到无反应, 相差甚多. 哪些患者能从术前放化疗中获益? 能否从分子生物学水平寻找到方便、准确的预测指标, 避免无效、过度的治疗, 成为临床急需解决的问题.
本研究中直肠癌术前放化疗的有效率和病理完全缓解均与国际上报道的数据接近(病理完全缓解率8%-29%). 本研究结果显示, 放化疗有效组的生存时间较放化疗无效组明显延长, 与国际权威杂志报道的研究结果吻合, 对联合检测放化疗前Smac和Caspase9在预测直肠癌术前放化疗敏感性的相关研究, 国内外少见报道.
目前关于直肠癌术前放化疗敏感性的研究较少, 有研究表明血清癌胚抗原水平、血管内皮生长因子水平、直肠癌组织中低氧诱导因子-1α表达水平等可能是反映直肠癌组织放疗敏感性的重要指标, 但均未进一步探讨其对总生存的影响. 本研究发现, 联合检测放化疗前直肠癌Smac及Caspase9的表达可较好地筛选出对放化疗敏感的患者, 从而使其获得更好的预后.
联合检测放化疗前直肠癌活检标本中Smac及Caspase9的表达情况可更好地预测直肠癌细胞对放化疗的敏感性, 有可能筛选出对放化疗敏感的患者, 从而使其获得更好的预后.
Smac: 是第二个线粒体来源的胱氨酸酶激活剂, 是2000年发现的一种从线粒体内释放到细胞质中的重要凋亡调节蛋白; Caspase: 是1996年由Alnemri等统一命名的一类人源的白细胞介素1β转换酶/Ced同源性半胱氨酸蛋白酶, Caspase9是线粒体依赖途径的启动分子, 启动线粒体依赖途径的细胞凋亡.
直肠癌患者术前放化疗的治疗效果个体差异较大, 寻找直肠癌术前放化疗敏感性生物学预测指标, 使直肠癌的治疗更具针对性显得尤其重要. 本文紧密结合临床实际, 拟寻找能预测直肠癌术前放化疗敏感性的生物学指标, 取得较好的结果, 具有一定的临床实用价值.
编辑: 郭鹏 电编: 都珍珍
| 1. | Glimelius B, Grönberg H, Järhult J, Wallgren A, Cavallin-Ståhl E. A systematic overview of radiation therapy effects in rectal cancer. Acta Oncol. 2003;42:476-492. [PubMed] |
| 2. | Suzuki T, Sadahiro S, Tanaka A, Okada K, Saito G, Kamijo A, Akiba T, Kawada S. Relationship between histologic response and the degree of tumor shrinkage after chemoradiotherapy in patients with locally advanced rectal cancer. J Surg Oncol. 2014;109:659-664. [PubMed] [DOI] |
| 3. | Hasenjäger A, Gillissen B, Müller A, Normand G, Hemmati PG, Schuler M, Dörken B, Daniel PT. Smac induces cytochrome c release and apoptosis independently from Bax/Bcl-x(L) in a strictly caspase-3-dependent manner in human carcinoma cells. Oncogene. 2004;23:4523-4535. [PubMed] [DOI] |
| 4. | Mizutani Y, Nakanishi H, Yamamoto K, Li YN, Matsubara H, Mikami K, Okihara K, Kawauchi A, Bonavida B, Miki T. Downregulation of Smac/DIABLO expression in renal cell carcinoma and its prognostic significance. J Clin Oncol. 2005;23:448-454. [PubMed] [DOI] |
| 5. | Du C, Fang M, Li Y, Li L, Wang X. Smac, a mitochondrial protein that promotes cytochrome c-dependent caspase activation by eliminating IAP inhibition. Cell. 2000;102:33-42. [PubMed] [DOI] |
| 6. | Alnemri ES, Livingston DJ, Nicholson DW, Salvesen G, Thornberry NA, Wong WW, Yuan J. Human ICE/CED-3 protease nomenclature. Cell. 1996;87:171. [PubMed] [DOI] |
| 7. | Li ZL, Liang S, Wang ZC, Li YB, Guo CX, Fang F, Gong SL, Lin CH. Expression of Smac induced by the Egr1 promoter enhances the radiosensitivity of breast cancer cells. Cancer Gene Ther. 2014;21:142-149. [PubMed] [DOI] |
| 8. | Matzinger O, Viertl D, Tsoutsou P, Kadi L, Rigotti S, Zanna C, Wiedemann N, Vozenin MC, Vuagniaux G, Bourhis J. The radiosensitizing activity of the SMAC-mimetic, Debio 1143, is TNFα-mediated in head and neck squamous cell carcinoma. Radiother Oncol. 2015; Jun 18. [Epub ahead of print]. [PubMed] [DOI] |
| 9. | Giagkousiklidis S, Vogler M, Westhoff MA, Kasperczyk H, Debatin KM, Fulda S. Sensitization for gamma-irradiation-induced apoptosis by second mitochondria-derived activator of caspase. Cancer Res. 2005;65:10502-10513. [PubMed] [DOI] |
| 10. | Lu CD, Altieri DC, Tanigawa N. Expression of a novel antiapoptosis gene, survivin, correlated with tumor cell apoptosis and p53 accumulation in gastric carcinomas. Cancer Res. 1998;58:1808-1812. [PubMed] |
| 11. | Sinicrope FA, Ruan SB, Cleary KR, Stephens LC, Lee JJ, Levin B. bcl-2 and p53 oncoprotein expression during colorectal tumorigenesis. Cancer Res. 1995;55:237-241. [PubMed] |
| 12. | Wheeler JM, Warren BF, Mortensen NJ, Ekanyaka N, Kulacoglu H, Jones AC, George BD, Kettlewell MG. Quantification of histologic regression of rectal cancer after irradiation: a proposal for a modified staging system. Dis Colon Rectum. 2002;45:1051-1056. [PubMed] |
| 13. | Sauer R, Becker H, Hohenberger W, Rödel C, Wittekind C, Fietkau R, Martus P, Tschmelitsch J, Hager E, Hess CF. Preoperative versus postoperative chemoradiotherapy for rectal cancer. N Engl J Med. 2004;351:1731-1740. [PubMed] [DOI] |
| 14. | AlSaeed EF, Tunio M, Zubaidi A, Al-Obaid O, Ahmed AK, Al-Omar OA, Abid EA, Alsiwat MJ. Five-year outcomes of preoperative chemoradiation for rectal carcinoma in Saudi population: single-institutional experience. Ann Saudi Med. 2015;35:23-30. [PubMed] [DOI] |
| 15. | Kelley ST, Coppola D, Yeatman T, Marcet J. Tumor response to neoadjuvant chemoradiation therapy for rectal adenocarcinoma is mediated by p53-dependent and caspase 8-dependent apoptotic pathways. Clin Colorectal Cancer. 2005;5:114-118. [PubMed] |
| 16. | Abdalla AA, Alawad AA, Ali HA. Pathologic response after neoadjuvant chemoradiotherapy in Sudanese patients with locally advanced rectal adenocarcinoma. Int J Med (Dubai). 2015;3:53-55. [PubMed] [DOI] |
| 17. | Wu WM, Qiu HZ, Wu B, Xiao Y, Lin GL, Zhou L. [Clinical pathologic factors predicting tumor response after preoperative neoadjuvant therapy for rectal cancer]. Zhonghua Waike Zazhi. 2010;48:348-352. [PubMed] |
| 18. | Lin JZ, Zeng ZF, Wu XJ, Wan DS, Chen G, Li LR, Lu ZH, Ding PR, Pan ZZ. Phase II study of pre-operative radiotherapy with capecitabine and oxaliplatin for rectal cancer and carcinoembryonic antigen as a predictor of pathological tumour response. J Int Med Res. 2010;38:645-654. [PubMed] [DOI] |
| 19. | 窦 雪. 肿瘤标记物与PDCD4预测直肠癌新辅助放化疗敏感性的临床研究. 济南: 济南大学 2014; . |
| 20. | Zlobec I, Steele R, Compton CC. VEGF as a predictive marker of rectal tumor response to preoperative radiotherapy. Cancer. 2005;104:2517-2521. [PubMed] [DOI] |
| 21. | Giralt J, Eraso A, Armengol M, Rosselló J, Majó J, Ares C, Espin E, Benavente S, de Torres I. Epidermal growth factor receptor is a predictor of tumor response in locally advanced rectal cancer patients treated with preoperative radiotherapy. Int J Radiat Oncol Biol Phys. 2002;54:1460-1465. [PubMed] [DOI] |
| 22. | Giralt J, de las Heras M, Cerezo L, Eraso A, Hermosilla E, Velez D, Lujan J, Espin E, Rosello J, Majó J. The expression of epidermal growth factor receptor results in a worse prognosis for patients with rectal cancer treated with preoperative radiotherapy: a multicenter, retrospective analysis. Radiother Oncol. 2005;74:101-108. [PubMed] |
| 23. | Richter I, Dvořák J, Urbanec M, Bluml A, Čermáková E, Bartoš J, Petera J. The prognostic significance of tumor epidermal growth factor receptor (EGFR) expression change after neoadjuvant chemoradiation in patients with rectal adenocarcinoma. Contemp Oncol (Pozn). 2015;19:48-53. [PubMed] [DOI] |
| 25. | Yan H, Wang R, Yu J, Jiang S, Zhu K, Mu D, Xu Z. Predictive value of Smac, VEGF and Ki-67 in rectal cancer treated with neoadjuvant therapy. Oncol Lett. 2010;1:641-647. [PubMed] |
| 26. | Yan H, Yu J, Wang R, Jiang S, Zhu K, Mu D, Xu Z. Prognostic value of Smac expression in rectal cancer patients treated with neoadjuvant therapy. Med Oncol. 2012;29:168-173. [PubMed] [DOI] |
| 28. | Wasmuth HH, Rekstad LC, Tranø G. The outcome and the frequency of pathological complete response after neoadjuvant radiotherapy in curative resections for advanced rectal cancer: a population-based study. Colorectal Dis. 2015; Jul 22. [Epub ahead of print]. [PubMed] [DOI] |
| 29. | Kim NK, Baik SH, Seong JS, Kim H, Roh JK, Lee KY, Sohn SK, Cho CH. Oncologic outcomes after neoadjuvant chemoradiation followed by curative resection with tumor-specific mesorectal excision for fixed locally advanced rectal cancer: Impact of postirradiated pathologic downstaging on local recurrence and survival. Ann Surg. 2006;244:1024-1030. [PubMed] [DOI] |
| 31. | Valentini V, Coco C, Picciocchi A, Morganti AG, Trodella L, Ciabattoni A, Cellini F, Barbaro B, Cogliandolo S, Nuzzo G. Does downstaging predict improved outcome after preoperative chemoradiation for extraperitoneal locally advanced rectal cancer? A long-term analysis of 165 patients. Int J Radiat Oncol Biol Phys. 2002;53:664-674. [PubMed] [DOI] |