修回日期: 2015-07-14
接受日期: 2015-07-24
在线出版日期: 2015-08-28
目的: 评估比较窄带成像技术联合放大内镜(narrow band imaging-magnifying endoscopy, NBI-ME)、内镜病理活检在早期胃癌诊断中的价值.
方法: 首先在普通白光下系统观察, 发现可疑病变(胃黏膜形态或颜色改变)后行NBI-ME观察, 采集照片并做出内镜下诊断, 于病灶最明显处取活检并行病理检查. 所有患者均行内镜下切除或外科手术治疗, 术后行病理活检. 分别计算NBI-ME、内镜活检诊断早期胃癌的敏感度、特异度、阳性预测值、阴性预测值、准确率. 比较内镜活检与术后切除病理的一致性, 并计算Kappa值.
结果: 123例纳入本研究, 最终术后切除病理示胃炎51例, 低级别上皮内瘤变(low-grade neoplasia, LGIN)24例, 早期胃癌48例. NBI-ME诊断早期胃癌的敏感度、特异度、阳性预测值、阴性预测值、准确率分别为97.9%、80.0%、75.8%、98.4%、87.0%, 内镜活检的对应值分别为66.7%、94.7%、88.9%、81.6%、83.7%. NBI-ME诊断早期胃癌的敏感度明显高于内镜活检(P<0.005), 特异度低于内镜活检(P<0.005), 两者准确率无明显差异(P>0.05). 内镜下活检病理与术后切除病理Kappa值为0.642(P<0.05).
结论: NBI-ME对早期胃癌诊断价值较高, 对于NBI-ME下符合早期胃癌诊断的患者建议行内镜或手术进一步治疗.
核心提示: 窄带成像技术是近年来发展起来的新型内镜技术, 联合放大内镜可以增强胃黏膜表层的对比性, 使黏膜表面的细微结构更加清晰可辨, 提高早期胃癌的诊断水平. 在临床实践中, 对窄带成像技术联合放大内镜下符合早期胃癌诊断标准的患者行进一步治疗, 具有重要意义.
引文著录: 郑洪伟, 薛会光, 杨爱华, 刘华, 鞠辉, 刘希双. 窄带成像技术联合放大内镜与胃镜活检诊断早期胃癌的价值比较. 世界华人消化杂志 2015; 23(24): 3917-3922
Revised: July 14, 2015
Accepted: July 24, 2015
Published online: August 28, 2015
AIM: To evaluate the diagnostic performance of narrow-band imaging combined with magnifying endoscopy (NBI-ME) for early gastric cancer by comparing with gastric biopsy.
METHODS: Patients with suspicious early gastric lesions (including abnormal mucosal morphology and abnormal mucosal color) as revealed by white light endoscopy (WLE) were enrolled in the study. These suspicious lesions were examined by NBI-ME to give a diagnosis. Biopsy specimens were then taken from suspicious lesions for pathological examination. All patients received endoscopic resection or surgical intervention. The diagnostic performance of the two modalities was compared.
RESULTS: A total of 123 patients were enrolled, including 76 men and 47 women. The final pathology showed 51 cases of gastritis, 24 cases of low grade intraepithelial neoplasia, and 48 cases of early gastric cancer. The sensitivity, specificity, positive predictive value, negative predictive value and accuracy of NBI-ME for diagnosing early gastric cancer were 97.9%, 80.0%, 75.8%, 98.4%, and 87.0%, respectively; the corresponding percentages for endoscopic biopsy were 66.7%, 94.7%, 88.9%, 81.6%, and 83.7%, respectively. The sensitivity of NBI-ME was significantly better than that of endoscopic biopsy (P < 0.005), but specificity was lower than that of endoscopic biopsy (P < 0.005). There was no statistical difference in diagnostic accuracy between the two modalities. The Kappa value for the two modalities was 0.642 (P < 0.05).
CONCLUSION: NBI-ME can improve the diagnosis of early gastric cancer. When early gastric cancer is diagnosed by NBI-ME, further intervention treatment is required.
- Citation: Zheng HW, Xue HG, Yang AH, Liu H, Ju H, Liu XS. Comparison between narrow-band imaging combined with magnifying endoscopy and gastric biopsy for diagnosis of early gastric cancer. Shijie Huaren Xiaohua Zazhi 2015; 23(24): 3917-3922
- URL: https://www.wjgnet.com/1009-3079/full/v23/i24/3917.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i24.3917
胃癌在世界范围内是第四大最常见的恶性肿瘤, 病死率第二的恶性肿瘤[1]. 早期胃癌预后良好, 5年生存率超过90%; 而晚期胃癌预后较差, 5年生存率仅为10%-20%[2]. 因此提高早期胃癌的诊断水平, 将明显减少胃癌的病死率及改善患者的生存质量. 目前普通胃镜联合活检在胃癌的诊断过程中仍具有重要地位, 内镜活检结果往往决定着患者治疗方案的选择. 但内镜活检局限, 取材浅而少, 能多大程度反应病灶整体情况尚无定论. 已经有研究[3-5]报道, 内镜活检与术后切除病理存在一定的差异. 窄带成像技术(narrow band imaging, NBI)是近年来发展起来的内镜技术[6], 联合放大内镜(magnifying endoscopy, ME)可以更清晰的显示黏膜表面的微细结构. 本研究旨在比较内镜活检与NBI-ME在早期胃癌诊断中的价值, 探讨如何更好提高早期胃癌的诊断水平.
前瞻性收集2013-06/2015-01在青岛大学附属医院消化内镜中心行胃镜检查的患者. 将普通光镜下黏膜形态改变(隆起、平坦、凹陷)或颜色改变(发红、发白、黏膜反光增强)、自发性出血等浅表性病变纳入本研究. 排除以下情况: 患者已确诊胃癌, 进展期胃癌, 胃术后; 存在心肺等严重系统疾病, 不能耐受胃镜检查; 存在精神疾病不能合作者; 拒绝接受进一步治疗者. 本研究通过青岛大学附属医院伦理委员会审批, 入选患者均签署知情同意书. 本研究采用日本Olympus公司GIF-H260Z放大胃镜, 主机采用EVIS260系统. 二甲硅油(自贡鸿鹤制药), 盐酸利多卡因胶浆(济川药业), 山莨菪碱(杭州民生药业).
1.2.1 操作: 所有患者胃镜检查当天均空腹, 术前20 min口服二甲硅油20 mL, 术前10 min口服盐酸利多卡因胶浆10 mL, 山莨菪碱10 mg肌注解痉. 患者首先在普通白光下仔细观察, 发现可疑病灶(颜色或形态改变)后, 行NBI联合放大观察并做出内镜下诊断, 最后于病灶最明显处行标准活检2块. 对于NBI-ME及内镜活检考虑早期胃癌的患者, 行全腹计算机断层扫描(computed tomography, CT)、超声内镜检查, 明确肿瘤浸润及转移情况, 综合评估病情, 并向患者告知后决定内镜切除或手术切除, 术后行病理检查.
1.2.2 内镜下分型及诊断标准: 依据巴黎分型[7], 将早期胃癌分为三型, 即隆起型(Ⅰ型)、浅表型(Ⅱ型)及凹陷型(Ⅲ型). 其中浅表型(Ⅱ型)又可分为浅表隆起型(Ⅱa)、浅表平坦型(Ⅱb)及浅表凹陷型(Ⅱc). 实际临床中又分为混合型(如Ⅱa+Ⅱc、Ⅱc+Ⅲ等). 而在临床实践中, 白光下系统详细的观察, 隆起型及凹陷型早期胃癌不难发现, 但浅表型早期胃癌往往由于其类似胃炎改变, 仍然难以发现[8]. 本研究我们主要选取浅表型(Ⅱ型)及其复合型病灶.
本研究NBI-ME诊断早期胃癌标准, 采用Yao[9]提出的"VS分类系统", 即(1)不规则的表面微结构(irregular microsurface pattern, IMSP)和明显的分界线(demarcation line, DL); (2)不规则的微血管(irregular microvascular pattern, IMVP)和明显DL. 符合任意一条即可诊断为早期胃癌, 反之为非癌性病变.
1.2.3 病理诊断: 内镜发现的可疑病灶, 在NBI-ME指导下行标准活检2块, 将标本放在40 g/L甲醛溶液中保存, 然后送往病理科. 将内镜切除及外科术后的整块组织送往病理科行病理检查. 病理检查由青岛大学附属医院同一位高资历病理医师完成.病理诊断参照修正的维也纳分类方法[10], 将高级别上皮内瘤变(high-grade neoplasia, HGIN)、非浸润性癌、可疑浸润癌、黏膜内癌等诊断为早期胃癌; 将胃炎、低级别上皮内瘤变等诊断为非癌性病变.
统计学处理 采用SPSS 20.0软件包进行数据的管理及统计分析, 分别计算NBI-ME、内镜活检诊断早期胃癌的准确率、敏感度、特异度、阳性预测值、阴性预测值, 率的比较采用卡方检验, 一致性检验采用Kappa分析, 当P<0.05时, 差异有统计学有意义.
本研究最终纳入123例, 其中男性76例, 女性47例, 年龄39-79岁, 平均年龄59.9岁±9.1岁. 其中上腹隐痛68例, 腹胀19例, 反酸烧心13例, 上腹不适10例, 无明显不适8例, 其他5例. 经内镜黏膜下层剥离术(endoscopic submucosal dissection, ESD)66例, 内镜下黏膜剥离切除术(endoscopic mucosal resection, EMR)49例, 行外科手术8例, 所有患者手术顺利, 未出现严重的并发症及死亡病例. 术后病理示早期胃癌48例, LGIN 24例, 胃炎51例, 所有胃癌病例均局限在黏膜内, 未出现淋巴结转移及脉管侵犯(表1).
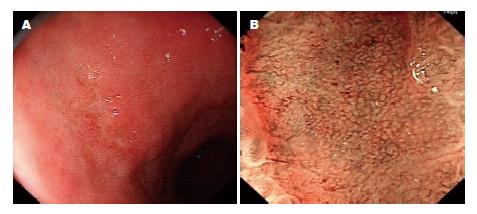
最终术后病理分化型胃癌24例, 未分化型胃癌6例, HGIN 18例, LGIN 24例, 胃炎51例. 以术后病理为诊断早期胃癌的金标准, 分别计算NBI-ME、内镜活检诊断早期胃癌(图1)的敏感度、特异度、阳性预测值、阴性预测值及准确率(表2). NBI-ME与内镜活检相比, 敏感度较好(P<0.005), 特异度较差(P<0.005), 两者准确率无统计学意义(P>0.05).
| 观察方法 | 敏感度 | 特异度 | 阳性预测值 | 阴性预测值 | 准确率 |
| NBI-ME | 97.9(47/48) | 80.0(60/75) | 75.8(47/62) | 98.4(60/61) | 87.0(107/123) |
| 内镜活检 | 66.7(32/48) | 94.7(71/75) | 88.9(32/36) | 81.6(71/87) | 83.7(103/123) |
内镜下活检结果: 未分化胃癌3例, 分化型胃癌13例, HGIN 20例, LGIN 37例, 胃炎50例. 内镜活检与术后病理比较(表3). 内镜活检与术后病理不一致率为26.0%(32/123). 内镜活检与术后病理Kappa值为0.642, P<0.05, 符合程度一般.
| 内镜活检 | 术后最终病理 | 总计 | ||||
| 胃炎 | LGIN | HGIN | 分化型胃癌 | 未分化型胃癌 | ||
| 胃炎 | 50 | 0 | 0 | 0 | 0 | 50 |
| LGIN | 1 | 20 | 11 | 5 | 0 | 37 |
| HGIN | 0 | 4 | 7 | 8 | 1 | 20 |
| 分化型胃癌 | 0 | 0 | 0 | 11 | 2 | 13 |
| 未分化型胃癌 | 0 | 0 | 0 | 0 | 3 | 3 |
| 总计 | 51 | 24 | 18 | 24 | 6 | 123 |
我国是胃癌高发国家, 每年新增病例约40万例, 占世界总发病例数的42%, 至2005年胃癌成为我国癌症发病率和死亡率首位的恶性肿瘤[11]. 胃癌早期症状不典型, 发现大部分已进入中晚期, 预后差. 而早期胃癌经内镜或手术治疗后, 预后良好. 因此, 对于早期胃癌的早发现、早治疗, 是降低胃癌病死率及提高患者生存质量的有效途径. 而目前普通胃镜检查并取活检仍是诊断胃癌的主要方法, 活检病理结果直接影响到临床诊疗方案的选择. 但局灶性内镜活检能在多大程度上反应整体病灶的情况尚无定论.
NBI是近年来发展起来的新型内镜技术, 联合ME更有利于观察胃黏膜细微结构. 本研究中我们比较了NBI-ME与内镜活检对早期胃癌的诊断能力, 活检病理与术后病理的一致性情况. NBI-ME发现早期胃癌62例, 术后证实早期胃癌47例, LGIN 13例, 胃炎2例, 1例早期胃癌漏诊. NBI-ME的特异度、阳性预测值、准确率都不是很理想, 但敏感度、阴性预测值较好. 据文献[12]报道NBI-ME诊断早期胃癌的敏感度、特异度、阳性预测值、阴性预测值、准确率分别为73.7%、99.2%、93.3%、96.3%、96.0%, 本研究准确率低于文献报道水平. 可能原因为早期胃癌的诊断水平往往与检查者的操作水平及对早期胃癌的经验认识水平有关; 另外本研究选择病例均为浅表型早期胃癌, 诊断本身存在难度. 本研究中NBI-ME将13例LGIN诊断为早期胃癌, 这是导致我们特异度、阳性预测值、准确率下降的原因. 有报道[13]43%的LGIN存在不规则微血管, 34%的存在不规则的表面微结构, 23%存在明确的分界线. 因此, NBI-ME下LGIN与早期胃癌的鉴别仍然比较困难.
同时我们比较了内镜活检与术后切除病理, 结果术前活检共诊断早期胃癌36例, 术后证实32例为早期胃癌, 3例LGIN, 1例胃炎, 16例早期胃癌漏诊, 内镜活检与术后病理不一致率为26.0%(32/123). 两者检验的Kappa值为0.642, 一致性一般. 而Lee等[14]研究表明内镜活检与内镜切除病理的不一致率为44.5%, 与胃癌组(高分化、中分化、低分化、印戒)相比上皮内瘤变组(高级别上皮内瘤变与低级别上皮内瘤变)的不一致率更高. 而本研究术前术后符合率高于文献水平, 考虑原因除了纳入样本量存在差异外, 我们采用NBI指导下靶向活检, 靶向活检较白光下盲目而随机的活检准确率更高. 分析术前术后病理差异原因, 我们认为有以下原因: 活检取材浅而少; 病变局限, 活检时位置出现偏离; 病理医师认识差异, 我国诊断早期胃癌较保守; 内镜电凝切除致病变组织难以辨认.
通过对比内镜活检与NBI-ME, 我们发现内镜活检诊断的早期胃癌, NBI-ME下仅1例诊断为非癌性病变, 而活检漏诊的16例早期胃癌患者, 在NBI-ME下均符合早期胃癌诊断, NBI-ME诊断早期胃癌的敏感度明显高于内镜活检(P<0.005). 但本研究中NBI-ME将13例LGIN诊断为早期胃癌, 以至于特异度低于内镜活检(P<0.005), 两者的准确率没有明显差异(P>0.05). 尽管新修正的维也纳分类标准[10]对于LGIN的处理建议是随访或内镜切除, 但许多学者强烈推荐LGIN行内镜下切除治疗[15,16]. 而我国诊断早期胃癌相对保守, LGIN失访率较高, 我们建议LGIN行内镜治疗. 鉴于内镜活检与切除病理的差异, NBI-ME具有较高的敏感度及阴性预测值, 胃癌发展的隐匿性, 中晚期胃癌预后差, 在临床实践过程中, 若内镜活检诊断为非癌性病变, 而NBI-ME下符合胃癌诊断, 我们建议给予内镜治疗或手术治疗, 以期达到明确诊断及治疗的目的; 若两者均阴性, 建议随访观察.
本研究也存在一些问题, 首先本研究为单中心研究, 纳入样本量相对较少, 尚需要多中心大样本随机试验验证; 其次NBI-ME下表面微血管及表面微结构的判断主观性较强, 更客观的诊断标准需要进一步研究.
总之, NBI-ME对早期胃癌诊断价值较高, 对于NBI-ME诊断为早期胃癌的患者无论活检结果如何, 建议行进一步治疗, 以达到明确诊断及治疗的目的.
我国是胃癌的高发国家, 而目前普通胃镜联合活检是诊断早期胃癌的主要方法, 但内镜活检多大程度反映病灶的整体情况尚存在争议, 窄带成像技术(narrow band imaging, NBI)是近年来发展起来的内镜增强技术, 联合放大内镜(magnifying endoscopy, ME)可提高早期胃癌的诊断水平.
李兆申, 教授, 主任医师, 博士生导师, 上海长海医院消化科; 张庆瑜, 教授, 主任医师, 天津医科大学总医院科研处
NBI由日本开发,目前广泛应用于临床. 基于NBI的"VS分类系统"是目前诊断早期胃癌的重要理论, 可提高早期胃癌的诊断水平, 但主观性仍较强. 而目前主流的内镜活检与术后病理存在差异, 两者价值比较需进一步研究.
有研究表明普通胃镜联合活检具有一定的局限性及盲目性, 与术后最终病理存在一定的差异, 内镜活检多大程度反映病灶的整体情况尚无定论. NBI-ME可以更清晰的显示胃黏膜的细微结构, 可明显的提高早期胃癌的诊断水平.
内镜活检是目前诊断早期胃癌的主要方法, 但内镜活检与术后病理存在一定差异, 本研究以术后最终病理为金标准, 评估比较NBI-ME与胃镜活检对早期胃癌的诊断价值.
NBI-ME可以提高早期胃癌的诊断水平, 鉴于早期胃癌发展的隐匿性及严重性, 对符合NBI-ME早期胃癌诊断标准的患者, 无论内镜活检结果如何, 行进一步治疗, 具有重要的临床意义.
本文对NBI-ME、内镜病理活检在早期胃癌诊断中价值进行比较, 抓住了学科前沿. 结果表明NBI-ME对早期胃癌诊断价值较高, 对于NBI-ME下符合早期胃癌诊断的患者建议行内镜或手术进一步治疗, 防止胃癌的进一步发展. 该研究对早期胃癌的诊断有很重要的价值, 在临床中值得推广.
编辑: 郭鹏 电编:闫晋利
| 1. | Ferlay J, Shin HR, Bray F, Forman D, Mathers C, Parkin DM. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008. Int J Cancer. 2010;127:2893-2917. [PubMed] [DOI] |
| 2. | Borie F, Rigau V, Fingerhut A, Millat B. Prognostic factors for early gastric cancer in France: Cox regression analysis of 332 cases. World J Surg. 2004;28:686-691. [PubMed] [DOI] |
| 3. | Takao M, Kakushima N, Takizawa K, Tanaka M, Yamaguchi Y, Matsubayashi H, Kusafuka K, Ono H. Discrepancies in histologic diagnoses of early gastric cancer between biopsy and endoscopic mucosal resection specimens. Gastric Cancer. 2012;15:91-96. [PubMed] [DOI] |
| 4. | Choi CW, Kang DH, Kim HW, Park SB, Kim S, Cho M. Endoscopic submucosal dissection as a treatment for gastric adenomatous polyps: predictive factors for early gastric cancer. Scand J Gastroenterol. 2012;47:1218-1225. [PubMed] [DOI] |
| 5. | Kato M, Nishida T, Tsutsui S, Komori M, Michida T, Yamamoto K, Kawai N, Kitamura S, Zushi S, Nishihara A. Endoscopic submucosal dissection as a treatment for gastric noninvasive neoplasia: a multicenter study by Osaka University ESD Study Group. J Gastroenterol. 2011;46:325-331. [PubMed] [DOI] |
| 6. | Gono K, Obi T, Yamaguchi M, Ohyama N, Machida H, Sano Y, Yoshida S, Hamamoto Y, Endo T. Appearance of enhanced tissue features in narrow-band endoscopic imaging. J Biomed Opt. 2004;9:568-577. [PubMed] [DOI] |
| 7. | The Paris endoscopic classification of superficial neoplastic lesions: esophagus, stomach, and colon: November 30 to December 1, 2002. Gastrointest Endosc. 2003;58:S3-S43. [PubMed] |
| 8. | Uedo N, Yao K, Ishihara R. Screening and treating intermediate lesions to prevent gastric cancer. Gastroenterol Clin North Am. 2013;42:317-335. [PubMed] [DOI] |
| 9. | Yao K. How is the vs (vessel plus surface) classification system applicable to magnifying narrow-band imaging examinations of gastric neoplasias initially diagnosed as low-grade adenomas? Gastric Cancer. 2012;15:118-120. [PubMed] [DOI] |
| 10. | Dixon MF. Gastrointestinal epithelial neoplasia: Vienna revisited. Gut. 2002;51:130-131. [PubMed] [DOI] |
| 12. | 郭 涛, 陆 星华, 周 炜洵, 杨 爱明, 姚 方, 吴 晰, 李 玥, 王 莉英, 钱 家鸣. 放大胃镜结合窄带成像技术在早期胃癌诊断中的应用价值研究. 中华消化内镜杂志. 2011;28:375-379. |
| 13. | Tao G, Xing-Hua L, Ai-Ming Y, Wei-Xun Z, Fang Y, Xi W, Li-Yin W, Chong-Mei L, Gui-Jun F, Hui-Jun S. Enhanced magnifying endoscopy for differential diagnosis of superficial gastric lesions identified with white-light endoscopy. Gastric Cancer. 2014;17:122-129. [PubMed] [DOI] |
| 14. | Lee CK, Chung IK, Lee SH, Kim SP, Lee SH, Lee TH, Kim HS, Park SH, Kim SJ, Lee JH. Is endoscopic forceps biopsy enough for a definitive diagnosis of gastric epithelial neoplasia? J Gastroenterol Hepatol. 2010;25:1507-1513. [PubMed] [DOI] |
| 15. | Rugge M, Cassaro M, Di Mario F, Leo G, Leandro G, Russo VM, Pennelli G, Farinati F. The long term outcome of gastric non-invasive neoplasia. Gut. 2003;52:1111-1116. [PubMed] [DOI] |
| 16. | Park SY, Jeon SW, Jung MK, Cho CM, Tak WY, Kweon YO, Kim SK, Choi YH. Long-term follow-up study of gastric intraepithelial neoplasias: progression from low-grade dysplasia to invasive carcinoma. Eur J Gastroenterol Hepatol. 2008;20:966-970. [PubMed] [DOI] |