修回日期: 2015-07-13
接受日期: 2015-07-30
在线出版日期: 2015-08-28
目的: 通过慢病毒载体介导的RNA干扰技术过表达和干扰肠上皮细胞热休克转录因子2(heat shock transcription factor 2, HSF2)表达, 研究不同HSF2水平对肠上皮细胞凋亡和迁移的影响.
方法: (1)选取HT-29(人结肠癌细胞株)作为研究材料, 丁酸钠(设置不同时间点/浓度)诱导细胞凋亡, MTT法检测细胞增殖活性, 流式细胞仪检测细胞凋亡、周期. 按实验结果选取最佳丁酸钠浓度及时间位点; (2)慢病毒载体介导的RNA干扰技术过表达和干扰结肠上皮细胞HSF2表达; 用倒置荧光显微镜、Western blot法检测目的基因在细胞中的转染效率; (3)细胞迁移实验(划痕法/Transwell小室)检测过表达和干扰HSF2后细胞迁移能力的改变; (4)经过表达和干扰HSF2后的细胞, 给予丁酸钠诱导凋亡, MTT法检测细胞增殖活性, 流式细胞仪检测细胞凋亡率、细胞周期.
结果: (1)MTT实验结果显示: 阴性对照组(NC组)的HT-29细胞增殖活性在实验观察期间(0-96 h)不断升高, 48 h后, 实验组的细胞对4个丁酸钠浓度组均表现出明显的生长抑制, 相对于NC组之间差异具有统计学意义(P<0.01), 故丁酸钠对HT-29细胞的生长抑制作用呈浓度、时间依赖性. 流式细胞仪检测细胞凋亡率结果显示: NC组有少量凋亡, 总凋亡率为0.548%±0.113%, 而实验组经4个不同浓度丁酸钠处理48 h后, 总凋亡率分别为51.588%±5.110%、77.732%±2.746%、90.115%±1.438%、94.247%±1.243%, 与NC组之间差异具有统计学意义(P<0.01). 而当丁酸钠浓度>2.5 mmol/L, 凋亡率较1.25 mmol/L明显上升. 细胞周期检测结果显示: 与NC相比, 1.25 mmol/L丁酸钠处理HT-29细胞48 h, G0/G1期HT-29细胞未显示出明显差异(P = 1.00>0.05), 即无明显细胞周期阻滞; 而2.5、5.0、10 mmol/L以上浓度在各观察点均出现明显的细胞周期阻滞现象, 呈明显的G1/G0期阻滞(P<0.01); (2)慢病毒载体转染效果检测: 通过倒置荧光显微镜(×100)观察可发现, 各组HT-29细胞经慢病毒载体转染后均有GFP表达, 转染率达80%以上. 用Western blot法检测结果显示: 慢病毒构建载体能够在细胞中高效、稳定地过表达和干扰目的基因; (3)MTT法检测转染过表达和siRNA的HSF2细胞在丁酸钠诱导凋亡环境下活性变化, 结果显示: 过表达组细胞活性高于过表达对照组(P<0.05), 干扰组的细胞活性低于干扰对照组, 差异具有统计学意义(P<0.05); (4)细胞迁移实验发现: 过表达组的细胞迁移能力较NC组明显增加, 而干扰组则明显降低(P<0.05); (5)过表达和干扰HSF2后丁酸钠诱导凋亡环境下细胞周期的影响: NC组以及使用慢病毒载体处理的5组之间, 各时间点细胞周期分布差异均无统计学意义(P>0.05); (6)过表达和干扰HSF2后丁酸钠诱导凋亡环境下细胞凋亡率的变化: 过表达组总凋亡率低于过表达对照组(P<0.05); 干扰组总凋亡率高于干扰对照组(P<0.05).
结论: 细胞发生凋亡时, HSF2可能对肠上皮细胞起保护作用, 提示HSF2可能通过调控细胞周期来实现对细胞增殖的影响, 但也可能还有其他途径; HSF2可能在凋亡损伤时对肠上皮细胞起修复作用.
核心提示: 通过慢病毒载体介导的RNA干扰技术过表达和沉默肠上皮细胞热休克转录因子2(heat shock transcription factor 2, HSF2)表达, 研究其对肠上皮细胞凋亡和迁移的影响, 发现细胞发生凋亡时, HSF2可能对肠上皮细胞起保护作用以及修复作用; HSF2可能通过调控细胞周期来实现对细胞增殖的影响.
引文著录: 杨刚, 牛俊坤, 李小玉, 张峰睿, 缪应雷. 干扰和过表达热休克转录因子2对肠上皮细胞凋亡和迁移的影响. 世界华人消化杂志 2015; 23(24): 3846-3859
Revised: July 13, 2015
Accepted: July 30, 2015
Published online: August 28, 2015
AIM: To explore the role of heat shock transcription factor 2 (HSF2) in cell apoptosis and migration in human colonic epithelial cell line HT-29 by means of interference and overexpression.
METHODS: Apoptosis of HT-29 cells was induced by incubation with sodium butyrate (SB) for different durations. Cytotoxicity was estimated by MTT assay, and the cell cycle and apoptosis were observed by flow cytometry to choose the optimal time and concentration of SB. HT-29 cells were then transfected with HSF2 siRNA or a lentiviral vector (Ubi-MCS-3FLAG-SV40-EGFP). The overexpression or knockdown of HSF2 was detected by Leica DMIRB and Western blot. After transfection, cell migration ability was measured by wound healing assay and Transwell assay. Apoptosis of HT-29 cells was induced with SB after transfection, cell proliferation was studied by MTT assay, and cell cycle and apoptosis were observed by flow cytometry.
RESULTS: Compared with the negative control (NC) group, SB at 2.5, 5.0, or 10 mmol/L could significantly cause growth inhibition after 48 h of incubation (P < 0.01), and the effect was time- and dose-dependent. The apoptosis rate was significantly higher in the SB treated groups (1.25, 2.5, 5.0, or 10 mmol/L for 48 h) than in the NC group (51.588% ± 5.110%, 77.732% ± 2.746%, 90.115% ± 1.438%, 94.247% ± 1.243% vs 0.548% ± 0.113%, P < 0.01). When the SB concentration was>2.5 mmol/L, the apoptosis rate increased significantly (P < 0.01). When treated with 1.25 mmol/L SB for 48 h, the percentage of cells in G0/G1 phase cell did not show a significant difference compared with the NC group; when the concentration was > 2.5 mmol/L (5.0 or 10.0 mmol/L), SB could induce G1/G0 arrest (P < 0.01). After lentiviral transfection, a large number of HT-29 cells with green fluorescence was observed by Leica DMIRB (transfection efficiency>80%). Lentiviral transfection of siRNA could effectively inhibit expression of HSF2, while lentiviral transfection of Ubi-MCS-3FLAG-SV40-EGFP induced overexpression of HSF2. HSF2 overexpression significantly increased cell proliferation and migration compared with the empty vector treated group (P < 0.05), while HSF2 knockdown significantly inhibited the proliferation and migration of HT-29 cells compared with the negative siRNA group (P < 0.05). HSF2 overexpression or knockdown had no significant impact on cell cycle distribution. HSF2 overexpression significantly decreased cell apoptosis rate (P < 0.05), while HSF2 knockdown significantly increased cell apoptosis rate (P < 0.05).
CONCLUSION: HSF2 might be a protective factor for epithelial cell apoptosis. HSF2 achieves the effects of cell protection possibly through the cell cycle regulation.
- Citation: Yang G, Niu JK, Li XY, Zhang FR, Miao YL. Effect of knockdown or overexpression of heat shock transcription factor 2 on apoptosis and migration of human colonic epithelial cells. Shijie Huaren Xiaohua Zazhi 2015; 23(24): 3846-3859
- URL: https://www.wjgnet.com/1009-3079/full/v23/i24/3846.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i24.3846
溃疡性结肠炎(ulcerative colitis, UC)是一种以反复便血、腹痛等为特征的慢性非特异性结肠炎症. 十多年前, 炎症性肠病(inflammatory bowel disease, IBD)在亚洲尚属罕见, 但如今在亚洲地区该病的发病率明显升高, 近期有学者对亚洲地区的一次大规模人群流行病学调查结果显示2011-2012年IBD发病率从0.60/100000上升为3.44/100000[1]. 尽管亚洲总体发病率仍低于西方国家, 但流行病学调查显示在上海等沿海地区该病发病率已接近国外平均水平. 据预计, 亚洲和西方国家之间IBD发生率的差异会逐渐减小, 最终可能会消失[2]. 尽管近年来黏膜愈合(mucosal healing, MH)已被提出作为IBD治疗的新目标[3], 且越来越多证据显示MH可改变IBD的自然病程, 达到持续临床缓解, 降低住院率和手术风险目的, 还后续临床治疗安排[4], 但临床上仍缺乏特异性的诊断指标. 目前临床上主要依靠患者的临床表现、内镜学改变及病理支持诊断该病, 内镜及活检作为有创检查手段, 不但给患者带来痛苦, 而且IBD在临床及内镜方面的表现缺乏特异性. 因此, 尽快探索其作用机制、特异性的诊断标志物、开发其针对性的生物制剂作为治疗靶点显得意义重大. 近年来, 有研究[5-7]认为热休克蛋白(heat shock proteins, HSPs)作为细胞内的重要保护性蛋白之一, 对结肠黏膜上皮细胞的修复具有重要作用. HSP70是研究最广泛的HSP, 具有许多重要的陪伴功能, 促进HSP70的合成能够抑制肠黏膜细胞的凋亡[8]. 研究[9]表明, 热休克转录因子2(heat shock transcription factor 2, HSF2)能够调节HSP25、HSP40、HSP110, 特别是主要的热休克蛋白HSP70的转录表达, 但该因子在UC发生发展中的作用目前在国内外均无相关报告. 本研究团队于前期研究通过多项实验已经证实UC患者无论在基因, 还是血清、肠道黏膜的蛋白质表达水平均可发现HSF2表达上调[10-13], 提示HSF2参与了UC的发生发展过程, 能间接反映炎症程度, HSF2表达量可作为判断UC病情严重程度及治疗疗效的指标之一, HSF2可能作为一项新的UC炎症活动水平的评价指标. 但HSF2在肠上皮细胞增殖、凋亡、黏膜修复中的作用仍有待进一步研究, 研究成果可能为UC发病机制的研究、寻找诊断标志物以及开发生物治疗靶点提供新的思路.
HT-29细胞(中国科学院昆明动物研究所细胞库购买), RPMI 1640培养基, Transwell小室, 噻唑兰(methylthiazolyldiphenyl-tetrazolium bromide, MTT), 丁酸钠, 二甲基亚砜, 0.25%Trypsin-EDTA(1×), 0.25%胰酶消化液(不含EDTA), 碘化丙啶(propidium iodide, PI), 胎牛血清(fetal bovine serum, FBS), HSF2(721D1) mouse monoclona IgG1 Santa Cruz, USA, Anti-mouse IgG(H+L)Cat No: SA00001-1, Proteintech, USA, Mouse anti beta actin Monoclonal antibody Cat No: 60008-1-Ig, Proteintech, USA, ECL免疫印迹底物(32106), Thermo fisher scientific, USA, Prestained Protein MolecularWeight Marker Thermofisher scientific, USA, RestoreTMPlus Western blot Stripping Buffer, Thermo fisher scientific, USA, X光片、显影液、定影液, 无水乙醇、异丙醇、十二烷基硫酸钠、过硫酸铵、丙烯酰胺、TEMED(N,N,N,N-四甲基乙二胺)、甲醇、Tris、结晶紫等; 目的基因合成由上海吉凯基因化学技术有限公司完成. Annexin V-FITC/PI凋亡检测试剂盒, Annexin V-PE/7-AAD凋亡检测试剂盒, 倒置荧光显微镜(Leica, Germany), 流式细胞仪(BD, USA), 酶标仪(Infinite M200).
1.2.1 丁酸钠诱导细胞凋亡, MTT法检测细胞增殖活性: 培养HT-29细胞, 取24、48、72、96 h 4个时间点, 每个时间点用不同丁酸钠浓度(1.25、2.5、5.0、10 mmol/L)诱导细胞凋亡, 用MTT比色法检测不同处理组细胞相对活性的变化. 用吸光度值代表细胞增殖程度, 比较各组细胞各个点的变化. 根据结果选取最佳时间及浓度.
1.2.2 流式细胞仪(Annexin V-FITC/PI双标记法)检测细胞凋亡: 选取HT-29(人结肠癌细胞株)作为研究材料, 丁酸钠(设置1.25、2.5、5.0、10 mmol/L不同浓度)诱导细胞凋亡, 贴壁细胞用不含EDTA的胰酶消化收集, 用PBS洗涤细胞2次(2000 r/min离心5 min)收集, 加入500 μL的Binding Buffer悬浮细胞; 加入5 μL Annexin V-FITC混匀后, 加入5 μL Propidium Iodide, 混匀; 室温、避光、反应5-15 min; 在1 h内, 进行流式细胞仪的观察和检测, 结果用FlowJo软件分析.
1.2.3 流式细胞仪(PI染色法)检测细胞周期: 选取HT-29(人结肠癌细胞株)作为研究材料, 丁酸钠(设置1.25、2.5、5.0、10 mmol/L不同浓度)诱导细胞凋亡, 离心收集细胞, 弃上清, 用预冷PBS洗细胞2次, 加入预冷700 mL/L乙醇, 于4 ℃固定过夜, 离心收集细胞, PBS 1 mL洗细胞1次, 加入500 μL PBS含50 μg/mL PI, 100 μg/mL RNaseA, 0.2%Triton X-100, 4 ℃避光孵育30 min后流式细胞仪检测, 结果用FlowJo软件分析.
1.2.4 HSF2目的基因的慢病毒感染: 根据吉凯基因《慢病毒使用操作手册》提供的MOI参照表提供的资料, 当HT-29细胞MOI = 10时感染效率最高. 在12孔培养板接种5孔, 每个孔内接种4×105/L-5×105/L个HT-29细胞, 铺板时每孔培养基体积为1 mL, 当细胞的融合度约为30%-50%时进行病毒感染, 将培养基体积换为500 μL并加入病毒感染目的细胞, 混匀后放于培养箱(37 ℃、50 mL/L CO2)孵育过夜. 病毒感染72 h后转染率可达80%以上.
1.2.5 Western blot检测目的蛋白的表达情况: 用倒置荧光显微镜观察, Western blot法检测目的基因在细胞中的转染效率.
1.2.6 MTT法检测干扰和过表达HSF2后细胞活性的变化: 将成功转染的细胞加入含5.0 mmol/L丁酸钠的有血清培养液, 经过丁酸钠处理48 h后, 用MTT法检测增殖程度.
1.2.7 干扰和过表达HSF2后对细胞迁移的影响(划痕法/Transwell小室法): 划痕法: 6孔板每孔中加入约5×106个细胞, 待细胞融合达到40%, 进行干扰、过表达组转染72 h后, 用200 μL枪头比着直尺, 垂至于背后的横线划痕, 用PBS洗细胞3次, 去除划下的细胞, 加入低血清培养基( ≤ 2%), 放入37 ℃、50 mL/L CO2培养箱中继续培养. 按0、24、48、72、96、120 h取样, 拍照. 拍照后用Image-Pro Plus图像分析软件, 统计分析细胞向划痕区迁移的相对距离, 根据原始细胞致伤区距离计算细胞实际迁移距离.
Transwell小室法: 将成功转染的细胞用无血清培养基悬浮, 每孔150 μL接种至Transwell小室上室, 在24孔板下室内加入600 μL含10%FBS的1640培养基, 继续在孵箱培养48 h, 取出Transwell小室, 弃去孔中培养液, 用PBS洗2遍, 甲醇固定30 min, 将小室适当风干, 0.1%结晶紫染色30 min, 用棉签轻轻擦掉上层未迁移细胞, 用PBS洗3遍, 200倍显微镜下随机选取5个视野观察细胞, 记数.
1.2.8 干扰和过表达HSF2后对HT-29细胞周期的影响(PI染色法, 流式细胞仪检测):HSF2目的基因慢病毒的感染方法同前, 凋亡检测操作步骤: 贴壁细胞用不含EDTA的胰酶消化收集; 用预冷的PBS洗涤细胞2次, 吸出PBS; 用预冷1×Binding Buffer将细胞悬浮, 加入5 μL Annexin V-PE, 10 μL 7-AAD染液; 轻轻混匀, 避光、冰上孵育15 min; 每管中加入380 μL预冷1×Binding Buffer重悬后流式细胞仪进行检测.
1.2.9 干扰和过表达HSF2后对HT-29细胞凋亡的影响(Annexin V-PE/7-AAD双标记法, 流式细胞仪检测):HSF2目的基因的慢病毒的感染/流式细胞仪PI染色法操作方法均同前.
统计学处理 所有数据均来源于至少3次独立的实验, 有可重复性. 所有数据采用SPSS17.0软件进行统计分析, 计量资料数据经正态检验均为正态分布, 用mean±SD表示, 多组间计量资料的比较采用单因素方差分析(One-way ANOVA), 组间差异采用成组设计t检验分析. 相关性分析采用两变量关联性分析(Perason法), P<0.05为差异具有统计学意义.
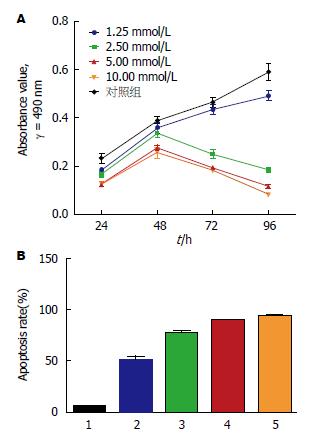
MTT法检测丁酸钠对HT-29人结肠癌细胞生长的抑制作用, 结果显示: 正常对照组HT-29细胞活力在观察期间(0-96 h)不断上升, 而实验组HT-29细胞在48 h之后、2.5 mmol/L以上浓度均表现出明显的生长抑制作用, 且各组之间差异具有统计学意义(P<0.01), 即2.5 mmol/L以上丁酸钠浓度组对HT-29细胞的生长抑制作用呈现出浓度、时间依赖性. 根据实验结果, 选取最佳丁酸钠浓度及时间位点: 2.5 mmol/L丁酸钠诱导48 h, 为后续试验提供选择依据(表1, 图1A).
根据MTT实验结果, 由于丁酸钠诱导HT-29细胞凋亡48 h后细胞可出现明显的生长抑制作用, 因此我们选择48 h为时间点, 用不同丁酸钠浓度(1.25、2.5、5.0、10 mmol/L)诱导细胞凋亡, 从凋亡率来观察HT-29细胞所受丁酸钠的影响.
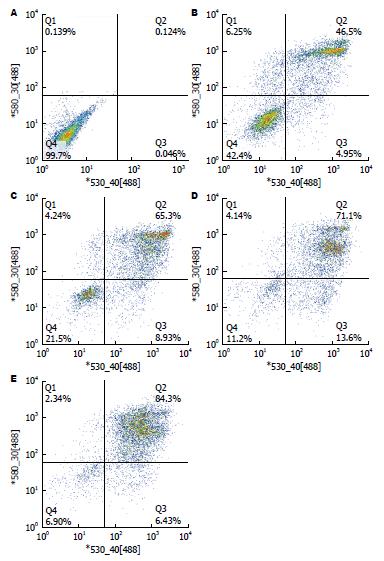
Annexin V-FITC/PI双标记法流式细胞仪分析HT-29细胞凋亡结果显示: 对照组有少量凋亡, 总凋亡率为0.548%±0.113%, 而实验组经丁酸钠分别处理1.25、2.5、5.0、10 mmol/L作用48 h后, 总凋亡率分别为51.588%±5.110%、77.732%±2.746%、90.115%±1.438%、94.247%±1.243%, 与对照组之间差异具有统计学意义(P<0.01). 当丁酸钠>2.5 mmol/L, 凋亡率较1.25 mmol/L明显上升, 差异具有统计学意义(P<0.01)(图1B, 2).
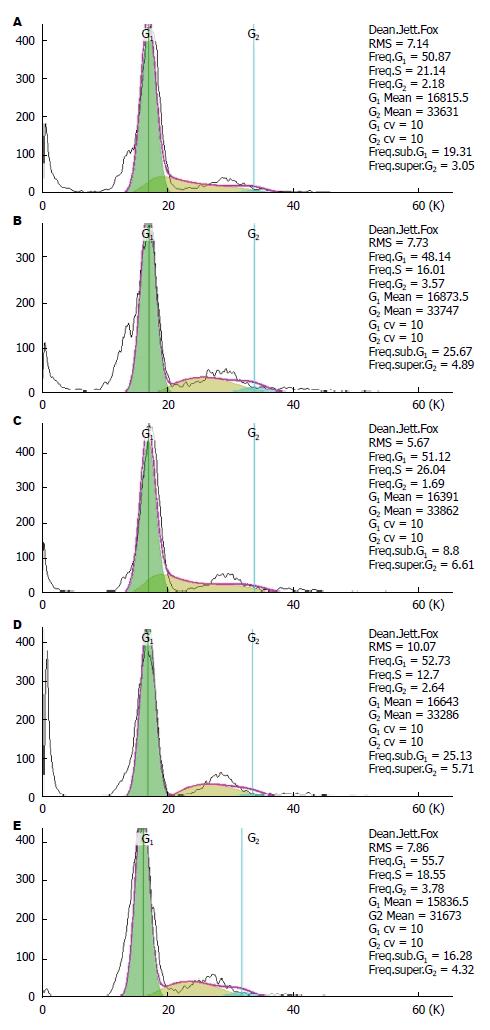
用不同浓度(1.25、2.5、5.0、10 mmol/L)丁酸钠处理HT-29细胞48 h后, 采用流式细胞仪对细胞进行DNA含量测定, FlowJo软件根据DNA含量的分布情况进行细胞周期分析. 结果显示: 与阴性对照组(negative control, NC)相比, 丁酸钠1.25 mmol/L浓度组经48 h处理G0/G1期HT-29细胞未显示出明显差异(P = 1.00>0.05); 2.5 mmol/L以上浓度在各观察点显示出明显的细胞周期阻滞现象, 越来越多的HT-29细胞被阻滞在G0/G1期, 各组之间差异具有统计学意义(P<0.01)(表2).
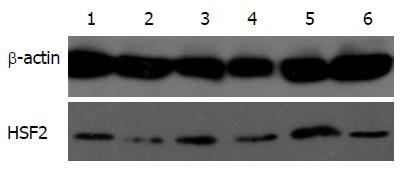
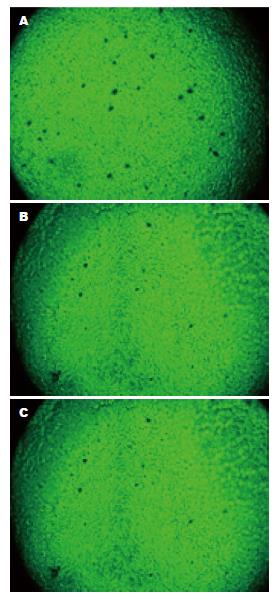
将HSF2 siRNA和HSF2过表达通过慢病毒载体感染转入细胞, 倒置荧光显微镜观察目的基因转染效率, 结果发现: 通过倒置荧光显微镜(×100)观察可发现, 各组转染后大部分HT-29细胞均有GFP表达, 转染效率达80%以上(图3).
将HT-29细胞以5×105个/mL浓度接种于12孔板中, 当待细胞融合达到40%后分别予HSF2 siRNA和过表达及其各自对照组的慢病毒载体转染细胞, 培育72 h后, 提取蛋白质, β-actin为内参, 用Western blot检测转染效率及目的基因蛋白质的表达情况. 结果显示转染入目的基因RNA干扰慢病毒细胞的蛋白质水平较干扰对照组(negative RNA, N-R)及NC组显著减少, 说明合成的siRNA能有效地干扰HSF2靶基因, 相反, 用慢病毒转染入目的基因过表达的过表达组细胞的HSF2蛋白质水平较过表达对照组及NC组明显升高; 因此, 用上述慢病毒来构建载体能够高效、稳定地过表达和干扰目的基因的表达(图4).
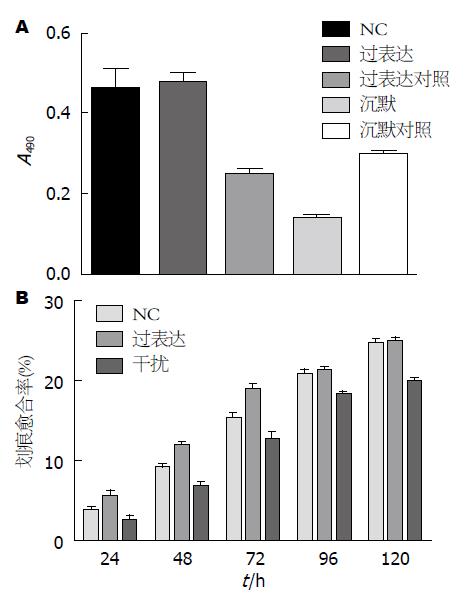
为了对比丁酸钠诱导细胞凋亡环境下, 经慢病毒载体介导的RNA干扰/过表达HSF2的细胞增殖是否改变, 采用MTT比色法检测不同处理组细胞相对活性的变化. 根据前面实验结果, 选取最佳丁酸钠诱导凋亡的浓度及时间位点: 2.5 mmol/L丁酸钠诱导48 h. 结果显示: 细胞凋亡环境下, NC组、过表达组、过表达对照组、干扰组、干扰对照组的A值分别为0.462±0.112、0.480±0.054、0.248±0.036、0.136±0.029、0.295±0.027, 可见NC组以及使用慢病毒转染处理的这5个细胞组之间, HSF2过表达的细胞活性明显高于过表达对照组, 干扰组细胞的活性相对于干扰对照组则明显下降, 两组间具有显著差异(P<0.05)(图5A).
目前最常应用的检测体外培养细胞迁移能力的方法包括: Transwell迁移小室和Wound scratch assay划痕实验法, 二者均能较好地反映细胞的迁移能力.
划痕法: 显微镜拍得的照片用Image-Pro Plus图像分析软件, 统计分析细胞向划痕区迁移的相对距离计算划痕愈合率[划痕愈合率 = (0 h划痕宽度-所检测时间点的划痕宽度)/0 h划痕宽度×100%]. 划痕实验结果显示: HSF2过表达组在72 h以前划痕愈合率快于NC组, 但在96-120 h期间过表达组与NC组差异无统计学意义(P>0.05), 而HSF2干扰组在观测期间(0-120 h)与NC组比较, 细胞划痕愈合能力明显降低(表3, 图5B, 图6).
Transwell小室法检测干扰和过表达HSF2后对HT-29细胞迁移的影响: 结果显示在200倍显微镜下计数Transwell膜底面的迁移细胞(图7), NC组迁移细胞数为23±2, 过表达组为30±2, 干扰组为12±2, 实验组与NC组相比, 差异均具有统计学意义(P<0.05). Transwell细胞迁移实验发现过表达组的细胞迁移能力较NC组明显增加, 而干扰组较NC组的细胞迁移能力则明显降低.
为研究经慢病毒载体介导的RNA干扰/过表达HSF2的细胞在丁酸钠诱导细胞凋亡环境下, 细胞周期是否改变, 我们用流式细胞仪PI染色法进行检测, 结果显示: NC组以及转染组的这5个细胞组之间, 各时间点细胞活性差异无统计学意义(P>0.05)(表4, 图8). 以上结果显示, HSF2 siRNA和过表达目的基因的HT-29之间的细胞周期并无显著差异.
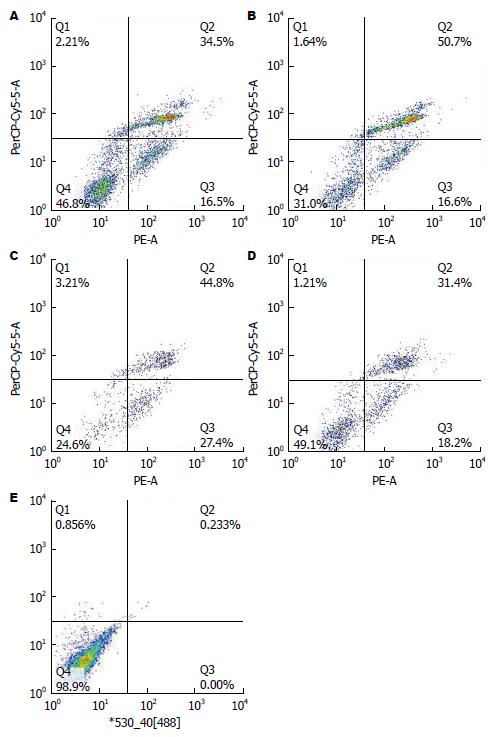
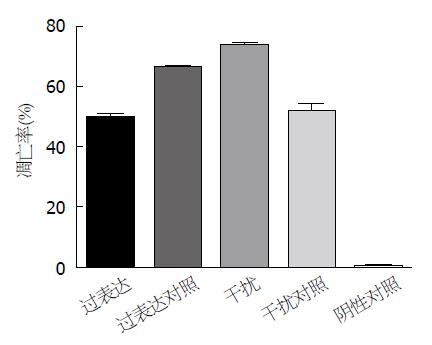
为研究经慢病毒载体介导的RNA干扰/过表达HSF2的细胞在丁酸钠诱导细胞凋亡环境下的细胞凋亡率, 采用流式细胞仪进行检测. 结果显示: 过表达组有部分凋亡, 总凋亡率为51.000%±1.987%, 过表达对照组总凋亡率为67.300%±0.999%, 两组之间有显著差异(P<0.05); 干扰组总凋亡率73.567%±1.234%, 干扰对照组总凋亡率为52.033%±3.667%, 两组之间差异具有统计学意义(P<0.05)(图9, 图10).
细胞凋亡(apoptosis)是一种由自由基调控的细胞主动死亡的过程, 凋亡可以使机体清除受损的、衰老的、无用的细胞, 但凋亡本身不引起机体微环境的损伤、炎症, 他对维持组织内环境的稳定、细胞群的动力学平衡和组织器官的各项生理功能和病理反应都是不可或缺的. 细胞凋亡与人类许多疾病发生有密切关系, 例如肿瘤、自身免疫病、神经退行性病以及艾滋病等[14-16]. 肠黏膜屏障主要由肠黏膜基底膜、上皮细胞层及其表面黏液层构成[17], 可以将肠腔内的细菌、抗原等物质与肠黏膜固有层免疫细胞隔离开, 避免固有层免疫细胞激活, 肠上皮细胞作为抵御抗原入侵的免疫防御首道防线, 不仅是肠黏膜物理屏障, 还在调节肠黏膜固有免疫防御及损伤-修复的平衡中发挥不可或缺的重要作用, 若受损可引起肠上皮通透性增加[18], 导致肠上皮和固有层免疫细胞之间的相互作用的异常, 扰乱肠道免疫系统, 所有这些都关系到IBD的临床病程. IBD发病时, 大量肠黏膜上皮细胞凋亡[19,20], 由于与凋亡细胞相邻的上皮细胞不能有效封闭凋亡细胞留下的空间, 导致肠黏膜通透性增高, 肠道内的细菌、抗原等物质移位至黏膜固有层而激活免疫细胞, 诱导黏膜异常免疫反应[21]. 肠黏膜上皮本身的防御修复功能是整个黏膜保护功能的关键阶段, 他的功能受损可能与肠上皮细胞凋亡失调相关, 进而导致IBD的发生、发展[22,23]. 近年来, 越来越多的证据提示细胞凋亡在IBD的发病机制中起重要作用[24,25]. 研究[26]证明凋亡失调可能导致肠道T细胞的活性, 促进黏膜炎症和临床严重程度的持久性. 炎症细胞浸润是IBD的特征之一, 研究证明细胞凋亡参与组织中炎症细胞数量的调节, 主要表现为上皮细胞凋亡加速, 炎症细胞凋亡减缓. 在UC病变肠道区域或其附近的区域, 结肠隐窝上皮细胞均有凋亡增加的现象[27]. 而随着结肠炎症程度加剧, 结肠隐窝上皮细胞凋亡率也随之增加[28]. 因此肠道黏膜屏障功能受损可能与肠黏膜上皮细胞凋亡失调有关, 肠黏膜上皮细胞凋亡过度, 肠黏膜固有层T淋巴细胞和中性粒细胞凋亡迟滞可能是IBD发生、发展的原因. 随着该领域的研究不断深入, 选择性地减少IBD肠上皮细胞凋亡造成的组织损伤, 有可能进一步减轻炎症.
肠道黏膜损伤及炎症是UC的主要特点, 目前在这个领域的研究很少关注黏膜自身细胞的修复功能, 同时在IBD治疗上也反映了这种缺陷, 目前的大部分治疗仍集中在抑制免疫产物及炎症因子的产生上, 很少关注黏膜的自身防御修复功能. 细胞为保护自身免受应激损伤所产生的HSPs, 而HSPs在保护肠细胞的结果和功能方面的作用提示我们在IBD的治疗中可通过建立靶向特殊治疗, 减轻黏膜损伤和疾病的严重程度. 基于本研究团队前期实验发现UC患者中参与转录对黏膜有保护作用的HSPs的HSF2, 无论从患者基因, 还是血清、肠道黏膜的蛋白质表达水平均表达上调的基础上, 在本次研究中, 通过慢病毒转染过表达或干扰技术, 比较不同的HSF2水平对细胞凋亡及迁移的影响, 从细胞水平探讨HSF2与UC的关系.
丁酸钠可通过不同途径诱导多种肿瘤细胞的凋亡, 这一观点已经得到共识[29,30], 也有学者认为丁酸在体内是结肠上皮细胞的主要能量来源, 被认为是刺激增殖的作用, 相反, 丁酸钠在体外具有抑制增殖和结肠上皮细胞诱导分化和凋亡[31]. 实验先通过MTT检测法、流式细胞仪检测细胞周期、凋亡检测不同丁酸钠浓度、时效下处理的HT-29细胞, 发现丁酸钠(5.0 mmol/L, 48 h)能够开始有效诱导细胞发生凋亡. 接着我们进行不同水平HSF2的转染HT-29细胞, 并在丁酸钠诱导凋亡下进行MTT实验、周期分布、凋亡率的检测, MTT体外增殖实验中我们发现过表达HSF2细胞组的增殖活性明显高于对照组. 相似地, 通过流式细胞仪检测发现过表达HSF2的HT-29凋亡凋亡率低于其对照组. 这提示HSF2在机体受应激损伤时, 是一种必要的保护因素. 而在细胞迁移实验中, 无论是划痕法还是Transwell小室法, 过表达组的HSF2的细胞迁移率高于NC组, 也提示HSF2对肠上皮细胞发生凋亡或者损伤时所产生的保护修复作用.
相反, MTT体外增殖实验中我们发现干扰HSF2处理后的HT-29细胞, 其细胞增殖活性与对照组比较明显降低, 这提示干扰HSF2处理后的HT-29细胞在机体受应激损伤时, 失去保护能力. 流式细胞仪检测凋亡实验结果显示HSF2 siRNA组与其对照组HT-29细胞凋亡率相比明显升高, 进一步证明了HSF2干扰表达后的细胞失去了保护作用, 提示HSF2可能在凋亡反应中细胞起保护作用. 细胞迁移实验中, 无论是划痕法还是Transwell小室法, 均发现干扰HSF2的细胞迁移能力受到抑制, 提示HSF2对肠上皮细胞发生凋亡或者损伤时所产生的保护修复作用. 另外我们发现, 流式细胞仪分析细胞周期实验中, 经过丁酸钠模拟凋亡环境下, 不同HSF2水平转染细胞周期分布与对照组比较并无明显差异, 未出现G0/G1期细胞周期阻滞现象, 这与前面丁酸钠诱导凋亡下HT-29细胞细胞周期分布结果不同, 提示HSF2可能通过调控细胞周期来实现对细胞保护作用, 但也可能还另有途径; 本研究还处于初步阶段, 有很多问题值得我们继续探索: HSF2在凋亡情况下的保护作用的调控机制中间还存在哪些重要的调控因子, 以及周期分布的调控机制还需要深入的研究.
我们通过前期实验已经证实UC患者无论从基因, 还是血清、肠道黏膜的蛋白质表达水平均可发现HSF2表达上调, 本次实验又从细胞水平发现HSF2对肠道黏膜凋亡环境有保护作用, 对肠黏膜损伤有促进修复的作用. 肠上皮细胞的迁移和增殖(恢复)是黏膜损伤后上皮缺损愈合的关键机制[32], 提示HSF2在UC的愈合中发挥重要作用, 为我们对UC的诊断、治疗及病情评估提供了新线索.
近年来黏膜愈合被提出作为炎症性肠病(inflammatory bowel disease, IBD)治疗的新目标. 本研究团队于前期研究通过多项实验已经证实溃疡性结肠炎(ulcerative colitis, UC)患者无论在基因, 还是血清、肠道黏膜的蛋白质表达水平均可发现热休克转录因子2(heat shock transcription factor 2, HSF2)表达上调, 提示HSF2参与了UC的发生发展过程, 能间接反映炎症程度, HSF2表达量可作为判断UC病情严重程度及治疗疗效的指标之一, 但其与肠上皮细胞增殖、凋亡、黏膜修复中的作用表达的相关性仍有待研究.
刘杰民, 主任医师, 贵州省人民医院消化内镜科; 潘秀珍, 教授, 主任医师, 福建省立医院消化科
联合慢病毒转染过表达/干扰技术, 比较不同水平的HSF2对细胞增殖、凋亡、黏膜修复中的影响, 为研究UC的发病机制、寻找诊断标志物和开发生物治疗靶点提供新的思路.
目前就HSF2参与机体的保护机制国内外均无统一的定论, 而HSF2与UC的明确关系及其在UC中的作用机制也未见相关报道. 本研究小组于2008年采用高通量基因芯片技术, 从全基因组角度比较UC患者与健康人群外周血单个核细胞差异表达基因, 发现差异表达2倍以上的基因及基因表达序列标签共270个. 另于2010年应用蛋白质组学双向凝胶电泳和基质辅助激光解吸电离飞行时间质谱寻找并鉴定出UC患者与健康对照者血清之间9个差异表达的蛋白质. 两者均发现HSF2呈上调趋势. 并比较其在UC诊断中需鉴别的疾病(肠结核、克罗恩病、肠淋巴瘤、白塞病、感染性肠炎), 亦发现其在UC患者黏膜明显增强. 一系列研究提示HSF2与UC关系密切, 参与了UC的发生发展过程, 能间接反映炎症程度, 其表达量可作为判断UC病情严重程度及治疗疗效的指标之一.
肠道黏膜损伤及炎症是UC的主要特点, 目前在这个领域的研究很少关注黏膜自身细胞的修复功能, 同时在IBD治疗上也反映了这种缺陷, 目前大部分治疗仍集中在抑制免疫产物及炎症因子的产生上, 很少关注黏膜的自身防御修复功能. 本研究团队前期实验发现UC患者中参与转录对黏膜有保护作用的热休克蛋白(heat shock proteins, HSPs)的HSF2, 无论从患者基因, 还是血清、肠道黏膜的蛋白质表达水平均上调.
本次实验从细胞水平发现HSF2对肠道黏膜凋亡环境有保护作用, 对肠黏膜损伤有促进修复的作用, 肠上皮细胞的迁移和增殖(恢复)是黏膜损伤后上皮缺损愈合的关键机制, 提示HSF2在UC的愈合中发挥重要作用, 为研究者对UC的诊断、治疗及病情评估提供了新线索. 本研究有很多问题值得继续探索: HSF2在凋亡情况下的保护作用调控机制中间还存在哪些重要的调控因子, 以及周期分布的调控机制还需要深入的研究.
凋亡: 是一种由自由基调控的细胞主动死亡的过程, 凋亡可以使机体清除受损的、衰老的、无用的细胞, 但凋亡本身不引起机体微环境的损伤、炎症, 他对维持组织内环境的稳定、细胞群的动力学平衡和组织器官的各项生理功能和病理反应都是不可或缺的;
细胞迁移: 正常细胞的基本功能之一, 是机体正常生长发育的生理过程, 也是活细胞普遍存在的一种运动形式, 胚胎发育、血管生成、伤口愈合、免疫反应、炎症反应、动脉粥样硬化、癌症转移等过程中都涉及细胞迁移, 能较好地反映细胞的迁移能力.
本研究从细胞水平发现HSF2对肠道黏膜凋亡环境有保护作用, 对肠黏膜损伤有促进修复的作用. 提示HSF2在UC的愈合中发挥重要作用, 为临床对UC的诊断、治疗及病情评估提供了新线索. 本研究立题依据充分, 也有预先研究基础, 目标明确, 设计合理, 方法先进, 技术难度较大, 结果可信, 论点清晰. 对IBD发病机制和临床防治有意义.
编辑: 韦元涛 电编:闫晋利
| 1. | Ng SC. Emerging leadership lecture: Inflammatory bowel disease in Asia: emergence of a "Western" disease. J Gastroenterol Hepatol. 2015;30:440-445. [PubMed] [DOI] |
| 2. | Ye L, Cao Q, Cheng J. Review of inflammatory bowel disease in China. ScientificWorldJournal. 2013;2013:296470. [PubMed] [DOI] |
| 3. | Florholmen J. Mucosal healing in the era of biologic agents in treatment of inflammatory bowel disease. Scand J Gastroenterol. 2015;50:43-52. [PubMed] [DOI] |
| 4. | Neurath MF, Travis SP. Mucosal healing in inflammatory bowel diseases: a systematic review. Gut. 2012;61:1619-1635. [PubMed] [DOI] |
| 5. | van Eden W. Diet and the anti-inflammatory effect of heat shock proteins. Endocr Metab Immune Disord Drug Targets. 2015;15:31-36. [PubMed] |
| 6. | Hu S, Wang Y, Lichtenstein L, Tao Y, Musch MW, Jabri B, Antonopoulos D, Claud EC, Chang EB. Regional differences in colonic mucosa-associated microbiota determine the physiological expression of host heat shock proteins. Am J Physiol Gastrointest Liver Physiol. 2010;299:G1266-G1275. [PubMed] [DOI] |
| 7. | Al-Sadi R, Ye D, Said HM, Ma TY. IL-1beta-induced increase in intestinal epithelial tight junction permeability is mediated by MEKK-1 activation of canonical NF-kappaB pathway. Am J Pathol. 2010;177:2310-2322. [PubMed] [DOI] |
| 8. | Wu X, Zhang Y, Yin Y, Ruan Z, Yu H, Wu Z, Wu G. Roles of heat-shock protein 70 in protecting against intestinal mucosal damage. Front Biosci (Landmark Ed). 2013;18:356-365. [PubMed] [DOI] |
| 9. | Alastalo TP, Hellesuo M, Sandqvist A, Hietakangas V, Kallio M, Sistonen L. Formation of nuclear stress granules involves HSF2 and coincides with the nucleolar localization of Hsp70. J Cell Sci. 2003;116:3557-3570. [PubMed] [DOI] |
| 11. | 陈 丽芳, 缪 应雷, 杜 艳, 李 红纳, 肖 玉良. CEACAM6, Syndecan-1, PDGFA, HLA-DRB5在溃疡性结肠炎中的表达和意义. 世界华人消化杂志. 2010;18:2971-2975. [DOI] |
| 13. | Miao J, Niu J, Wang K, Xiao Y, Du Y, Zhou L, Duan L, Li S, Yang G, Chen L. Heat shock factor 2 levels are associated with the severity of ulcerative colitis. PLoS One. 2014;9:e88822. [PubMed] [DOI] |
| 14. | Albenberg LG, Lewis JD, Wu GD. Food and the gut microbiota in inflammatory bowel diseases: a critical connection. Curr Opin Gastroenterol. 2012;28:314-320. [PubMed] [DOI] |
| 15. | Wu GD, Bushmanc FD, Lewis JD. Diet, the human gut microbiota, and IBD. Anaerobe. 2013;24:117-120. [PubMed] [DOI] |
| 16. | Yamamoto T. Nutrition and diet in inflammatory bowel disease. Curr Opin Gastroenterol. 2013;29:216-221. [PubMed] [DOI] |
| 17. | Arrieta MC, Bistritz L, Meddings JB. Alterations in intestinal permeability. Gut. 2006;55:1512-1520. [PubMed] [DOI] |
| 18. | Terc J, Hansen A, Alston L, Hirota SA. Pregnane X receptor agonists enhance intestinal epithelial wound healing and repair of the intestinal barrier following the induction of experimental colitis. Eur J Pharm Sci. 2014;55:12-19. [PubMed] [DOI] |
| 19. | Di Sabatino A, Ciccocioppo R, Luinetti O, Ricevuti L, Morera R, Cifone MG, Solcia E, Corazza GR. Increased enterocyte apoptosis in inflamed areas of Crohn's disease. Dis Colon Rectum. 2003;46:1498-1507. [PubMed] |
| 20. | Luo K, Cao SS. Endoplasmic reticulum stress in intestinal epithelial cell function and inflammatory bowel disease. Gastroenterol Res Pract. 2015;2015:328791. [PubMed] [DOI] |
| 21. | Lee SH. Intestinal permeability regulation by tight junction: implication on inflammatory bowel diseases. Intest Res. 2015;13:11-18. [PubMed] [DOI] |
| 22. | Lissner D, Schumann M, Batra A, Kredel LI, Kühl AA, Erben U, May C, Schulzke JD, Siegmund B. Monocyte and M1 macrophage-induced barrier defect contributes to chronic intestinal inflammation in IBD. Inflamm Bowel Dis. 2015;21:1297-1305. [PubMed] [DOI] |
| 23. | Iablokov V, Hirota CL, Peplowski MA, Ramachandran R, Mihara K, Hollenberg MD, MacNaughton WK. Proteinase-activated receptor 2 (PAR2) decreases apoptosis in colonic epithelial cells. J Biol Chem. 2014;289:34366-34377. [PubMed] [DOI] |
| 24. | Sun J, Zhang H, Guan L, Zhou H, Sun M. Alpha-lipoic acid attenuates trinitrobenzene sulfonic acid-induced ulcerative colitis in mice. Int J Clin Exp Med. 2015;8:358-367. [PubMed] |
| 25. | Zeng LX, Tao J, Liu HL, Tan SW, Yang YD, Peng XJ, Liu ZH, Jiang J, Wu B. β-Arrestin2 encourages inflammation-induced epithelial apoptosis through ER stress/PUMA in colitis. Mucosal Immunol. 2015;8:683-695. [PubMed] [DOI] |
| 26. | Jergens A, Young J, Moore D, Wang C, Hostetter J, Augustine L, Allenspach K, Schmitz S, Mosher C. Bcl-2/caspase 3 mucosal imbalance favors T cell resistance to apoptosis in dogs with inflammatory bowel disease. Vet Immunol Immunopathol. 2014;158:167-174. [PubMed] [DOI] |
| 27. | Araki Y, Mukaisyo K, Sugihara H, Fujiyama Y, Hattori T. Increased apoptosis and decreased proliferation of colonic epithelium in dextran sulfate sodium-induced colitis in mice. Oncol Rep. 2010;24:869-874. [PubMed] [DOI] |
| 28. | D'Argenio G, Farrace MG, Cosenza V, De Ritis F, Della Valle N, Manguso F, Piacentini M. Expression of apoptosis-related proteins in rat with induced colitis. Int J Colorectal Dis. 2004;19:451-460. [PubMed] [DOI] |
| 29. | Litvak DA, Hwang KO, Evers BM, Townsend CM. Induction of apoptosis in human gastric cancer by sodium butyrate. Anticancer Res. 2000;20:779-784. [PubMed] |
| 30. | Wang L, Luo HS, Xia H. Sodium butyrate induces human colon carcinoma HT-29 cell apoptosis through a mitochondrial pathway. J Int Med Res. 2009;37:803-811. [PubMed] [DOI] |
| 31. | Singh B, Halestrap AP, Paraskeva C. Butyrate can act as a stimulator of growth or inducer of apoptosis in human colonic epithelial cell lines depending on the presence of alternative energy sources. Carcinogenesis. 1997;18:1265-1270. [PubMed] [DOI] |
| 32. | Schroll S, Sarlette A, Ahrens K, Manns MP, Göke M. Effects of azathioprine and its metabolites on repair mechanisms of the intestinal epithelium in vitro. Regul Pept. 2005;131:1-11. [PubMed] [DOI] |