修回日期: 2015-07-21
接受日期: 2015-07-24
在线出版日期: 2015-08-18
目的: 评价C臂计算机断层扫描(Dyna computed tomography, DynaCT)技术在肝癌介入治疗中的应用价值及疗效, 为临床合理应用DynaCT提供依据.
方法: 回顾性分析89例原发性肝癌介入患者, 分为DynaCT组与常规数字减影血管造影(digtal subtraction angiography, DSA)组, DynaCT组46例, 常规DSA组43例, DynaCT组为二维常规DSA联合增强DynaCT检查. 对两组的手术操作时间、X线辐射量及造影剂用量进行对比分析; 同时对DynaCT检出病灶数量和明确血管走行的能力与常规DSA及螺旋CT进行对比, 并随访两组患者, 统计总生存期进行对比分析.
结果: 与常规DSA组相比, DynaCT组缩短了手术时间(P<0.05); 两组间X线辐射量及造影剂用量间差异无统计学意义, 说明术中加做DynaCT检查并未增加X 线辐射量和造影剂用量. DynaCT组共检测病灶92个(46例患者), 在直径<10 mm及10-20 mm直径的小肝癌中, DynaCT的诊断敏感率明显优于螺旋CT(P<0.001); 直径>20 mm肝癌中三种检查方法均能明确诊断, 不具有统计学差异. DynaCT组内46例患者中共有11例行常规DSA后发现肿瘤供血动脉严重前后重叠, 不能分辨肿瘤具体供血动脉, 行增强DynaCT后, 其中9例肿瘤供血动脉分支及走行显影清晰, 超选择插管后诊断明确. 二者差异有统计学意义. DynaCT组总生存期为17.3 mo±1.1 mo, 常规DSA组总生存期为12.6 mo±0.9 mo, 经Log-rank检验, P = 0.003.
结论: 常规DSA基础上应用DynaCT在原发性肝癌介入化疗栓塞中具有重要的临床应用价值, 提供更多诊断治疗信息, 改善患者预后.
核心提示: 肝动脉灌注化疗栓塞过程中, 传统的数字减影血管造影方法由于前后位重叠, 有着其局限性, 影响了治疗效果. C臂计算机断层扫描(Dyna computed tomography)技术作为新的影像诊断系统, 能给予介入医师更多关于肿瘤部位、血供来源方面的信息, 使得血管超选成功率明显增高, 同时在造影剂用量及手术时间方面并未存在风险, 提高了患者治疗效果及生存期.
引文著录: 艾宁, 李智岗, 李顺宗, 李博, 赵瑜. DynaCT在原发性肝癌介入治疗的应用价值. 世界华人消化杂志 2015; 23(23): 3781-3788
Revised: July 21, 2015
Accepted: July 24, 2015
Published online: August 18, 2015
AIM: To evaluate the application value of Dyna computed tomography (DynaCT) technology in hepatic carcinoma patients undergoing transcatheter arterial chemoembolization (TACE) and to provide evidence for clinical utilization of DynaCT.
METHODS: Eighty-nine patients with primary liver cancer were retrospectively analyzed, and they were divided into either a DynaCT group (46 cases) or a conventional digital subtraction angiography (DSA) group (43 cases). Patients in the DynaCT group underwent two-dimensional conventional DSA combined with DynaCT, and the conventional DSA group underwent DSA only. Operative time, X-ray radiation and dosage of contrast agent were analyzed in two groups. The number of lesions detected and the ability to detect blood vessels were compared between the two groups. All patients were followed to analyze overall survival.
RESULTS: Compared with the conventional DSA group, the DynaCT group has significantly shortened operative time (P < 0.05). There was no statistical significant difference in X-ray radiation and dosage of contrast medium between the two groups. DynaCT detected a total of 92 lesions (in 46 patients). DynaCT was superior to conventional CT and MDCT in the detection of lesions with a diameter < 10 mm or between 10 and 20 mm (P < 0.001), although there was no significant difference in the detection of lesions with a diameter > 20 mm. Eleven cases in the DynaCT group manifested no clear tumor feeding artery during conventional DSA, of which 9 cases had clearly indicated blood supplying artery branches by DynaCT. Overall survival of the DynaCT group was 17.3 mo ± 1.1 mo, which was significantly longer than that of the conventional DSA group (12.6 mo ± 0.9 mo; Log-rank, P = 0.003).
CONCLUSION: Utilization of DynaCT on the basis of conventional DSA in TACE for primary liver cancer has important clinical value, providing more diagnosis and treatment information that can help improve the prognosis of patients.
- Citation: Ai N, Li ZG, Li SZ, Li B, Zhao Y. Application value of DynaCT in patients with hepatic carcinoma undergoing transcatheter arterial chemoembolization. Shijie Huaren Xiaohua Zazhi 2015; 23(23): 3781-3788
- URL: https://www.wjgnet.com/1009-3079/full/v23/i23/3781.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i23.3781
肝动脉灌注化疗栓塞(transcatheter arterial chemoembolization, TACE)已成为公认的不能手术切除肝癌患者的首选治疗方法[1]. 明确肿瘤血供来源和获得充足的影像学信息在介入治疗过程中至关重要. 然而, 传统的数字减影血管造影(digital subtraction angiography, DSA)方法由于前后位重叠, 不能准确判断肿瘤的结构、肝段位置及血供情况, 并在碘油沉积情况方面存在劣势, 进而影响患者疗效及生存期. 为了改善这些不足之处, 西门子公司推出了集平板探测及锥形束计算机断层扫描(computed tomography, CT)于一体的C臂CT系统(DynaCT), 他能提供独特的影像学模式并类似于传统CT平扫, 在肝癌的TACE过程中能给予介入医师更多关于肿瘤部位、血供来源方面的信息, 使得血管超选成功率明显增高, 避免了血管损伤. 目前, DynaCT在神经介入中应用广泛, 而在腹部介入中报道较少, 我们对不能手术切除的原发性肝癌患者在介入过程应用DynaCT技术, 与常规DSA以及螺旋CT进行对比, 并进行预后分析, 现报道如下.
2011-08/2013-05河北医科大学第四医院介入病房首次住院治疗的原发性肝癌患者89例, 男性53例, 女性36例, 年龄39-78岁, 平均53.2岁. 入选患者均经影像学、肿瘤标志物甲胎蛋白(α-fetoprotein, AFP)检查确诊原发性肝癌, 并有慢性肝病病史, 符合2011年卫生部颁布的原发性肝癌诊疗规范(2011年版)诊断标准与临床分期标准[2], 所有病例均无外科手术切除指征, 不伴有门静脉瘤栓及肝-门静脉瘘, 肝功能Child-Pugh分级A或B级, 且生活质量Kamofsky评分>70分, 术前均行上腹部强化CT或磁共振成像(magnetic resonance imaging, MRI)检查, 无严重心肺功能不全, 血常规、凝血功能及肝肾功能检查无绝对介入禁忌症. 术前向患者交代治疗方案并签署知情同意书. 排除标准: 伴有其他脏器转移或有其他原发肿瘤患者, 碘过敏及不能行股动脉穿刺患者. 根据治疗方法分为DynaCT和常规DSA两组, 两组在性别、年龄及介入前肝功能情况方面、门脉癌栓、肿瘤大小等方面均无显著性差异(P>0.05)(表1). DynaCT组46例, 为常规DSA基础上联合DynaCT检查, 其中男性38例, 女性8例, 年龄43-78岁. 肝功能Child A级39例, B级7例. 常规DSA组43例, 为单纯DSA检查, 其中男36例, 女7例, 年龄39-72岁, 肝功能Child A级37例, B级6例.
| 相关因素 | DynaCT组 | 常规DSA组 | P值 |
| 年龄(岁) | >0.05 | ||
| ≤ 65 | 37 | 35 | |
| >65 | 9 | 8 | |
| 性别 | >0.05 | ||
| 男 | 38 | 36 | |
| 女 | 8 | 7 | |
| 肿瘤最大径(cm) | >0.05 | ||
| ≤ 3 | 22 | 24 | |
| >3 | 24 | 19 | |
| 肿瘤数目 | >0.05 | ||
| 1 | 28 | 25 | |
| ≥2 | 18 | 18 | |
| 肿瘤血供 | >0.05 | ||
| 富血供 | 36 | 37 | |
| 乏血供 | 10 | 6 | |
| 门静脉癌栓 | >0.05 | ||
| 有 | 13 | 12 | |
| 无 | 33 | 31 | |
| AFP(ng/mL) | >0.05 | ||
| ≤ 400 | 10 | 11 | |
| >400 | 36 | 32 | |
| HBV | >0.05 | ||
| + | 39 | 35 | |
| - | 7 | 8 |
1.2.1 治疗: 所有患者采用Seldinger法进行, 将5 F肝导管插至腹腔动脉造影并观察间接门静脉造影, 必要时加做肠系膜上动脉、胃左动脉、右侧膈动脉造影, 以明确肝脏肿瘤供血血管, 然后导管超选择进入靶血管内, 部分患者需借助Progreat微导管(日本泰尔茂公司生产)进行. 根据患者术前肝功能情况缓慢灌注替加氟1000 mg, 亚叶酸钙200 mg, 然后以8-25 mL碘化油中加入洛铂50 mg混合成乳剂来栓塞肿瘤供血动脉, 栓塞剂种类选择和栓塞剂量根据瘤体位置和大小估计, 并兼顾术前肝功能状况. 肿瘤直径>10 cm时则行分次栓塞. 在治疗过程中尽可能超选择插管, 减少正常肝组织损伤及胆囊动脉损伤. 栓塞后再行肝动脉造影, 了解栓塞情况及肿瘤染色残留情况, 满意后拔管并行右股动脉加压包扎.
DynaCT检查方法使用德国SIEMENS公司生产具有DynaCT功能的平板DSA系统(AXIOMArtis Zee Ceiling), 定位于感兴趣区域, 选择8 s DSA模式, 使用DynaCT 8SDR模式进行增强扫描, 当导管头位于腹腔干动脉时, 使用对比剂总量40-50 mL, 流速为4 mL/s, 高压注射器给予压力为300 PSI, 曝光延迟为5-8 s; 当导管头位于肝固有动脉时, 使用对比剂总量20-30 mL, 流速为1.5-2.5 mL/s, 高压注射器给予压力为200 PSI, 曝光延迟为3-5 s; 当导管头位于肝右、肝左或进一步超选择插管的动脉时, 使用对比剂总量10-20 mL, 流速为1-2 mL/s, 高压注射器给予压力为100 PSI, 曝光延迟为1-3 s. 每例行3D DSA采集的原始数据在1 min内经主机传至Syngo Workplace工作站上, 以多种重建方式查看重建图像, 图像可手动优化清晰度并进行伪影校正及剪切调整.
1.2.2 评价指标: 由3名高年资介入医师及2名影像诊断医师对所有患者TACE前增强CT或MRI、DSA图像和DynaCT图像及TACE后CT扫描图像分别独立进行分析, 记录肝脏肿瘤所在的肝段, 并测量肿瘤数目和最大直径. 根据实验数据及最初的影像学表现决定患者随访期限, 平均每1-3 mo复查1次CT, 根据新发的早期强化瘤灶确定患者复发及转移程度, 统计患者无进展生存期及总生存期. 所有患者随访至2015-04. 手术时间计算标准均为对患者的实际介入操作时间.
统计学处理 所有统计学处理均采用SPSS19.0版本统计软件完成, 两组间手术时间、X线曝光量及对比剂用量均采用两独立样本的t检验; 常规DSA、DynaCT和螺旋CT对肿瘤病灶检出情况及对血供判断情况采用χ2检验. 以Kaplan-Meier方法进行生存分析, P<0.05为差异有统计学意义.
与常规DSA组相比, DynaCT组缩短了手术时间(P<0.05); 而两组间X线辐射量及造影剂用量间无统计学意义, 说明术中加做DynaCT检查并未增加X线辐射量和造影剂用量(表2, 图1, 图2).
| 分组 | 手术时间(min) | 辐射剂量(mGY) | 造影剂用量(mL) |
| DynaCT | 51.2±10.1 | 760.5±152.3 | 85.2±13.5 |
| 常规DSA | 69.3±13.2 | 780.3±132.6 | 88.3±15.1 |
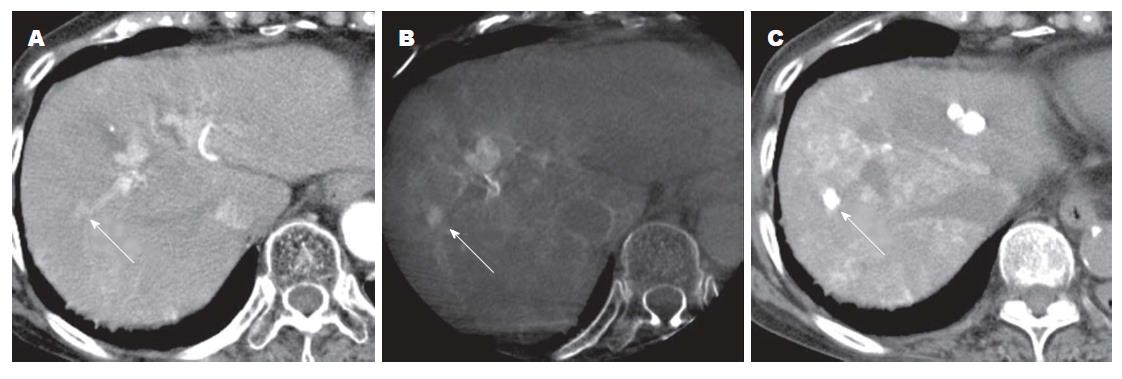
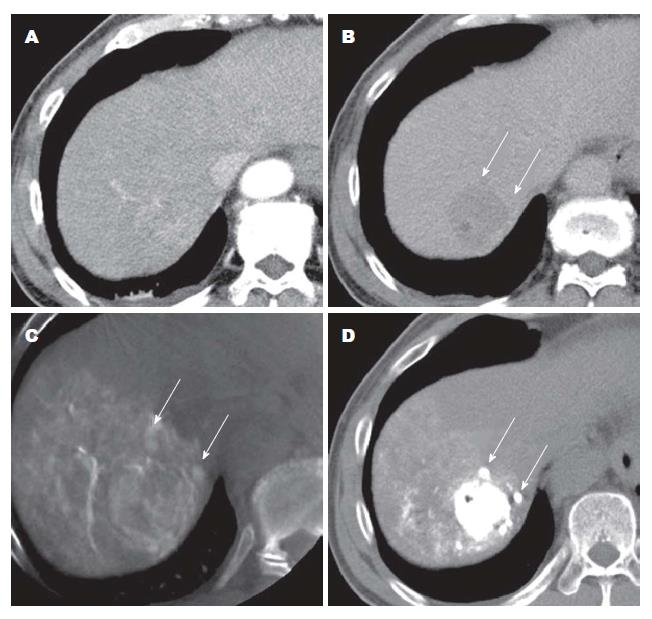
DynaCT组共检测病灶92个(46例患者), 直径<10 mm 35个, 10-20 mm 27个,>20 mm 30个. 在直径<10 mm及10-20 mm直径的小肝癌中, DynaCT的诊断敏感率明显优于螺旋CT(P<0.001); 直径>20 mm肝癌中3种检查方法均能明确诊断, 差异不具有统计学意义(表3, 图3).
| 病灶直径(mm) | 螺旋CT | 常规DSA | DynaCT | P值 |
| <10 | 8/35 | 12/35 | 33/35 | <0.001 |
| 10-20 | 12/27 | 19/27 | 26/27 | <0.001 |
| >20 | 30/30 | 30/30 | 30/30 | 1.000 |
| 合计 | 50/92 | 61/92 | 89/92 | <0.001 |
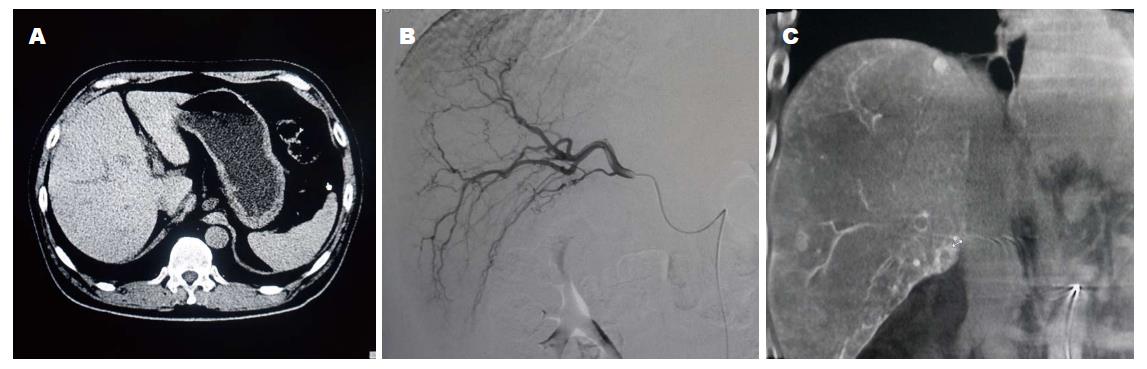
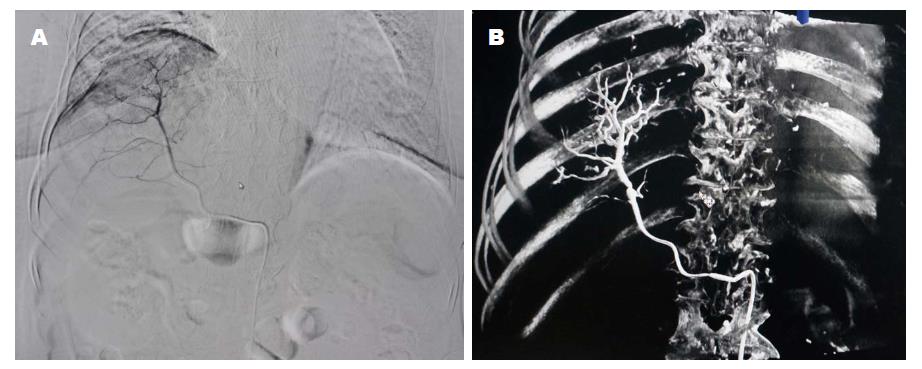
DynaCT组内46例患者中共有11例行常规DSA后发现肿瘤供血动脉严重前后重叠, 反复转动角度后仍不能分辨肿瘤具体供血动脉, 行增强DynaCT后, 其中9例肿瘤供血动脉分支及走行显影清晰, 超选择插管后诊断明确. 二者差异具有统计学意义(图3, 图4).
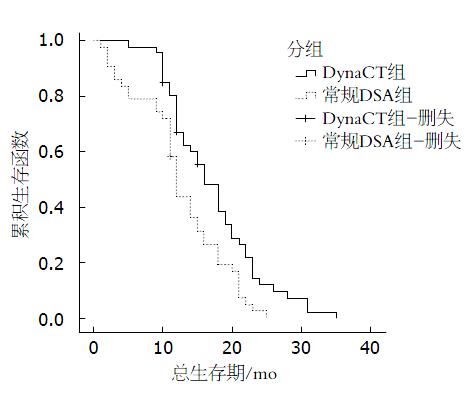
共随访85例患者, 失访4例. 截至2015-04, DynaCT组总生存期为17.3 mo±1.1 mo, 常规DSA组总生存期为12.6 mo±0.9 mo, 经Log-rank检验, P = 0.003(图5).
DynaCT技术是集合了平板DSA上C型臂旋转以及平板探测器同步采集的功能于一体, 可同时获得血管三维图像及靶器官软组织图像, 平面重建图像可避免DSA与CT室间搬运患者的繁琐与不安全因素[3]. 原发性肝癌的单次TACE治疗并不能完全性地消融肿瘤, 经常要经过多次治疗才可以达到更佳的疗效. TACE术中全面了解肝肿瘤侧支供血情况及肿瘤血供情况, 对治疗方案的制定及评估患者预后有很大的帮助[4]. 与常规DSA相比, DynaCT为肝癌介入治疗提供了额外的影像学信息, 使得TACE治疗更加完善与精确.
由于肝癌的血供丰富呈多样性, 大多数肝癌患者肿瘤供血动脉走形较复杂, 且有多支供血情况, 并存在肝外变异血供[5], 因此准确找到肿瘤的供应动脉并避开正常肝脏组织的供血动脉是超选择性插管的关键. 同时, 在提倡肝癌精准TACE治疗的趋势下[6], DynaCT可明确肿瘤的详细分段部位、血供来源及血管走行, 缩短手术操作时间, 从而能够减少操作医师及患者受辐射时间和造影剂总用量, 避免造影剂过量应用引起的心肾并发症, 还能够有效避免因血供来源不清采用排除法进行反复插管而造成的血管损伤. Meyer等[7]统计发现60%的病例中, DynaCT可提供有效的影像学信息, 而这些信息无法在常规DSA中体现, 进而为19%的患者制定了更完善的方案, 优化介入治疗的流程, 改善了患者预后. Wallace等[8]的研究表明, 在TACE治疗中应用DynaCT协助介入医师修正在常规DSA下的初步判断, 从而较快的将介入导管置于正确的位置, 避免了多走弯路的情况. 本文对患者介入过程中相关指标进行分析, 发现虽然术中行DynaCT需进行扫描前准备、DynaCT扫描及分析处理等过程延长操作时间, 但由于定位更准确, 避免了多次插管, 使得总操作时间DynaCT组患者要少于常规DSA组, 差异具有统计学意义; 尽管有人提出DynaCT扫描增加辐射量的质疑, 但由于减少反复透视插管及多次采集造影次数, 总体辐射量两组患者差异不显著, 本研究证明DynaCT并不会显著增加辐射量及操作时间, 并可减少对比剂大量应用引起的并发症, 可在肝癌介入治疗中广泛推广.
受限于部分肝癌的乏血供特点及肝硬化组织的不规则强化背景因素, 有23%的螺旋CT证实的病例其病灶不能在常规DSA上显示[9], 报道[10]中89%的极早期小肝癌(平均直径1.9 cm±1.1 cm)能够在DynaCT呈阳性改变, 另外所有小肝癌(平均直径1.3 cm±0.3 cm)不能被常规DSA检测到, DynaCT已被证实在肝癌诊断的准确性及敏感性都要优于常规DSA, 甚至在一定程度上也要优于螺旋增强CT扫描[11], Higashihara等[12]研究认为DynaCT在肝脏恶性肿瘤早期诊断中的敏感性与特异性可以与螺旋CT相媲美, 他们成为肝脏恶性肿瘤手术前评价肿瘤可切除性及治疗方式选择的重要依据. 这归因于DynaCT可以在周围软组织背景下清楚的显示瘤灶, 协助介入医师与术前螺旋CT进行对比, 并且由于在DynaCT过程中进行了间接门静脉造影, 对微小病灶的显示优于螺旋CT, 与文献[13]报道一致, 已成为肝癌巴塞罗那分期极早期肝癌的有效诊断手段, 在部分甲胎蛋白增高而螺旋CT阴性病例的早期诊断中阳性率较高. 本文的DynaCT组46患者中共检测了92个病灶, 在直径<10 mm及10-20 mm病灶中, DynaCT的敏感性要明显优于常规DSA及螺旋CT, 表明DynaCT技术在小肝癌的诊断上具有优势, 尤其对于原发性肝癌手术切除患者预防性介入治疗中有很大的意义. 本研究中有6例原发性肝癌手术切除患者于术后1 mo行预防性介入治疗, 术前腹部螺旋CT未发现复发病灶, 而DynaCT发现早期肝内转移病灶, 给予超选择插管后治疗效果良好, 生存期延长, 达到了介入治疗早期预防肝癌术后复发的目的.
DynaCT与常规DSA相比的另一优势为准确判定治疗结束时机, 避免栓塞剂如碘油等的栓塞不彻底, 同时在碘油沉积不理想时及时应用DynaCT扫描可发现正确血供或异位栓塞, 避免碘油过量栓塞引起肝功能受损情况. 而肝脏功能受损是影响TACE术后预后的独立影响因素[14]. Iwazawa等[15]认为, DynaCT可预警可能出现的肝功能损害, 并有助于观测碘油沉积情况, 其研究表明术中应用DynaCT的病例7 d后碘油沉积情况要优于常规DSA, 患者总生存期及无进展生存期较常规DSA组延长, 差异具有统计学意义. 本研究随访观察结果提示术中应用DynaCT的患者其总生存期要优于常规DSA治疗患者, 分析原因为应用DynaCT可早期发现微小病灶并给予积极处理, 降低肿瘤负荷, 延缓肿瘤发展进程, 同时可以通过正确选择供血动脉及治疗结束时机, 避免对正常肝脏组织的损害, 使患者预后好转, 生存期延长. 因此, DynaCT可为原发性肝癌介入治疗的提供有效的治疗信息, 协助介入医师制定合理方案, 提高患者预后及生存期, 值得广泛推广.
C臂计算机断层扫描(Dyna computed tomography, DynaCT)技术是集合了平板数字减影血管造影(digital subtraction angiography, DSA)上C型臂旋转以及平板探测器同步采集的功能于一体, 可同时获得血管三维图像及靶器官软组织图像, 平面重建图像可避免DSA与计算机断层扫描(computed tomography, CT)室间搬运患者的繁琐与不安全因素, 介入术后即可早期了解患者治疗效果.
肖恩华, 教授, 中南大学湘雅二医院放射教研室
DynaCT可提供有效的影像学信息, 而这些信息无法在常规DSA中体现, 进而为更多的患者制定了更完善的方案, 优化介入治疗的流程, 改善了患者预后. 目前DynaCT在神经介入中应用广泛, 而在腹部介入中应用较少, 缺少大样本量的病例报道.
DynaCT在肝脏恶性肿瘤早期诊断中的敏感性与特异性可以与螺旋CT相媲美, 他们成为肝脏恶性肿瘤手术前评价肿瘤可切除性及治疗方式选择的重要依据. 这些报道可为DynaCT技术早期肝癌诊断提供依据. DynaCT技术提供的诊断与治疗信息更佳, 协助介入医师制定合理的诊治路径.
本研究与常规螺旋CT及普通DSA之间进行对比分析, 对不同范围大小的肝癌诊断率进行总结, 明确其在肝癌介入治疗术前诊断及术中介入方式选择上的独特优势, 目前尚无相关报道.
对原发性肝癌术后早期预防复发及判定介入治疗时机提供依据, 可根据其早期发现的肝内转移病灶较早实施干预治疗, 延长患者生存期.
DynaCT技术作为一种新的影像技术, 在肝癌的TACE过程中能给予介入医师更多关于肿瘤部位、血供来源方面的信息, 有助于发现20 mm直径以下的病灶; 有助于显示肿瘤供血动脉分支及其走行, 从而使肝癌患者获益.
编辑: 郭鹏 电编:都珍珍
| 1. | Lo CM, Ngan H, Tso WK, Liu CL, Lam CM, Poon RT, Fan ST, Wong J. Randomized controlled trial of transarterial lipiodol chemoembolization for unresectable hepatocellular carcinoma. Hepatology. 2002;35:1164-1171. [PubMed] [DOI] |
| 4. | 李 立, 林 浩皋, 张 伟章, 吴 沛宏. 原发性肝癌术后复发的动脉栓塞治疗. 影像诊断与介入放射学. 1997;6:232-234. |
| 7. | Meyer BC, Frericks BB, Albrecht T, Wolf KJ, Wacker FK. Contrast-enhanced abdominal angiographic CT for intra-abdominal tumor embolization: a new tool for vessel and soft tissue visualization. Cardiovasc Intervent Radiol. 2007;30:743-749. [PubMed] [DOI] |
| 8. | Wallace MJ, Murthy R, Kamat PP, Moore T, Rao SH, Ensor J, Gupta S, Ahrar K, Madoff DC, McRae SE. Impact of C-arm CT on hepatic arterial interventions for hepatic malignancies. J Vasc Interv Radiol. 2007;18:1500-1507. [PubMed] [DOI] |
| 9. | Iwazawa J, Ohue S, Mitani T, Abe H, Hashimoto N, Hamuro M, Nakamura K. Identifying feeding arteries during TACE of hepatic tumors: comparison of C-arm CT and digital subtraction angiography. AJR Am J Roentgenol. 2009;192:1057-1063. [PubMed] |
| 10. | Miyayama S, Matsui O, Yamashiro M, Ryu Y, Takata H, Takeda T, Aburano H, Shigenari N. Detection of hepatocellular carcinoma by CT during arterial portography using a cone-beam CT technology: comparison with conventional CTAP. Abdom Imaging. 2009;34:502-506. [PubMed] [DOI] |
| 11. | Kakeda S, Korogi Y, Ohnari N, Moriya J, Oda N, Nishino K, Miyamoto W. Usefulness of cone-beam volume CT with flat panel detectors in conjunction with catheter angiography for transcatheter arterial embolization. J Vasc Interv Radiol. 2007;18:1508-1516. [PubMed] [DOI] |
| 12. | Higashihara H, Osuga K, Onishi H, Nakamoto A, Tsuboyama T, Maeda N, Hori M, Kim T, Tomiyama N. Diagnostic accuracy of C-arm CT during selective transcatheter angiography for hepatocellular carcinoma: comparison with intravenous contrast-enhanced, biphasic, dynamic MDCT. Eur Radiol. 2012;22:872-879. [PubMed] [DOI] |
| 13. | 李 建军, 郑 加生, 崔 雄伟, 王 向东. 64排CT与DSA及C臂CT检出肝癌小病灶的对比. 中国介入影像与治疗学. 2011;8:236-239. |
| 14. | Huppert PE, Lauchart W, Duda SH, Torkler C, Kloska SP, Weinlich M, Benda N, Pereira P, Claussen CD. [Chemoembolization of hepatocellular carcinomas: which factors determine therapeutic response and survival?]. Rofo. 2004;176:375-385. [PubMed] |
| 15. | Iwazawa J, Ohue S, Hashimoto N, Muramoto O, Mitani T. Survival after C-arm CT-assisted chemoembolization of unresectable hepatocellular carcinoma. Eur J Radiol. 2012;81:3985-3992. [PubMed] [DOI] |