修回日期: 2015-07-21
接受日期: 2015-07-24
在线出版日期: 2015-08-18
目的: 观察上调miR-203表达对肝星状细胞增殖活性及胶原合成的影响.
方法: 利用Lipofectamine™ 2000将miR-203模拟物(mimics)转染大鼠肝星状细胞(HSC-T6), 培养48 h后, 收集细胞提取总蛋白和总RNA, 分别行Western blot和RT-qPCR, 检测α平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)、Ⅰ型胶原和Ⅲ型胶原表达; MTT(噻唑蓝)法检测细胞增殖活性.
结果: 与阴性对照组相比, miR-203 mimics组α-SMA蛋白和mRNA表达分别下降75%和80%(均P<0.01); Ⅰ型胶原蛋白表达下降56%(P<0.01), mRNA表达下降48%(P<0.05); Ⅲ型胶原蛋白与mRNA表达分别下降45%和60%(P<0.05); HSC-T6细胞增殖活性下降20%±5%(P<0.01).
结论: 上调miR-203表达能显著抑制肝星状细胞增殖及胶原合成.
核心提示: 上调miR-203表达可以明显抑制肝星状细胞增殖活性, 降低胶原合成的能力, 根据本研究结果及以往世界范围内研究显示miR-203在肝纤维化形成过程中起到负调控的作用.
引文著录: 胡丹平, 胡益冰, 徐旺旺, 徐婷燕, 倪顺兰, 付荣泉. 上调miR-203表达对肝星状细胞增殖及胶原合成的影响. 世界华人消化杂志 2015; 23(23): 3749-3754
Revised: July 21, 2015
Accepted: July 24, 2015
Published online: August 18, 2015
AIM: To investigate the impact of upregulation of miR-203 on cell proliferation and collagen synthesis in hepatic stellate cells.
METHODS: HSC-T6 cells were transfected with miR-203 mimic using Lipofectamine™ 2000, and propagated for 48 h. Total proteins and total RNAs were extracted from these cells. The mRNA and protein expression of α-smooth muscle actin (α-SMA), type Ⅰ collagen and type Ⅲ collagen was measured by RT-qPCR and Western blot, respectively. The proliferation of HSC-T6 cells was assessed using MTT assay.
RESULTS: Compared with the negative control group, α-SMA protein and mRNA expression in the miR-203 mimic group decreased by 75% and 80%, respectively (P < 0.01); type Ⅰ collagen protein and mRNA expression decreased by 56% (P < 0.01) and 48% (P < 0.05), respectively; type Ⅲ collagen protein and mRNA expression decreased 45% and 60%, respectively (P < 0.05); cellular proliferative activity decreased by 20% ± 5% (P < 0.01).
CONCLUSION: Upregulation of miR-203 can significantly inhibit cell proliferation and collagen synthesis in hepatic stellate cells.
- Citation: Hu DP, Hu YB, Xu WW, Xu TY, Ni SL, Fu RQ. Impact of upregulation of miR-203 on cell proliferation and collagen synthesis in hepatic stellate cells. Shijie Huaren Xiaohua Zazhi 2015; 23(23): 3749-3754
- URL: https://www.wjgnet.com/1009-3079/full/v23/i23/3749.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i23.3749
肝纤维化(hepatic fibrosis)是多种病因引起的肝脏慢性损伤修复过程中肝内细胞外基质(extracellular matrix, ECM)生成与降解失衡的病理生理过程[1]. 肝星状细胞(hepatic stellate cells, HSCs)的激活是肝纤维化形成过程中的关键环节, 激活的HSC分化转移, 拥有肌成纤维细胞(myofibroblast, MFB)表型, 成为ECM的主要来源[2,3]. 微小RNA(microRNA, miRNA)是动物和植物细胞中自然产生的18-24 nt的非编码小RNA[4], 参与调节多种纤维化信号通路和细胞外基质生成[5]. 目前已有大量研究[5-8]发现miRNAs参与肝纤维化发生. 关于miR-203与肝纤维化的关系, Song等[9]研究发现miR-203在肝纤维化组织和转化生长因子-β1(transforming growth factor-β1, TGF-β1)处理的大鼠肝星状细胞(HSC-T6)中表达下调, 但miR-203对HSC胶原合成的影响尚不清楚, 本实验将通过上调miR-203表达观察HSC增殖能力及胶原合成的变化, 初步探索miR-203在肝纤维化发生胶原合成过程中的作用.
大鼠肝星状细胞株(HSC-T6)温州医科大学附属第一医院肝病中心实验室贮存. 高糖型DMEM和胎牛血清购自美国Gibco公司; Opti-MEM® Ⅰ Reduced Serum Medium购自Gibco公司; Lipofectamine™ 2000购自美国Invitrogen公司; miR-203模拟物(mimics)和NC-miRNA由上海吉玛制药技术有限公司(GenePharma)合成; TRIzol试剂购自美国Invitrogen公司; 逆转录试剂盒购自美国Thermo公司; 引物由上海吉玛制药技术有限公司(GenePharma)合成; 荧光实时定量PCR使用日本东洋纺(TOYOBO, Japan)SYBR® Green Real-time PCR Master Mix-Plus; 定量PCR仪使用美国APPLIED BIOSYSTENS 7500; 内参GAPDH多克隆抗体购自杭州贤至生物科技有限公司(GOOD HERE); α平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)和Ⅰ型、Ⅲ型胶原单克隆抗体购自美国abcam公司; 辣根过氧化物酶标记羊抗兔和羊抗小鼠二抗购自中国biosharp生物科技公司; BCA蛋白浓度检测试剂盒购自中国碧云天生物技术研究所(Beyotime); MTT细胞增殖及细胞毒性检测试剂盒购自凯基生物公司(KeyGEN BioTECH).
1.2.1 大鼠肝星状细胞(HSC-T6)的培养: HSC-T6细胞接种于25 cm2的培养瓶中, 使用含10%胎牛血清(FBS)的高糖型DMEM培养基, 培养在37 ℃, 50 mL/L CO2培养箱内. 贴壁生长, 24 h换液1次, 3-4 d细胞长满培养瓶底, 用0.25%胰酶消化传代1次.
1.2.2 细胞转染: 6孔板接种细胞, 每孔接种细胞约(1.0-2.5)×105个, 加入不含抗生素的完全培养基(含10%胎牛血清), 37 ℃, 50 mL/L CO2培养24 h, 细胞融合度约70%, 换不完全培养基(不含胎牛血清的Opti-MEM培养基)继续培养约10-12 h. 根据Lipofectamine™ 2000说明书转染等量miR-203模拟物(mimics)和NC-miRNA, 继续培养4-6 h后换含2%胎牛血清培养基, 继续培养48 h提取总蛋白和总RNA.
1.2.3 RT-qPCR: HSC-T6细胞转染48 h后使用TRIzol试剂提取细胞总RNA, 用赛默飞(Thermo, USA)RevertAid First Strand cDNA Synthesis Kit试剂盒逆转录合成cDNA, 用日本东洋纺(TOYOBO, Japan)SYBR® Green Real-time PCR Master Mix-Plus试剂盒进行实时荧光定量PCR, PCR循环使用两步法: 95 ℃ 15 s; 60 ℃ 60 s, 扩增40个循环. 引物由上海吉玛制药技术有限公司(GenePharma)合成(表1).
| 引物名称 | 引物序列 | 扩增大小(bp) |
| β-actin | F: 5'-CGTAAAGACCTCTATGCCAACA-3' | 131 |
| R: 5'-GGAGGAGCAATGATCTTGATCT-3' | ||
| α-SMA | F: 5'-GTGCTGTCCCTCTATGCCTCTGG-3' | 77 |
| R: 5'-GGCACGTTGTGAGTCACACCATC-3' | ||
| Col1a1 | F: 5'-GTACATCAGCCCAAACCCCAAG-3' | 95 |
| R: 5'-CGGAACCTTCGCTTCCATACTC-3' | ||
| Col3a1 | F: 5'-GACTGCCCCAACCCAGAGATC-3' | 88 |
| R: 5'-TACCATCAGGAATGACAGGAGCAG-3' | ||
| Rno-miR-203 | F: 5'-CGATGCTGTGAAATGTTTAGGGAC-3' | 67 |
| R: 5'-TATGGTTTTGACGACTGTGTGAT-3' | ||
| U6 | F: 5'-ATTGGAACGATACAGAGAAGATT-3' | 70 |
| R: 5'-GGAACGCTTCACGAATTTG-3' |
1.2.4 总蛋白提取和Western blot法: HSC-T6细胞转染48 h, 弃旧培养基, 磷酸盐缓冲液(PBS液)冲洗, 每孔加入150-250 μL RIPA(Radio Immunoprecipitation Assay)裂解液, 按组收集培养板内细胞与RIPA裂解液混合物至1.5 mL EP管中, 冰上裂解30 min, 4 ℃ 10000 r/min 10 min, 上清分装至新EP管中, BCA蛋白浓度检测试剂盒测蛋白浓度, -80 ℃长期保存. 取10-20 μg总蛋白进行SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE), 并使用PVDF膜转膜, 5%BSA封闭90 min, 一抗4 ℃孵育过夜, TBS-T(含0.2% Tween-20, 20 mmol/L Tris-HCl, 150 mmol/L NaCl)洗膜4次, 每次7 min; 二抗室温孵育1 h, TBS-T再次洗膜4次, 每次7 min, 应用Bio-Rad凝胶成像分析仪采集并分析结果. 一抗分别为兔抗大鼠GAPDH(1:1000), 兔抗大鼠α-SMA单克隆抗体(1:1000); 小鼠抗大鼠Ⅰ型胶原和Ⅲ型胶原单克隆抗体(1:500). 二抗分别为辣根过氧化物酶标记羊抗兔和羊抗小鼠的抗体(1:8000).
1.2.5 细胞增殖与细胞毒性实验(MTT法): 采用噻唑蓝(MTT)比色法. 取对数生长期细胞约1×104个/孔加入96孔板, 分3组, 分置于37 ℃, 50 mL/L CO2培养箱内培养24 h, 换无血清培养基继续培养10-12 h, 转染后6 h换液继续培养48 h, 每孔加入50 μL 1×MTT, 37 ℃孵育4 h, 使MTT还原为甲臜. 去上清, 每孔加入150 μL二甲基亚砜(DMSO)溶解甲臜, 酶标仪490 nm处检测每孔的吸光度值(A值). 根据MTT试剂盒说明书计算细胞增殖活性.
统计学处理 用SPSS20.0统计软件进行统计学分析, 实验数据均采用mean±SD表示, 两样本均数比较采用t检验, P<0.05为差异具有统计学意义.
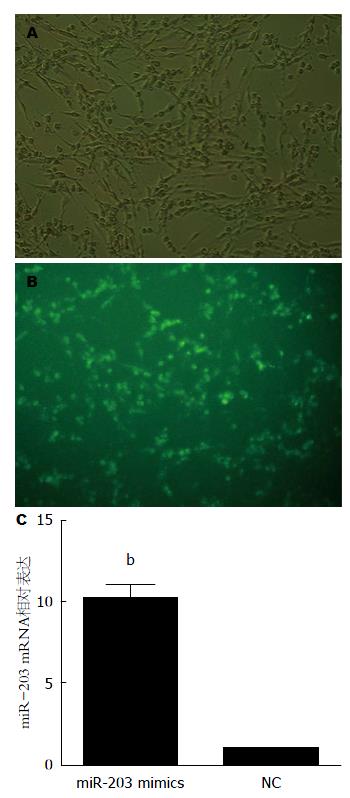
荧光显微镜观察转染HSC-T6细胞的转染效率达80%以上, 如图1A, B; RT-qPCR结果提示miR-203 mimics和阴性对照组(NC组)相比miR-203表达明显上升, miR-203 mimics组是阴性对照组的10倍(P<0.01)(图1C).
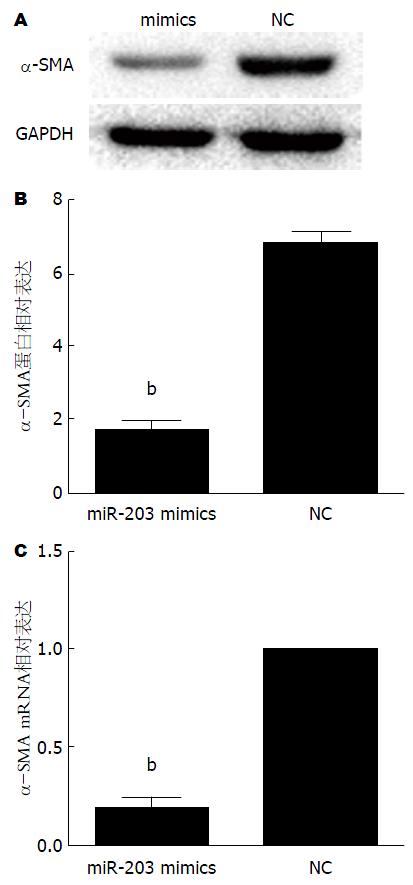
与阴性对照组相比, Western blot结果显示miR-203组较NC组α-SMA蛋白相对表达减少约75%(P<0.01)(图2A, B); RT-qPCR结果显示miR-203 mimics较NC组α-SMA mRNA相对表达量减少约80%(P<0.01)(图2C). 结果提示上调miR-203表达可抑制HSC-T6表达α-SMA.
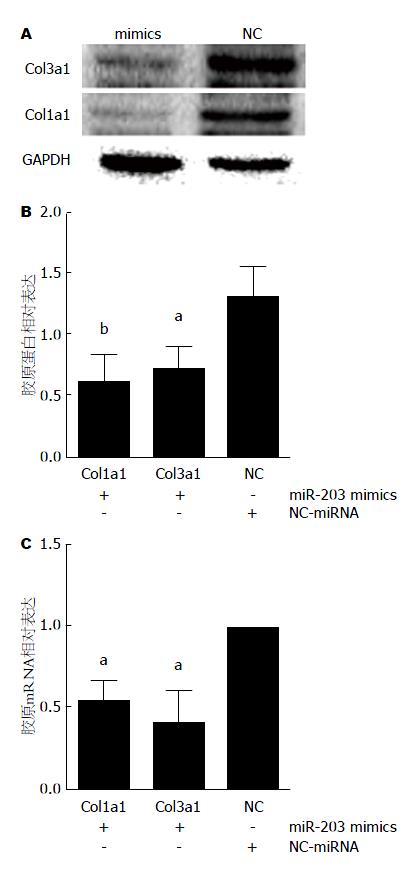
与阴性对照组(NC组)相比, Western blot结果显示miR-203 mimics组较阴性对照组Ⅲ型胶原蛋白相对表达量减少约45%(P<0.05), Ⅰ型胶原蛋白相对表达量减少约56%(P<0.01)(图3A, B); RT-qPCR结果显示miR-203 mimics组较阴性对照组Ⅲ型胶原mRNA相对表达下降约60%(P<0.05), Ⅰ型胶原mRNA相对表达下降约48%(P<0.05)(图3C). 结果提示上调miR-203表达可抑制HSC-T6合成Ⅰ型和Ⅲ型胶原.
MTT比色法结果分析显示miR-203 mimics组A值为0.86±0.05, NC组为0.65±0.07, miR-203 mimics组增殖活性较NC组下降约20%±5%(P<0.01). 结果提示上调miR-203表达可抑制HSC-T6增殖活性.
肝纤维化是慢性肝脏疾病进展为肝硬化的中心环节, 目前有动物实验和临床研究[10]发现肝纤维化存在逆转可能, 如果能阻止、减弱甚至逆转肝纤维化发生发展,将会很大程度上改善慢性肝脏疾病预后. 近年来肝纤维化一直是肝病研究领域的重点, 目前为止尚无有效治疗肝纤维化的方法[11].
ECM合成与降解失衡, 并在肝内沉积是肝纤维化发生的关键环节[2]. 抑制、降解ECM是目前研究肝纤维化治疗策略重点方向之一[12,13]. Ⅰ型胶原和Ⅲ型胶原是ECM的主要成分, 是研究肝纤维化的重要标志[1]. α-SMA具有收缩功能, HSC活化后大量分泌, 是研究肝纤维化发生发展灵敏的指标之一[14].
miRNAs是内源性小分子非编码RNA, 目前已有较多研究[7,8,15-17]显示miRNAs参与肝纤维化发生发展, 研究通过调节miRNAs表达观察对肝纤维化发生的影响, 从而探索miRNA对肝纤维化潜在的治疗作用. Song等[9]通过研究发现肝纤维化发生时miR-203表达下调, 但该研究中miR-203对HSC胶原合成的影响尚不清楚, 本实验通过转染miR-203 mimics上调miR-203表达时观察到HSC-T6细胞Ⅰ型胶原、Ⅲ型胶原及α-SMA表达明显下降; 细胞增殖试验(MTT法)观察到上调miR-203表达后HSC-T6增殖能力明显下降, 本次研究结果显示miR-203对HSC胶原合成具有负向调节作用, 进一步完善了对miR-203在肝纤维化发生中作用的研究, 然而, 本实验尚未涉及miR-203影响HSC胶原合成的调节机制, 需要进一步研究阐明. 本实验设计限于细胞水平研究, 有待于更广泛的研究进一步阐明miR-203在肝纤维化发生发展中的作用, 为将来研究肝纤维化治疗策略提供帮助.
miRNA与肝纤维化发生发展的关系在全世界范围内已有大量研究, 显示肝纤维化组织与肝星状细胞内miR-203表达下调有关. 在此基础上, 本文在细胞水平上调miR-203表达, 观察HSC-T6细胞增殖活性和胶原合成变化, 进一步完善miR-203在肝纤维化发生中的作用.
朱传武, 教授, 主任医师, 苏州市第五人民医院肝病科
miRNA与肝纤维化发生发展是近几年肝纤维化研究领域的热点, 重点是miRNA影响肝纤维化机制研究, 目前尚未完全阐明, 仍需进一步深入研究.
Song等发现大鼠肝纤维化组织与活化的肝星状细胞miR-203和瞬时受体阳离子通道亚家族V成员4(transient receptor potential cation channel, subfamily V, member 4, TRPV4)表达下调, 生物信息学预测TRPV4是miR-203的靶基因, 通过上调miR-203表达观察到肝星状细胞增殖活性下调; 双荧光素酶报告基因实验证实TRPV4与miR-203的靶向关系.
miR-203在肝纤维化发生中的作用研究尚少, Song等研究发现上调miR-203表达抑制肝星状细胞增殖活性, 本文通过实验进一步发现上调miR-203表达抑制肝星状细胞胶原的合成.
此文章进一步完善了miR-203在肝纤维化发生中的作用, 为将来研究深入肝纤维化治疗策略提供帮助.
本文在细胞水平上研究了上调miR-203表达对肝星状细胞增殖活性及胶原合成的影响, 研究在设计、方法上有自己的特点, 有一定意义.
编辑: 郭鹏 电编:都珍珍
| 1. | Friedman SL. Mechanisms of hepatic fibrogenesis. Gastroenterology. 2008;134:1655-1669. [PubMed] [DOI] |
| 2. | Jiao J, Friedman SL, Aloman C. Hepatic fibrosis. Curr Opin Gastroenterol. 2009;25:223-229. [PubMed] |
| 3. | Li D, Friedman SL. Liver fibrogenesis and the role of hepatic stellate cells: new insights and prospects for therapy. J Gastroenterol Hepatol. 1999;14:618-633. [PubMed] |
| 4. | Bartel DP. MicroRNAs: target recognition and regulatory functions. Cell. 2009;136:215-233. [PubMed] [DOI] |
| 5. | Vettori S, Gay S, Distler O. Role of MicroRNAs in Fibrosis. Open Rheumatol J. 2012;6:130-139. [PubMed] [DOI] |
| 6. | He X, Xie J, Zhang D, Su Q, Sai X, Bai R, Chen C, Luo X, Gao G, Pan W. Recombinant adeno-associated virus-mediated inhibition of microRNA-21 protects mice against the lethal schistosome infection by repressing both IL-13 and transforming growth factor beta 1 pathways. Hepatology. 2015;61:2008-2017. [PubMed] [DOI] |
| 7. | Yu F, Guo Y, Chen B, Dong P, Zheng J. MicroRNA-17-5p activates hepatic stellate cells through targeting of Smad7. Lab Invest. 2015;95:781-789. [PubMed] [DOI] |
| 8. | Lakner AM, Steuerwald NM, Walling TL, Ghosh S, Li T, McKillop IH, Russo MW, Bonkovsky HL, Schrum LW. Inhibitory effects of microRNA 19b in hepatic stellate cell-mediated fibrogenesis. Hepatology. 2012;56:300-310. [PubMed] [DOI] |
| 9. | Song Y, Zhan L, Yu M, Huang C, Meng X, Ma T, Zhang L, Li J. TRPV4 channel inhibits TGF-β1-induced proliferation of hepatic stellate cells. PLoS One. 2014;9:e101179. [PubMed] [DOI] |
| 10. | Ramachandran P, Iredale JP. Liver fibrosis: a bidirectional model of fibrogenesis and resolution. QJM. 2012;105:813-817. [PubMed] [DOI] |
| 11. | Friedman SL. Evolving challenges in hepatic fibrosis. Nat Rev Gastroenterol Hepatol. 2010;7:425-436. [PubMed] [DOI] |
| 12. | Kawada N. Evolution of hepatic fibrosis research. Hepatol Res. 2011;41:199-208. [PubMed] [DOI] |
| 13. | Henderson NC, Iredale JP. Liver fibrosis: cellular mechanisms of progression and resolution. Clin Sci (Lond). 2007;112:265-280. [PubMed] [DOI] |
| 14. | Russo MW, Firpi RJ, Nelson DR, Schoonhoven R, Shrestha R, Fried MW. Early hepatic stellate cell activation is associated with advanced fibrosis after liver transplantation in recipients with hepatitis C. Liver Transpl. 2005;11:1235-1241. [PubMed] [DOI] |
| 15. | Wang XW, Heegaard NH, Orum H. MicroRNAs in liver disease. Gastroenterology. 2012;142:1431-1443. [PubMed] [DOI] |
| 16. | Venugopal SK, Jiang J, Kim TH, Li Y, Wang SS, Torok NJ, Wu J, Zern MA. Liver fibrosis causes downregulation of miRNA-150 and miRNA-194 in hepatic stellate cells, and their overexpression causes decreased stellate cell activation. Am J Physiol Gastrointest Liver Physiol. 2010;298:G101-G106. [PubMed] [DOI] |
| 17. | Feng X, Tan W, Cheng S, Wang H, Ye S, Yu C, He Y, Zeng J, Cen J, Hu J. Upregulation of microRNA-126 in Hepatic Stellate Cells May Affect Pathogenesis of Liver Fibrosis Through the NF-κB Pathway. DNA Cell Biol. 2015;34:470-480. [PubMed] [DOI] |