修回日期: 2015-07-02
接受日期: 2015-07-13
在线出版日期: 2015-08-18
目的: 探讨趋化因子受体CX3CR1对骨髓间充质干细胞(bone marrow-mesenchymal stem cells, BM-MSCs)修复受损肠上皮细胞的影响.
方法: 体外分离培养、鉴定BM-MSCs. 采用肿瘤坏死因子-α(tumor necrosis factor alpha, TNF-α)处理结肠癌上皮细胞(colon adenocarcinoma epithelial cell line, Caco-2)建立肠上皮损伤模型. 实验分为6组: (1)单纯BM-MSCs组; (2)单纯Caco-2组; (3)Caco-2+TNF-α组; (4)BM-MSCs+Caco-2组; (5)BM-MSCs+Caco-2+TNF-α组; (6)anti-CX3CR1-BM-MSCs+Caco-2+TNF-α组, 利用Transwell培养板将各组共培养, 通过免疫荧光、Western blot及荧光定量RT-PCR方法检测Caco-2上ZO-1(zonula occluden 1)、Occludin和BM-MSCs上CX3CR1蛋白及mRNA表达水平.
结果: 选择100 ng/mL TNF-α处理Caco-2细胞48 h建立损伤模型后, 检测ZO-1和Occludin表达水平明显降低(P<0.05). 在BM-MSCs与未受损的Caco-2共培养时ZO-1、Occludin和CX3CR1蛋白及mRNA的表达不受影响, 而在BM-MSCs与受损Caco-2共培养时, 其表达增加(P<0.05). 阻断CX3CR1后, ZO-1、Occludin蛋白及mRNA的表达与未阻断前相比明显减少(P<0.05).
结论: CX3CR1参与BM-MSCs对受损肠上皮的修复.
核心提示: 本文应用肿瘤坏死因子-α(tumor necrosis factor alpha)处理结肠腺癌Caco-2细胞, 成功建立肠黏膜上皮细胞损伤模型, ZO-1(zonula occluden 1)和Occludin表达水平明显降低, 将BM-MSCs和受损Caco-2共培养, ZO-1、Occludin和CX3CR1蛋白及mRNA的表达水平增加, 阻断CX3CR1后, ZO-1、Occludin蛋白及mRNA的表达与未阻断前相比明显减少, 揭示了CX3CR1能够参与骨髓间充质干细胞对受损肠上皮的修复作用.
引文著录: 曹毅, 刘涛, 尹明丽, 张博雅, 宋红丽. CX3CR1对骨髓间充质干细胞修复受损肠上皮细胞的影响. 世界华人消化杂志 2015; 23(23): 3670-3682
Revised: July 2, 2015
Accepted: July 13, 2015
Published online: August 18, 2015
AIM: To investigate the role of chemokine receptor CX3CR1 in the repair of injured intestinal epithelial cells by bone marrow mesenchymal stem cells (BM-MSCs).
METHODS: BM-MSCs were cultured and identified in vitro. Caco-2 cells were exposed to tumor necrosis factor alpha (TNF-α) to establish a cell model of injured intestinal epithelium. Cells were divided into six groups: BM-MSCs, Caco-2 cells, Caco-2 cells treated with TNF-α, co-cultured BM-MSCs and Caco-2 cells, co-cultured BM-MSCs and Caco-2 cells treated with TNF-α, and co-cultured BM-MSCs and Caco-2 cells treated with anti-CX3CR1 and TNF-α. The expression of tight junction proteins and mRNAs in Caco-2 cells, and CX3CR1 protein and mRNA in BM-MSCs was detected by immunofluorescence, Western blot and RT-PCR.
RESULTS: We selected 100 ng/mL TNF-α for 48 h to establish the injured model, because the expression of zonula occluden 1(ZO-1) and Occludin was reduced significantly at this time point (P < 0.05). The protein and mRNA levels of ZO-1, Occludin and CX3CR1 had no significant changes when BM-MSCs were co-cultured with untreated Caco-2 cells, but increased when BM-MSCs were co-cultured with injured Caco-2 cells (P < 0.05). When CX3CR1 was blocked, the protein and mRNA levels of ZO-1 and Occludin decreased significantly.
CONCLUSION: CX3CR1 participates in the repair of injured intestinal epithelial cells by BM-MSCs.
- Citation: Cao Y, Liu T, Yin ML, Zhang BY, Song HL. Role of CX3CR1 in repair of injured intestinal epithelial cells by bone marrow mesenchymal stem cells. Shijie Huaren Xiaohua Zazhi 2015; 23(23): 3670-3682
- URL: https://www.wjgnet.com/1009-3079/full/v23/i23/3670.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i23.3670
炎症性肠病、肝硬化、严重烧伤、缺血休克等疾病状态都会使肠道结构和功能遭到严重损害, 引发肠黏膜屏障功能障碍, 甚至全身炎症反应综合征和多器官功能障碍综合征等严重并发症[1-4]. 而在这些疾病的治疗中, 对于肠道的保护尤为重要. 研究[5,6]表明, 骨髓间充质干细胞(bone marrow-mesenchymal stem cells, BM-MSCs)对受损肠上皮组织有修复、支持作用. 但其定向分化修复作用主要是在其到达受损位点的前提下发挥的. 由于受损部位释放细胞信号, 如趋化因子、选择素、整合蛋白和其他黏附分子可与间充质干细胞上的细胞信号受体结合, 促使其到达受损部位发挥治疗作用[7-12]. 其中趋化因子发挥重要作用. 趋化因子被分为C、CC、CXC、CX3C 4个亚家族, 其受体对应为CR、CCR、CXCR、CX3CR. 对于哪种趋化因子及其受体相互作用调控BM-MSCs迁移到受损肠道组织发挥作用目前尚不清楚. 大量研究[13-15]指出, 当肠道组织受到炎性刺激时, CC、CXC亚族趋化因子及其配体会参与其中. 但关于CX3C亚族及其配体是否发挥作用尚无报道. CX3C类目前只发现CX3CRl-CX3CLl存在, 而CX3CRl表达在BM-MSCs表面, 故本实验旨在探讨CX3CRl在BM-MSCs修复受损肠上皮细胞过程中是否发挥作用.
实验动物选用SPF(Specific Pathogen Free)级健康、♂Wistar大鼠, 体质量60-80 g, 购自军事医学科学院实验动物中心. Caco-2细胞株购自美国模式生物典藏中心(American Type Culture Collection, ATCC). DMEM/F12培养基、L-DMEM/F12培养基、RPMI-1640培养基、胰蛋白酶/EDTA细胞消化液(Gibco, 美国)、胎牛血清(fetal bovine serum, FBS)(PAA, 奥地利); DMSO(Sigma-Aldrich, 美国)、抗大鼠CD34-异硫氰酸荧光素(fluorescein isothiocyanate, FITC)、CD29-PE、CD45-PE、CD90-FITC、RT1A-PE、RT1B-FITC(Biolegend, 美国)、Transwell小室(CORNING, 美国)、FACSCalibur流式细胞仪(BD, 美国)、重组人类肿瘤坏死因子-α(tumor necrosis factor alpha, TNF-α)(PeProTech, 美国)、兔抗Occludin抗体、兔抗CX3CRl抗体、兔抗GAPDH抗体、HRP标记山羊抗兔IgG(Abcam, 美国)、兔抗ZO-1(zonula occluden 1)抗体(Invitrogen, 美国)、Western blot相关试剂购自武汉博士德; 山羊血清(索莱宝, 中国), RNAiso Plus RNA等提取相关试剂、PrimeScriPt Ⅱ第一链cDNA合成试剂盒及SYBR Premix Ex Taq Ⅱ荧光定量PCR试剂盒(TaKaRa, 日本), 荧光定量PCR仪(APPlied Biosystems 7300, 美国).
1.2.1 BM-MSCs体外分离、培养及流式鉴定: Wistar大鼠处死, 取股骨和胫骨、减去骨骺, 用含10%血清的DMEM/F12完全培养液反复冲洗骨髓腔, 制成单细胞悬液, 接种培养瓶中, 37 ℃、50 mL/L CO2培养. 48 h换液, 去掉未贴壁细胞, 待细胞密度达到80%-90%融合时, 1:2传代培养. 使用生长状况良好的第三代BM-MSCs进行后续实验.
取生长良好的第三代BM-MSCs, 消化成单细胞悬液, 调整细胞浓度为106/mL, 加入荧光标记CD29-PE、CD45-PE、RT1A-PE、CD34-FITC、CD90-FITC、RT1B-FITC, 避光孵育30 min, 洗涤, 流式细胞仪检测这些表面标记的表达.
1.2.2 BM-MSCs向脂肪细胞的诱导分化: 在100 mL含10%血清的L-DMEM/F12培养液中, 加入200 mmol/L吲哚美辛50 μL, 0.5 mol/L 1-甲基-3-异丁基黄嘌呤100 μL, 40 U/mL胰岛素550 μL, 1 mmol/L地塞米松100 μL, 配制成成脂诱导培养液. 将BM-MSCs接种在6孔板中培养. 待细胞生长稳定后, 更换为成脂诱导培养液培养, 每3 d换液. 8-12 d时, 用油红O染液染色, 显微镜下观察细胞浆内橘红脂滴着色.
1.2.3 BM-MSCs向成骨细胞的诱导分化: 在100 mL含10%血清的L-DMEM/F12培养液中, 加入1 mmol/L地塞米松10 μL, 1 mol/L甘油磷酸钠 1 mL, 100 mg/mL维生素C 50 μL混匀, 调整pH值在7.3-7.4, 配制成成骨诱导培养液. 将BM-MSCs接种在6孔板中培养. 待细胞生长稳定后, 更换为成骨诱导培养液培养, 每3 d换液. 14 d左右, 用Von Kossa染色试剂盒染色. 显微镜下观察黑色钙盐颗粒沉积.
1.2.4 肠黏膜上皮损伤模型的建立: 用含10%血清的RPMI-1640完全培养液, 37 ℃、50 mL/L CO2培养Caco-2细胞. 隔天换液, 待细胞铺满80%以上瓶底时, 按1:2传为二代细胞. 取状态良好的Caco-2细胞, 按5×105/孔接种于六孔板中, 培养24 h左右, 待细胞贴壁均匀、单层融合后, 分别加入终浓度为0、50、100和200 ng/mL的重组人TNF-α培养48 h, 以及使用100 ng/mL的重组人TNF-α分别培养0、12、24和48 h[16,17]. 利用免疫荧光检测紧密连接蛋白ZO-1形态及表达, RT-PCR及Western blot技术检测紧密连接蛋白ZO-1和Occludin的含量来判定肠黏膜上皮细胞的损伤程度. 探讨TNF-α的最佳处理浓度和处理时间. 不同批次细胞重复实验3次以上, 验证肠黏膜上皮损伤模型的建立.
1.2.5 Transwell小室BM-MSCs与Caco-2共培养: 上面实验证实100 ng/mL TNF-α处理48 h为最佳处理条件. 实验分为6组: (1)单纯BM-MSCs组; (2)单纯Caco-2组; (3)Caco-2+TNF-α组(损伤组); (4)BM-MSCs+Caco-2组(共培养组); (5)BM-MSCs+Caco-2+TNF-α组(损伤修复组); (6)anti-CX3CR1-BM-MSCs+Caco-2+TNF-α组(阻断组). 将Caco-2、TNF-α刺激后Caco-2以1×106个/孔分别置于六孔Transwell小室下层, BM-MSCs及预先以5 μg/mL anti-CX3CR1抗体室温孵育1 h的anti-CX3CR1-BM-MSCs 4×105个/孔分别置于Transwell小室上层, 培养24 h收集细胞, 提取蛋白和RNA, 实验方法参照文献[18].
1.2.6 免疫荧光检测紧密连接蛋白ZO-1: 取接种了Caco-2细胞的玻片, PBS漂洗5 min×4次, 37 g/L甲醛固定15 min, PBS漂洗5 min×4次, 山羊血清封闭1 h, ZO-1(1:50), 4 ℃湿盒过夜, PBS漂洗后加入FITC标记羊抗兔免疫荧光抗体, 37 ℃ 1 h, PBS漂洗, 甘油封片.
1.2.7 荧光定量RT-PCR检测紧密连接ZO-1、Occludin mRNA和趋化因子受体CX3CR1 mRNA的表达: 收集细胞, 按照试剂盒说明书提取总RNA, 逆转录试剂盒反转录得到cDNA. 取1 μL cDNA加入20 μL的实时定量PCR反应体系, 反应条件: 95 ℃预变性30 s; PCR扩增(重复40个循环): 95 ℃ 5 s, 58 ℃ 30 s, 72 ℃ 30 s; ZO-1和Occludin使用Human-β-actin, CX3CR1使用Rat-β-actin作为内参. 结果用2-△Ct值比较. 每组实验取不同批次细胞重复3次. PCR引物序列如表1.
| 引物名称 | 序列(5'-3') | 扩增大小(bp) |
| ZO-1 | F: ACCTACCACCTCGTCGTCTG | 128 |
| R: CACTCTGTCTCCAGGTCCTTC | ||
| Occludin | F: GACAGATTTGATGGAGGAC | 265 |
| R: GGCAATACCAAGCAGTTC | ||
| CX3CR1 | F: GTCAACATCCTGGGCTTCG | 226 |
| R: CCCTCTTCATGCCACAACTAG | ||
| Human-β-actin | F: CGTGACATTAAGGAGAAGCTG | 501 |
| R: CTAGAAGCATTTGCGGTGGAC | ||
| Rat-β-actin | F: GCGTGACATTAAAGAGAAGCTG | 500 |
| R: AGAAGCATTTGCGGTGCAC |
1.2.8 Western blot技术检测紧密连接ZO-1、Occludin和趋化因子受体CX3CR1的蛋白含量: 收集共培养细胞, 提取蛋白, BCA法测定蛋白浓度. ZO-1采用8%SDS-PAGE, Occludin、CX3CR1和内参GAPDH采用10%SDS-PAGE电泳分离后湿转至NC膜, 5%脱脂奶粉封闭2 h, 一抗ZO-1(1:400)、Occludin(1:1500)、CX3CR1(1:500)和GAPDH(1:1000), 4 ℃孵育过夜, TBST洗膜, 二抗(1:2000)室温孵育2 h, 洗膜, ECL曝光显色, 图像经AlPhaView分析软件进行灰度值测定. 通过计算每组样品的(目的蛋白条带亮度值-背景值)与对应(内参蛋白GAPDH条带亮度值-背景值)的比值, 得到校正后的目的蛋白的相对表达量. 以对照组的目的蛋白相对表达量为1, 比较各组间校正后的目的蛋白相对表达量的关系. 每组实验取不同批次细胞重复3次.
统计学处理 采用SPSS21.0统计软件分析, 数据以mean±SD的形式表示, 多组比较采用单因素方差分析, 而各组间的进一步两两比较采用t检验. P<0.05为差异具有统计学意义.
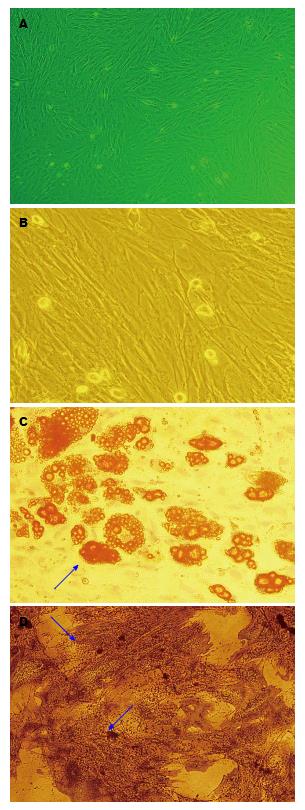
提取的原代BM-MSCs细胞12 h后开始逐步贴壁, 随着换液和传代, 造血细胞等杂质细胞越来越少, 15 d左右传至第三代, 以均匀长梭形生长, 呈漩涡状或平行排列, 具有典型的MSCs形态特征(图1A, B).
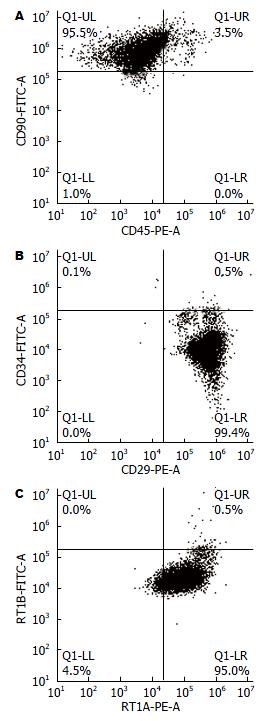
流式结果表明: 95.5%的细胞表达CD90而不表达CD45, 99.4%的细胞表达CD29而不表达CD34, 95.0%的细胞表达RT1A而不表达RT1B, 这说明我们提取的原代细胞培养至三代获得纯的BM-MSCs(图2).
作为一种多能干细胞, BM-MSCs具有向多种组织细胞分化的能力, 我们分离得到的BM-MSCs在成脂或成骨诱导培养液中能分化为脂肪细胞或成骨细胞, 脂肪细胞油红O染液染色, 显微镜下观察到细胞浆内出现橘红脂滴(图1C); 成骨细胞Von Kossa染色试剂盒染色, 显微镜下观察到黑色钙盐颗粒沉积(图1D).
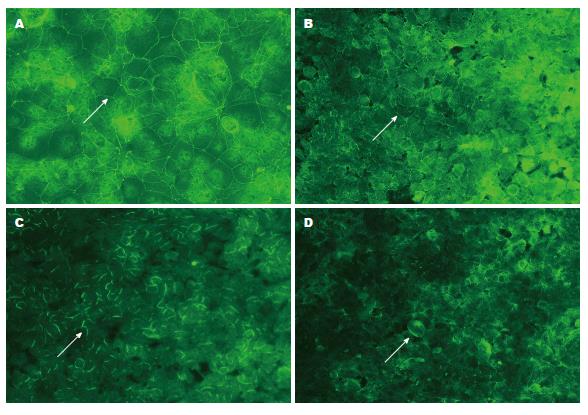
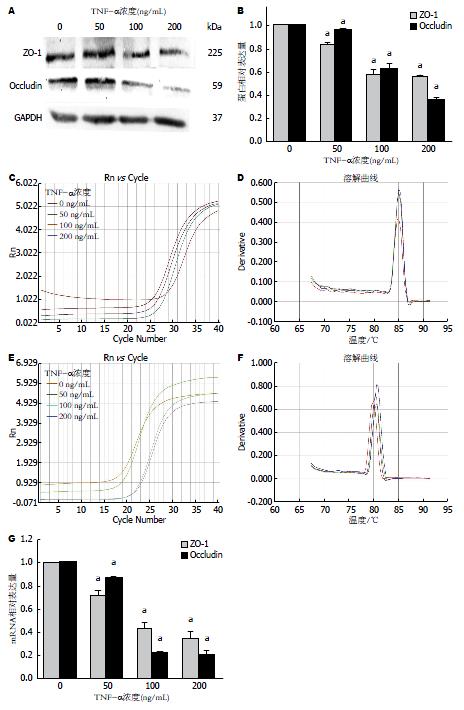
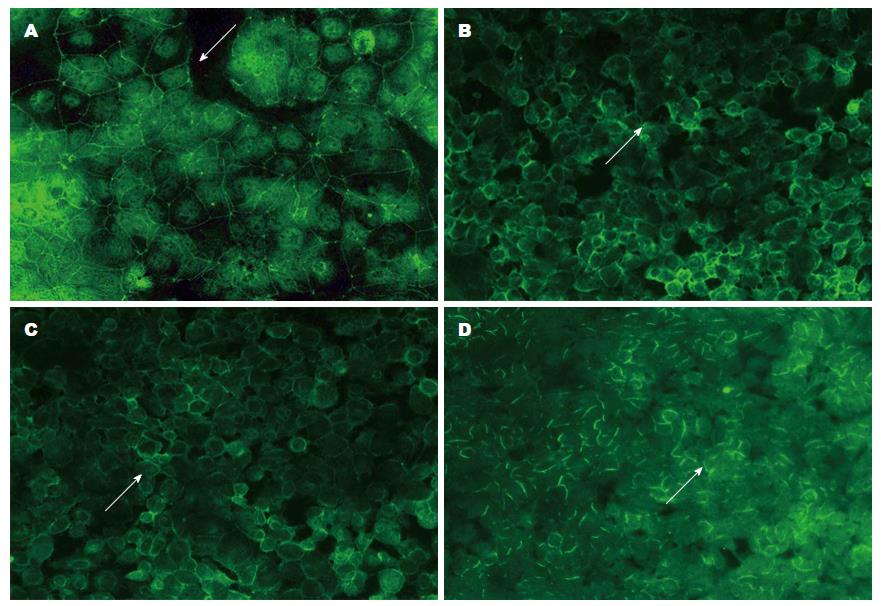
2.3.1 不同浓度(0、50、100及200 ng/mL)TNF-α处理Caco-2细胞: 免疫荧光检测ZO-1蛋白表达, 显微镜下ZO-1蛋白定位在细胞膜上, 0 ng/mL TNF-α组ZO-1的绿色荧光比较明亮, 且连续完整, 细胞间构成蜘蛛网状形态. 随着50、100及200 ng/mL TNF-α浓度的增加, ZO-1荧光的亮度逐渐减弱, 且100和200 ng/mL TNF-α组出现细胞膜上ZO-1荧光的断裂及其完整性的破坏(图3). Western blot结果显示, 在225、59和37 kDa位置处依次出现ZO-1、Occludin和GAPDH条带. 50、100及200 ng/mL组与0 ng/mL组相比, ZO-1蛋白的表达量逐渐减少(F = 293.36, P<0.05)、Occludin 蛋白的表达量亦逐渐减低(F = 216.73, P<0.05), 呈浓度依赖. PCR结果显示, 50、100及200 ng/mL组较0 ng/mL组, ZO-1 mRNA的表达量逐渐减少(F = 140.00, P<0.05)、Occludin mRNA的表达量也随之减少(F = 1196.65, P<0.05)(图4). mRNA与蛋白水平结果一致, 而100 ng/mL组与200 ng/mL组对紧密连接蛋白的影响两者间差异无统计学意义, 所以我们选用100 ng/mL为最终处理浓度.
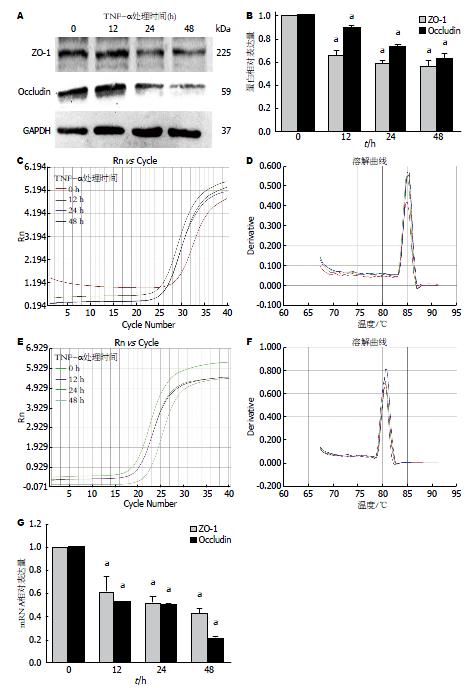
2.3.2 不同时间(0、12、24和48 h)100 ng/mL TNF-α处理Caco-2细胞: 使用TNF-α 100 ng/mL处理Caco-2细胞12、24和48 h后, 随着处理时间的延长, ZO-1免疫荧光亮度依次减弱, 蜘蛛网状形态破坏逐渐严重, 细胞间紧密连接蛋白排列不规则甚至断裂(图5). Western blot证实, 100 ng/mL TNF-α处理12、24和48 h组与0 h组相比, ZO-1(F = 115.49, P<0.05)和Occludin蛋白(F = 86.12, P<0.05)的表达受抑制, 呈时间依赖. PCR检测结果提示, ZO-1(F = 35.73, P<0.05)和Occludin mRNA(F = 17050.91, P<0.05)的表达量均减少, 且处理时间越长减少越明显, 差异有统计学意义(图6). 这些结果表明肠黏膜上皮损伤模型建立成功, 而TNF-α 100 ng/mL处理48 h为我们选用的最佳处理条件.
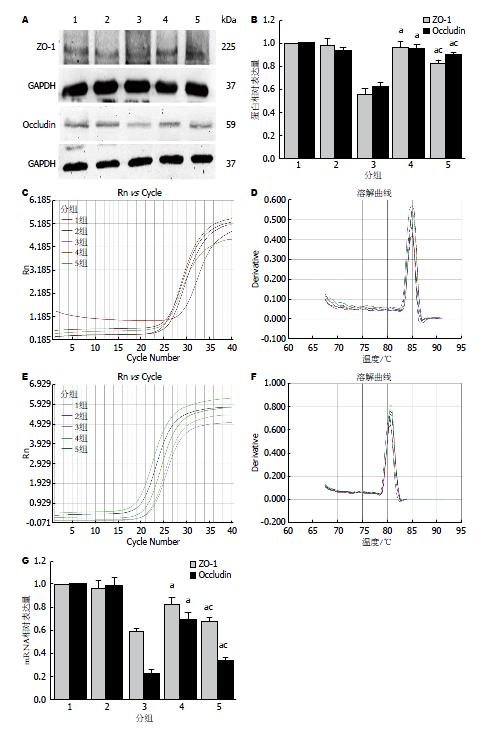
BM-MSCs与Caco-2共培养对ZO-1、Occludin的表达无影响. 而BM-MSCs与受损Caco-2共培养后, ZO-1、Occludin蛋白的表达量较受损Caco-2组均增加(t = 12.77, P<0.05; t = 14.71, P<0.05); ZO-1、Occludin mRNA的表达量也均增加(t = 7.40, P<0.05; t = 13.02, P<0.05). 该结果提示BM-MSCs对受损Caco-2有修复作用(图7).
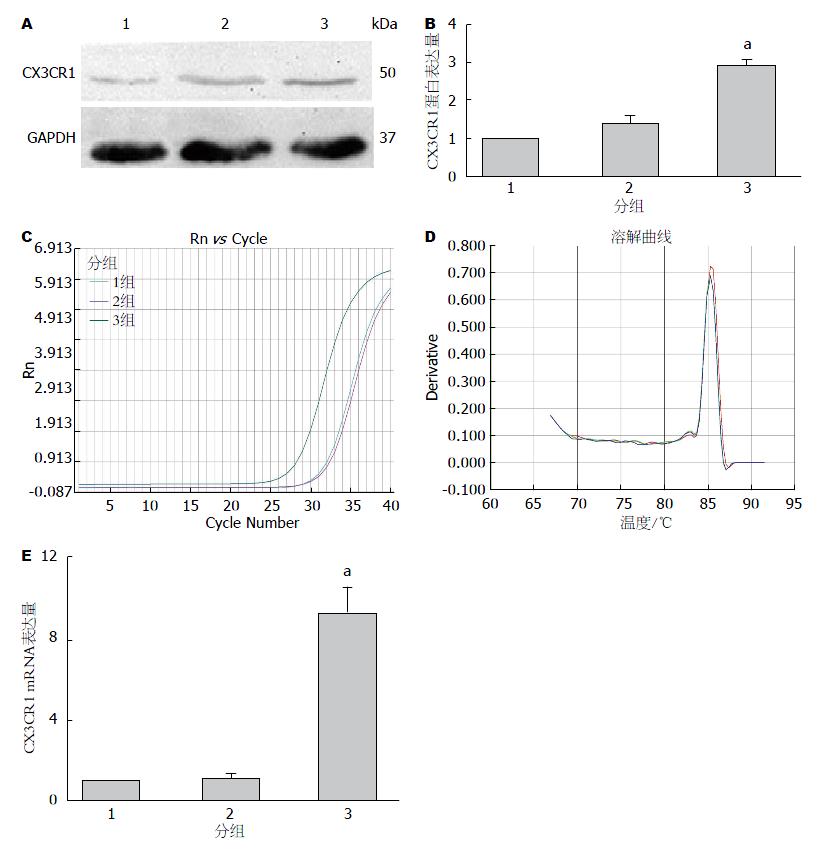
与单纯BM-MSCs组比较, BM-MSCs与Caco-2共培养时, CX3CR1蛋白和mRNA的表达水平轻微增加, 但差异无统计学意义; 而BM-MSCs与受损Caco-2共培养后, CX3CR1蛋白表达增加(t = 19.81, P<0.05), CX3CR1 mRNA的表达水平也明显增加(t = 12.27, P<0.05). 结果提示CX3CR1参与BM-MSCs修复受损Caco-2的过程.
观察阻断CX3CR1的结果: Anti-CX3CR1-BM-MSCs与受损Caco-2共培养后, ZO-1、Occludin蛋白的表达量较阻断前相比减少(t = 4.98, P<0.05; t = 3.02, P<0.05), 但高于受损Caco-2组的表达量(t = 11.81, P<0.05; t = 14.92, P<0.05). 而ZO-1、Occludin mRNA的表达量较阻断前相比减少(t = 4.37, P<0.05; t = 10.55, P<0.05), 但高于受损Caco-2组的表达量(t = 4.89, P<0.05; t = 4.66, P<0.05). 这个结果说明阻断CX3CR1影响BM-MSCs对受损Caco-2的修复(图8).
各种炎症、应激、缺血缺氧、肠道肿瘤放化疗处理都会导致肠上皮损伤, 肠上皮的损伤主要表现在肠黏膜屏障受损. 肠黏膜屏障由机械屏障、免疫屏障、化学屏障及生物屏障四部分构成. 其中机械屏障在维护肠道功能上起着至关重要的作用. 紧密连接是机械屏障的重要组成部分, 主要有ZO-1、Occludin、肌动蛋白β、咬合蛋白、钙黏蛋白等[17]. Caco-2细胞具有微绒毛和紧密连接结构, 类似于分化的人小肠黏膜上皮细胞, 被广泛用于肠道的功能研究[19].
研究[16,20]显示, 炎性介质TNF-α能够通过激活核因子-κB(nuclear factor-κB, NF-κB)引起MLCK肌球蛋白酶表达增加及其轻链磷酸化; 抑制ZO-1和Occludin mRNA表达, 导致肠黏膜间紧密连接处通透性增加. 本研究利用50、100及200 ng/mL TNF-α作用Caco-2细胞48 h以及100 ng/mL TNF-α作用Caco-2细胞0、12、24和48 h构建肠上皮损伤模型. 将紧密连接蛋白作为观察对象, 探讨TNF-α的最佳处理浓度和时间. 我们的结果提示随着TNF-α刺激时间的延长以及刺激浓度的增高, 紧密连接蛋白ZO-1和Occludin mRNA和蛋白表达降低, 荧光显示出明显断裂. 当100 ng/mL TNF-α刺激48 h时, 紧密连接蛋白的损伤已十分明显、且稳定, 并与200 ng/mL TNF-α刺激效果无明显差异, 所以我们选用100 ng/mL TNF-α处理48 h构建稳定的肠上皮细胞炎性损伤模型.
间充质干细胞(mesenchymal stem cells, MSCs)是属于中胚层的一类具有高度自我更新和多向分化潜能的干细胞, 广泛分布于全身多种组织, 以骨髓中含量最高. BM-MSCs在病灶部位能定向分化为软骨细胞[21]、骨骼肌和心肌细胞[22]、神经细胞[23]、肝细胞[24,25]等, 在肝纤维化[26]、急性胰腺炎[27]等多系统疾病治疗中发挥作用. 有研究[6]表明, BM-MSCs可以对异位肠道移植和肠道缺血灌注时造成的肠黏膜屏障损伤产生修复作用. 但是BM-MSCs的定向分化修复作用是在其到达受损部位的前提下发挥的. 其中趋化因子及其受体的作用对于BM-MSCs的迁移至关重要[28-31]. 趋化因子是一类由蛋白质组成的小分子多肽, 目前已发现50余种趋化因子以及20种趋化因子受体[32]. CX3CRl作为一种趋化因子受体, 表达在BM-MSCs表面, 能够促使间充质干细胞迁移到受损脑组织、胰腺组织发挥作用[33,34]. 我们为研究CX3CRl在BM-MSCs修复受损肠上皮中所发挥的作用, 采用Transwell小室建立体外趋化迁移模型, 发现BM-MSCs与Caco-2共培养, 不会对Caco-2上ZO-1和Occludin的表达造成影响. 而BM-MSCs与受损Caco-2共培养后, ZO-1和Occludin的表达增加, 提示BM-MSCs对受损Caco-2有修复作用. 对于CX3CRl, BM-MSCs与Caco-2共培养对其表达无影响. 而BM-MSCs与受损Caco-2共培养后, CX3CRl表达增加. 该结果提示CX3CRl参与BM-MSCs趋化迁移到受损肠上皮模型处发挥修复作用. 为进一步验证CX3CRl的作用, 我们使用anti-CX3CRl抗体预处理BM-MSCs后再与受损Caco-2共培养, 此时ZO-1和Occludin的表达较未封闭CX3CRl前减低, 进一步验证CX3CRl参与BM-MSCs趋化迁移修复受损肠道组织的过程. 但是本实验尚存在不足. CX3CRl被封闭后, ZO-1和Occludin的表达量仍比受损Caco-2组表达增加. 这个结果提示: (1)我们没有完全封闭BM-MSCs上CX3CRl的表达. 接下来我们将继续探讨CX3CRl的封闭浓度和时间; (2)由于封闭CX3CRl不能完全阻断BM-MSCs对受损肠上皮的修复, 提示尚存在其他细胞信号参与BM-MSCs对受损肠上皮的修复.
本研究发现CX3CRl在BM-MSCs体外修复受损肠上皮模型中的作用, 为我们临床上促进移植BM-MSCs到达受损肠道组织从而提高治疗效果提供线索. 但在体内是否存在类似作用, 还有哪些细胞信号参与肠黏膜损伤下间充质的修复, 这将是我们接下来研究的方向.
感谢天津市器官移植重点实验室为我提供科学研究的平台.
研究显示骨髓间充质干细胞(bone marrow-mesenchymal stem cells, BM-MSCs)具有促进小肠缺血再灌注损伤的修复和增生作用, 但单纯输注BM-MSCs存在到达受损部位数量及活性偏低等问题. 为提高受损组织内定向迁移BM-MSCs的数量、增强其对受损组织的保护作用, 本研究目的是探讨趋化因子CX3C亚族是否在BM-MSCs修复受损组织中发挥作用.
王阁, 教授, 中国人民解放军第三军医大学第三附属医院
BM-MSCs具有多向分化、免疫原性弱等优势, 已被广泛应用在组织修复、重建中, 但单纯输注BM-MSCs存在数量和活性偏低问题, 如何提高BM-MSCs修复受损组织的作用仍是目前研究的重点. 因此, 希望寻找特定基因能够增加受损组织内BM-MSCs的定向迁移能力.
炎性介质导致肠黏膜间紧密连接处通透性增加的报道很多, 如肿瘤坏死因子-α(tumor necrosis factor alpha, TNF-α)能够通过激活核因子-κB(nuclear factor-κB, NF-κB)通路抑制ZO-1(zonula occluden 1)和Occludin的表达等, BM-MSCs能够对异位肠道移植和肠道缺血灌注时造成的肠黏膜屏障损伤产生修复作用的研究也有报道, 但研究趋化因子在其中的作用较少.
本文发现体外BM-MSCs对受损肠黏膜屏障具有修复作用, 其中趋化因子受体CX3CRl参与此作用.
目前研究表明BM-MSCs虽然对损伤组织有修复作用, 但大多为其旁分泌发挥作用, 而其组织分化定向修复作用由于其只有少数到达受损部位而难以发挥, 本研究通过揭示趋化因子受体提高BM-MSCs对受损组织的保护作用, 为其应用临床治疗提供实验依据.
紧密连接蛋白ZO-1: 为第一个紧密连接相关蛋白, 属于跨膜蛋白, 可以连接咬合蛋白Occludin和肌动蛋白骨架的作用, 是构成肠黏膜上皮紧密连接的重要成分之一.
本文探讨趋化因子受体CX3CR1对BM-MSCs修复受损肠上皮细胞的影响, 整个课题工作量大, 具有一定创新性结果.
编辑: 郭鹏 电编:都珍珍
| 1. | Lee SH. Intestinal permeability regulation by tight junction: implication on inflammatory bowel diseases. Intest Res. 2015;13:11-18. [PubMed] [DOI] |
| 2. | Kalaitzakis E. Gastrointestinal dysfunction in liver cirrhosis. World J Gastroenterol. 2014;20:14686-14695. [PubMed] [DOI] |
| 3. | Hu S, Lin ZL, Zhao ZK, Liu R, Ma L, Luo HM, Zhou FQ, Bai XD. Pyruvate Is Superior to Citrate in Oral Rehydration Solution in the Protection of Intestine via Hypoxia-Inducible Factor-1 Activation in Rats With Burn Injury. JPEN J Parenter Enteral Nutr. 2015; Mar 23. [Epub ahead of print]. [PubMed] [DOI] |
| 4. | Yadav VR, Hussain A, Sahoo K, Awasthi V. Remediation of hemorrhagic shock-induced intestinal barrier dysfunction by treatment with diphenyldihaloketones EF24 and CLEFMA. J Pharmacol Exp Ther. 2014;351:413-422. [PubMed] [DOI] |
| 5. | Shen ZY, Zhang J, Song HL, Zheng WP. Bone-marrow mesenchymal stem cells reduce rat intestinal ischemia-reperfusion injury, ZO-1 downregulation and tight junction disruption via a TNF-α-regulated mechanism. World J Gastroenterol. 2013;19:3583-3595. [PubMed] [DOI] |
| 6. | Zhang W, Shen ZY, Song HL, Yang Y, Wu BJ, Fu NN, Liu T. Protective effect of bone marrow mesenchymal stem cells in intestinal barrier permeability after heterotopic intestinal transplantation. World J Gastroenterol. 2014;20:7442-7451. [PubMed] [DOI] |
| 7. | Chen J, Li Y, Wang L, Zhang Z, Lu D, Lu M, Chopp M. Therapeutic benefit of intravenous administration of bone marrow stromal cells after cerebral ischemia in rats. Stroke. 2001;32:1005-1011. [PubMed] |
| 8. | Horwitz EM, Gordon PL, Koo WK, Marx JC, Neel MD, McNall RY, Muul L, Hofmann T. Isolated allogeneic bone marrow-derived mesenchymal cells engraft and stimulate growth in children with osteogenesis imperfecta: Implications for cell therapy of bone. Proc Natl Acad Sci U S A. 2002;99:8932-8937. [PubMed] [DOI] |
| 9. | Wu GD, Nolta JA, Jin YS, Barr ML, Yu H, Starnes VA, Cramer DV. Migration of mesenchymal stem cells to heart allografts during chronic rejection. Transplantation. 2003;75:679-685. [PubMed] [DOI] |
| 10. | Lawton B, Boyette JR, Hu M, Lian TS. Selectin blockade decreases postischemic recruitment of bone marrow stromal cells. Laryngoscope. 2013;123:2993-2995. [PubMed] [DOI] |
| 11. | 王 艳国, 赵 岳, 李 喜梅, 唐 博, 褚 亚男, 刘 元林, 朱 恒, 张 毅. 细胞间粘附分子-1在小鼠间充质干细胞体外迁移中的作用及其机制. 中国实验血液学杂志. 2014;22:479-484. |
| 12. | Ji JF, He BP, Dheen ST, Tay SS. Interactions of chemokines and chemokine receptors mediate the migration of mesenchymal stem cells to the impaired site in the brain after hypoglossal nerve injury. Stem Cells. 2004;22:415-427. [PubMed] [DOI] |
| 13. | Papadakis KA, Targan SR. The role of chemokines and chemokine receptors in mucosal inflammation. Inflamm Bowel Dis. 2000;6:303-313. [PubMed] |
| 14. | Yang SK, Eckmann L, Panja A, Kagnoff MF. Differential and regulated expression of C-X-C, C-C, and C-chemokines by human colon epithelial cells. Gastroenterology. 1997;113:1214-1223. [PubMed] |
| 15. | Kim JM, Kim JS, Jun HC, Oh YK, Song IS, Kim CY. Differential expression and polarized secretion of CXC and CC chemokines by human intestinal epithelial cancer cell lines in response to Clostridium difficile toxin A. Microbiol Immunol. 2002;46:333-342. [PubMed] |
| 17. | He F, Peng J, Deng XL, Yang LF, Camara AD, Omran A, Wang GL, Wu LW, Zhang CL, Yin F. Mechanisms of tumor necrosis factor-alpha-induced leaks in intestine epithelial barrier. Cytokine. 2012;59:264-272. [PubMed] [DOI] |
| 19. | Lodemann U, Strahlendorf J, Schierack P, Klingspor S, Aschenbach JR, Martens H. Effects of the Probiotic Enterococcus faecium and Pathogenic Escherichia coli Strains in a Pig and Human Epithelial Intestinal Cell Model. Scientifica (Cairo). 2015;2015:235184. [PubMed] [DOI] |
| 20. | Song HL, Lv S, Liu P. The roles of tumor necrosis factor-alpha in colon tight junction protein expression and intestinal mucosa structure in a mouse model of acute liver failure. BMC Gastroenterol. 2009;9:70. [PubMed] [DOI] |
| 21. | Snyder TN, Madhavan K, Intrator M, Dregalla RC, Park D. A fibrin/hyaluronic acid hydrogel for the delivery of mesenchymal stem cells and potential for articular cartilage repair. J Biol Eng. 2014;8:10. [PubMed] [DOI] |
| 22. | Galli D, Vitale M, Vaccarezza M. Bone marrow-derived mesenchymal cell differentiation toward myogenic lineages: facts and perspectives. Biomed Res Int. 2014;2014:762695. [PubMed] [DOI] |
| 23. | Huat TJ, Khan AA, Pati S, Mustafa Z, Abdullah JM, Jaafar H. IGF-1 enhances cell proliferation and survival during early differentiation of mesenchymal stem cells to neural progenitor-like cells. BMC Neurosci. 2014;15:91. [PubMed] [DOI] |
| 24. | Ahmadi-Ashtiani HR, Allameh A, Rastegar H, Mortaz E, Saraf Z. Immunoregulatory effects of glutathione during mesenchymal stem cell differentiation to hepatocyte-like cells. Iran J Immunol. 2012;9:175-187. [PubMed] |
| 25. | An SY, Han J, Lim HJ, Park SY, Kim JH, Do BR, Kim JH. Valproic acid promotes differentiation of hepatocyte-like cells from whole human umbilical cord-derived mesenchymal stem cells. Tissue Cell. 2014;46:127-135. [PubMed] [DOI] |
| 26. | Tu XH, Song JX, Xue XJ, Guo XW, Ma YX, Chen ZY, Zou ZD, Wang L. Role of bone marrow-derived mesenchymal stem cells in a rat model of severe acute pancreatitis. World J Gastroenterol. 2012;18:2270-2279. [PubMed] [DOI] |
| 27. | Zhao W, Li JJ, Cao DY, Li X, Zhang LY, He Y, Yue SQ, Wang DS, Dou KF. Intravenous injection of mesenchymal stem cells is effective in treating liver fibrosis. World J Gastroenterol. 2012;18:1048-1058. [PubMed] [DOI] |
| 28. | Wang Y, Fu W, Zhang S, He X, Liu Z, Gao D, Xu T. CXCR-7 receptor promotes SDF-1α-induced migration of bone marrow mesenchymal stem cells in the transient cerebral ischemia/reperfusion rat hippocampus. Brain Res. 2014;1575:78-86. [PubMed] [DOI] |
| 29. | Naderi-Meshkin H, Matin MM, Heirani-Tabasi A, Mirahmadi M, Irfan-Maqsood M, Edalatmanesh MA, Shahriyari M, Ahmadiankia N, Moussavi NS, Bidkhori HR. Injectable hydrogel delivery plus preconditioning of mesenchymal stem cells: exploitation of SDF-1/CXCR4 axis towards enhancing the efficacy of stem cells' homing. Cell Biol Int. 2015; Mar 31. [Epub ahead of print]. [PubMed] [DOI] |
| 30. | Kamiya K. Inner ear cell therapy targeting hereditary deafness by activation of stem cell homing factors. Front Pharmacol. 2015;6:2. [PubMed] [DOI] |
| 31. | Hsu WT, Jui HY, Huang YH, Su MY, Wu YW, Tseng WY, Hsu MC, Chiang BL, Wu KK, Lee CM. CXCR4 Antagonist TG-0054 Mobilizes Mesenchymal Stem Cells, Attenuates Inflammation, and Preserves Cardiac Systolic Function in a Porcine Model of Myocardial Infarction. Cell Transplant. 2015;24:1313-1328. [PubMed] [DOI] |
| 32. | Bromley SK, Mempel TR, Luster AD. Orchestrating the orchestrators: chemokines in control of T cell traffic. Nat Immunol. 2008;9:970-980. [PubMed] [DOI] |
| 33. | Song CH, Honmou O, Furuoka H, Horiuchi M. Identification of chemoattractive factors involved in the migration of bone marrow-derived mesenchymal stem cells to brain lesions caused by prions. J Virol. 2011;85:11069-11078. [PubMed] [DOI] |
| 34. | Sordi V, Malosio ML, Marchesi F, Mercalli A, Melzi R, Giordano T, Belmonte N, Ferrari G, Leone BE, Bertuzzi F. Bone marrow mesenchymal stem cells express a restricted set of functionally active chemokine receptors capable of promoting migration to pancreatic islets. Blood. 2005;106:419-427. [PubMed] [DOI] |