修回日期: 2015-06-13
接受日期: 2015-06-24
在线出版日期: 2015-08-08
目的: 研究表皮生长因子(epidermal growth factor, EGF)对胰岛素-磷脂酰肌醇3-激酶(PI3K)信号通路的影响及其可能涉及的机制.
方法: 肝癌细胞系HepG2用含10%胎牛血清的DMEM培养. 细胞刺激试验前过夜血清饥饿, EGF和胰岛素刺激不同的时间, 裂解细胞后提取蛋白, Western blot检测相关信号蛋白水平.
结果: 胰岛素可以导致肝癌细胞系蛋白激酶B(Akt)的磷酸化. 当EGF短时间刺激后, 胰岛素对PI3K信号通路的调节没有受到明显的影响. 当EGF刺激4 h后, 胰岛素对Akt的激活效应受到抑制, 而当HepG2细胞转染质粒磷酸酶域突变型质粒pSvEGFP-PTEN C124S或PI3K调节亚基的p85 N末端缺失序列p50后, EGF预先刺激产生的对Akt的抑制效应消失.
结论: EGF和胰岛素的相互作用对肝癌细胞PI3K-Akt信号通路具有抑制效应, 其抑制机制涉及到PTEN和调节亚基p85. 当两基因突变后, 这种抑制作用则消失.
核心提示: 在HepG细胞上, 表皮生长因子对胰岛素-磷脂酰肌醇3-激酶(PI3K)信号通路的影响具有时间效应, 即短时促进作用, 长时抑制作用. 这种时间效应的关键调节点可能是PTEN-p85间的相互作.
引文著录: 胡先福, 叶火旺, 信思易, 何济满, 郭文. 表皮生长因子对胰岛素-PI3K信号通路的影响及机制. 世界华人消化杂志 2015; 23(22): 3592-3596
Revised: June 13, 2015
Accepted: June 24, 2015
Published online: August 8, 2015
AIM: To examine the effect of epidermal growth factor (EGF) on the insulin-PI3K signalling pathway and the potential mechanism involved.
METHODS: HepG2 cells were cultured in Dulbecco's modified Eagle' s medium (DMEM) containing 10% fetal calf serum with the addition of L-glutamine. After overnight serum starvation, cells were stimulated with EGF or insulin for different periods of time. Cell protein expression was determined by Western blot.
RESULTS: Insulin stimulation caused Akt phosphorylation in HepG2 cells. Prestimulation with epidemimal growth factor for 30 min had no significant effect on PI3K signalling. In contrast, prestimulation with EGF for 4 h inhibited insulin induced activation of p-Akt. When cells were transfected with phosphatase and tensin homolog deleted on chromosome 10 (PTEN) mutant C124S or N-terminal deleted p85, EGF induced inhibition of phospho-Akt was reversed.
CONCLUSION: Interaction between EGF and insulin inhibits PI3K-Akt activation. The underlying mechanism involves PTEN and regulatory subunit p85. Mutations of PTEN and p85 reverse the inhibition.
- Citation: Hu XF, Ye HW, Xin SY, He JM, Guo W. Effect of epidermal growth factor on insulin-PI3K signaling pathway and potential mechansim involved. Shijie Huaren Xiaohua Zazhi 2015; 23(22): 3592-3596
- URL: https://www.wjgnet.com/1009-3079/full/v23/i22/3592.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i22.3592
磷脂酰肌醇3-激酶/蛋白激酶B(PI3K/Akt)信号通路作为细胞内重要的活性信号通路, 与细胞存活、凋亡密切相关, 其过度激活与各类肿瘤的发生发展密切相关[1,2], 而过于抑制则与胰岛素(Insulin)抵抗类疾病紧密相连[3,4].
Ⅰ类PI3K由调节亚基p85和催化亚基p110构成, 调节亚基调节催化亚基的催化活性, 进而介导下游Akt、GSK等信号分子和其他多条信号通路, 调控细胞生长和增殖、运动和侵袭、存活和凋亡及新生血管的生成等多种细胞活动[5,6]. 许多激素或细胞因子可以激活该信号通路, 例如表皮生长因子(epidermal growth factor, EGF)、Insulin等. PTEN, 即第10号染色体缺失并与张力蛋白同源磷酸酶(phosphatase and tensin homolog deleted on chromosome 10), 是该信号通路的主要负调控因子[7,8]. PTEN具有脂质磷酸酶和蛋白磷酸酶的双重磷酸酶活性, 其抑癌作用的发挥主要是通过脂质磷酸酶活性, 抑制PI3K活性信号通路. PTEN基因在多种恶性肿瘤组织中存在着不同程度的突变或丢失[9].
EGF和Insulin在体内常常同时存在. 他们间的相互作用对肝细胞活性信号通路PI3K/Akt的影响还不清楚. 本文通过人肝癌细胞系HepG2研究EGF对Insulin的作用及对PI3K/Akt信号通路的影响机制.
人肝癌细胞系HepG2细胞株购自中国科学院昆明细胞库; 质粒磷酸酶域突变型质粒pSvEGFP-C124S和p50[SH2(C+N)]均由英国YorK大学Mike Sharrard教授赠送; E. coli(DH5α)购自广州威佳科技有限公司; 脂质体转染试剂LipofectamineTM2000购自Invitogen公司; DMEM高糖培养基与胎牛血清均购自美国Gibco公司; BCA蛋白检测试剂盒和化学发光增强剂(ECL)试剂盒均购自上海碧云天生物技术有限公司; 聚偏二氟乙烯膜(PVDF)购自美国Millipore公司; 重组人Insulin注射液(优必林)购自美国Lilly公司; Recombinant Human EGF购自美国PeproTech公司; p-Akt(Ser473)购自Santa Cruz; PTEN购自Enzo; p85购自Millipore; GAPDH、辣根过氧化物酶标记的山羊抗鼠IgG、辣根过氧化物酶标记的山羊抗兔IgG均购自北京中杉金桥.
1.2.1 细胞培养: 人肝癌细胞株HepG2细胞于含10%胎牛血清的DMEM培养基、37 ℃、50 mL/L CO2培养箱中培养. 待细胞贴满瓶底后用0.25%胰酶进行消化, 按照1:3或1:4的比例传代、铺板.
1.2.2 细胞转染: 将HepG2细胞种植于12孔板, 待细胞融合60%-70%时, 按LipofectamineTM 2000说明书中的转染程序, 分别将突变型pSvEGFP-C124S或p50[SH2(C+N)]转染入细胞.
1.2.3 蛋白提取: (1)非转染实验:待细胞融合至80%-90%时, 移去10%胎牛血清培养基, 予无血清DMEM培养基饥饿12 h, 按照实验方案予EGF(0.3 μg/mL)或Insulin(0.15 IU/mL)刺激, RIPA裂解液裂解收集细胞提取蛋白; (2)转染实验: 待转染共48 h后, 按照实验方案裂解前4 h、30 min予EGF(0.3 μg/mL), 裂解前10 min每组一半的孔加Insulin(0.15 IU/mL)刺激, RIPA裂解液裂解收集细胞提取蛋白.
1.2.4 Western blot检测p-Akt水平: 收集上述细胞裂解混悬液于4 ℃ 12000 g离心30 min, 取上清用BCA法测定蛋白浓度. 取等量蛋白进行SDS-PAGE电泳并转位到PVDF膜上, 最后采用ECL化学发光法检测. 具体步骤及实际配方参见参考文献[10].
统计学处理 数据以mean±SD标示, 采用SPSS13.0统计软件分析. 两组间比较方差齐性时采用两独立样本t检验, 方差不齐采用Satterthwaite近似t检验; 各组间比较采用方差分析(One-Way ANOVA), 多重比较方差齐性采用LSD检验, 以P<0.05为差异有统计学意义.
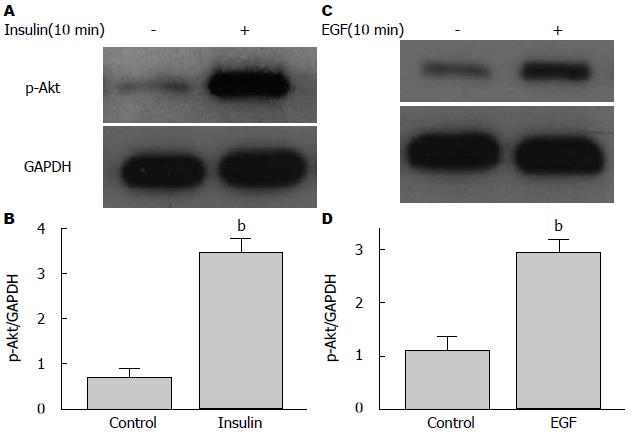
本文利用人肝癌细胞系HepG2为研究模型. 当用Insulin刺激细胞后, 与Control组(0.68±0.18)相比, Insulin组(3.47±0.28)的p-Akt表达明显上调(P<0.000), 这是体内正常的生理现象(图1). 本文再用EGF刺激HepG2细胞, 与Control组(1.11±0.22)相比, EGF组(2.93±0.23)的p-Akt表达明显上调(P = 0.001), 这也是体内正常的生理现象(图1).
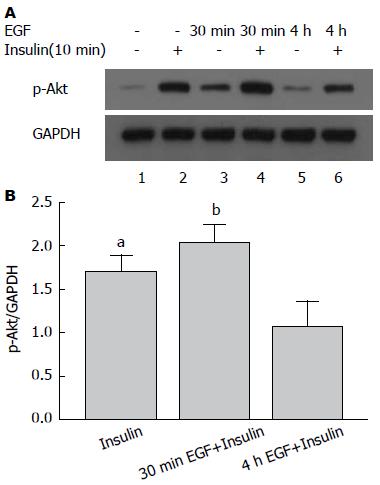
本文进一步在HepG2细胞上研究了EGF和Insulin间的相互作用. EGF分别刺激30 min或4 h, 而Insulin分别刺激10 min. 同样是Insulin刺激10 min, EGF提前刺激4 h(1.07±0.25)与无EGF刺激(1.70±0.17)或EGF刺激30 min(2.04±0.17)相比, p-Akt信号水平均显著降低(P = 0.019, P =0.001), 这说明长时间的EGF刺激对Insulin作用产生抑制效应(图2).
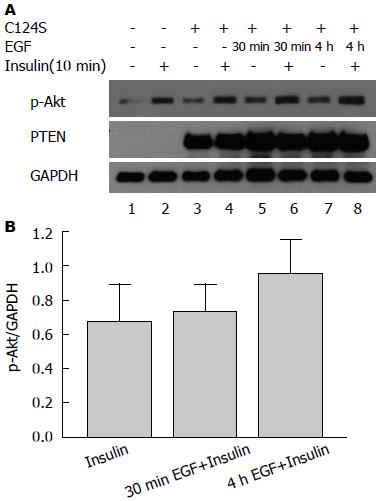
为了研究图2中的机制, 本文研究了该信号通路的负调控因子PTEN的作用. 结果显示, 转染突变型pSvEGFP-C124S质粒后, EGF和Insulin的处理方式虽然和图2中的一样, 但4 h EGF+Insulin组(0.95±0.17)与Insulin组(0.67±0.19)相比, p-Akt水平差异无统计学意义(P = 0.089)(图3).
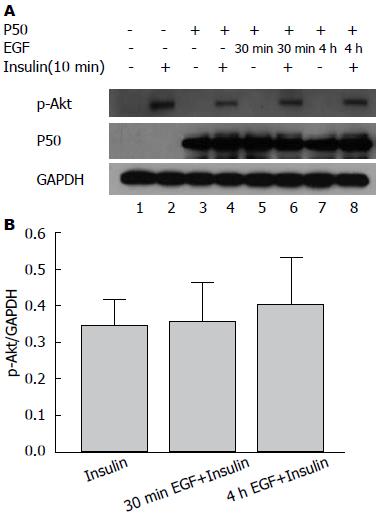
本文进一步研究PI3K调节亚基p85的变异对该信号通路的影响. 结果显示, 转染p85 N末端序列缺失的p50后, 4 h EGF+Insulin组(0.41±0.11)与Insulin组(0.35±0.06)相比, p-Akt水平差异无统计学意义(P = 0.454)(图4).
通过以人肝癌细胞系HepG2为研究模型, 本文发现, EGF长时间(几个小时)刺激对Insulin具有抑制效应. 而当该信号通路的负调控因子PTEN或PI3K调节亚基p85突变后, 这种抑制效应则消失.
PTEN在维持正常的物质代谢和内环境稳态及细胞的多种生命活动中具有重要的功能, 参与细胞的生长、聚集、黏附、迁移及凋亡以及血管的生成, 然而其确切机制尚未完全[11,12]. PTEN的N末端磷酸酶结构域的第123-130位氨基酸为N末端核心, 具有蛋白磷酸酶和脂质磷酸酶的双重磷酸酶活性, 能使磷脂及蛋白质脱磷酸化, 而其抑癌作用的发挥主要是通过脂质磷酸酶活性, 该磷酸酶核心内的点突变可导致PTEN蛋白的脂质磷酸酶或蛋白磷酸酶活性丧失[9,13]. PTEN能够阻止4,5-二磷酸磷脂酰肌醇(phosphatidylinositol 4,5-bisphosphate, PIP2)向3,4,5-三磷酸磷脂酰肌醇(phosphatidylinositol 3,4,5-trisphosphate, PIP3)的转化, 负性调控PI3K/Akt信号转导途径, 诱导Caspase9及P27等蛋白活性, 抑制周期素依赖性激酶(cyclin-dependent kinase, CDK)活性从而使细胞周期停滞在G1期, 介导细胞凋亡, 发挥抑癌作用[14]. 我们的结果显示, PTEN的这些调控作用受到激素或细胞因子间相互作用的影响, 提示我们研究抑癌基因PTEN的作用时需要结合体内具体的生理状态.
PTEN的PDZ-BD结构域能够通过与其他蛋白的相互作用, 增强PTEN的磷酸酶活性[9]. 最近的研究[15]报道显示, 调节亚基p85α可以通过N末端的SH3/BH结构域与PTEN结合, 激活PTEN的脂质磷酸酶活性. 基于我们实验室的前期发现, 我们研究了EGF对Insulin的抑制作用是否也与p85的介入有关. 我们的研究结果显示, 当调节亚基p85 N末端的SH3/BH结构域缺失后, EGF对Insulin的抑制作用丧失.
在人体内无时无刻都存在着各种各样的激素和细胞因子, 他们当中有许多都可以激活PI3K/Akt信号通路. 本部分实验在细胞水平验证了EGF对Insulin/PI3K/Akt信号通路的调节特点, 并发现了PTEN-p85这个关键调节点. 那么其他激素和细胞因子之间的调节效应是否也与EGF对Insulin的作用相类似? 他们之间的相互调节是否也是通过PTEN-p85这个关键调节点实现的? 我们正开展进一步的相关研究.
磷脂酰肌醇3-激酶/蛋白激酶B(PI3K/AKT)信号通路过度激活与各类肿瘤的发生发展密切相关. 第10号染色体缺失并与张力蛋白同源磷酸酶(phosphatase and tensin homolog deleted on chromosome 10, PTEN)能够阻止4,5-二磷酸磷脂酰肌醇(phosphatidylinositol 4,5-bisphosphate, PIP2)向PIP3的转化, 负性调控PI3K/AKT信号转导途径, 介导细胞凋亡, 发挥抑癌作用.
任粉玉, 教授, 延边大学附属医院消化内科; 徐庆, 教授, 桂林医学院药理教研室
PI3K/Akt信号通路是极其重要的细胞活性信号通路, 与细胞的代谢、存活、增殖等密切相关. PI3K/Akt信号通路有两个基本的负向调节因子, 即PTEN和p85, 这两个分子的调节异常与肿瘤形成密切相关.
PI3K调节亚基p85α可以通过N末端的SH3/BH结构域与PTEN结合, 激活PTEN的脂质磷酸酶活性.
本文研究了表皮生长因子(epidermal growth factor, EGF)对胰岛素(Insulin)的抑制作用是否与p85的介入有关. 研究结果显示, 当调节亚基p85 N末端的SH3/BH结构域缺失后, EGF对Insulin的抑制作用丧失. 提示PTEN-p85间的相互作用在维持Insulin信号通路稳态方面的重要作用.
PTEN-p85在维持PI3K/AKT信号通路稳态方面的重要作用, 避免了Akt的持续活化, 可能是肿瘤形成的关键调节点, PTEN-p85有望成为新的抗肿瘤靶点.
pSvEGFP-C124S: PTEN核心区域的第124位半胱氨酸被丝氨酸取代, 导致磷酸酶活性完全丧失; p50[SH2(C+N)]: PI3K调节亚基p85 N末端的SH3/BH结构域缺失.
本文利用人肝癌细胞系HepG2为研究模型证明了EGF对Insulin的作用有抑制效应; 而当该信号通路的负调控因子PTEN或PI3K调节亚基p85突变后, 这种抑制效应则消失, 说明EGF对Insulin的抑制效应可能与负调控因子PTEN或PI3K调节亚基p85有关. 研究较为深入, 内容新颖、设计合理, 具有很好的学术价值和可读性.
编辑: 韦元涛 电编:闫晋利
| 1. | Georgescu MM. PTEN Tumor Suppressor Network in PI3K-Akt Pathway Control. Genes Cancer. 2010;1:1170-1177. [PubMed] [DOI] |
| 2. | Viglietto G, Amodio N, Malanga D, Scrima M, De Marco C. Contribution of PKB/AKT signaling to thyroid cancer. Front Biosci (Landmark Ed). 2011;16:1461-1487. [PubMed] [DOI] |
| 3. | Schulman IH, Zhou MS. Vascular insulin resistance: a potential link between cardiovascular and metabolic diseases. Curr Hypertens Rep. 2009;11:48-55. [PubMed] [DOI] |
| 4. | Lee J, Kim MS. The role of GSK3 in glucose homeostasis and the development of insulin resistance. Diabetes Res Clin Pract. 2007;77 Suppl 1:S49-S57. [PubMed] [DOI] |
| 5. | Katso R, Okkenhaug K, Ahmadi K, White S, Timms J, Waterfield MD. Cellular function of phosphoinositide 3-kinases: implications for development, homeostasis, and cancer. Annu Rev Cell Dev Biol. 2001;17:615-675. [PubMed] [DOI] |
| 6. | Sheppard K, Kinross KM, Solomon B, Pearson RB, Phillips WA. Targeting PI3 kinase/AKT/mTOR signaling in cancer. Crit Rev Oncog. 2012;17:69-95. [PubMed] [DOI] |
| 7. | Sharrard RM, Maitland NJ. Regulation of protein kinase B activity by PTEN and SHIP2 in human prostate-derived cell lines. Cell Signal. 2007;19:129-138. [PubMed] [DOI] |
| 8. | Liu S, Knapp S, Ahmed AA. The structural basis of PI3K cancer mutations: from mechanism to therapy. Cancer Res. 2014;74:641-646. [PubMed] [DOI] |
| 9. | Worby CA, Dixon JE. PTEN. Annu Rev Biochem. 2014;83:641-669. [PubMed] [DOI] |
| 10. | Lu G, Chen J, Espinoza LA, Garfield S, Toshiyuki S, Akiko H, Huppler A, Wang QJ. Protein kinase D 3 is localized in vesicular structures and interacts with vesicle-associated membrane protein 2. Cell Signal. 2007;19:867-879. [PubMed] [DOI] |
| 12. | Chagpar RB, Links PH, Pastor MC, Furber LA, Hawrysh AD, Chamberlain MD, Anderson DH. Direct positive regulation of PTEN by the p85 subunit of phosphatidylinositol 3-kinase. Proc Natl Acad Sci U S A. 2010;107:5471-5476. [PubMed] [DOI] |
| 13. | Myers MP, Stolarov JP, Eng C, Li J, Wang SI, Wigler MH, Parsons R, Tonks NK. P-TEN, the tumor suppressor from human chromosome 10q23, is a dual-specificity phosphatase. Proc Natl Acad Sci USA. 1997;94:9052-9057. [PubMed] [DOI] |
| 14. | Won SH, Lee HJ, Jeong SJ, Lee HJ, Lee EO, Jung DB, Shin JM, Kwon TR, Yun SM, Lee MH. Tanshinone IIA induces mitochondria dependent apoptosis in prostate cancer cells in association with an inhibition of phosphoinositide 3-kinase/AKT pathway. Biol Pharm Bull. 2010;33:1828-1834. [PubMed] [DOI] |