修回日期: 2015-05-10
接受日期: 2015-06-25
在线出版日期: 2015-08-08
目的: 探讨芍药苷(paeoniflorin)对HepG2肝癌细胞凋亡诱导作用, 并考察其作用机制.
方法: 用不同浓度芍药苷(0.5、1.0、2.0 mg/mL)对HepG2肝癌细胞进行给药, MTT法检测细胞活力, Annexin V-FITC流式细胞法检测细胞凋亡情况, 酶标法检测Caspase3活性, Western blot检测核因子κB(nuclear factor kappa-B, NF-κB)信号通路相关蛋白表达.
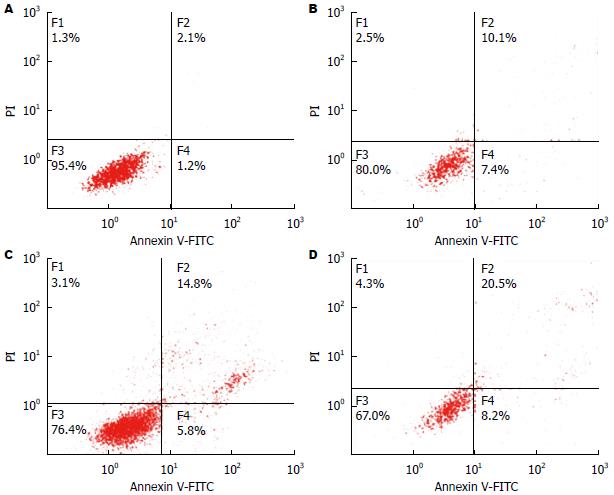
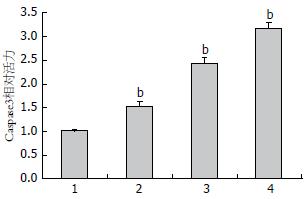
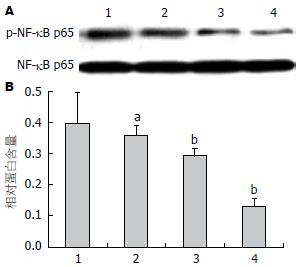
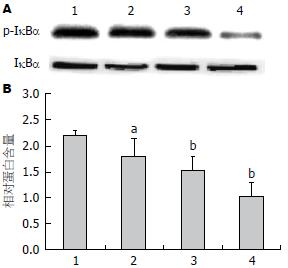
结果: 与对照组比较, 0.5、1.0、2.0 mg/mL芍药苷能逐渐降低HepG2肝癌细胞活力, 且在48 h, 抑制率最高(P<0.05); 与对照组比较, 0.5、1.0、2.0 mg/mL芍药苷能逐渐促进HepG2肝癌细胞凋亡并提高Caspase3活性(P<0.05), 还能显著抑制IκBα磷酸化, 从而促进细胞凋亡; 并且1.0、2.0 mg/mL芍药苷能抑制细胞核内NF-κB p65磷酸化(P<0.05).
结论: PF可能通过激活Caspase3活性以及抑制NF-κB p65和pIκBα表达促进HepG2细胞凋亡.
核心提示: 芍药苷可通过抑制核因子κB(nuclear factor kappa-B, NF-κB)信号通路, 来抑制胃癌细胞增殖, 且芍药苷具有抗肝癌作用; Caspase3及NF-κB活性促进细胞凋亡是治疗肿瘤的有效手段之一, 因此本文拟通过调节Caspase3活性及NF-κB信号通路来探讨芍药苷对肝癌细胞凋亡的抑制作用.
引文著录: 白春阳, 王红雷. 芍药苷通过调节Caspase3活性及核因子κB信号通路诱导HepG2肝癌细胞凋亡. 世界华人消化杂志 2015; 23(22): 3582-3586
Revised: May 10, 2015
Accepted: June 25, 2015
Published online: August 8, 2015
AIM: To explore the effect of paeoniflorin on apoptosis of HepG2 cells and the underlying mechanisms.
METHODS: HepG2 cells were treated with different concentrations of paeoniflorin (0.5, 1.0, and 2.0 mg/mL). The viability of cells was detected by MTT assay. Apoptotic cells were detected by Annexin V-FITC flow cytometry. Caspase3 activity was measured with a colorimetric assay kit. The expression of nuclear factor kappa-B (NF-κB) related proteins was detected by Western blot.
RESULTS: Compared with the control group, paeoniflorin at concentrations of 0.5, 1.0, and 2.0 mg/mL could reduce cell viability, and the inhibitory rate peaked at 48 h (P < 0.05). Compared with the control group, paeoniflorin at concentrations of 0.5, 1.0, and 2.0 mg/mL could promote cell apoptosis, increase Caspase3 activity, and suppress NF-κB p65 phosphorylation (P < 0.05). Paeoniflorin at concentrations of 1.0 and 2.0 mg/mL could suppress IκBα phosphorylation (P < 0.05).
CONCLUSION: Paeoniflorin induces apoptosis of HepG2 cells possibly via the NF-κB signal pathway.
- Citation: Bai CY, Wang HL. Paeoniflorin induces HepG2 cell apoptosis by regulating Caspase3 activation and nuclear factor kappa B signaling pathway. Shijie Huaren Xiaohua Zazhi 2015; 23(22): 3582-3586
- URL: https://www.wjgnet.com/1009-3079/full/v23/i22/3582.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i22.3582
肝癌是世界上常见恶性肿瘤之一, 目前其主要治疗手段为手术, 但术后复发、转移率高. 因此, 寻求有效治疗肝癌, 降低复发率的药物成为研究热点. 芍药苷(paeoniflorin, PF)是从毛茛科植物芍药(Paeonia Lactiflora Pall)中提取的有效单体成分, 具有抗各种肿瘤活性[1-4]. 已有报道[1]芍药苷可上调Bax、p53表达, 下调Bcl-2表达, 从而促进HepG2肝癌细胞凋亡, 但其具体机制还尚未可知. 并且芍药苷可通过抑制核因子κB(nuclear factor kappa B, NF-κB)信号通路, 来抑制胃癌细胞增殖[4,5], 因此本课题在此基础上探讨芍药苷是否也是通过抑制NF-κB信号通路, 来诱导HepG2肝癌细胞凋亡.
HepG2肝癌细胞, 购自美国标准生物品收藏中心(American Type Culture Collection, ATCC), 细胞培养在含10%胎牛血清的DMEM培养基中. 芍药苷购自中国药品生物制品检定所. 其余的材料包括: 四唑盐试剂(MTT)(Sigma公司); BCA法蛋白定量试剂盒(碧云天生物技术研究所); ECL超敏发光液(碧云天生物技术研究所); 小鼠p65抗体(碧云天生物技术研究所); β-actin(碧云天生物技术研究所); 兔核因子κB抑制因子α(nuclear factor of kappa B inhibitor alpha, IκBα)抗体(Epitmics公司); 兔抗pp65抗体(Epitmics公司); Caspase3分光光度法检测试剂盒(南京凯基生物技术有限公司); 胎牛血清(Gbico公司); DMEM培养基(Gbico公司); CO2培养箱(Thermo Scientific公司); 超净工作台(Thermo Scientific公司); Tecan Infinite F200/M200型多功能酶标仪(瑞士TECAN集团公司); ChemiDocTM XRS凝胶成像系统(Bio-Rad公司).
1.2.1 MTT实验: 将80%左右融合的HepG2肝癌细胞消化, 细胞浓度调整为4×103个细胞/mL, 接种, 37 ℃、50 mL/L CO2培养箱中培养24 h. 加入含PF[终浓度(0.5、1.0、2.0 mg/mL]DMEM培养基, 继续培养24、48、72 h, 加MTT(5 mg/mL)
20 μL, 培养4 h后, 弃上清, 加DMSO 150 μL, 10 min左右后, 570 nm处测定吸光度(A)值. 计算药物对细胞生长的抑制率.
1.2.2 Annexin V-FITC流式细胞法检测软骨细胞凋亡: 细胞培养同1.2.1, 培养48 h. 加入含PF[终浓度(0.5、1.0、2.0 mg/mL)]DMEM培养基, 按照Annexin V-FITC/PI细胞凋亡检测试剂盒说明书的方法, 用0.25%的胰蛋白酶(不含EDTA)消化, PBS洗涤, 2000 r/min离心5 min, 收集细胞; 加入Binding Buffer 500 μL悬浮细胞, 随后加入Annexin V-FITC 5 μL混匀后, 加入PI 5 μL, 混匀, 于室温避光反应5-15 min, 在1 h内进行流式细胞仪检测.
1.2.3 Caspase3酶活性检测: 按照Caspase3酶活性检测试剂盒说明书进行操作, 收集细胞, 裂解, 加底物, 显色, 于405 nm处测定A值.
1.2.4 Western blot收集细胞: 加入RIPA裂解液, 收获蛋白. 根据BCA试剂盒对蛋白浓度进行测定. 跑SDS凝胶电泳, 后湿法砖膜. 孵一抗过夜, 二抗1 h, 后在膜上滴加ECL曝光液, 在凝胶成像系统中曝光. 用"Quantity one"软件对各抗体条带灰度值进行统计.
统计学处理 采用SPSS17.0统计分析, 所有数据至少重复3次, 并用mean±SD表示, 两组之间差异显著性经t检验, 以P<0.05为差异具有显著性意义.
如表1所示, 随着给药浓度的增加(0.5、1.0、2.0 mg/mL), 芍药苷对HepG2肝癌细胞抑制作用逐渐增强, 在2.0 mg/mL时抑制率最大(P<0.05); 随着24、48 h给药时间增加, 芍药苷对HepG2肝癌细胞抑制作用也逐渐增强, 其中48、72 h作用强度一致, 所以在后续实验中我们选取48 h作为给药浓度.
与对照组比较, 0.5、1.0、2.0 mg/mL都能显著促进HepG2肝癌细胞凋亡(图1).
如图2所示, 与对照组比较, 0.5、1.0、2.0 mg/mL芍药苷能提高HepG2肝癌细胞Caspase3活性, 并呈剂量依赖性, 具有统计学意义(P<0.01).
如图3所示, 芍药苷能抑制HepG2肝癌细胞细胞核NF-κB p65蛋白磷酸化, 并呈剂量依赖性, 具有统计学意义(P<0.05), 而对细胞核内p65表达无任何影响, 无统计学意义. 因此继续探讨NF-κB p65上游蛋白的影响, 结果发现芍药苷对芍药苷能抑制HepG2肝癌细胞IκBα蛋白磷酸化, 并呈剂量依赖性, 具有统计学意义(P<0.05), 对IκBα自身表达无任何影响(图4).
肝癌是世界上常见恶性肿瘤之一, 其危害仅次于肺癌, 全球每年有约100万例死于肝癌, 其中50%在我国[5-7]. 目前其主要治疗手段为手术, 但即使获得手术切除机会, 其复发、转移率依然相当高. 因此, 寻求有效治疗肝癌, 降低复发率的药物成为研究热点. 而很多的抗肿瘤药物, 包括化疗药物、激素、生物制剂, 都能够引起肿瘤细胞发生凋亡. 凋亡对肿瘤的抑制起到重要作用, 并且抑制NF-κB活性促进细胞凋亡是治疗肿瘤的有效手段之一[8]. 芍药苷可通过抑制NF-κB信号通路, 来抑制胃癌细胞增殖[2,4], 所以本文拟尝试用不同浓度(0.5、1.0、2.0 mg/mL)芍药苷对HepG2肝癌细胞进行给药, 结果表明随着给药浓度的增加, 芍药苷可以逐渐地降低细胞活力, 抑制肿瘤细胞的增殖, 在48 h时其抑制率就可达到最高点. 与芍药苷对其他肿瘤细胞抑制作用浓度有稍许差别[4,9], 这可能是各种肿瘤细胞抵抗外环境不同所造成的, 对各种药物敏感程度不一样所致的.
Caspase3是Caspase家族中最重要的凋亡执行者之一, 他被合成后通常以非活化的酶原形式存在于细胞质中, 在多种凋亡信号刺激下经蛋白水解作用被激活成活化形式, 可对多种蛋白底物进行降解, 从而在细胞凋亡过程中起关键作用, 被认为是整个凋亡级联反应的一个关键调节点[10]. Caspase3在HepG2肝癌细胞中活性高于给药组[11-13], 在本研究中, 与对照组中对比, 芍药苷(0.5、1.0、2.0 mg/mL)剂量依赖性抑制Caspase3活性.
NF-κB是一类广泛存在于肿瘤细胞内的重要转录因子, 是多信号转导途径的汇聚点, 参与组织细胞的免疫调节、炎症反应、生长分化和凋亡等[14]. 未受刺激时与IκB结合, 当受到刺激时, IκB磷酸化, 释放NF-κB, 使之恢复转录活性并从细胞质转移到细胞核内, 调节相关基因的表达. NF-κB在肝癌[15]、胃癌[16]、乳腺癌[17]等肿瘤中都被激活, 过表达. 在原发性肝癌中NF-κB持续被激活, 与原发性肝癌肿瘤的发生发展及预后不良密切相关[18], NF-κB抑制剂PDTC可抑制NF-κB活性, 抑制肿瘤细胞增殖[19]. 朱开梅等[20]报道八角中莽草酸可通过抑制NF-κB p65活性, 从而抑制人肝癌HepG2细胞增殖. 本实验结果也表明芍药苷能抑制HepG2肝癌细胞NF-κB p65、IκBα蛋白磷酸化, 最终提高Caspase3活性, 诱导肿瘤细胞凋亡.
因此可以得出PF可能通过激活Caspase3活性以及抑制pp65和pIκBα表达促进HepG2细胞凋亡.
肝癌是世界上常见恶性肿瘤之一, 目前其主要治疗手段为手术, 但术后复发、转移率高. 而芍药苷(paeoniflorin, PF)是从毛茛科植物芍药(Paeonia Lactiflora Pall)中提取的有效单体成分, 具有抗各种肿瘤活性, 因此本文通过一定剂量芍药苷作用于肝癌细胞HepG2, 并探讨其机制.
李孟森, 教授, 海南医学院, 海南省肿瘤发生和干预重点实验室
朱开梅等报道八角中莽草酸可通过抑制NF-κB p65活性, 从而抑制人肝癌HepG2细胞增殖. 本实验结果也表明芍药苷能抑制HepG2肝癌细胞NF-κBp65, IκBα蛋白磷酸化, 最终提高Caspase3活性, 诱导肿瘤细胞凋亡.
芍药苷可通过激活Caspase3活性以及抑制pp65和pIκBα表达促进HepG2细胞凋亡.
本文研究内容新颖, 有一定的参考价值.
编辑: 郭鹏 电编:闫晋利
| 2. | Fang S, Zhu W, Zhang Y, Shu Y, Liu P. Paeoniflorin modulates multidrug resistance of a human gastric cancer cell line via the inhibition of NF-κB activation. Mol Med Rep. 2012;5:351-356. [PubMed] [DOI] |
| 3. | Lu JT, He W, Song SS, Wei W. Paeoniflorin inhibited the tumor invasion and metastasis in human hepatocellular carcinoma cells. Bratisl Lek Listy. 2014;115:427-433. [PubMed] |
| 4. | 方 申存, 戴 伟, 吴 昊, 束 永前, 刘 平. 芍药苷对人胃癌SGC7901/VCR细胞增殖抑制作用及其机制研究. 南京医科大学学报(自然科学版). 2010;30:636-640. |
| 5. | Chang H, Xu J, Mu Q, Qin C, Zhang Z, Wu T. Occult hepatocellular carcinoma: a case report of a special icteric-type hepatoma and literature review. Eur J Cancer Care (Engl). 2010;19:690-693. [PubMed] [DOI] |
| 6. | Wáng YX, De Baere T, Idée JM, Ballet S. Transcatheter embolization therapy in liver cancer: an update of clinical evidences. Chin J Cancer Res. 2015;27:96-121. [PubMed] [DOI] |
| 7. | Bruix J, Han KH, Gores G, Llovet JM, Mazzaferro V. Liver cancer: Approaching a personalized care. J Hepatol. 2015;62:S144-S156. [PubMed] [DOI] |
| 8. | Baud V, Karin M. Is NF-kappaB a good target for cancer therapy? Hopes and pitfalls. Nat Rev Drug Discov. 2009;8:33-40. [PubMed] [DOI] |
| 10. | Porter AG, Jänicke RU. Emerging roles of caspase-3 in apoptosis. Cell Death Differ. 1999;6:99-104. [PubMed] [DOI] |
| 11. | Xiang Q, Ma Y, Dong J, Shen R. Carnosic acid induces apoptosis associated with mitochondrial dysfunction and Akt inactivation in HepG2 cells. Int J Food Sci Nutr. 2015;66:76-84. [PubMed] [DOI] |
| 12. | Zhang H, Guo Z, Han L, You X, Xu Y. The antitumor effect and mechanism of taipeinine A, a new C19-diterpenoid alkaloid from Aconitum taipeicum, on the HepG2 human hepatocellular carcinoma cell line. J BUON. 2014;19:705-712. [PubMed] |
| 13. | Sudan S, Rupasinghe HP. Flavonoid-enriched apple fraction AF4 induces cell cycle arrest, DNA topoisomerase II inhibition, and apoptosis in human liver cancer HepG2 cells. Nutr Cancer. 2014;66:1237-1246. [PubMed] [DOI] |
| 14. | Zhang YH, Yan HQ, Wang F, Wang YY, Jiang YN, Wang YN, Gao FG. TIPE2 inhibits TNF-α-induced hepatocellular carcinoma cell metastasis via Erk1/2 downregulation and NF-κB activation. Int J Oncol. 2015;46:254-264. [PubMed] [DOI] |
| 15. | Huang X, Qin J, Lu S. Kanglaite stimulates anticancer immune responses and inhibits HepG2 cell transplantationinduced tumor growth. Mol Med Rep. 2014;10:2153-2159. [PubMed] [DOI] |
| 16. | Cheng CY, Hu CC, Yang HJ, Lee MC, Kao ES. Inhibitory effects of scutellarein on proliferation of human lung cancer A549 cells through ERK and NFκB mediated by the EGFR pathway. Chin J Physiol. 2014;57:182-187. [PubMed] [DOI] |
| 17. | Zeng L, Zhen Y, Chen Y, Zou L, Zhang Y, Hu F, Feng J, Shen J, Wei B. Naringin inhibits growth and induces apoptosis by a mechanism dependent on reduced activation of NFκB/COX2caspase-1 pathway in HeLa cervical cancer cells. Int J Oncol. 2014;45:1929-1936. [PubMed] [DOI] |
| 18. | Calvisi DF, Frau M, Tomasi ML, Feo F, Pascale RM. Deregulation of signalling pathways in prognostic subtypes of hepatocellular carcinoma: novel insights from interspecies comparison. Biochim Biophys Acta. 2012;1826:215-237. [PubMed] |
| 19. | Madonna G, Ullman CD, Gentilcore G, Palmieri G, Ascierto PA. NF-κB as potential target in the treatment of melanoma. J Transl Med. 2012;10:53. [PubMed] [DOI] |