修回日期: 2015-05-30
接受日期: 2015-06-10
在线出版日期: 2015-08-08
目的: 检测CD68和CD11c在肝细胞癌(hepatocellular carcinoma, HCC)和癌旁组织巨噬细胞中的表达情况, 探讨并比较其与CD68在HCC中的相关临床病理特征的关系及其意义.
方法: 采用免疫组织化学方法检测60例HCC患者肝癌组织和癌旁组织CD68和CD11c的表达, 分析并比较CD68和CD11c在巨噬细胞中的表达情况以及与HCC临床病理特征的关系; 免疫荧光双染HCC石蜡切片肝癌组织的CD68和CD11c, 采用倒置荧光显微镜观察, 并采集图像分析CD68和CD11c的表达意义.
结果: 免疫组织化学染色结果显示CD68、CD11c主要在肝癌和癌旁组织巨噬细胞中表达. 癌旁组织中的CD68和CD11c表达水平明显高于肝癌组织(P<0.01), 肝癌和癌旁组织中的CD68和CD11c存在一定的相关性(r = 0.601, P<0.01; r = 0.626, P<0.01); 肝癌组织和癌旁组织中CD68的表达水平明显高于CD11c的表达(分别为P<0.01和P<0.01); 免疫荧光双染结果显示在肝癌组织CD68的表达明显高于CD11c, 与免疫组织化学结果一致.
结论: CD68巨噬细胞在癌旁组织中表达明显高于肝癌组织, CD11c巨噬细胞在癌旁组织中表达也明显高于肝癌组织, 并且与CD68相比, CD11c标记的巨噬细胞与HCC的发生、进展关系更为密切; 可以帮助我们为诊断及治疗HCC提供一些新的思路和理论基础.
核心提示: M2型巨噬细胞通过调节肿瘤生长、适应性免疫、血管生成和肿瘤基质形成促进肿瘤的发展和转移, 并且可作为预后指标. 本文研究发现CD68泛-巨噬细胞、CD11c M1型巨噬细胞在癌旁组织中表达明显高于肝癌组织, 并且与CD68相比, CD11c M1型巨噬细胞与肝细胞癌的发生发展关系更为密切, 从而为肝癌提供新的辅助治疗策略.
引文著录: 束青华, 葛勇胜, 许戈良, 马金良, 荚卫东, 余继海, 张传海, 刘文斌. CD68和CD11c在肝细胞癌中的表达及临床意义. 世界华人消化杂志 2015; 23(22): 3538-3547
Revised: May 30, 2015
Accepted: June 10, 2015
Published online: August 8, 2015
AIM: To investigate the clinical significance of expression of CD68 and CD11c in hepatocellular carcinoma (HCC).
METHODS: Sixty HCC and matched peritumoral tissues were collected. The expression of CD68 and CD11c in macrophages in these tissues was detected by immunohistochemical staining. The relationship between CD68 and CD11c expression and clinicopathologic features of HCC was analyzed. Paraffin sections of HCC tumor tissues were stained for CD68 and CD11c by double immunofluorescence to analyze the expression and significance of CD68 and CD11c.
RESULTS: CD68 and CD11c were expressed mainly in macrophages in HCC and peritumoral tissues. The expression levels of CD68 and CD11c were significantly higher in peritumoral tissues than in HCC tissues (P < 0.01). The expression of CD68 and CD11c had a significant correlation in both HCC and peritumoral tissues (r = 0.601, P < 0.01; r = 0.626, P < 0.01). The expression level of CD68 in macrophages in HCC and peritumoral tissues was significantly higher than that of CD11c (P < 0.01 for both). Double immunofluorescence analysis showed that the relative content of CD68 in HCC tissues was significantly higher than that of CD11c, which is consistent with the results of immunohistochemistry.
CONCLUSION: The expression levels of CD68 and CD11c in tumor adjacent tissues are significantly higher than those in HCC tissues. Compared with CD68+ macrophages, CD11c+ macrophages may be closely related to the oncogenesis and progression of HCC.
- Citation: Shu QH, Ge YS, Xu GL, Ma JL, Jia WD, Yu JH, Zhang CH, Liu WB. Clinical significance of expression of CD68 and CD11c in hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2015; 23(22): 3538-3547
- URL: https://www.wjgnet.com/1009-3079/full/v23/i22/3538.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i22.3538
肝细胞癌(hepatocellular carcinoma, HCC)约占原发性肝癌的70%-85%, 是全世界最常见的恶性肿瘤之一, 且是男性患者中癌症死亡的第二大原因, 女性患者癌症死亡的第六大原因, 其中约有一半发生在中国[1]. 虽然, 肝切除术是治疗肝癌患者长期生存的最佳方法之一, 但是术后高复发率是主要问题[2]. 尽管肝移植术切除了全部肝病, 包括肝癌原发灶和肝内转移灶, 但5年生存率也仅为47%-61%[3]. 最近研究[4]指出, 肿瘤微环境, 特别是巨噬细胞在各种肿瘤的发生、发展和转移中发挥着重要的作用. 大量相关研究[5-10]指出, 瘤内巨噬细胞与预后有关, 但是这种结果具有异质性, 因其未将巨噬细胞分为M1型(经典活化的)和M2型(替代性活化的)巨噬细胞亚型. 此外, 部分研究[11,12]指出, 在各种肿瘤中肿瘤相关巨噬细胞主要是M2型巨噬细胞, M2型巨噬细胞通过调节肿瘤生长、适应性免疫、血管生成和肿瘤基质形成促进肿瘤的发展和转移, 并且可作为预后指标[13-15]. 因此推测, M1型巨噬细胞也参与了肿瘤的过程, 可能起着抗肿瘤作用. 但是, CD68(泛-巨噬细胞)是最广泛使用的巨噬细胞标志物, 但不能区分M1(CD11c)和M2巨噬细胞[16]. 本文初步探讨HCC中CD68和CD11c的表达及其与相关临床病理特征的关系, 为诊断及治疗HCC提供一些新的思路和理论基础.
收集安徽医科大学附属省立医院肝脏外科2008-01/2011-12行肝切除术并经术后病理证实为HCC60例石蜡标本. 上述患者术前未接受任何形式的抗肿瘤治疗. 其中男50例, 女10例; 年龄30-79岁(57.8岁±10.2岁). 包膜完整者40例, 不完整者20例; 甲胎蛋白(alpha fetoprotein, AFP)≤20 ng/mL者25例, >20 ng/mL 35例. 按照2010年国际抗癌联盟/美国癌症联合委员会(International Union Against Cancer/American Joint Committee on Cancer, UICC/AJCC)第七次修订的HCC TNM临床分期标准[17]:Ⅰ-Ⅱ期37例, Ⅲ-Ⅳ期23例; 肝癌组织Edmondson分级:Ⅰ-Ⅱ级38例, Ⅲ-Ⅳ级22例; 血管侵犯(包括肉眼癌栓和镜下癌栓)25例, 无血管侵犯35例; 肿瘤转移者28例, 无肿瘤转移者32例; 巴塞罗那临床肝癌分期(Barcelona Clinic Liver Cancer, BCLC)[18]: A-B期40例, C-D期20例; 美国东部肿瘤协作组-体力活动状态评分系统(Eastern Cooperative Oncology Group performance status, ECOG-PS)[19]: 0分39例, ≥1分21例. 以上资料得到患者及家属的书面同意及安徽医科大学医学伦理委员会批准. 鼠抗人单克隆抗体CD68(Abcam, Cambridge, MA), 兔抗人单克隆抗体CD11c(Abcam, Cambridge, MA), 免疫组织化学试剂盒、免疫荧光双染试剂盒均购自北京中杉金桥生物技术有限公司.
1.2.1 免疫组织化学染色: 采用SP法免疫组织化学染色. 单染: 经乙醇梯度脱蜡水化, 柠檬酸水浴加热进行抗原修复; 3%过氧化氢灭活内源性过氧化物酶, 血清封闭, 一抗鼠抗人单克隆抗体CD68(1:200), 兔抗人单克隆抗体CD11c(1:100), 4 ℃孵育过夜; 通用型二抗室温孵育30 min, DAB染色, 苏木精复染, 梯度无水乙醇脱水, 中性树胶封片.
1.2.2 免疫荧光双染: 抗原修复等步骤与单染基本类似, 加一抗: 滴加用5%BSA按一定比例稀释好的一抗覆盖组织. 于湿盒内4 ℃孵育过夜; 加二抗: 玻片置于PBS(pH 7.4)中在脱色摇床上晃动洗涤3次, 每次5 min. 滴加与一抗相应种属的二抗(FITC标记)覆盖组织, 避光室温孵育50 min; DAPI复染细胞核: 玻片置于PBS(pH 7.4)中在脱色摇床上晃动洗涤3次, 每次5 min. 滴加DAPI染液, 避光室温孵育10 min; 封片: 玻片置于PBS(pH 7.4)中在脱色摇床上晃动洗涤3次, 每次5 min. 切片稍甩干后用抗荧光淬灭封片剂封片; 镜检拍照: 切片于尼康倒置荧光显微镜下观察并采集图像. 步骤均参照试剂盒的说明书进行操作, 并由两位病理专家采用双盲法对染色结果进行评估. 抗CD68免疫组织化学标记泛-巨噬细胞, 抗CD11免疫组织化学标记M1型巨噬细胞[20].
1.2.3 免疫组织化学及免疫荧光双染结果判定: 双染: 在400倍镜下选取具有代表性的细胞视野, 出现红色和绿色双重染色的归类为M1型巨噬细胞. 单染: CD68表达以细胞质或细胞膜中出现黄褐色或棕褐色颗粒为阳性, CD11c以细胞质或细胞膜中出现黄褐色或棕褐色颗粒为阳性, 先在低倍(100倍)光学显微镜下观察切片, 随机选择癌旁和癌组织中5个不重叠具有代表性的区域, 高倍视野(200倍)下计数阳性细胞, 求其均值, 即为该切片的TAM(tumor-associated macrophage)数, 计数方法参照Molin法[21], 以中位数截取值分高密度组和低密度组.
统计学处理 应用SPSS17.0软件处理数据, 计量资料以mean±SD表示, 用t检验及相关分析; 组间比较用χ2检验, P<0.05为差异有统计学意义.
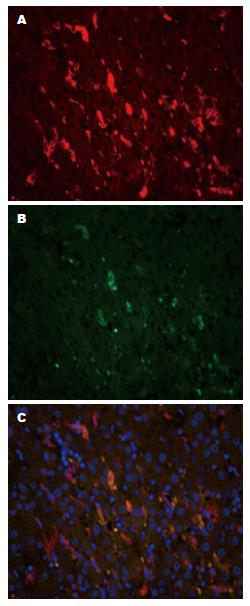
免疫组织化学染色结果显示, CD68、CD11c主要在肝癌和癌旁组织巨噬细胞中表达(图1). 免疫荧光双染结果显示, CD11c阳性巨噬细胞包括在CD68阳性巨噬细胞内, 在肝癌组织内不存在CD11c(+)CD68(-)巨噬细胞, 这与免疫组织化学染色结果一致(图2).
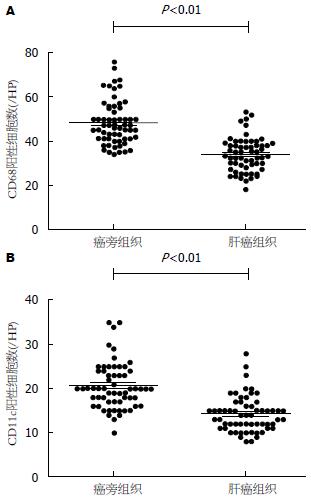
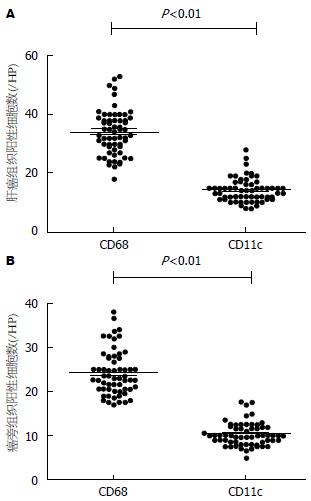
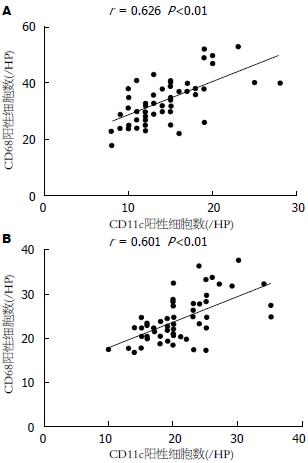
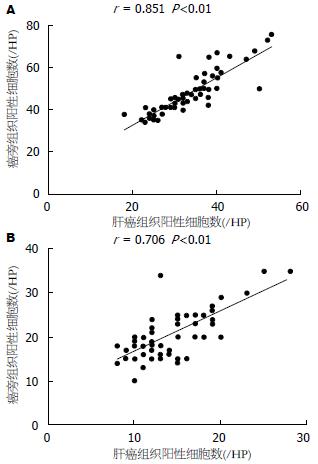
癌旁组织中的CD68和CD11c表达水平明显高于肝癌组织, 差异有统计学意义(t = 8.87, P<0.01; t = 7.41, P<0.01)(图3). 癌旁组织CD68和CD11c计数分别是48.42/视野±10.10/视野和20.55/视野±5.24/视野, 中位数分别是46.50/视野和20.00/视野; 肝癌组织CD68和CD11c计数分别是33.88/视野±7.68/视野和14.22/视野±4.03/视野, 中位数分别是33.50/视野和14.00/视野. 肝癌组织和癌旁组织中CD68的表达水平明显高于CD11c的表达, 差异有统计学意义(t = 25.23, P<0.01; t = 26.59, P<0.01)(图4). 以及肝癌和癌旁组织中的CD68和CD11c存在一定的相关性(r = 0.601, P<0.01; r = 0.626, P<0.01)(图5); CD68和CD11c在肝癌组织和癌旁组织也存在一定的相关性(r = 0.851, P<0.01; r = 0.706, P<0.01)(图6).
癌旁组织CD11c表达与患者肿瘤数目相关(χ2 = 4.418, P = 0.042); 肝癌组织和癌旁组织CD11c表达与患者肿瘤包膜、血管侵犯、肿瘤转移、TNM分期和ECOG-PS相关(P<0.05); 癌旁组织CD68与患者肿瘤包膜、血管侵犯、肿瘤转移、TNM分期和ECOG-PS、Edmondson分级及BCLC分期相关(P<0.05); 肝癌组织CD68与患者肿瘤包膜、血管侵犯、肿瘤转移、TNM分期和ECOG-PS、Edmondson分级及BCLC分期无相关; 肝癌组织和癌旁组织CD68、CD11c表达与患者年龄、性别、HBsAg、肝硬化等无明显相关(P>0.05)(表1).
| 临床因素 | 癌旁组织CD68 | 癌旁组织CD11c | 肝癌组织CD68 | 肝癌组织CD11c | ||||||||||||
| 低 | 高 | χ2值 | P值 | 低 | 高 | χ2值 | P值 | 低 | 高 | χ2值 | P值 | 低 | 高 | χ2值 | P值 | |
| 性别 | 1.080 | 0.299 | 0.919 | 0.338 | 1.080 | 0.299 | 0.054 | 0.817 | ||||||||
| 男 | 27 | 23 | 33 | 17 | 23 | 27 | 27 | 23 | ||||||||
| 女 | 3 | 7 | 5 | 5 | 7 | 3 | 5 | 5 | ||||||||
| 年龄(岁) | 1.270 | 0.260 | 0.875 | 0.350 | 1.270 | 0.260 | 0.115 | 0.735 | ||||||||
| ≤50 | 7 | 11 | 13 | 5 | 11 | 7 | 9 | 9 | ||||||||
| >50 | 23 | 19 | 25 | 17 | 19 | 23 | 23 | 19 | ||||||||
| HBsAg | 0.417 | 0.519 | 0.161 | 0.688 | 0.000 | 1.000 | 0.067 | 0.796 | ||||||||
| 阳性 | 23 | 25 | 31 | 17 | 24 | 24 | 26 | 22 | ||||||||
| 阴性 | 7 | 5 | 7 | 5 | 6 | 6 | 6 | 6 | ||||||||
| 肝硬化 | 0.739 | 0.390 | 0.208 | 0.649 | 0.739 | 0.390 | 1.233 | 0.267 | ||||||||
| 阳性 | 20 | 23 | 28 | 15 | 20 | 23 | 21 | 22 | ||||||||
| 阴性 | 10 | 7 | 10 | 7 | 10 | 7 | 11 | 6 | ||||||||
| AFP(ng/ml) | 3.360 | 0.067 | 0.402 | 0.526 | 1.714 | 0.190 | 0.490 | 0.484 | ||||||||
| ≤20 | 16 | 9 | 17 | 8 | 15 | 10 | 12 | 13 | ||||||||
| >20 | 14 | 21 | 21 | 14 | 15 | 20 | 20 | 15 | ||||||||
| 肿瘤数目(个) | 1.080 | 0.299 | 4.148 | 0.042 | 0.120 | 0.729 | 0.857 | 0.355 | ||||||||
| 1 | 27 | 23 | 35 | 15 | 26 | 24 | 28 | 22 | ||||||||
| ≥2 | 3 | 7 | 3 | 7 | 4 | 6 | 4 | 6 | ||||||||
| 肿瘤直径(cm) | 2.500 | 0.114 | 0.191 | 0.662 | 2.500 | 0.114 | 1.350 | 0.245 | ||||||||
| ≤5 | 15 | 9 | 16 | 8 | 15 | 9 | 15 | 9 | ||||||||
| >5 | 15 | 21 | 22 | 14 | 15 | 21 | 17 | 19 | ||||||||
| 肿瘤包膜 | 9.075 | 0.003 | 7.033 | 0.008 | 0.000 | 1.000 | 9.676 | 0.002 | ||||||||
| 完整 | 26 | 14 | 30 | 10 | 20 | 20 | 27 | 13 | ||||||||
| 不完整或无 | 4 | 16 | 8 | 12 | 10 | 10 | 5 | 15 | ||||||||
| 血管侵犯1 | 15.429 | 0.000 | 4.339 | 0.037 | 1.714 | 0.190 | 5.173 | 0.023 | ||||||||
| 阳性 | 5 | 20 | 12 | 13 | 15 | 10 | 9 | 16 | ||||||||
| 阴性 | 25 | 10 | 26 | 9 | 15 | 20 | 23 | 12 | ||||||||
| 肿瘤转移 | 24.174 | 0.000 | 13.074 | 0.000 | 0.972 | 0.324 | 6.548 | 0.010 | ||||||||
| 阳性 | 4 | 24 | 11 | 17 | 10 | 18 | 10 | 18 | ||||||||
| 阴性 | 26 | 6 | 27 | 5 | 20 | 12 | 22 | 10 | ||||||||
| Edmondson分级 | 10.335 | 0.001 | 1.320 | 0.251 | 2.584 | 0.108 | 0.155 | 0.694 | ||||||||
| Ⅰ-Ⅱ | 25 | 13 | 22 | 16 | 22 | 16 | 21 | 17 | ||||||||
| Ⅲ-Ⅳ | 5 | 17 | 16 | 6 | 8 | 14 | 11 | 11 | ||||||||
| TNM分期 | 28.202 | 0.000 | 13.092 | 0.000 | 3.455 | 0.063 | 11.125 | 0.001 | ||||||||
| Ⅰ-Ⅱ | 29 | 8 | 30 | 7 | 22 | 15 | 26 | 11 | ||||||||
| Ⅲ-Ⅳ | 1 | 22 | 8 | 15 | 8 | 15 | 6 | 17 | ||||||||
| BCLC分期 | 9.075 | 0.003 | 2.297 | 0.130 | 2.700 | 0.100 | 2.143 | 0.143 | ||||||||
| A-B | 26 | 14 | 28 | 12 | 23 | 17 | 24 | 16 | ||||||||
| C-D | 4 | 16 | 10 | 10 | 7 | 13 | 8 | 12 | ||||||||
| ECOG-PS | 8.864 | 0.003 | 5.833 | 0.016 | 3.590 | 0.058 | 5.192 | 0.023 | ||||||||
| 0 | 25 | 14 | 29 | 10 | 23 | 16 | 25 | 14 | ||||||||
| ≥1 | 5 | 16 | 9 | 12 | 7 | 14 | 7 | 14 | ||||||||
近年来, 炎症在肿瘤中扮演的作用越来越重要, 肿瘤免疫微环境在肿瘤发生发展过程中的作用已成为临床研究的热点之一. 巨噬细胞是肿瘤局部浸润的免疫细胞中比例最大的一群细胞, 他由不同的亚型组成, 每种亚型由于所处的微环境不同具有不同的表型并发挥不同甚至相反的生物学功能. 巨噬细胞分为M1型巨噬细胞和M2型巨噬细胞, M1型巨噬细胞能够调整宿主对多种细菌和病毒的防御能力, 在抗肿瘤过程中起到重要的作用[22]; M2型巨噬细胞通过调节肿瘤生长、适应性免疫、血管生成和肿瘤基质形成促进肿瘤的发展和转移[13-15]. 前期的相关研究显示癌旁巨噬细胞的浸润和巨噬细胞集落刺激因子(macrophage colony-stimulating factors, M-CSF)的高表达, 和肝癌手术后的进展、复发及不良预后相关[23-25]. 本研究发现癌旁组织中的CD68表达水平明显高于肝癌组织, 且癌旁组织CD68与患者肿瘤包膜、血管侵犯、肿瘤转移、TNM分期和ECOG-PS、Edmondson分级及BCLC分期相关, 可能由此推测巨噬细胞在肝癌组织中减少, 可能与肿瘤组织内肝小叶结构紊乱、破坏较多, 导致正常肝血窦环境无法维持, 引起细胞表面共刺激信号缺乏, 不能为T细胞活化提供足够的第二信号, 从而诱导抗肿瘤免疫应答能力下降, 使肿瘤细胞易于免疫逃逸, 最终导致肿瘤生长发展加快[26]. HCC中肿瘤相关巨噬细胞的极化尚未完全阐明, 之前的研究均直接将泛-巨噬细胞CD68作为识别肿瘤相关巨噬细胞组织中标志. 因此才会导致巨噬细胞和肿瘤患者预后关系的偏差. 实际上, CD68是M1型巨噬细胞和M2型巨噬细胞共表达结果, 因此使用CD68标记巨噬细胞不能作为可靠的生物学标志物, 来评估两种具有相反生物学特征的巨噬细胞在组织中的意义. 在本项研究中, 我们使用免疫荧光双染CD11c/CD68标记M1型巨噬细胞, 这与大多数先前发表的文章进行表型鉴定研究巨噬细胞极化是一致的. 在脂肪组织中, CD11c作为M1型巨噬细胞常用标志物, 同时也被看作是髓系树突状细胞(DCs)的标志物, 因此可能存在疑问是CD11c阳性巨噬细胞标记是巨噬细胞还是DCs[27,28]. 定义巨噬细胞和DCs的主要问题在于他们源于共同髓系前体和表达共同的细胞表面标志物[22]. 因此, 应该注意到, 这个问题在这些领域不是唯一的, 在免疫学家当中即使定义良好的淋巴组织巨噬细胞和DCs之间的区别也是有争议的[29,30].
有趣的是在本项研究中, CD11c阳性巨噬细胞表达与患者单个肿瘤数目、具有完整包膜、无血管侵犯、无肿瘤转移的早期肿瘤相关. Ma等[31]发现在非小细胞肺癌中M1型巨噬细胞与患者的生存时间有显著相关性. 可能的解释就是, M1型巨噬细胞能够释放大量促炎症细胞因子、活性氧、活性氮媒介和共刺激因子, 在肿瘤免疫应答中可能起着重要的正性调控作用, 能通过促进DCs对抗原的呈递和抑制肿瘤的转移等多种机制在肿瘤的发生发展过程中发挥重要的作用.
总之, M1型巨噬细胞参与了肿瘤的发生发展, 特别是在肿瘤早期, 为HCC的发生发展机制提供另一种思路, 为此我们可以通过研究使M2型巨噬细胞向M1型巨噬细胞转变的机制, 通过寻找和研究调节M2向M1型转变的药物, 为探索肝癌治疗新方法, 延长患者术后的生存期, 减少肝内播散造成的术后复发, 提供新的辅助治疗策略.
肝细胞癌是世界常见的恶性肿瘤之一, 且术后高复发率是主要问题, 同时, M2型巨噬细胞促进肿瘤的发展和转移, M1型巨噬细胞在抗肿瘤过程中起到重要的作用, 但是, CD68是泛-巨噬细胞标志物, 不能区分M1和M2型巨噬细胞.
邓庆, 副研究员, 上海人类基因组研究中心功能基因组部
肿瘤免疫微环境在肿瘤发生发展过程中的作用已成为临床研究的热点, 巨噬细胞是免疫微环境的主要成分, 其在肝癌进展中的作用及其机制, 以及针对巨噬细胞的靶向药物是该研究领域中的前沿问题.
近年来, 巨噬细胞在炎症、肿瘤等疾病中的作用引起了极大的关注. 但有关M1型巨噬细胞的研究与报道较少, 尤其M1型细胞在肝脏生理、病理活动中所发挥作用以及M1型巨噬细胞趋化募集、调控等报道更少, 其具体作用机制亟待进一步的研究.
有关M1型巨噬细胞在肝细胞癌中的研究相当有限, 本实验通过与泛-巨噬细胞相比, 得出以下结论: M1型巨噬细胞参与了肿瘤的发生发展, 特别是在分化良好的肿瘤中, 表明M1型巨噬细胞可以抑制肿瘤进一步恶化.
本文研究CD68和CD11c在肝细胞癌患者中的关系, 提示了M1型巨噬细胞与肝细胞癌的发生发展有关, 为进一步研究M1型巨噬细胞在疾病中的作用机制提供了方向, 同时为术后复发提供了一些理论指导.
CD68: 一种分子量为110 kDa的细胞浆蛋白, 表达于巨噬细胞、单核细胞、Kupffer细胞、破骨细胞、粒细胞及其前体, 是巨噬细胞最可靠的标志物;
CD11c: 黏附分子家族成员, 对免疫细胞具有协同刺激作用, 在人类树突状细胞、单核细胞、巨噬细胞、中性粒细胞和部分淋巴细胞有表达.
本文系统地总结了肝星状细胞相关信号通路与miRNA相互调控的相关研究结果, 为肝星状细胞激活的内在机制、肝纤维化病理进程过程中的分子机制研究以及分子靶向治疗提供文献参考.
编辑: 郭鹏 电编:闫晋利
| 1. | Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin. 2011;61:69-90. [PubMed] [DOI] |
| 2. | Llovet JM, Burroughs A, Bruix J. Hepatocellular carcinoma. Lancet. 2003;362:1907-1917. [PubMed] [DOI] |
| 3. | Llovet JM, Bruix J. Molecular targeted therapies in hepatocellular carcinoma. Hepatology. 2008;48:1312-1327. [PubMed] [DOI] |
| 4. | Lewis CE, Pollard JW. Distinct role of macrophages in different tumor microenvironments. Cancer Res. 2006;66:605-612. [PubMed] [DOI] |
| 5. | Lissbrant IF, Stattin P, Wikstrom P, Damber JE, Egevad L, Bergh A. Tumor associated macrophages in human prostate cancer: relation to clinicopathological variables and survival. Int J Oncol. 2000;17:445-451. [PubMed] [DOI] |
| 6. | Ohno S, Ohno Y, Suzuki N, Kamei T, Koike K, Inagawa H, Kohchi C, Soma G, Inoue M. Correlation of histological localization of tumor-associated macrophages with clinicopathological features in endometrial cancer. Anticancer Res. 2004;24:3335-3342. [PubMed] |
| 7. | Hanada T, Nakagawa M, Emoto A, Nomura T, Nasu N, Nomura Y. Prognostic value of tumor-associated macrophage count in human bladder cancer. Int J Urol. 2000;7:263-269. [PubMed] [DOI] |
| 8. | Lee CH, Espinosa I, Vrijaldenhoven S, Subramanian S, Montgomery KD, Zhu S, Marinelli RJ, Peterse JL, Poulin N, Nielsen TO. Prognostic significance of macrophage infiltration in leiomyosarcomas. Clin Cancer Res. 2008;14:1423-1430. [PubMed] [DOI] |
| 9. | Forssell J, Oberg A, Henriksson ML, Stenling R, Jung A, Palmqvist R. High macrophage infiltration along the tumor front correlates with improved survival in colon cancer. Clin Cancer Res. 2007;13:1472-1479. [PubMed] [DOI] |
| 10. | Ohno S, Inagawa H, Dhar DK, Fujii T, Ueda S, Tachibana M, Suzuki N, Inoue M, Soma G, Nagasue N. The degree of macrophage infiltration into the cancer cell nest is a significant predictor of survival in gastric cancer patients. Anticancer Res. 2003;23:5015-5022. [PubMed] |
| 11. | Kurahara H, Shinchi H, Mataki Y, Maemura K, Noma H, Kubo F, Sakoda M, Ueno S, Natsugoe S, Takao S. Significance of M2-polarized tumor-associated macrophage in pancreatic cancer. J Surg Res. 2011;167:e211-e219. [PubMed] [DOI] |
| 12. | Sica A, Schioppa T, Mantovani A, Allavena P. Tumour-associated macrophages are a distinct M2 polarised population promoting tumour progression: potential targets of anti-cancer therapy. Eur J Cancer. 2006;42:717-727. [PubMed] [DOI] |
| 13. | Balkwill F, Mantovani A. Inflammation and cancer: back to Virchow? Lancet. 2001;357:539-545. [PubMed] [DOI] |
| 14. | Coussens LM, Tinkle CL, Hanahan D, Werb Z. MMP-9 supplied by bone marrow-derived cells contributes to skin carcinogenesis. Cell. 2000;103:481-490. [PubMed] [DOI] |
| 15. | Mantovani A, Sozzani S, Locati M, Allavena P, Sica A. Macrophage polarization: tumor-associated macrophages as a paradigm for polarized M2 mononuclear phagocytes. Trends Immunol. 2002;23:549-555. [PubMed] [DOI] |
| 16. | Falini B, Flenghi L, Pileri S, Gambacorta M, Bigerna B, Durkop H, Eitelbach F, Thiele J, Pacini R, Cavaliere A. PG-M1: a new monoclonal antibody directed against a fixative-resistant epitope on the macrophage-restricted form of the CD68 molecule. Am J Pathol. 1993;142:1359-1372. [PubMed] |
| 17. | Edge SB, Byrd DR, Compton CC, Fritz AG, Greene FL, Trotti A. AJCC cancer staging manual. New York: Springer 2010; . |
| 18. | Llovet JM, Brú C, Bruix J. Prognosis of hepatocellular carcinoma: the BCLC staging classification. Semin Liver Dis. 1999;19:329-338. [PubMed] [DOI] |
| 19. | McCorkle R, Ercolano E, Lazenby M, Schulman-Green D, Schilling LS, Lorig K, Wagner EH. Self-management: Enabling and empowering patients living with cancer as a chronic illness. CA Cancer J Clin. 2011;61:50-62. [PubMed] [DOI] |
| 20. | Hirata Y, Tabata M, Kurobe H, Motoki T, Akaike M, Nishio C, Higashida M, Mikasa H, Nakaya Y, Takanashi S. Coronary atherosclerosis is associated with macrophage polarization in epicardial adipose tissue. J Am Coll Cardiol. 2011;58:248-255. [PubMed] [DOI] |
| 21. | Molin D, Edström A, Glimelius I, Glimelius B, Nilsson G, Sundström C, Enblad G. Mast cell infiltration correlates with poor prognosis in Hodgkin's lymphoma. Br J Haematol. 2002;119:122-124. [PubMed] [DOI] |
| 22. | Murray PJ, Wynn TA. Protective and pathogenic functions of macrophage subsets. Nat Rev Immunol. 2011;11:723-737. [PubMed] [DOI] |
| 23. | Zhu XD, Zhang JB, Zhuang PY, Zhu HG, Zhang W, Xiong YQ, Wu WZ, Wang L, Tang ZY, Sun HC. High expression of macrophage colony-stimulating factor in peritumoral liver tissue is associated with poor survival after curative resection of hepatocellular carcinoma. J Clin Oncol. 2008;26:2707-2716. [PubMed] [DOI] |
| 24. | Wang Y, Wang YP, Zheng G, Lee VW, Ouyang L, Chang DH, Mahajan D, Coombs J, Wang YM, Alexander SI. Ex vivo programmed macrophages ameliorate experimental chronic inflammatory renal disease. Kidney Int. 2007;72:290-299. [PubMed] [DOI] |
| 25. | Talmadge JE, Donkor M, Scholar E. Inflammatory cell infiltration of tumors: Jekyll or Hyde. Cancer Metastasis Rev. 2007;26:373-400. [PubMed] [DOI] |
| 27. | Nguyen MT, Favelyukis S, Nguyen AK, Reichart D, Scott PA, Jenn A, Liu-Bryan R, Glass CK, Neels JG, Olefsky JM. A subpopulation of macrophages infiltrates hypertrophic adipose tissue and is activated by free fatty acids via Toll-like receptors 2 and 4 and JNK-dependent pathways. J Biol Chem. 2007;282:35279-35292. [PubMed] [DOI] |
| 28. | Wu H, Perrard XD, Wang Q, Perrard JL, Polsani VR, Jones PH, Smith CW, Ballantyne CM. CD11c expression in adipose tissue and blood and its role in diet-induced obesity. Arterioscler Thromb Vasc Biol. 2010;30:186-192. [PubMed] [DOI] |
| 29. | Hume DA. Macrophages as APC and the dendritic cell myth. J Immunol. 2008;181:5829-5835. [PubMed] [DOI] |
| 30. | Geissmann F, Gordon S, Hume DA, Mowat AM, Randolph GJ. Unravelling mononuclear phagocyte heterogeneity. Nat Rev Immunol. 2010;10:453-460. [PubMed] [DOI] |
| 31. | Ma J, Liu L, Che G, Yu N, Dai F, You Z. The M1 form of tumor-associated macrophages in non-small cell lung cancer is positively associated with survival time. BMC Cancer. 2010;10:112. [PubMed] [DOI] |