修回日期: 2015-05-14
接受日期: 2015-05-19
在线出版日期: 2015-07-28
目的: 探讨炎性因子白介素-6(interleukin-6, IL-6)、肿瘤坏死因子-α(tumor necrosis factor α, TNF-α)、IL-22与胃、十二指肠放射性损伤的关系.
方法: 共有20例健康成年人及30例胰腺癌患者纳入研究. 收集健康对照组及胰腺癌患者放疗前、放疗中期、放疗后外周血标本, 通过实时荧光定量核酸扩增检测(real-time quantitative PCR detecting system, QPCR)和双抗体夹心酶联免疫(enzyme linked immunosorbent assay, ELISA)法检测外周血中IL-6、TNF-α、IL-22的基因及蛋白水平表达变化情况.
结果: 实验组IL-6、TNF-α、IL-22 mRNA表达量均显著高于正常对照组(t = 4.404, P = 0.000; t = 2.250, P = 0.030; t = 2.178, P = 0.038), 且IL-6的表达量在蛋白表达水平差异有显著意义(t = 3.766, P = 0.001); 随着放疗剂量的累加, 不同放疗时期IL-6、TNF-α mRNA的表达表现为逐渐下降趋势, 且IL-6放疗前后mRNA表达水平有显著差异(t = 2.800, P = 0.007); IL-22 mRNA表达水平变化表现为放疗中期下降, 但不同放疗时期相互比较差别无统计学意义(P>0.05). 30例胰腺癌患者放疗后胃镜下黏膜损伤发生率为40%(12例); 其中无黏膜损伤组IL-6、TNF-α mRNA表达随着放疗剂量的增加均呈逐步下降趋势, 且IL-6组放疗前后比较差异有显著意义(t = 2.439, P = 0.021); 而黏膜损伤组则持续维持在相对较高水平, 其放疗后炎性因子表达水平高于无黏膜损伤组(P>0.05); IL-22 mRNA表达在无黏膜损伤组表现为放疗中期短暂下降后迅速回升, 而黏膜损伤组则无明显变化趋势, 其放疗后表达水平低于无黏膜损伤组(P>0.05); 在蛋白表达水平, IL-6黏膜无损伤组表达略低于损伤组, 而IL-22则表现为无损伤组高于损伤组(P>0.05).
结论: IL-6、TNF-α及IL-22与胰腺癌的发生、发展以及与胰腺癌患者的放射性胃、十二指肠损伤密切相关, IL-6、TNF-α的表达变化可能是预测胃、十二指肠放射性损伤的指标之一.
核心提示: 促炎因子白介素-6(interleukin-6, IL-6)、肿瘤坏死因子-α(tumor necrosis factor α)的表达升高与胃肠道黏膜的放射性损伤的发生密切相关; 而抑炎因子IL-22可能参与放射性损伤黏膜的修复, 对维持消化道黏膜屏障功能具有重要作用.
引文著录: 罗妍, 陈晓, 徐向升, 韩根成, 张晓丹, 蒋兴伟, 邢陈, 于佳卉, 周平. 胰腺癌放疗中炎性因子在胃、十二指肠放射性损伤中的变化及临床意义. 世界华人消化杂志 2015; 23(21): 3374-3383
Revised: May 14, 2015
Accepted: May 19, 2015
Published online: July 28, 2015
AIM: To investigate the relationship between the expression of interleukin-6 (IL-6), tumor necrosis factor α (TNF-α), interleukin-22 (IL-22) and radiation induced gastric and duodenal injury in pancreatic cancer patients.
METHODS: Twenty healthy adults and 30 pancreatic cancer patients were enrolled in the study. Peripheral blood samples were collected from these subjects before, in the middle of and after radiotherapy. Real-time quantitative PCR (QPCR) and enzyme linked immunosorbent assay (ELISA) were used to detect the mRNA and protein levels of IL-6, TNF-α and IL-22, respectively.
RESULTS: Expression of IL-6, TNF-α, and IL-22 mRNAs was significantly higher in the experimental group than in the normal control group (t = 4.404, P = 0.000; t = 2.250, P = 0.030; t = 2.178, P = 0.038). At the protein level, the expression of IL-6 was significantly higher in the experimental group than in the control group (t = 3.766, P = 0.001). The expression of IL-6 and TNF-α mRNAs showed a descending trend along with the accumulation of radiation dose. The expression level of IL-6 mRNA had a significant difference between before and after radiotherapy (t = 2.800, P = 0.007). The expression level of IL-22 was slightly higher in the experimental group than in the control group, though the difference was not statistically significant (P > 0.05). The incidence of mucosal injury was 40% (12 cases) in the study. The expression of IL-6 and TNF-α mRNAs in patients without mucosal injury group showed a gradually declining trend. The expression of IL-6 in patients differed between after and before radiotherapy (t = 2.439, P = 0.021). The expression of IL-6 in patients with mucosal injury was maintained at a relatively high level after radiotherapy. The mRNA expression of IL-22 in patients without mucosal injury decreased in the middle of radiotherapy. The expression of inflammatory factors in patients with mucosa injury was significantly lower than that in patients without mucosa injury (P > 0.05). Similarly, although protein expression of IL-6 in patients without mucosa injury seemed lower than that in patients with mucosa injury groups, and the expression of IL-22 seemed higher than that in the injury group, the differences were not statistically significant (P > 0.05).
CONCLUSION: IL-6, TNF-α and IL-22 are associated with the pathogenesis of radiation induced gastric and duodenal injury in patients with pancreatic cancer. These inflammatory factors may be used as predictors of radiation induced gastric and duodenal injury in pancreatic cancer patients.
- Citation: Luo Y, Chen X, Xu XS, Han GC, Zhang XD, Jiang XW, Xing C, Yu JH, Zhou P. Association between expression of inflammatory factors and gastric and duodenal mucosa injury induced by radiotherapy in patients with pancreatic cancer. Shijie Huaren Xiaohua Zazhi 2015; 23(21): 3374-3383
- URL: https://www.wjgnet.com/1009-3079/full/v23/i21/3374.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i21.3374
胰腺癌是常见的消化系恶性肿瘤, 其5年生存率低至0.2%[1], 预后极差, 目前放射治疗已成为其重要的治疗手段之一. 有研究[2]报道胰腺癌在接受规范化伽马刀治疗早期出现胃肠道反应率高达70%, 胃镜下急性胃、十二指肠黏膜糜烂及溃疡发生率为7%, 主要表现为腹胀、腹痛、呕血、便血. 晚期反应主要表现为胃溃疡、十二指肠溃疡和消化道挛缩、狭窄、梗阻等, 发生率分别为17%、9%. 根据前期的研究[3]我们发现, 胃、十二指肠的放射性损伤作为胰腺癌根治性放疗常见并发症, 严重影响了患者的生活质量. 胃镜下主要表现为胃肠黏膜充血水肿、糜烂, 溃疡形成, 或肠腔环周型狭窄, 或伴消化系出血, 部分患者甚至因此而终止放疗. 而目前对放射性损伤的具体作用机制仍不明确, 因而寻找一种简单、有效的检查方法及明确相关作用靶点对放射性损伤的诊断及治疗有重大的临床价值及意义.
根据胃肠黏膜损伤的差异我们推测除了与胃酸、幽门螺杆菌(Helicobacter pylori, H. pylori)感染相关外, 可能与炎性因子的表达水平也有密切联系. 并且目前关于胃、十二指肠放射性损伤与炎性因子相关性的研究尚未见报道. 研究中我们主要分析白介素-6(interleukin-6, IL-6)、肿瘤坏死因子-α(tumor necrosis factor α, TNF-α)、IL-22 3种因子, 是因为既往已有动物实验证明IL-6、TNF-α在放射性肠炎小鼠的外周血及免疫器官中高表达, 并与放疗的剂量呈正相关[2], 且其作为急性炎性因子在放射损伤的短时间内即分泌增高[4,5], 为我们进行临床实验研究奠定了坚实的基础. 且大量文献[6-8]提示, 在炎症性肠病患者外周血中, 促炎因子IL-6、TNF-α的表达远高于健康人群, 而抑炎因子IL-22作为保护因子, 其受体主要表达于消化道黏膜组织[9,10]. Pickert等[11]发现IL-22缺陷小鼠结肠黏膜伤口愈合延迟, 进一步提示IL-22与肠黏膜修复密切相关. 但也有研究者认为根据作用部位不同, IL-22具有抑炎和促炎双重生物活性[12], 故明确IL-22在放射性胃肠损伤的作用具有重要临床意义.
本研究主要通过收集健康成年人和胰腺癌患者放疗前、放疗中期及放疗后外周血标本, 用QPCR、ELISA实验方法分别检测外周血中IL-6、IL-22、TNF-α的基因及蛋白水平, 拟探究胰腺癌患者外周血中IL-6、IL-22、TNF-α的变化与胃、十二指肠放射性损伤的关系.
本研究为前瞻性研究, 收集中国人民解放军空军总医院2014-05-28/12-28胰腺癌患者放疗前、放疗中期及放疗结束后3个时间点的外周血标本, 所有患者经病理或正电子发射计算机断层显像(positron emission tomography-computed tomography, PET-CT)诊断为胰腺癌, 并从电子病历系统中收集相关患者临床资料信息建立基线, 共入选30例患者. 排除标准: (1)有严重肝肾或心功能不全的患者; (2)合并急慢性炎症或自身免疫性疾病患者; (3)放疗前或放疗期间应用炎症抑制药物和/或免疫抑制剂的患者; (4)近期有创伤、烧伤、血液病、急性脑血管意外病史和/或放疗期间内有任何部位感染病史等; (5)放疗前胃镜异常患者. 另外随机选取20例同期于中国人民解放军空军总医院行健康体检成年人作为正常对照组. 全部标本的采集均获得本人知情同意并经医院伦理委员会审核批准.
1.2.1 标本采集及处理: 采用肝素抗凝止血管分别采集健康对照组和实验入组患者(治疗前、治疗期间及治疗后)清晨空腹外周静脉血4 mL. 分取200 μL抗凝全血置于1 mL TRIzol(美国Invitrogen公司)溶液中, 吹打混匀, 使细胞充分裂解, 其余抗凝血标本经1500 g离心10 min后分离血浆, 所有标本置于-80 ℃冰箱中冻存统一检测. 用QPCR、ELISA实验方法分别检测外周血中IL-6、IL-22、TNF-α的基因及蛋白水平变化, 严格按说明书进行具体操作.
1.2.2 评价指标: 胃肠反应根据肿瘤放射治疗组织(radiation therapy oncology group, RTOG)急性放射损伤评分标准进行分级: 0度: 无反应; Ⅰ度: 恶心, 正常进食, 无腹痛; Ⅱ度暂时性呕吐, 纳差, 上腹部隐痛; Ⅲ度: 呕吐, 腹痛, 需治疗; Ⅳ度难控制的上腹部痛, 频繁呕吐、便血或吐血. 根据胃镜下黏膜损伤情况将患者分为: (1)无黏膜损伤组: 黏膜光滑, 无变形, 绒毛好; (2)黏膜损伤组: 黏膜充血、肿胀, 接触性出血; 黏膜点片状糜烂、黏膜溃疡形成, 或消化道出血, 肠腔狭窄等.
统计学处理 所有数据均使用SPSS13.0进行统计分析, 计量资料用mean±SD表示, 两组间比较采用独立样本t检验, 分类资料的比较采用Fisher确切概率和χ2检验. 采用双侧检验, P<0.05为差异有统计学意义.
本研究共收集中国人民解放军空军总医院2014-05-28/12-28 30例胰腺癌患者外周血. 其中男性18例(60.0%)、女性12例(40.0%), 中位年龄是55岁(33-77岁). 临床分期Ⅰ期0例(0.0%)、Ⅱ期4例(13.3%)、Ⅲ期14例(46.7%)、Ⅳ期12例(40%). 所有病例均经病理组织学检查、影像学检查(PET-CT)诊断为胰腺癌, 并选择放疗为主要治疗手段, 包括伽马刀4例(13.3%)、三维适形放疗(three-dimensional conformal radiotherapy, 3DCRT)1例(3.3%)、调强放疗(intensity modulated radiotherapy, IMRT)1例(3.3%)、螺旋断层放疗(tomotherapy, TOMO)24例(80.0%), 本组患者单次放疗剂量波动在3.0-4.7 Gy之间, 其中TOMO等效生物剂量(biological effective dose, BED)波动在78.0-102.7 Gy, 伽马刀的BED波动58.5-70.9 Gy之间. 同步收集20名健康成年人外周血做对照组, 其中男性9例(45.0%), 女性11例(55.0%), 中位年龄38岁(25-51岁).
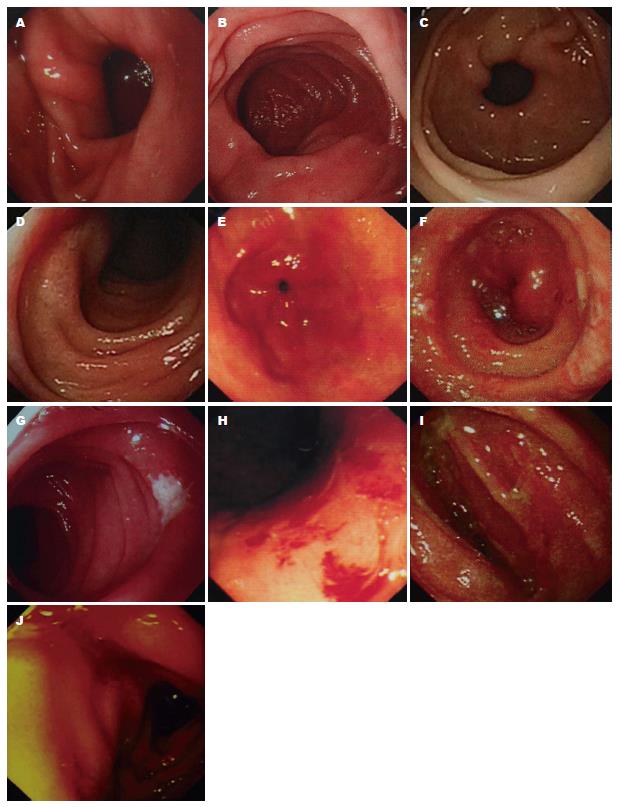
收集胰腺癌患者放疗前后电子胃镜资料(图1), 并根据放疗后检查结果将患者分为: (1)无黏膜损伤组(18例): 男性11例, 女性7例, 中位年龄55.5岁(34-77岁); (2)黏膜损伤组(12例): 男性7例, 女性5例, 中位年龄48岁(33-63岁); 对影响30例胰腺癌患者胃肠道损伤的潜在因素进行相关性分析, 发现: H. pylori感染与胃、十二指肠黏膜损伤有关(P = 0.009), 且黏膜损伤组胃肠道反应重(P = 0.007); 年龄、性别、肿瘤分期、原发肿瘤位置与胃、十二指肠放射性损伤无相关性(P>0.05)(表1).
| 临床特征 | n | 黏膜损伤组 | 无黏膜损伤组 | P值 |
| 年龄(岁) | 0.722 | |||
| ≥55 | 16 | 7(43.8) | 9(56.2) | |
| <55 | 14 | 5(35.7) | 9(64.3) | |
| 性别 | 1.000 | |||
| 男 | 18 | 7(38.9) | 11(61.1) | |
| 女 | 12 | 5(41.7) | 7(58.3) | |
| 临床分期 | 0.244 | |||
| Ⅰ | 0 | 0(0.0) | 0(0.0) | |
| Ⅱ | 4 | 1(25.0) | 3(75.0) | |
| Ⅲ | 14 | 4(28.6) | 10(71.4) | |
| Ⅳ | 12 | 7(58.3) | 5(41.7) | |
| 肿瘤位置 | 1.000 | |||
| 胰头颈部 | 19 | 8(42.1) | 11(57.9) | |
| 胰体尾部 | 11 | 4(36.4) | 7(63.6) | |
| H. pylori检测 | 0.009 | |||
| 阳性 | 7 | 6(85.7) | 1(14.3) | |
| 阴性 | 23 | 6(26.1) | 17(73.9) | |
| 胃肠道反应 | 0.007 | |||
| 0度 | 0 | 0(0.0) | 0(0.0) | |
| Ⅰ度 | 13 | 1(7.7) | 12(92.3) | |
| Ⅱ度 | 14 | 9(64.3) | 5(35.7) | |
| Ⅲ度 | 3 | 2(66.7) | 1(33.3) | |
| Ⅳ度 | 0 | 0(0.0) | 0(0.0) | |
| 放疗手段 | 0.537 | |||
| 伽马刀 | 4 | 2(50.0) | 2(50.0) | |
| TOMO | 24 | 10(41.7) | 14(58.3) | |
| 3DCRT | 1 | 0(0.0) | 1(100.0) | |
| IMRT | 1 | 1(100.0) | 0(0.0) |
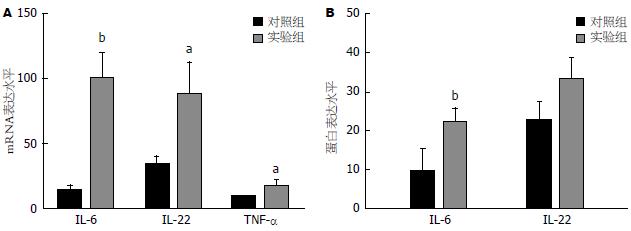
2.3.1 实验组及对照组IL-6、TNF-α、IL-22 mRNA及蛋白表达水平比较: 胰腺癌患者外周血中IL-6、TNF-α、IL-22 mRNA表达量增高, 且均显著高于正常对照组(t = 4.404, P = 0.000; t = 2.250, P = 0.030; t = 2.178, P = 0.038)(图2A); 而在蛋白表达水平, 仅IL-6的表达量显著高于对照组(t = 3.766, P = 0.001); TNF-α mRNA总体表达水平偏低, 且因其蛋白检测含量过低, 用ELISA方法检测可能出现较大实验误差, 故其数据予以剔除; IL-22蛋白表达量则略高于正常对照组, 但差异无统计学意义(P>0.05)(图2B).
2.3.2 不同放疗时期胰腺癌患者IL-6、TNF-α、IL-22 mRNA及蛋白表达水平变化: 随着放疗剂量的累加, 炎性因子IL-6、TNF-α mRNA的表达均表现为逐渐下降趋势, 且IL-6放疗前后mRNA表达水平有显著差异(t = 2.800, P = 0.007); 余两组之间的表达(放疗前与放疗中期; 放疗中期与放疗后)差异均无统计学意义(P>0.05); 另外, 炎性因子IL-22 mRNA表达水平变化表现为放疗中期下降, 但不同放疗时期表达水平相比较, 差别均无统计学意义(P>0.05). 进一步对IL-6、IL-22的蛋白表达水平变化进行成对比较, 差异均无统计学意义(P>0.05)(表2).
| 炎性因子 | 时间 | mRNA | 蛋白 |
| IL-6 | 放疗前 | 100.54±19.33b | 22.48±3.17 |
| 放疗中期 | 63.39±23.13 | 21.10±3.29 | |
| 放疗后 | 37.50±11.53 | 22.10±3.27 | |
| TNF-α | 放疗前 | 17.47±3.44 | - |
| 放疗中期 | 13.48±2.88 | - | |
| 放疗后 | 10.34±2.11 | - | |
| IL-22 | 放疗前 | 88.08±24.07 | 33.23±5.37 |
| 放疗中期 | 48.51±9.91 | 25.44±3.99 | |
| 放疗后 | 83.98±18.20 | 30.57±5.12 |
2.3.3 IL-6、TNF-α、IL-22 mRNA及蛋白的表达水平与胃镜下黏膜表现的关系: 为了进一步明确胰腺癌患者外周血中, IL-6、TNF-α、IL-22 mRNA及蛋白的表达水平与放射性胃肠损伤的关系, 根据患者放疗后胃镜下胃、十二指肠黏膜改变情况分为无黏膜损伤组及黏膜损伤组, 发现无黏膜损伤组IL-6、TNF-α mRNA表达均表现为逐渐下降, 且IL-6组放疗前后比较差异有显著意义(t =2.439, P = 0.021), 而IL-22则表现为放疗中期短暂下降后回升; 黏膜损伤组IL-6、TNF-α、IL-22 mRNA则总体变化均不明显, 差异无统计学意义(P>0.05); 单独对放疗后上述炎性因子表达水平进行分析, 发现无黏膜损伤组IL-6、TNF-α mRNA表达低于黏膜损伤组, 而IL-22则表现为无黏膜损伤组处于较高水平, 但3组比较差异无统计学意义(P>0.05); 在蛋白表达水平, IL-6无损伤组表达略低于损伤组, 而IL-22则表现为无损伤组高于损伤组, 两种因子总体变化差异无统计学意义(P>0.05)(表3).
| 炎性因子 | 分组 | 时间 | mRNA | 蛋白 |
| IL-6 | 无黏膜损伤组 | 放疗前 | 136.12±27.20a | 19.84±3.76 |
| 放疗中期 | 77.59±38.04 | 18.47±3.82 | ||
| 放疗后 | 25.53±5.21 | 18.89±3.80 | ||
| 黏膜损伤组 | 放疗前 | 47.16±17.80 | 26.43±5.56 | |
| 放疗中期 | 42.10±10.22 | 25.06±5.93 | ||
| 放疗后 | 55.47±27.65 | 26.91±5.80 | ||
| TNF-α | 无黏膜损伤组 | 放疗前 | 20.14±5.26 | - |
| 放疗中期 | 11.97±4.18 | - | ||
| 放疗后 | 8.63±1.89 | - | ||
| 黏膜损伤组 | 放疗前 | 13.69±3.70 | - | |
| 放疗中期 | 15.61±3.80 | - | ||
| 放疗后 | 12.75±4.37 | - | ||
| IL-22 | 无黏膜损伤组 | 放疗前 | 106.57±34.98 | 40.26±7.64 |
| 放疗中期 | 39.24±10.38 | 31.41±5.75 | ||
| 放疗后 | 98.40±25.99 | 34.28±7.73 | ||
| 黏膜损伤组 | 放疗前 | 58.50±27.64 | 22.68±6.15 | |
| 放疗中期 | 63.35±19.54 | 16.50±13.86 | ||
| 放疗后 | 60.91±22.23 | 25.02±5.45 |
放射性胃、十二指肠损伤是胰腺肿瘤放射治疗中常见的并发症之一, 主要通过电离辐射直接引起消化道黏膜细胞DNA断裂, 或间接作用于细胞水分子, 破坏氧化和抗氧化平衡及改变细胞膜表面受体状态, 活化不同的信号传导通路引起[13]. 有学者[13,14]认为放射性黏膜炎的信号传导通路错综复杂, 其中炎性因子的表达及信号传递贯穿了整个放射性黏膜炎形成的各个阶段, 充分体现了放射性黏膜损伤的炎性本质, 并且目前关于炎性因子在放射性胃肠损伤中的作用机制鲜有报道, 因此对该机制的深入研究具有极其重要的临床价值.
然而引起炎性因子表达变化的因素有很多, 目前有研究表明, 肿瘤的发生与效应性T细胞和体液免疫反应的抑制有关, 而其生长及转移主要通过肿瘤相关性炎症产生促炎和抗炎信号实现[15]. 林三仁等[16]也认为, 持续的慢性炎症刺激是肿瘤干细胞转化为肿瘤的始动和持续促进因素. 许多肿瘤, 包括消化系统肿瘤的发生与慢性炎症密切相关[17]. 胰腺癌属于"炎症相关性肿瘤"[18], 可以通过核因子-κB(nuclear factor κB, NF-κB)和信号传导及信号传导与转录激活因子3(signal transducer and activator of transcription 3, STAT3)路径等通路释放促炎因子(IL-1β、IL-6、TNF-α等)和重要的介质, 来维持炎症并促进肿瘤增殖[19]. 大量文献报道[20-24]认为, IL-6、TNF-α、IL-8及急性期反应蛋白在胰腺癌以及其他恶性肿瘤患者血浆中表达升高, 并显著高于慢性胰腺炎患者和健康人群[25]. Mroczko等[26]通过对78例胰腺癌患者进行随访研究发现IL-6与肿瘤分期密切相关, 是影响胰腺癌预后的重要因素之一. 另外, 近期有文献[27]提示IL-22作为一种主要由辅助性T(helper T cell, Th)17细胞分泌的新型炎性因子, 能通过磷酸化STAT3来活化胰腺肿瘤细胞(HPAFII cells)并促进其血管生成. Xu等[28]也通过对胰腺癌患者肿瘤组织进行蛋白印记及免疫组织化学分析后发现, IL-22在胰腺肿瘤组织中表达显著高于肿瘤周边及正常胰腺组织, 且在组织中的含量远高于外周血, 并认为肿瘤内IL-22的高表达及IL-22+CD4+ T细胞和Th22细胞分泌增加与胰腺癌患者的TNM分期密切相关. 本研究中, 胰腺癌患者外周血中IL-6、TNF-α、IL-22 mRNA及蛋白表达水平均高于健康对照组, 与文献报道一致. 但因本组实验对象主要来源于Ⅲ、Ⅳ期胰腺癌患者, 故上述炎性因子表达水平变化与TMN分期的关系难以论证, 需增加早期胰腺癌患者样本量验证. 进一步对不同放疗时间IL-6、TNF-α、IL-22炎性因子的表达水平变化进行分析发现: 随着放疗剂量的增加, IL-6、TNF-α mRNA表达逐步下降, 且放疗前后差异有统计学意义, 我们推测这一变化与局部放疗导致肿瘤细胞坏死、凋亡, 进而引起促炎因子分泌降低有关, 提示上述炎性因子可能参与肿瘤的形成与发展过程. IL-22 mRNA表现为放疗中期短暂下降后逐步回升, 考虑与放疗导致局部消化道黏膜损伤后, 激活机体防御机制, 继而分泌大量IL-22促进黏膜修复有关, 需要通过对局部损伤组织的IL-22表达情况进行检测来证实. 本研究中不同放疗时间IL-6、IL-22的蛋白总体含量水平较低, 且变化趋势不明显, 不排除为实验样本量过小所致.
IL-6、TNF-α属于促炎细胞因子, 可由活化的CD4+细胞释放, 可作用于多种效应细胞, 并通过诱导活化STAT3, 促进生成抗凋亡因子bal-2和bcl-xL, 继而使T细胞对细胞凋亡产生抵抗并聚集于炎症部位产生局部炎症[12]. 为明确炎性因子与胃十二指肠放射性损伤的关系, 我们按放疗后胃镜下黏膜改变将实验组分为无黏膜损伤组和黏膜损伤组后发现: 无黏膜损伤组IL-6、TNF-α mRNA表达均呈逐步下降趋势, 而黏膜损伤组则持续维持在相对较高水平, 且黏膜损伤组放疗后炎性因子表达水平高于无黏膜损伤组; IL-6在蛋白表达水平整体表现为无黏膜损伤组低于黏膜损伤组, 提示IL-6、TNF-α水平升高可能与胃镜下黏膜放射性损伤的发生有关, 可作为相关炎性指标进行深入研究. IL-22作为新型细胞因子, 其受体在胃肠道中高表达[29], 大部分研究者[30,31]认为其能与消化道上皮细胞的受体复合物IL-22RAl/IL-10RA2结合, 通过抗炎、重塑黏膜细胞、分泌抗菌肽及促进组织修复等功能, 来发挥对消化道黏膜保护作用[32-34]. 也有研究[35]认为, 电离辐射能导致胃肠道局部缺氧, 进而破坏紧密连接(tight junctions, TJs)蛋白及释放大量炎性介质, 影响胃肠道黏膜屏障功能, 而IL-22可通过启动固有和获得性免疫参与肠道黏膜的免疫防御, 从而预防肠黏膜组织的炎症损伤[33]. 在本研究中, IL-22 mRNA表达在无黏膜损伤组表现为放疗中期短暂下降后迅速回升, 而黏膜损伤组则无明显变化趋势, 且其放疗后黏膜损伤组mRNA及蛋白表达水平均低于无黏膜损伤组, 提示IL-22可能参与放射性损伤黏膜的修复, 与丁连安等[36]报道结果一致.
总之, IL-6、TNF-α、IL-22相关细胞因子在胰腺癌患者外周血中均存在异常表达, 且其表达与放射性胃肠损伤的发生密切相关, 同时上述炎性因子也相互影响, 共同维持消化道黏膜屏障功能.
本研究属于小样本前瞻性实验研究, 目前还存在一些局限性. 首先, 一些分组中的病例数量明显过少, 需要进一步通过扩大样本量进行论证; 其次, 上述研究指标均与胰腺癌本身密切相关, 在肿瘤治疗过程中, 会对炎性因子的变化产生干扰; 最后, 本实验缺乏对局部炎性因子表达的检测及实验组研究对象的预后随访, 下一步我们将对这方面工作进行相应补充及论证.
放射性胃肠损伤的发生与炎性因子的表达密切相关. 而白介素-6(interleukin-6, IL-6)、肿瘤坏死因子-α(tumor necrosis factor α, TNF-α)、IL-22的表达变化与胃肠道炎性损伤的发生有关, 且目前尚无相关研究报道, 故明确炎性因子在放射性胃肠损伤中的作用具有重要临床意义.
柏愚, 副教授, 副主任医师, 硕士生导师, 第二军医大学长海医院消化内科
放射性胃肠损伤是胰腺癌放疗中常见并发症之一, 严重影响患者生活质量, 目前对其具体作用机制仍不明确, 寻找一种简单、有效的检查方法及明确相关作用靶点对放射性损伤的诊断及治疗有重大的临床价值及意义.
陈晓等通过动物实验证明IL-6、TNF-α在放射性肠炎小鼠的外周血及免疫器官中高表达, 并与放疗的剂量呈正相关, 而Pickert等发现IL-22缺陷小鼠结肠黏膜伤口愈合延迟, 进一步提示IL-22与肠黏膜修复密切相关.
目前关于炎性因子与放射性损伤关系的研究还十分有限, 且相关临床研究尚未见报道, 本实验通过对胰腺癌患者外周血标本进行检测, 发现IL-6、TNF-α、IL-22与放射性胃肠损伤的发生密切相关.
本研究初步证实了IL-6、TNF-α、IL-22在放射性胃肠损伤作用, 为进一步明确放射性损伤发生的作用靶点和进行相关机制研究奠定了基础, 以期为相关治疗药物的研发提供新思路.
放射损伤: 哺乳动物细胞的放射损伤有3种: (1)致死损伤: 是不可逆和不可修复的, 最终无可挽回地走向死亡; (2)亚致死损伤: 正常情况下可在1 h内修复; (3)潜在致死损伤: 这部分损伤受照射后环境的影响, 或能修复, 或走向死亡.
本文有一定的临床意义.
编辑: 郭鹏 电编:都珍珍
| 1. | Carpelan-Holmström M, Nordling S, Pukkala E, Sankila R, Lüttges J, Klöppel G, Haglund C. Does anyone survive pancreatic ductal adenocarcinoma? A nationwide study re-evaluating the data of the Finnish Cancer Registry. Gut. 2005;54:385-387. [PubMed] |
| 4. | Kim K, McBride WH. Modifying radiation damage. Curr Drug Targets. 2010;11:1352-1365. [PubMed] [DOI] |
| 5. | Van Landeghem L, Blue RE, Dehmer JJ, Henning SJ, Helmrath MA, Lund PK. Localized intestinal radiation and liquid diet enhance survival and permit evaluation of long-term intestinal responses to high dose radiation in mice. PLoS One. 2012;7:e51310. [PubMed] [DOI] |
| 6. | 王 佐, 吴 正祥, 杨 九华, 杨 枫, 吴 强. IL-17、IL-23、IL-6、TGF-β1和Foxp3在实验性结肠炎中的表达. 胃肠病学和肝病学杂志. 2010;19:141-144. |
| 7. | Yen D, Cheung J, Scheerens H, Poulet F, McClanahan T, McKenzie B, Kleinschek MA, Owyang A, Mattson J, Blumenschein W. IL-23 is essential for T cell-mediated colitis and promotes inflammation via IL-17 and IL-6. J Clin Invest. 2006;116:1310-1316. [PubMed] [DOI] |
| 8. | Fujino S, Andoh A, Bamba S, Ogawa A, Hata K, Araki Y, Bamba T, Fujiyama Y. Increased expression of interleukin 17 in inflammatory bowel disease. Gut. 2003;52:65-70. [PubMed] [DOI] |
| 9. | Dumoutier L, Louahed J, Renauld JC. Cloning and characterization of IL-10-related T cell-derived inducible factor (IL-TIF), a novel cytokine structurally related to IL-10 and inducible by IL-9. J Immunol. 2000;164:1814-1819. [PubMed] |
| 10. | 李 莉, 曹 江, 刘 玲, 朱 祖安, 吴 克俭, 费 素娟. 溃疡性结肠炎患者外周血IL-22及相关CD4 T细胞亚群的表达. 中华微生物学和免疫学杂志. 2012;32:323-325. |
| 11. | Pickert G, Neufert C, Leppkes M, Zheng Y, Wittkopf N, Warntjen M, Lehr HA, Hirth S, Weigmann B, Wirtz S. STAT3 links IL-22 signaling in intestinal epithelial cells to mucosal wound healing. J Exp Med. 2009;206:1465-1472. [PubMed] [DOI] |
| 12. | Mudter J, Neurath MF. Il-6 signaling in inflammatory bowel disease: pathophysiological role and clinical relevance. Inflamm Bowel Dis. 2007;13:1016-1023. [PubMed] [DOI] |
| 13. | 顾 阳春, 张 照辉, 梁 莉. 放射性肠炎发生的分子机制. 中华放射医学与防护杂志. 2013;33:211-214. |
| 14. | Sonis S, Haddad R, Posner M, Watkins B, Fey E, Morgan TV, Mookanamparambil L, Ramoni M. Gene expression changes in peripheral blood cells provide insight into the biological mechanisms associated with regimen-related toxicities in patients being treated for head and neck cancers. Oral Oncol. 2007;43:289-300. [PubMed] [DOI] |
| 15. | Murdoch C, Muthana M, Coffelt SB, Lewis CE. The role of myeloid cells in the promotion of tumour angiogenesis. Nat Rev Cancer. 2008;8:618-631. [PubMed] [DOI] |
| 17. | Balkwill F, Mantovani A. Inflammation and cancer: back to Virchow? Lancet. 2001;357:539-545. [PubMed] [DOI] |
| 18. | Okada F. Inflammation-related carcinogenesis: current findings in epidemiological trends, causes and mechanisms. Yonago Acta Med. 2014;57:65-72. [PubMed] |
| 19. | Djaldetti M, Bessler H. Modulators affecting the immune dialogue between human immune and colon cancer cells. World J Gastrointest Oncol. 2014;6:129-138. [PubMed] [DOI] |
| 20. | Nikiteas NI, Tzanakis N, Gazouli M, Rallis G, Daniilidis K, Theodoropoulos G, Kostakis A, Peros G. Serum IL-6, TNFalpha and CRP levels in Greek colorectal cancer patients: prognostic implications. World J Gastroenterol. 2005;11:1639-1643. [PubMed] |
| 21. | Bartsch R, Woehrer S, Raderer M, Hejna M. Serum interleukin-6 levels in patients with gastric MALT lymphoma compared to gastric and pancreatic cancer. Anticancer Res. 2006;26:3187-3190. [PubMed] |
| 22. | Müller MW, Friess H, Köninger J, Martin D, Wente MN, Hinz U, Ceyhan GO, Blaha P, Kleeff J, Büchler MW. Factors influencing survival after bypass procedures in patients with advanced pancreatic adenocarcinomas. Am J Surg. 2008;195:221-228. [PubMed] |
| 23. | Groblewska M, Mroczko B, Wereszczyńska-Siemiatkowska U, Kedra B, Lukaszewicz M, Baniukiewicz A, Szmitkowski M. Serum interleukin 6 (IL-6) and C-reactive protein (CRP) levels in colorectal adenoma and cancer patients. Clin Chem Lab Med. 2008;46:1423-1428. [PubMed] [DOI] |
| 24. | Bellone G, Smirne C, Mauri FA, Tonel E, Carbone A, Buffolino A, Dughera L, Robecchi A, Pirisi M, Emanuelli G. Cytokine expression profile in human pancreatic carcinoma cells and in surgical specimens: implications for survival. Cancer Immunol Immunother. 2006;55:684-698. [PubMed] |
| 25. | Talar-Wojnarowska R, Gasiorowska A, Smolarz B, Romanowicz-Makowska H, Kulig A, Malecka-Panas E. Clinical significance of interleukin-6 (IL-6) gene polymorphism and IL-6 serum level in pancreatic adenocarcinoma and chronic pancreatitis. Dig Dis Sci. 2009;54:683-689. [PubMed] [DOI] |
| 26. | Mroczko B, Groblewska M, Gryko M, Kedra B, Szmitkowski M. Diagnostic usefulness of serum interleukin 6 (IL-6) and C-reactive protein (CRP) in the differentiation between pancreatic cancer and chronic pancreatitis. J Clin Lab Anal. 2010;24:256-261. [PubMed] [DOI] |
| 27. | Curd LM, Favors SE, Gregg RK. Pro-tumour activity of interleukin-22 in HPAFII human pancreatic cancer cells. Clin Exp Immunol. 2012;168:192-199. [PubMed] [DOI] |
| 28. | Xu X, Tang Y, Guo S, Zhang Y, Tian Y, Ni B, Wang H. Increased intratumoral interleukin 22 levels and frequencies of interleukin 22-producing CD4+ T cells correlate with pancreatic cancer progression. Pancreas. 2014;43:470-477. [PubMed] [DOI] |
| 29. | Mizoguchi A. Healing of intestinal inflammation by IL-22. Inflamm Bowel Dis. 2012;18:1777-1784. [PubMed] [DOI] |
| 30. | Witte E, Witte K, Warszawska K, Sabat R, Wolk K. Interleukin-22: a cytokine produced by T, NK and NKT cell subsets, with importance in the innate immune defense and tissue protection. Cytokine Growth Factor Rev. 2010;21:365-379. [PubMed] [DOI] |
| 31. | Zheng Y, Valdez PA, Danilenko DM, Hu Y, Sa SM, Gong Q, Abbas AR, Modrusan Z, Ghilardi N, de Sauvage FJ. Interleukin-22 mediates early host defense against attaching and effacing bacterial pathogens. Nat Med. 2008;14:282-289. [PubMed] [DOI] |
| 32. | Sugimoto K, Ogawa A, Mizoguchi E, Shimomura Y, Andoh A, Bhan AK, Blumberg RS, Xavier RJ, Mizoguchi A. IL-22 ameliorates intestinal inflammation in a mouse model of ulcerative colitis. J Clin Invest. 2008;118:534-544. [PubMed] [DOI] |
| 33. | Zenewicz LA, Yancopoulos GD, Valenzuela DM, Murphy AJ, Stevens S, Flavell RA. Innate and adaptive interleukin-22 protects mice from inflammatory bowel disease. Immunity. 2008;29:947-957. [PubMed] [DOI] |
| 34. | Zenewicz LA, Yancopoulos GD, Valenzuela DM, Murphy AJ, Karow M, Flavell RA. Interleukin-22 but not interleukin-17 provides protection to hepatocytes during acute liver inflammation. Immunity. 2007;27:647-659. [PubMed] |
| 35. | Zenewicz LA, Flavell RA. Recent advances in IL-22 biology. Int Immunol. 2011;23:159-163. [PubMed] [DOI] |