修回日期: 2015-05-16
接受日期: 2015-06-09
在线出版日期: 2015-07-18
目的: 观察溃疡性结肠炎(ulcerative colitis, UC)大鼠结肠肌层分子量为25 kDa的突触小体相关蛋白(synaptosomal associated protein of 25 kDa, SNAP-25)的表达情况.
方法: 应用2,4-二硝基苯磺酸(2,4-dinitrobenzene sulfonic acid, DNBS)灌肠的方法制作大鼠UC模型, 免疫组织化学评估结肠肌层SNAP-25标记的神经轴突的密度, Western blot半定量检测肌层SNAP-25含量, HE染色法评价结肠炎症状态, 生化检测方法评价结肠匀浆髓过氧化物酶(myeloperoxidase, MPO)活力、超氧化物歧化酶(superoxide dismutase, SOD)活力及丙二醛(malonaldehyde, MDA)含量的变化, 酶联免疫吸附试验(enzyme-linked immunosorbent assay, ELISA)法检测白介素1β(interleukin 1β, IL-1β)含量的变化.
结果: 在DNBS诱导的UC大鼠, 结肠肌层中SNAP-25标记的轴突密度减小为对照的22.60%(23.76个/百个平滑肌细胞±13.24个/百个平滑肌细胞 vs 5.37个/百个平滑肌细胞±1.96个/百个平滑肌细胞, P<0.01), 肠道肌层SNAP-25蛋白表达量减少为对照组的34.31%(P<0.01). 与对照组相比, 结肠组织中MPO活力增高(1.91 U/g wet weight±0.58 U/g wet weight vs 0.99 U/g wet weight±0.21 U/g wet weight, P<0.01) , SOD活力显著降低(4.11 U/mg protein±1.80 U/mg protein vs 9.01 U/mg protein±2.17 U/mg protein, P<0.01), MDA含量增高(1.72 nmol/mg protein±0.28 nmol/mg protein vs 1.11 nmol/mg protein±0.27 nmol/mg protein, P<0.01), IL-1β表达量增高(181.51 pg/mg protein±55.30 pg/mg protein vs 84.27 pg/mg protein±42.27 pg/mg protein, P<0.01).
结论: DNBS诱导的UC大鼠的结肠肌层SNAP-25蛋白表达量明显减少, 肠道组织炎症及氧化应激水平增高可能是其重要原因之一.
核心提示: 肠肌间神经元是肠道的重要组成部分, 与肠道的运动及感觉功能密切相关, 研究溃疡性结肠炎(ulcerative colitis, UC)时肠肌间神经元的损伤及突触小体相关蛋白25的表达情况可更加深入的认识UC的病理状态及症状产生机制.
引文著录: 商博鑫, 董蕾, 史海涛, 王华, 杨素贞. 溃疡性结肠炎大鼠结肠肌层突触小体相关蛋白25的表达变化. 世界华人消化杂志 2015; 23(20): 3270-3276
Revised: May 16, 2015
Accepted: June 9, 2015
Published online: July 18, 2015
AIM: To investigate the change in the expression of synaptosomal associated protein of 25 kDa (SNAP-25) in the colonal muscle layer of rats with ulcerative colitis (UC).
METHODS: A rat model of UC was induced by intracolonic instillation of 2,4-dinitrobenzene sulfonic acid (DNBS). Immunohistochemical technique was used to observe the density of SNAP-25 labeled axons in the colonic smooth muscle layer. The expression of SNAP-25 in the smooth muscle layer was semi-quantified by Western blot. Myeloperoxidase activity (MPO), malonaldehyde (MDA) and superoxide dismutase activity (SOD) were measured by biochemical methods, and the content of interleukin 1β (IL-1β) was measured by enzyme-linked immunosorbent assay (ELISA).
RESULTS: In the colonic smooth muscle layer of rats with DNBS induced UC, the density of the SNAP-25 labeled axons decreased to 22.60% of that in the control rats (23.76 ± 13.24 vs 5.37 ± 1.96, P < 0.01), and the expression level of SNAP-25 decreased to 34.31% of that in the control rats (P < 0.01). Compared with the control group, MPO activity significantly increased (1.91 U/g wet weight ± 0.58 U/g wet weight vs 0.99 U/g wet weight ± 0.21 U/g wet weight, P < 0.01), SOD activity significantly declined (4.11 U/mg protein ± 1.80 U/mg protein vs 9.01 U/mg protein ± 2.17 U/mg protein, P < 0.01), MDA level (1.72 nmol/mg protein ± 0.28 nmol/mg protein vs 1.11 nmol/mg protein ± 0.27 nmol/mg protein, P < 0.01) and IL-1β (181.51 pg/mg protein ± 55.30 pg/mg protein vs 84.27 pg/mg protein ± 42.27 pg/mg protein, P < 0.01) significantly increased in rats with UC.
CONCLUSION: In the smooth muscle layer of rats with DNBS induced UC, the expression of SNAP-25 decreases significantly, which may be partly attributed to increased inflammation and oxidative stress level in the colon.
- Citation: Shang BX, Dong L, Shi HT, Wang H, Yang SZ. Change in expression of synaptosomal associated protein of 25 kDa in the colonic muscle layer of rats with ulcerative colitis. Shijie Huaren Xiaohua Zazhi 2015; 23(20): 3270-3276
- URL: https://www.wjgnet.com/1009-3079/full/v23/i20/3270.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i20.3270
溃疡性结肠炎(ulcerative colitis, UC)是一种非特异性慢性结肠炎症, 在我国发病率不断攀升, 严重影响患者生活质量. 肠肌间神经元(myenteric neuron, MN)分布于肠道环行平滑肌和纵行平滑肌之间, 与肠平滑肌细胞及肠道外来的传入及传出神经元具有广泛的联系, 直接调节肠道运动及感觉, MN的损伤及功能异常可造成肠道感觉及运动功能障碍[1,2]. UC患者在病理上不但有炎症表现, 并出现MN损伤, 有研究[3]显示UC患者MN数目减少了61%以上. 因此, UC患者的腹痛、腹泻、腹胀等感觉及运动功能异常相关症状与MN的损伤及功能异常密切相关, 保护MN不受损伤是治疗UC的重要方面, 对于改善症状及疾病预后意义重大. 突触小体相关蛋白25(synaptosomal associated protein 25 kDa, SNAP-25)属于可溶性N-乙基马来酰亚胺敏感性因子结合蛋白受体(soluble N-ethylmaleimide sensitive factor attachment protein receptor, SNARE)的一种, 与突触小泡蛋白及突触融合蛋白形成SNARE核心复合体, 直接参与MN细胞突触小泡与突触前膜的膜融合以及神经递质的释放, 与MN的感觉及运动功能密切相关, SNAP-25蛋白的正常表达是MN能够保持正常感觉及运动功能的重要基础. 然而, 目前国内外在对UC时MN损伤情况进行研究的同时对结肠组织中SNAP-25蛋白的表达情况极少关注, 因此我们利用DNBS诱导大鼠生成UC模型, 采用免疫组织化学及Western blot来全面评价MN的损伤及SNAP-25蛋白在结肠组织的表达情况, 并且测定炎症及氧化应激相关指标来初步探讨产生SNAP-25蛋白表达量变化的原因.
♂SD大鼠, 250-300 g, 购自西安交通大学实验动物中心. DNBS(Sigma, USA), SNAP-25兔抗大鼠多克隆抗体(Bioworld, USA), 辣根过氧化物酶标记的山羊抗兔IgG抗体(Abcam, USA), ECL化学发光底物(Thermo Fisher, USA), RIPA蛋白裂解液(西安赫特生物科技有限公司), 髓过氧化物酶(myeloperoxidase, MPO)检测试剂盒(南京建成生物研究所), 超氧化物歧化酶(superoxide dismutase, SOD)、丙二醛(malondialdehyde, MDA)检测试剂盒(碧云天, 上海), 白介素1β(interleukin 1β, IL-1β)ELISA试剂盒(北京欣博盛生物科技有限公司). 垂直电泳槽/转膜仪、化学发光图像分析系统(天能, 上海).
1.2.1 大鼠UC模型的建立: 12只大鼠随机分成两组, 对照组及模型组各6只. 适应性喂养5 d, 造模前禁食不禁水24 h, 采用Sanovic等[4]描述的方法并进行改进, 应用DNBS的方法制作UC模型. 具体如下, 腹腔注射10%的水合氯醛轻度麻醉大鼠后, 用直径2 mm的硅胶管经肛门插入8 cm后, 模型组缓慢注入溶解有DNBS的500 mL/L的乙醇, 使DNBS的剂量为100 mg/kg, 头低位保持30 s, 以使DNBS能够良好作用于造模部位, 对照组以生理盐水代替DNBS注入, 操作完成后由大鼠自然苏醒.
1.2.2 取材和组织准备: 正常喂养4 d后处死大鼠, 模型组以炎症中央为中点取材2 cm, 对照组以距肛门8 cm处为中心取材2 cm. 去处标本肠系膜后, 沿肠系膜连接处剪开肠管, 生理盐水冲洗干净. 将标本切成小块, 一部分用4%的甲醛溶液固定, 石蜡包埋, 用于HE及免疫组织化学染色, 剩余部分用液氮速冻后保存于-80 ℃冰箱, 用于检测其他指标. 取结肠全层组织, 称质量, 加入冰生理盐水, 在冰上匀浆, 制作10%的匀浆液, 根据试剂盒要求直接用于测定MPO, 或者进行离心取上清用于SOD、MDA、IL-1β的测定. 依照文献[5]的方法, 解剖显微镜下, 在冰生理盐水中快速剔除肠道黏膜层及黏膜下层, 分离出带有肠肌间神经元的肠道平滑肌组织(smooth muscle layer containing the myenteric plexus, SM/MP) , 然后在RIPA裂解液中匀浆裂解, 4 ℃孵育40 min后, 低温离心机中12000 g离心5 min, 上清液分装后用于Western blot检测.
1.2.3 结肠大体形态评分及HE染色后评分: 按Nosál'ová等[6]的评价标准进行评分: 0分, 正常黏膜; 1分, 黏膜充血; 2分, 黏膜出血; 3分, 一处溃疡; 4分, 两处或更多溃疡; 5分, 溃疡沿肠道长轴长度>1 cm; 6-10分, 溃疡沿肠道长轴长度>2 cm, 长度每增加1 cm, 评分增加1分. 常规切片, 厚度为4 μm, 然后进行HE染色, 按照Tahan等[7]描述的标准按照每一项的严重程度对炎症水平进行评分: (1)黏膜结构消失, 0-3分; (2)炎症细胞浸润, 0-3分; (3)平滑肌增厚, 0-3分; (4)腺窝脓肿形成, 0-1分; (5)杯状细胞减少, 0-1分. 最后计算总分, 评分结果为0到11分.
1.2.4 结肠组织免疫组织化学染色及轴突密度评价: 沿着肠道纵轴连续切片, 切片厚度为4 μm, 随机选取2张切片, 按照下述方法进行免疫组织化学染色: 脱蜡, 水化, 一抗4 ℃孵育过夜, 孵育二抗, 显色, 苏木素复染, 脱水封片. 每张切片随机计数5个400倍视野, 同时计数视野内平滑肌细胞核数目, 最后依照以下公式: 轴突密度 = 所有视野内轴突数目总和/所有视野内平滑肌细胞核数总和, 计量每只大鼠的轴突密度.
1.2.5 Western blot测定SM/MP中SNAP-25蛋白含量: 采用十二烷基硫酸钠-变性聚丙烯酰胺凝胶不连续缓冲系统, 先后配制12%的分离胶和4%的浓缩胶, 每条泳道上样20 μg蛋白, 电泳, 应用转膜仪将凝胶上的蛋白转到PVDF膜, 5%牛奶孵育1 h进行封闭, 兔抗大鼠SNAP-25抗体(1:1000稀释)4 ℃孵育过夜, 再用辣根过氧化物酶标记的山羊抗兔二抗(1:2000稀释)室温孵育1 h, 最后以ECL试剂盒显色, 化学发光图像分析系统采集图像并进行分析.
1.2.6 MPO、SOD、MDA的测定: 应用生化方法进行, 具体操作步骤依照试剂说明书进行.
1.2.7 结肠组织IL-1β含量的测定: 取100 μL组织匀浆液上清加入包被有IL-1β的酶标板进行孵育, 接着按照试剂盒依次孵育生物素化的抗体工作液及酶结合工作液, 最后加入显色底物避光孵育, 应用酶标仪测定吸光度, 根据标准曲线计算每个样本的IL-1β含量.
统计学处理 计量资料采用mean±SD表示, 两组间比较采用独立样本t检验, 数据采用SPSS18.0统计软件包进行统计分析, P<0.05为差异具有统计学意义.
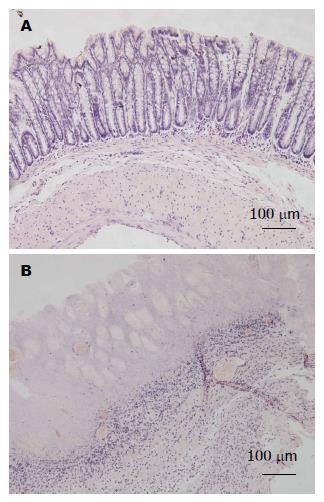
大体标本观察可见模型组结肠有明显的充血水肿、糜烂及大小不一的溃疡形成, 并可见局部黏膜发黑; 对照组黏膜光滑, 无明显充血水肿、糜烂及溃疡面. 与对照组比较, 模型组大体炎症水平评分明显升高(6.3分±0.8分 vs 0.0分±0.0分, P<0.01). 显微镜下观察HE染色切片, 可见对照组结肠黏膜结构规则, 有完整的上皮、隐窝、黏膜下层及肌层(图1A). 在模型组大鼠结肠组织中可见到广泛的肠上皮细胞及杯状细胞消失、明显的炎症细胞浸润、溃疡形成、肌层增厚、隐窝结构变形及隐窝脓肿形成(图1B). 与对照组比较, 模型组肠道损伤评分明显升高(9.2分±1.7分 vs 0.7分±0.8分, P<0.01).
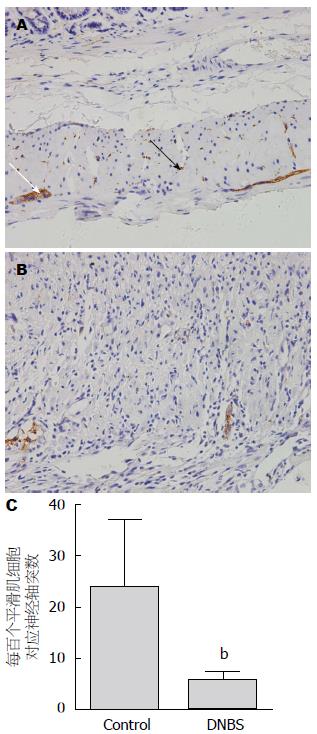
从图2A和图2B中可以看到, 相比于对照组, SNAP-25蛋白在DNBS诱导的UC大鼠的平滑肌层及肠肌间神经节表达明显减少. 因SNAP-25蛋白标记的肠神经元突起主要为轴突[8], 因此平滑肌层中经过SNAP-25标记的神经突起可以反映出轴突的密度, 如图2C所示, 与对照组相比, 模型组平滑肌中轴突密度明显减少(5.37个/百个平滑肌细胞±1.96个/百个平滑肌细胞 vs 23.76个/百个平滑肌细胞±13.24个/百个平滑肌细胞, P<0.01), 肠神经元的功能受到影响.
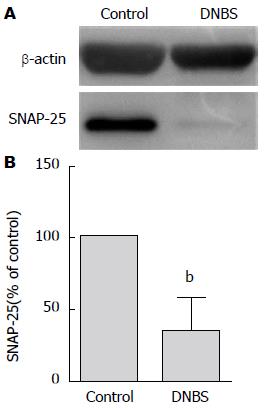
与对照组比较, 模型组结肠去处掉黏膜层及黏膜下层的SM/MP中SNAP-25蛋白表达量显著降低, 相对于对照组的表达量为34.31±23.73%(P<0.01)(图3).
与对照组比较, 在全层结肠组织匀浆液中, SOD活力明显降低, 模型组MPO活力明显增高, MDA含量明显增高, IL-1β蛋白表达量明显增高(表1).
结肠组织中的MN细胞是其肠神经元系统的重要组成部分, 与外来神经元及自身之间形成紧密的联系, 构成结肠感觉及运动功能的解剖形态学基础[9]. SNARE 核心复合体广泛存在于神经元轴突末梢, 由突触小泡蛋白、突触融合蛋白及SNAP-25三种蛋白按照1:1:1的比例聚合形成, 介导突触囊泡的锚定和融合, 参与神经递质的停靠、释放等过程, 是肠道MN细胞的感觉及运动功能的分子学基础[10,11]. 由于SNAP-25蛋白是SNARE核心复合体的重要结构成分, 因此, SNAP-25蛋白表达量的变化会直接影响到MN细胞的感觉及运动功能, 进而可能产生疼痛及腹泻等感觉及运动功能改变. 已有研究显示UC时结肠组织中MN细胞密度降低[3], 而SNAP-25蛋白广泛表达于MN细胞, 提示结肠SM/MP中SNAP-25蛋白的表达量可能会随着MN细胞数的减少而降低, 结肠肌层中神经轴突密度也可能而降低, 成为产生MN功能异常的重要原因.
Poli等[12]的研究虽然应用SNAP-25抗体对UC大鼠模型肠道进行了免疫组织化学的染色, 但只是进行了定性描述, 未进行进一步的定量研究. Sanovic等[4]同样应用DNBS诱导的UC模型, 认为结肠肌层神经轴突密度并未发生变化, 可能与其使用了蛋白基因产物9.5(protein gene product 9.5, PGP 9.5)抗体相关, 因PGP 9.5抗体标记神经元的所有结构, 不能区分轴突和树突, 因此不能针对轴突进行准确地评价, 也可能与其观察的时间点有关. 本研究应用免疫组织化学对结肠SNAP-25进行标记后, 利用SNAP-25蛋白同时可作为轴突标记的特点对平滑肌层中的轴突密度进行分析, 得出轴突密度减少的结论. 在此基础上, 更进一步应用Western-blot对SNAP-25的表达进行了定量研究, 并且明确了急性炎症状况下SNAP-25蛋白在SM/MP组织中表达量减少.
已有研究[13]表明, 炎症时组织氧化应激水平明显增高, 生成大量的活性氧及自由基, 而氧化应激是大脑神经元SNAP-25蛋白表达减少的重要原因, 具有抗氧化应激作用的维生素E可以抑制SNAP-25蛋白表达量的减少. 另外, 双氧水作为常用的氧化应激诱导剂, 使体外培养的肠肌间神经元细胞计数及SNAP-25蛋白表达量明显减少, 其部分机制是通过诱导细胞产生凋亡实现的[14]. 动物实验研究[15,16]表明, UC大鼠模型结肠组织炎症反应明显, 氧化应激水平增高. 在本实验中, DNBS诱导UC大鼠结肠有明显的炎症表现, 炎症评分及组织中炎症指标MPO和IL-1β明显升高, 同时抗氧化物质SOD减少, 脂质过氧化产物MDA含量明显增多, 提示大鼠结肠急性炎症和氧化应激很可能是造成SNAP-25蛋白表达减少及轴突密度减少的直接原因.
肠肌间神经元完整的形态及功能结构是肠道正常运动及感觉功能的基础, 本研究提示UC大鼠SNAP-25蛋白表达量减少, 结肠肌层轴突密度降低, 为评价UC患者的结肠神经结构及肠道感觉及运动功能提供了病理学基础, 为以后更加深入的研究UC的肠道感觉及运动障碍提供了新的依据.
突触小体相关蛋白25与突触小泡蛋白及突触融合蛋白在突触前膜形成核心复合体, 直接参与肠肌间神经元突触小泡与突触前膜的膜融合以及神经递质的释放, 与肠肌间神经元(myenteric neuron, MN)的感觉及运动功能密切相关. 因此研究溃疡性结肠炎(ulcerative colitis, UC)时肠道肌层突触小体相关蛋白25的表达量的变化可直接反映肠肌间神经元的损伤及功能变化情况, 可更进一步了解UC感觉及运动障碍的发生机制.
张小晋, 主任医师, 北京积水潭医院; 任粉玉, 教授, 延边大学附属医院消化内科
肠肌间神经元损伤及功能改变在UC的病理生理变化及症状成因方面所起的作用尚不完全清楚, 亟待进一步的研究阐明, 以利于对UC的病理生理和治疗评价进行更全面和深入的了解.
越来越多的研究者开始关注UC时肠神经元的损伤及功能变化情况, 提出肠神经元的损伤及功能变化与UC的疼痛、腹泻等症状密切相关, 为更加深入的理解UC的病理改变及发病机制提供了有价值的资料.
本文首次通过免疫组织化学染色及Western blot对UC大鼠结肠肌层中与肠肌间神经元密切相关的突触小体相关蛋白25的表达进行了定量研究, 得出该蛋白表达减少的结论, 并且分析了其机制可能与炎症和氧化应激水平升高相关.
本文研究表明UC大鼠肠道肌层突触小体相关蛋白25的表达量明显下降, 该蛋白在肠道肌层的表达情况可能会成为评价UC患者感觉及运动功能的重要指标之一.
可溶性N-乙基马来酰亚胺敏感性因子结合蛋白受体(soluble N-ethylmaleimide sensitive factor attachment protein receptor, SNARE)核心复合体: 广泛存在于神经元轴突末梢, 由突触小泡蛋白、突触融合蛋白及SNAP-25三种蛋白按照1:1:1的比例聚合形成, 介导突触囊泡的锚定和融合, 参与神经递质的停靠、释放等过程, 是肠道MN细胞的感觉及运动功能的分子学基础.
本文设计合理, 方法可靠, 具有可读性及学术价值, 对UC的进一步研究有参考价值.
编辑: 郭鹏 电编:闫晋利
| 1. | Linden DR. Enhanced excitability of guinea pig ileum myenteric AH neurons during and following recovery from chemical colitis. Neurosci Lett. 2013;545:91-95. [PubMed] [DOI] |
| 2. | Yarandi SS, Srinivasan S. Diabetic gastrointestinal motility disorders and the role of enteric nervous system: current status and future directions. Neurogastroenterol Motil. 2014;26:611-624. [PubMed] [DOI] |
| 3. | Bernardini N, Segnani C, Ippolito C, De Giorgio R, Colucci R, Faussone-Pellegrini MS, Chiarugi M, Campani D, Castagna M, Mattii L. Immunohistochemical analysis of myenteric ganglia and interstitial cells of Cajal in ulcerative colitis. J Cell Mol Med. 2012;16:318-327. [PubMed] [DOI] |
| 4. | Sanovic S, Lamb DP, Blennerhassett MG. Damage to the enteric nervous system in experimental colitis. Am J Pathol. 1999;155:1051-1057. [PubMed] [DOI] |
| 5. | Lourenssen S, Wells RW, Blennerhassett MG. Differential responses of intrinsic and extrinsic innervation of smooth muscle cells in rat colitis. Exp Neurol. 2005;195:497-507. [PubMed] [DOI] |
| 6. | Nosál'ová V, Zeman M, Cerná S, Navarová J, Zakálová M. Protective effect of melatonin in acetic acid induced colitis in rats. J Pineal Res. 2007;42:364-370. [PubMed] [DOI] |
| 7. | Tahan G, Gramignoli R, Marongiu F, Aktolga S, Cetinkaya A, Tahan V, Dorko K. Melatonin expresses powerful anti-inflammatory and antioxidant activities resulting in complete improvement of acetic-acid-induced colitis in rats. Dig Dis Sci. 2011;56:715-720. [PubMed] [DOI] |
| 8. | Tasdemir S, Parlakpinar H, Vardi N, Kaya E, Acet A. Effect of endogen-exogenous melatonin and erythropoietin on dinitrobenzene sulfonic acid-induced colitis. Fundam Clin Pharmacol. 2013;27:299-307. [PubMed] [DOI] |
| 9. | Furness JB, Callaghan BP, Rivera LR, Cho HJ. The enteric nervous system and gastrointestinal innervation: integrated local and central control. Adv Exp Med Biol. 2014;817:39-71. [PubMed] [DOI] |
| 10. | Barrenschee M, Böttner M, Harde J, Lange C, Cossais F, Ebsen M, Vogel I, Wedel T. SNAP-25 is abundantly expressed in enteric neuronal networks and upregulated by the neurotrophic factor GDNF. Histochem Cell Biol. 2015; Feb 6. [Epub ahead of print]. [PubMed] [DOI] |
| 11. | Shin OH. Exocytosis and synaptic vesicle function. Compr Physiol. 2014;4:149-175. [PubMed] [DOI] |
| 12. | Poli E, Lazzaretti M, Grandi D, Pozzoli C, Coruzzi G. Morphological and functional alterations of the myenteric plexus in rats with TNBS-induced colitis. Neurochem Res. 2001;26:1085-1093. [PubMed] |
| 13. | Kaneai N, Arai M, Takatsu H, Fukui K, Urano S. Vitamin E inhibits oxidative stress-induced denaturation of nerve terminal proteins involved in neurotransmission. J Alzheimers Dis. 2012;28:183-189. [PubMed] [DOI] |
| 14. | Lourenssen S, Miller KG, Blennerhassett MG. Discrete responses of myenteric neurons to structural and functional damage by neurotoxins in vitro. Am J Physiol Gastrointest Liver Physiol. 2009;297:G228-G239. [PubMed] [DOI] |
| 16. | Boussenna A, Goncalves-Mendes N, Joubert-Zakeyh J, Pereira B, Fraisse D, Vasson MP, Texier O, Felgines C. Impact of basal diet on dextran sodium sulphate (DSS)-induced colitis in rats. Eur J Nutr. 2014; Nov 20. [Epub ahead of print]. [PubMed] [DOI] |