修回日期: 2015-06-09
接受日期: 2015-06-19
在线出版日期: 2015-07-18
目的: 通过脱氧核糖核苷酸末端转移酶介导的缺口末端标记(TdT-mediated dUTP nick labeling, TUNEL)染色检测大鼠急性胰腺炎(acute pancreatitis, AP)中腺泡细胞的死亡情况, 探讨TUNEL染色阳性细胞的形态与细胞死亡方式之间的关系.
方法: 大鼠随机分为ANP组和假手术组(sham operation, SO), 每组6只, 利用4%的牛磺胆酸钠胰胆管逆行注射建立大鼠急性坏死性胰腺炎(acute necrotizing pancreatitis, ANP)模型, 对两组大鼠胰腺组织进行病理学观察并采用TUNEL技术对胰腺组织切片进行染色, 光镜下观察TUNEL染色阳性细胞的形态学表现.
结果: 对比假手术组, ANP组大鼠胰腺组织出现典型的AP样病理改变, 同时可见大量的TUNEL染色阳性腺泡细胞. 阳性细胞之间的形态学特点各异, 其中既有细胞呈凋亡表现, 如核固缩和核破裂伴凋亡小体形成; 也有细胞呈坏死表现, 如核膨胀、核溶解以及胞质空泡化. 两种细胞死亡方式的形态学表现之间存在显著差异.
结论: AP时, TUNEL染色并不能很好地区分腺泡细胞的坏死与凋亡, 但其联合阳性染色细胞的形态学特征可初步鉴别两种细胞死亡方式.
核心提示: 现有证据表明脱氧核糖核苷酸末端转移酶介导的缺口末端标记(TdT-mediated dUTP nick labeling, TUNEL)在检测急性胰腺炎时腺泡细胞凋亡方面缺乏特异性. 本研究提示TUNEL染色结合细胞学形态特点可初步区分腺泡细胞的凋亡与坏死, 从而提高TUNEL染色在检测急性胰腺炎时腺泡细胞死亡反应中的特异性.
引文著录: 胡洋洋, 周春华, 窦文欢, 凤辉, 王少峰. TUNEL染色结合细胞形态学特点鉴别急性胰腺炎时腺泡细胞的死亡方式. 世界华人消化杂志 2015; 23(20): 3259-3264
Revised: June 9, 2015
Accepted: June 19, 2015
Published online: July 18, 2015
AIM: To detect acinar cell death in rats with acute pancreatitis (AP) by TdT-mediated dUTP nick labeling (TUNEL) staining and to study the correlation between the morphology of TUNEL positive cells and their death modes.
METHODS: Acute necrotizing pancreatitis (ANP) was induced in rats by injection of 4% sodium taurocholate in the pancreaticobiliary duct, and the pathological changes in pancreatic tissue were observed. Pancreatic tissue sections were stained by TUNEL, and the morphological changes of TUNEL positive cells were evaluated under a light microscope.
RESULTS: Compared to the sham operated group, the pancreas of ANP rats exhibited typical pathological changes of AP, and had a large number of TUNEL positive acinar cells. The TUNEL positive cells showed various morphologic characteristics, which included the manifestations of both apoptosis and necrosis. The apoptotic morphology was characterized by nuclear condensation and karyorrhexis followed by the formation of apoptotic bodies, while necrotic cells demonstrated nuclear swelling, karyolysis and cytoplasmic vacuolization. There were significant differences between the morphologic characteristics of the two cell death modes.
CONCLUSION: TUNEL staining itself cannot well differentiate the apoptosis and necrosis of acinar cells in AP. However, when combined with the morphologic characteristics of TUNEL positive cells, TUNEL staining can preliminarily identify the two modes of cell death.
- Citation: Hu YY, Zhou CH, Dou WH, Feng H, Wang SF. TUNEL staining combined with cell morphologic characteristics for identifying acinar cell death mode in rats with acute pancreatitis. Shijie Huaren Xiaohua Zazhi 2015; 23(20): 3259-3264
- URL: https://www.wjgnet.com/1009-3079/full/v23/i20/3259.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i20.3259
急性胰腺炎(acute pancreatitis, AP)时, 腺泡细胞大量死亡. 细胞凋亡和坏死是两种主要的死亡方式, 因其各自在AP的病理生理中发挥重要的作用, 近来已成为AP研究领域中的热点[1]. 许多研究[1-3]表明, 人为干预以强化AP时腺泡细胞的凋亡反应有助于AP严重程度的缓解, 提示其潜在的临床应用价值. 相关的基础研究亦可为临床开发出新型的AP治疗手段提供理论及实验依据. 长久以来, 脱氧核糖核苷酸末端转移酶介导的缺口末端标记(TdT-mediated dUTP nick labeling, TUNEL)染色被认为是凋亡检测的经典方法之一, 但其检测细胞凋亡的特异性一直存在争议. 有学者认为, TUNEL阳性结果只能反应核内的DNA发生断裂, 并不能很好地区分凋亡与坏死[4]; 也有观点认为, 细胞发生凋亡或坏死时, 其各自的形态学特征存在明显的差异, 并可作为对细胞凋亡或坏死进行辨别的依据[5]. 因此, 本实验在急性坏死性胰腺炎(acute necrotizing pancreatitis, ANP)动物模型的基础上, 利用TUNEL法对胰腺组织切片进行染色, 结合阳性染色细胞的形态学特点的差异分析胰腺腺泡细胞的死亡方式.
健康清洁级♂SD大鼠12只, 体质量200 g左右, 由苏州大学实验动物中心提供. 牛磺胆酸钠(美国Sigma公司); TUNEL试剂盒及蛋白酶K工作液(美国罗氏公司).
1.2.1 动物模型的制备: 大鼠随机分为ANP组和假手术组(sham operation, SO), 每组6只. 实验前禁食16 h, 自由饮水, 实验前3 h禁水. ANP模型制备参考Wittel等[6]所用方法: 2%戊巴比妥钠溶液腹腔内注射麻醉, 固定、消毒、剖腹, 找到胰胆管, 用无损伤动脉夹夹闭肝门部胆管, 从胰胆管开口十二指肠系膜缘对侧肠壁穿刺插入24号肠管套针, 连接微量输液泵以0.1 mL/min的速度推注4%牛磺胆酸钠0.1 mL/100 g, 注毕后观察5 min拔管, 移除动脉夹, 缝合十二指肠穿刺口并关腹. 术后于大鼠后肢皮下注射生理盐水10 mL以补足液体. SO组开腹后仅将十二指肠提出切口, 翻动胰腺后关腹. 以胰腺组织病理检查判断造模是否成功.
1.2.2 胰腺组织病理学检查: 两组大鼠于造模后12 h处死, 取大鼠胰腺组织固定于40 g/L多聚甲醛溶液中, 常规脱水、包埋、切片成4 μm, 苏木素-伊红(HE)染色后光镜下观察. 典型的ANP病理表现为胰腺组织间质出血, 组织明显水肿, 大量炎性细胞浸润, 组织细胞大片坏死.
1.2.3 胰腺组织TUNEL染色: TUNEL染色步骤按TUNEL试剂盒(美国罗氏公司)说明进行: 胰腺组织石蜡切片60 ℃烤片15 min, 依次置入二甲苯中脱蜡, 梯度乙醇水化; 蛋白酶K工作液室温下处理切片10 min, 磷酸盐缓冲液(phosphate buffer solution, PBS)漂洗3次; 加入配置好的TUNEL反应工作液(TdT:核酸混合液 = 1:9), 37 ℃下孵育1 h; 3%H2O2甲醇溶液室温处理10 min, PBS漂洗3次; 加入转化-过氧化物酶溶液, 37 ℃下孵育30 min, PBS漂洗3次; 加入二氨基联苯胺显色, PBS冲洗, 苏木素复染胞核, 梯度乙醇脱水, 二甲苯透明, 中性树胶封片, 光镜下见细胞核棕染为TUNEL阳性染色, 观察并记录阳性细胞的胞核以及胞质形态.
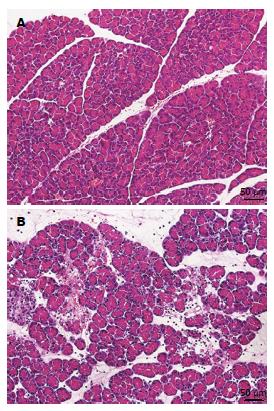
SO组大鼠胰腺组织光镜下腺体小叶及腺泡结构清晰完整, 间质轻度水肿(图1A). ANP组胰腺组织内可见大片腺泡细胞坏死, 腺泡细胞空泡化明显, 腺泡及小叶正常结构被破坏, 间质明显水肿, 实质及间质内炎症细胞浸润, 间质内血管扩张或出血(图1B).
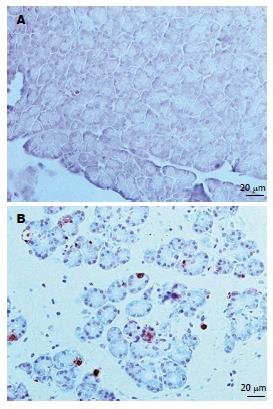
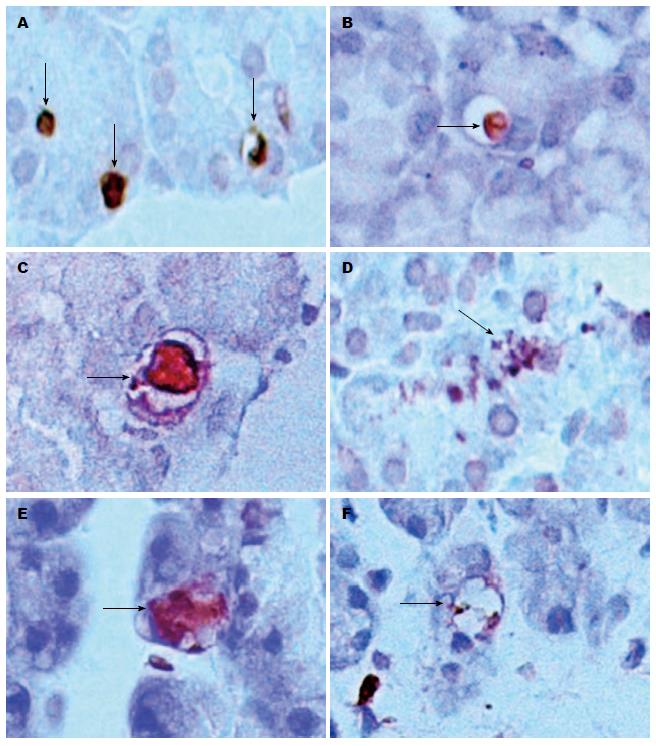
SO组偶见个别阳性棕染细胞(图2A), ANP组见大量的细胞核染成深棕色(图2B). ANP组TUNEL染色阳性细胞具有多种形态, 具体表现为: (1)核固缩: 棕染细胞核体积缩小, 染色质颗粒状固缩或在核膜下边集形成环形、新月体形(图3A); 可合并胞质空泡化(图3B); (2)核膨胀: 棕染细胞核体积膨大, 但核膜尚完整, 形态较规则, 常合并胞质空泡化(图3C); (3)核破裂: 棕染细胞核大小不一, 核膜破裂, 染色质碎片与胞膜结构形成凋亡小体(图3D); 如合并胞质空泡化, 则染色质在胞内弥漫分布(图3E); (4)核溶解: 核内DNA被酶解, 核内染色质淡染, 有的仅余核轮廓(图3F).
胰腺腺泡细胞的损伤被认为是AP的起始事件, 其中腺泡细胞的凋亡和坏死是细胞损伤的两种主要死亡结局[7]. 凋亡时, 细胞胞膜结构完整, 凋亡小体形成, 并可诱导吞噬细胞对其进行清除, 不诱发局部炎症反应; 而坏死表现为胞膜的破坏, 胞内致炎物质释放, 可诱发或放大局部炎症[8,9]. 在多种AP动物模型中都可观察到AP的严重程度与腺泡细胞凋亡的程度呈反比, 与坏死呈正比[10]. 多种干预手段, 如大黄承气汤治疗以及抑制内源性硫化氢合成等, 可通过诱导腺泡细胞凋亡以减轻实验性AP的严重程度[11,12]. 因此, 诱导细胞凋亡有望成为AP的新型临床治疗手段, 对AP时腺泡细胞死亡反应的检测也有助于判断实验性或临床AP的严重程度. 但目前, 如何有效而又特异地检测腺泡细胞的原位死亡反应仍是一大难题.
细胞凋亡的检测手段有多种, 其中TUNEL是最直观的原位检测方法之一, TUNEL的工作原理是利用脱氧核糖核苷酸和生物素所组成的衍生物对凋亡细胞核DNA断裂产生的3'-OH末端进行原位标记, 核酸内切酶活化使DNA降解断裂是TUNEL法检测凋亡的基础[13]. 但也有许多研究[14,15]表明, 细胞坏死时也可发生DNA断裂, 并能被TUNEL法所检测到; 另一方面, AP往往同时出现大量的细胞凋亡和坏死, 这些因素都能降低TUNEL法在检测AP腺泡细胞凋亡中的特异性. 与此同时, 有学者观察了AP时TUNEL染色阳性腺泡细胞的形态, 发现其形态学特征之间存在明显的差异, 通过辨别这种差异, 可对TUNEL阳性细胞是凋亡还是坏死进行初步的判定[16]. 本实验中, 大鼠予4%牛磺胆酸钠胰胆管内逆行灌注后, 病理学观察显示胰腺组织出现典型的ANP病理改变, 提示造模成功. 进一步利用TUNEL法对胰腺组织切片进行染色, 结果显示ANP组大鼠胰腺组织内出现多量的棕染阳性细胞, 胞核及细胞的形态各异, 其胞核的形态学表现可基本概括为上述的核固缩、核膨胀、核破裂及核溶解四种类型; 胞质的形态学表现可有凋亡小体形成和胞质空泡化.
凋亡和坏死虽然都指向细胞的不可逆性死亡, 但两种细胞死亡方式的形态学特征却存在明显的不同[17]. 细胞凋亡时, 胞质和胞核发生固缩, 继而细胞核发生裂解产生核碎片, 核碎片与胞质内成分一起被胞膜结构包绕形成凋亡小体[18]; 坏死则表现为细胞整体结构的膨胀, 细胞膜结构崩解, 核固缩、核破裂及核溶解[19]. 由此可见, 核破裂合并凋亡小体形成是细胞凋亡的特异性表现, 核膨胀及核溶解则指向坏死. 然而, 核固缩及核破裂既可在凋亡也可在坏死时发生[20], 如何对此类情况下的细胞死亡方式进行辨别? 在本实验中, 我们观察到许多的TUNEL阳性细胞出现胞质空泡化. 胞质空泡化是AP中常见的病理现象, 研究[21]表明这种病理现象源于细胞自噬通路的受阻. 自噬是细胞内重要的物质与能量再生通路,其功能状态可影响细胞的死亡过程. Fortunato等[16]认为AP时TUNEL检测阳性合并胞质空泡化提示腺泡细胞正在发生坏死; 细胞发生空泡化时, 自噬通路受阻, 导致胞内的ATP耗竭, 从而促进了细胞坏死. Degterev等[22]则认为自噬参与了细胞的"程序性坏死", 若细胞同时出现自噬和凋亡的形态学特征提示细胞正在发生"程序性坏死"[23]. 因此在AP胰腺组织中, TUNEL阳性细胞的空泡化现象是判定坏死的重要指标.
总之, 基于检测断裂DNA的TUNEL法可反应AP中腺泡细胞的死亡情况, 但TUNEL染色阳性本身并不能很好地区分凋亡与坏死, 两者之间的鉴别还需结合阳性染色细胞的形态学特点. 在TUNEL染色阳性的腺泡细胞中, 核膨胀及核溶解表明细胞坏死; 核固缩、核破裂连同凋亡小体形成指向细胞凋亡; 而无论核形态,如细胞发生空泡化, 则提示细胞发生坏死. 目前鉴定细胞原位死亡最可靠的指标还是形态学特征, TUNEL仍是这一领域的经典方法, 重视TUNEL检测中的细胞形态学特性可进一步优化此法在AP腺泡细胞死亡反应研究中的应用, 从而更有利于实验或临床中的AP病理生理研究.
腺泡细胞的凋亡和坏死与急性胰腺炎的病理生理密切相关, 诱导腺泡细胞从坏死向凋亡转变有望成为急性胰腺炎的有效治疗手段. 急性胰腺炎时腺泡细胞的死亡反应成为研究中的热点, 但目前仍缺乏对腺泡细胞的凋亡与坏死进行原位检测的有效指标和方法.
徐灿, 副教授, 副主任医师, 上海市长海医院
TUNEL染色是检测组织细胞原位凋亡的最直观方法, 但其同时也可对坏死细胞产生阳性染色. 细胞形态学表现是判断细胞死亡方式的可靠依据, 将其与TUNEL染色相结合有助于提高TUNEL染色检测AP时腺泡细胞凋亡与坏死的特异性, 从而更好地应用于基础及临床研究.
Fortunato等在2009年报道了酒精联合脂多糖诱导的急性胰腺炎模型, 其对急性胰腺炎时腺泡细胞的凋亡与坏死进行了深入研究. 该研究利用TUNEL染色结合细胞形态学表现对腺泡细胞的死亡方式进行了初步的鉴别, 并且深入地研究了自噬、坏死与凋亡三者之间的关系.
本研究通过TUNEL法对急性坏死性胰腺炎胰腺组织进行染色, 分析了TUNEL染色阳性细胞之间的形态学差异以及其与细胞死亡方式的关系, 揭示TUNEL染色联合细胞形态学观察可用于初步鉴别腺泡细胞的坏死与凋亡情况.
本研究通过将TUNEL染色与细胞形态学观察相结合, 提高了其在检测急性胰腺炎时腺泡细胞凋亡与坏死中的特异性, 从而为急性胰腺炎病理生理的临床及基础研究提供了更加优化的细胞死亡检测方法.
脱氧核糖核苷酸末端转移酶介导的缺口末端标记(TUNEL): 通过末端脱氧核苷酸转移酶将荧光素标记的dUTP连接到断裂DNA的3'-OH端, 并进一步偶联辣根过氧化酶标记的荧光素抗体, 利用辣根过氧化物酶的底物二氨基联苯胺显影, 可在光镜下观察到呈深棕色的阳性染色.
本文对实验性急性胰腺炎胰腺组织进行病理及TUNEL检查, 结合细胞形态学特点对腺泡细胞的死亡方式进行鉴别, 研究设计尚可, 但需要指出该研究的临床指导意义.
编辑: 郭鹏 电编:闫晋利
| 1. | Bhatia M. Apoptosis versus necrosis in acute pancreatitis. Am J Physiol Gastrointest Liver Physiol. 2004;286:G189-G196. [PubMed] [DOI] |
| 2. | Lin Z, Guo J, Xue P, Huang L, Deng L, Yang X, Xia Q. Chaiqinchengqi decoction regulates necrosis-apoptosis via regulating the release of mitochondrial cytochrome c and caspase-3 in rats with acute necrotizing pancreatitis. J Tradit Chin Med. 2014;34:178-83. [PubMed] |
| 3. | Weng TI, Wu HY, Chen BL, Liu SH. Honokiol attenuates the severity of acute pancreatitis and associated lung injury via acceleration of acinar cell apoptosis. Shock. 2012;37:478-484. [PubMed] [DOI] |
| 4. | 来 茂德. 凋亡与坏死及相关问题. 浙江大学学报(医学版). 2001;30:245-247. |
| 5. | Davidovich P, Kearney CJ, Martin SJ. Inflammatory outcomes of apoptosis, necrosis and necroptosis. Biol Chem. 2014;395:1163-1171. [PubMed] [DOI] |
| 6. | Wittel UA, Wiech T, Chakraborty S, Boss B, Lauch R, Batra SK, Hopt UT. Taurocholate-induced pancreatitis: a model of severe necrotizing pancreatitis in mice. Pancreas. 2008;36:e9-21. [PubMed] [DOI] |
| 9. | Mareninova OA, Sung KF, Hong P, Lugea A, Pandol SJ, Gukovsky I, Gukovskaya AS. Cell death in pancreatitis: caspases protect from necrotizing pancreatitis. J Biol Chem. 2006;281:3370-3381. [PubMed] [DOI] |
| 10. | Kaiser AM, Saluja AK, Sengupta A, Saluja M, Steer ML. Relationship between severity, necrosis, and apoptosis in five models of experimental acute pancreatitis. Am J Physiol. 1995;269:C1295-C1304. [PubMed] |
| 11. | Wang J, Chen G, Gong H, Huang W, Long D, Tang W. Amelioration of experimental acute pancreatitis with Dachengqi Decoction via regulation of necrosis-apoptosis switch in the pancreatic acinar cell. PLoS One. 2012;7:e40160. [PubMed] [DOI] |
| 12. | Wang G, Han B, Zhou H, Wu L, Wang Y, Jia G, Lv J, Cheng Z, Pan S, Liu J. Inhibition of hydrogen sulfide synthesis provides protection for severe acute pancreatitis rats via apoptosis pathway. Apoptosis. 2013;18:28-42. [PubMed] [DOI] |
| 13. | Gavrieli Y, Sherman Y, Ben-Sasson SA. Identification of programmed cell death in situ via specific labeling of nuclear DNA fragmentation. J Cell Biol. 1992;119:493-501. [PubMed] |
| 14. | Dong Z, Saikumar P, Weinberg JM, Venkatachalam MA. Internucleosomal DNA cleavage triggered by plasma membrane damage during necrotic cell death. Involvement of serine but not cysteine proteases. Am J Pathol. 1997;151:1205-1213. [PubMed] |
| 15. | Grasl-Kraupp B, Ruttkay-Nedecky B, Koudelka H, Bukowska K, Bursch W, Schulte-Hermann R. In situ detection of fragmented DNA (TUNEL assay) fails to discriminate among apoptosis, necrosis, and autolytic cell death: a cautionary note. Hepatology. 1995;21:1465-1468. [PubMed] |
| 16. | Fortunato F, Bürgers H, Bergmann F, Rieger P, Büchler MW, Kroemer G, Werner J. Impaired autolysosome formation correlates with Lamp-2 depletion: role of apoptosis, autophagy, and necrosis in pancreatitis. Gastroenterology. 2009;137:350-360, 360.e1-5. [PubMed] [DOI] |
| 17. | Fink SL, Cookson BT. Apoptosis, pyroptosis, and necrosis: mechanistic description of dead and dying eukaryotic cells. Infect Immun. 2005;73:1907-1916. [PubMed] [DOI] |
| 18. | Taylor RC, Cullen SP, Martin SJ. Apoptosis: controlled demolition at the cellular level. Nat Rev Mol Cell Biol. 2008;9:231-241. [PubMed] [DOI] |
| 20. | Majno G, Joris I. Apoptosis, oncosis, and necrosis. An overview of cell death. Am J Pathol. 1995;146:3-15. [PubMed] |
| 21. | Mareninova OA, Hermann K, French SW, O'Konski MS, Pandol SJ, Webster P, Erickson AH, Katunuma N, Gorelick FS, Gukovsky I. Impaired autophagic flux mediates acinar cell vacuole formation and trypsinogen activation in rodent models of acute pancreatitis. J Clin Invest. 2009;119:3340-3355. [PubMed] [DOI] |
| 22. | Degterev A, Huang Z, Boyce M, Li Y, Jagtap P, Mizushima N, Cuny GD, Mitchison TJ, Moskowitz MA, Yuan J. Chemical inhibitor of nonapoptotic cell death with therapeutic potential for ischemic brain injury. Nat Chem Biol. 2005;1:112-119. [PubMed] [DOI] |
| 23. | Ouyang L, Shi Z, Zhao S, Wang FT, Zhou TT, Liu B, Bao JK. Programmed cell death pathways in cancer: a review of apoptosis, autophagy and programmed necrosis. Cell Prolif. 2012;45:487-498. [PubMed] [DOI] |