修回日期: 2014-11-26
接受日期: 2014-12-05
在线出版日期: 2015-01-18
目的: 报道7例不可手术切除的肝门部胆管癌患者行肝移植术, 结合文献对其临床预后因素、临床结果进行分析.
方法: 回顾性调查研究分析2000-03/2010-12中国人民解放军海军总医院7例肝门部胆管癌行肝移植患者的临床资料, 分析总结其临床病理特征、术后生存时间、肿瘤复发以及预后因素.
结果: 7例患者术前评估均不能达到根治性切除, 均行肝移植术, 术后病理诊断明确, 无围手术期死亡, 淋巴结转移者为57.1%(4/7), 2例术前CA19-9>100 KU/L. 随访时间为7-108 mo, 7例均死亡, 肿瘤特异性死亡者5例, 其中淋巴结阴性者[国际抗癌联盟(Union for International Cancer Control, UICC)分期均为2期]生存时间分别为108、37 mo, 淋巴结阳性者(UICC分期, 2例3b期, 1例4a期)则分别为11、26、7 mo; 而肿瘤非特异性死亡者2例, 生存时间分别为18、34 mo.
结论: 对于不能外科手术切除且无淋巴结转移的肝门部胆管癌患者行肝移植术是一种有效的治疗手段.
核心提示: 对于不能外科手术切除且无淋巴结转移的肝门部胆管癌患者行肝移植术是一种有效的治疗手段.
引文著录: 谭勇, 邱宝安, 夏念信, 杨英祥, 祝建勇, 刘鹏, 安阳, 吴印涛. 肝门部胆管癌行肝移植术7例. 世界华人消化杂志 2015; 23(2): 313-317
Revised: November 26, 2014
Accepted: December 5, 2014
Published online: January 18, 2015
AIM: To report seven cases of patients with unresectable hilar cholangiocarcinoma who underwent liver transplantation and to
METHODS: The clinical data for seven patients with unresectable hilar cholangiocarcinoma who underwent liver transplantation were retrospectively analyzed. The clinicopathological features, tumor recurrence, postoperative survival and prognostic-related factors are discussed.
RESULTS: Hilar cholangiocarcinoma was confirmed by histopathology postoperatively in all patients, and no perioperative deaths occurred. Lymph node metastases were found in three patients (3/7), and preoperative CA19-9 > 100 KU/L was found in two cases. During a 108-month follow-up period, all patients died. Of 5 patients who died of tumor recurrence, the survival time was 108 and 37 mo in two lymph node-negative patients [both had Union for International Cancer Control (UICC) stage II disease], and 11, 26 and 7 mo in the three with lymph node metastases (UICC stage IIIb in 2 patients, and IVa in 1). The survive time for the 2 patients dying from other causes was 18 and 34 mo.
CONCLUSION: Liver transplantation may be an effective treatment strategy for lymph node-negative patients with unresectable hilar cholangiocarcinoma.
- Citation: Tan Y, Qiu BA, Xia NX, Yang YX, Zhu JY, Liu P, An Y, Wu YT. Liver transplantation for hilar cholangiocarcinoma: Analysis of 7 cases. Shijie Huaren Xiaohua Zazhi 2015; 23(2): 313-317
- URL: https://www.wjgnet.com/1009-3079/full/v23/i2/313.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i2.313
胆管癌是一种不常见但非罕见的恶性肿瘤, 占整个胃肠道肿瘤的3%左右, 他来源于肝内或肝外胆管上皮细胞, 大概60%-70%的胆管癌发生在肝胆管汇合部附近(肝门部胆管癌)[1-3]. 尽管其具有生长缓慢、罕见的血道转移特点, 但肿瘤侵犯肝门区结构往往导致其根治性切除率低. Jarnagin等[4]报道了在美国纪念斯隆-凯特琳癌症中心1991-2000年间225例肝门部胆管癌患者中, 仅27.6%得到了根治性切除. 针对这些非根治性切除患者, 肝移植被认为是一种治疗手段, 但由于术后肿瘤复发率高、器官资源的短缺以及缺乏足够长期随访结果等, 使得肝移植作为肝门部胆管癌治疗手段的合理性一直受到置疑. 在这里, 我们报道了7例海军总医院2000-03/2010-12间肝门部胆管癌接受肝移植病例, 并结合文献对其临床预后因素、临床结果进行分析.
所有资料均来自于中国人民解放军海军总医院2000-03/2010-12间肝门部胆管癌接受肝移植患者, 术后病理诊断明确. 采用回顾性调查研究分析每例患者临床和肿瘤特征, 以及预后因素等. 根据第7版TNM分期法对每例患者进行TNM分期.
术前影像学检查包括胸片、腹部超声、胸腹计算机断层扫描(computerized tomography, CT)、磁共振胰胆管造影(magnetic resonance cholangiopancreatography, MRCP)、磁共振成像(magnetic resonance imaging, MRI)等, 用于诊断、分期以及排除远处转移. 所有患者均进行严格肝移植评估, 即术前认为肿瘤不可切除(包括预计不能行R0切除以及严重肝损害不允许行肝部分切除来达到根治性切除等)、未发现远处转移、患者有行肝移植强烈意愿, 且影像学评估可通过全肝切除来完整切除肿瘤, 包括达到组织学切缘阴性、肝十二指肠韧带骨骼化, 但不需附加行胰十二指肠切除. 符合以上要求进行肝移植的肝门部胆管癌共7例. 采用电话、门诊以及住院复查进行随访, 随访起点为手术日期, 随访截止点为2013-12. 7例患者均有较完整的随访资料, 无失访者, 术后随访时间为7-108 mo.
统计学处理 使用Kaplan-Meier方法绘制术后总生存曲线图. 因病例数较少缘故, 故未对每个变量分组以及组间进行统计学分析.
在这10年当中, 中国人民解放军海军总医院共有82例肝移植患者, 其中因肝门部胆管癌行肝移植者7例. 关于这7例患者的临床和肿瘤特征如表1. 7例患者中男5例, 女2例, 平均年龄为52岁(41-63岁); 术前肿瘤标志物检查提示2例CA19-9>100 KU/L, 分别为797.72、145.8 KU/L; 淋巴结转移者为57.1%(4/7); 肿瘤复发者为5例; 所有患者均为尸体肝移植, 无围手术期死亡, 均达到R0切除. 术后并发症发生率为42.9%(3/7). 1例术后2 mo出现进行性加重性肝损害, 经T管造影提示胆管近段部分充盈缺损, 但行腹部CT以及正电子发射计算机断层显像(positron emission tomography, PET)/CT检查并未发现胆道吻合口肿瘤复发, 综合考虑为肝移植术后胆道缺血狭窄, 给予经皮经肝胆管穿刺置管引流后肝功能渐恢复, 后此患者因肿瘤腰椎转移, 在术后7 mo死亡. 1例患者术后出现溶血性贫血, 给予输血、激素冲击疗法后病情好转. 1例患者术后出现切口感染和肺部感染, 给予加强抗感染、换药后感染得到控制, 切口预后良好.
| 参数 | 肝门部胆管癌 |
| n | 7 |
| 性别(男/女) | 5/2 |
| 年龄(岁), 平均(范围) | 52(41-63) |
| 供肝类(尸体肝) | 7 |
| 术前CA19-9>100 KU/L | 2 |
| 肿瘤大小(cm), 平均(范围) | 4.7(2.8-6.5) |
| 组织学分级 | |
| 低 | 2 |
| 中 | 4 |
| 高 | 1 |
| T分类(UICC 2010) | |
| pT1 | 0 |
| pT2a | 1 |
| pT2b | 3 |
| pT3 | 2 |
| pT4 | 1 |
| N分类 | |
| N0 | 3 |
| N1 | 4 |
| M分类 | |
| M0 | 7 |
| M1 | 0 |
| 切缘(R0) | 7 |
| 术后并发症 | 3 |
| 围手术期死亡 | 0 |
| 肿瘤复发 | 5 |
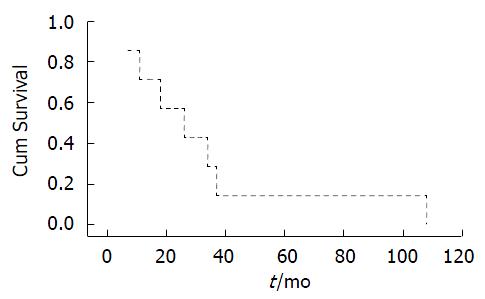
7例患者随访结果以及临床病理特征参数如表2. 术后随访时间为7-108 mo, 无失访者. 术后1、3、5年总生存率分别为71%、29%、14%, 累积生存曲线图如图1. 在随访过程当中, 7例患者均死亡, 其中5例患者因肿瘤复发所致; 1例患者死于严重肺部感染, 1例患者死于卵巢癌, 且均无原发肿瘤复发证据. 2例患者术前CA19-9分别为797.72 KU/L、145.8 KU/L, 其生存时间分别为108、7 mo, 其余患者CA19-9均<100 KU/L. 5例肿瘤特异性死亡者中, 淋巴结阴性者(UICC分期均为2期)生存时间分别为108、37 mo, 淋巴结阳性者(UICC分期, 2例3b期, 1例4a期)则分别为11、26、7 mo, 其中前者无瘤生存时间最长者为104 mo, 后者1例术中发现肿瘤侵犯门静脉主干壁, 在保证血管吻合良好的情况下完全切除所受侵犯的血管, 但此患者术后出现肿瘤腰椎以及腹腔淋巴结转移, 并于术后7 mo死于肿瘤复发.
| 病例 | 病理TNM分期 | UICC分期(2010) | 组织分级 | 复发类型 | 无瘤时间(mo) | 生存状态 | 生存时间(mo) |
| 1 | T3N1M0 | 3b | 低 | 肝内转移 | 6 | 死亡 | 11 |
| 2 | T4N1M0 | 4a | 中 | 骨转移 | 4 | 死亡 | 7 |
| 3 | T2bN0M0 | 2 | 低 | 肺转移 | 104 | 死亡 | 108 |
| 4 | T2bN1M0 | 3b | 中 | 无复发 (死于肺部感染) | 18 | 死亡 | 18 |
| 5 | T3N1M0 | 3b | 中 | 淋巴结复发 | 21 | 死亡 | 26 |
| 6 | T2bN0M0 | 2 | 中 | 局部复发 | 32 | 死亡 | 37 |
| 7 | T2aN0M0 | 2 | 高 | 无复发 (死于卵巢癌) | 34 | 死亡 | 34 |
综合以上, 提示以下因素显示较差的生存趋势: 淋巴结阳性、高TNM分期. 然而由于病例数较少, 并未针对这些因素分组行统计学分析.
外科手术切除和肝移植是肝门部胆管癌患者唯一有望得到根治的治疗手段. 但由于起始阶段肝门部胆管癌行肝移植患者入选条件不恰当, 以致术后长期随访结果令人失望[5], 再加上器官资源的短缺以及近年来肝门部胆管癌根治性切除率的提高, 使得肝移植作为肝门部胆管癌治疗的合理性一直成为肝胆外科医师们的一个敏感话题. 最近国外学者报道了肝门部胆管癌患者行姑息性化疗或同步放化疗, 其中位生存时间为仅9-12 mo, 且没有长期存活者[6]. 而Robles等[7]报道了在1990-2003年对36例肿瘤非广泛浸润且不可切除的肝门部胆管癌患者行原位肝移植, 术后1、3、5年生存率分别为82%、53%、30%, 达到了与手术根治相似的效果. 中国人民解放军海军总医院7例肝门部胆管癌行肝移植术者中, 术后3年总生存率为29%(2/7), 术后5年总生存率为14%(1/7), 其中有2例分别在术后18、34 mo死亡, 但并未发现原发肿瘤复发迹象. 显示对于手术不可切除的患者行肝移植有望获得较好的预后.
关于本研究预后因素方面, 虽然未对各参数行统计学分析, 但我们的资料显示无淋巴结转移患者的预后趋势要明显好于淋巴结转移者. 在5例肿瘤特异性死亡患者中, 淋巴结阴性者生存时间分别为108、37 mo, 淋巴结阳性者则分别为11、7、26 mo, 其中前者无瘤生存时间最长者为104 mo; 而在另外2例肿瘤非特异性死亡者中, 淋巴阴性者存活时间为34 mo, 随访期间无肿瘤复发证据. 回顾过去肝门部胆管癌患者行肝移植术的文献, 大量文献报道了淋巴结转移是其重要的预后因素, 且有着惨淡的5年生存率[8,9]. Schüle等[10]报道16例肝门部胆管癌接受肝移植患者, 淋巴结阴性者和阳性者各8例, 前者3年、5年生存率分别为63%、50%, 而后者仅分别为15%、0%, 且在总体生存率方面, 淋巴结转移在统计学上是唯一有意义的参数. 另一组研究[11]报道, 在肝门部胆管癌行肝移植联合胰十二指肠切除术病例中, 剔除围手术期死亡病例, 淋巴结阴性者10年生存率达到56%, 在随访截止点时, 仍无瘤生存时间最长者已达到200 mo.
Pichlmayr等[12]报道了25例肝门部胆管癌行肝移植术, 1期和2期患者5年生存率为37.8%, 而4期患者为5.8%, 显示肝移植用于2期以内肝门部胆管癌患者是合理的. 我们的资料亦显示相似的数据, 在7例患者中, UICC分期为2期的患者生存时间分别为108、34、37 mo, 而UICC分期大于2期者生存时间分别为7、11、18、26 mo. 除了淋巴结转移、UICC分期是影响患者生存的因素外, 国外另有报道显示血管和神经浸润、CA19-9>100 U/mL等亦是影响预后的因素[11,13,14]. 但由于本研究病例数有限, 并未分析术前CA19-9水平、肿瘤大小、组织学分级以及血管神经浸润等因素对术后生存的影响.
正如前面所提及一样, 对于肝门部胆管癌不可手术切除患者, 通过严格的病例入选标准, 包括术前腹腔镜探查、剖腹探查排除肝外转移, 甚至给予辅助放化疗等措施, 其5年生存率有望得到大幅度提高. 在此等条件下, Rosen等[15]报道了胆管癌行肝移植术其5年生存率为79%, 肿瘤复发率仅为17%. 在Mayo Clinic中心研究报道, 此类肝门部胆管癌移植术后5年生存率达到76%[14]. Rea等[16]报道, 对61例患者行剖腹探查以排除肿瘤肝外转移, 最终共有38例肝门部胆管癌患者接受肝移植术, 在剔除3例死于术后并发症的病例后, 其1年、3年、5年肿瘤复发率分别为0%、5%、12%, 生存率分别为92%、82%、82%; 而另外54例接受外科手术切除者, 仅26例达到R0切除, 其1年、3年、5年则分别为82%、48%、21%; 上述结果显示移植组术后生存明显优于手术组. 而在我们所报道的7例患者当中, 1例淋巴结阴性、UICC分期为2期患者在术后没有行辅助放化疗等治疗手段的情况下, 其无瘤生存时间达到104 mo.
总之, 我们可以初步认为, 对于手术不可切除的肝门部胆管癌患者, 经过合适的病例入选, 行肝移植甚至附加胰十二指肠切除术以及辅助放化疗等治疗, 可为此类患者长期存活提供了一线生机. 但在当今器官资源短缺时代, 如何降低肿瘤复发率以及进一步提高术后生存时间是广大器官移植者需要攻克的一个难题.
肝门部胆管癌是一种相对罕见以及具有生长缓慢、晚期转移为特点的恶性肿瘤,预后差; 外科完全切除肿瘤(包括达到组织学切缘阴性)是肝门部胆管癌患者获得长期生存的唯一方法, 但肿瘤侵犯肝门区重要结构往往导致其根治性切除率低. 而肝移植用于治疗肝门部胆管癌则一直饱受争议.
陈进宏, 副主任医师, 复旦大学附属华山医院普外科
肝移植用于治疗肝门部胆管癌已有数十年历史, 但前期由于病例入选条件不恰当, 导致术后长期随访结果令人失望. 目前研究焦点主要集中在移植术后肿瘤复发率高和生存率低上, 且缺少统一的病例选择标准, 也缺少循证医学的依据. 因此, 如何降低移植术后肿瘤复发率、提高术后生存率以及制定相应病例入选标准是目前亟需解决的问题.
对于一部分不可手术切除的肝门部胆管癌, 原位肝移植术则可做到根治性切除, 为治愈这类患者带来了新的希望; 但早期由于病例入选条件不恰当导致在术后肿瘤复发率以及生存率上的结果一直难令人满意. 近期相关报道了通过严格的术前评估筛选病例行肝移植术, 其术后肿瘤复发率和生存率均得到较大的改观.
如何合理选择不可手术切除的肝门部胆管癌患者行肝移植术是目前亟需解决的问题, 本文研究结果以及结合相关文献报道, 显示不能外科手术切除且无淋巴结转移的肝门部胆管癌是肝移植术的重要适应证.
本文分析7例不可手术切除的肝门部胆管癌患者行肝移植术, 并结合文献对其临床预后因素、临床结果进行分析, 显示肝移植术适应于不能外科手术切除且无淋巴结转移的肝门部胆管癌患者.
肝门部胆管癌: 又称近端胆管癌或高位胆管癌, 是指发生于胆囊管开口以上肝总管与左右二级肝管起始部之间的肿瘤; 1965年美国Klatskin教授最先描述了此病临床病理特征, 因此又称Klatskin瘤.
本文虽病例数尚少, 且非前瞻性对照研究, 但结果提示对于不能外科手术切除且无淋巴结转移的肝门部胆管癌患者行肝移植术是一种有效的治疗手段. 为进一步研究奠定一定基础.
编辑: 韦元涛 电编:闫晋利
| 1. | Cheng Q, Luo X, Zhang B, Jiang X, Yi B, Wu M. Predictive factors for prognosis of hilar cholangiocarcinoma: postresection radiotherapy improves survival. Eur J Surg Oncol. 2007;33:202-207. [PubMed] [DOI] |
| 2. | Rerknimitr R, Angsuwatcharakon P, Ratanachu-ek T, Khor CJ, Ponnudurai R, Moon JH, Seo DW, Pantongrag-Brown L, Sangchan A, Pisespongsa P. Asia-Pacific consensus recommendations for endoscopic and interventional management of hilar cholangiocarcinoma. J Gastroenterol Hepatol. 2013;28:593-607. [PubMed] [DOI] |
| 3. | Soares KC, Kamel I, Cosgrove DP, Herman JM, Pawlik TM. Hilar cholangiocarcinoma: diagnosis, treatment options, and management. Hepatobiliary Surg Nutr. 2014;3:18-34. [PubMed] [DOI] |
| 4. | Jarnagin WR, Fong Y, DeMatteo RP, Gonen M, Burke EC, Bodniewicz BS J, Youssef BA M, Klimstra D, Blumgart LH. Staging, resectability, and outcome in 225 patients with hilar cholangiocarcinoma. Ann Surg. 2001;234:507-517; discussion 517-519. [PubMed] |
| 5. | Ringe B, Wittekind C, Bechstein WO, Bunzendahl H, Pichlmayr R. The role of liver transplantation in hepatobiliary malignancy. A retrospective analysis of 95 patients with particular regard to tumor stage and recurrence. Ann Surg. 1989;209:88-98. [PubMed] [DOI] |
| 6. | Seehofer D, Kamphues C, Neuhaus P. Management of bile duct tumors. Expert Opin Pharmacother. 2008;9:2843-2856. [PubMed] [DOI] |
| 7. | Robles R, Figueras J, Turrión VS, Margarit C, Moya A, Varo E, Calleja J, Valdivieso A, Garcia-Valdelcasas JC, López P. Liver transplantation for hilar cholangiocarcinoma: Spanish experience. Transplant Proc. 2003;35:1821-1822. [PubMed] [DOI] |
| 8. | Friman S, Foss A, Isoniemi H, Olausson M, Höckerstedt K, Yamamoto S, Karlsen TH, Rizell M, Ericzon BG. Liver transplantation for cholangiocarcinoma: selection is essential for acceptable results. Scand J Gastroenterol. 2011;46:370-375. [PubMed] [DOI] |
| 9. | Robles R, Figueras J, Turrión VS, Margarit C, Moya A, Varo E, Calleja J, Valdivieso A, Valdecasas JC, López P. Spanish experience in liver transplantation for hilar and peripheral cholangiocarcinoma. Ann Surg. 2004;239:265-271. [PubMed] [DOI] |
| 10. | Schüle S, Altendorf-Hofmann A, Uteß F, Rauchfuß F, Freesmeyer M, Knösel T, Dittmar Y, Settmacher U. Liver transplantation for hilar cholangiocarcinoma--a single-centre experience. Langenbecks Arch Surg. 2013;398:71-77. [PubMed] [DOI] |
| 11. | Seehofer D, Thelen A, Neumann UP, Veltzke-Schlieker W, Denecke T, Kamphues C, Pratschke J, Jonas S, Neuhaus P. Extended bile duct resection and [corrected] liver and transplantation in patients with hilar cholangiocarcinoma: long-term results. Liver Transpl. 2009;15:1499-1507. [PubMed] [DOI] |
| 12. | Pichlmayr R, Weimann A, Klempnauer J, Oldhafer KJ, Maschek H, Tusch G, Ringe B. Surgical treatment in proximal bile duct cancer. A single-center experience. Ann Surg. 1996;224:628-638. [PubMed] [DOI] |
| 13. | Hong JC, Jones CM, Duffy JP, Petrowsky H, Farmer DG, French S, Finn R, Durazo FA, Saab S, Tong MJ. Comparative analysis of resection and liver transplantation for intrahepatic and hilar cholangiocarcinoma: a 24-year experience in a single center. Arch Surg. 2011;146:683-689. [PubMed] [DOI] |
| 14. | Heimbach JK, Gores GJ, Haddock MG, Alberts SR, Pedersen R, Kremers W, Nyberg SL, Ishitani MB, Rosen CB. Predictors of disease recurrence following neoadjuvant chemoradiotherapy and liver transplantation for unresectable perihilar cholangiocarcinoma. Transplantation. 2006;82:1703-1707. [PubMed] [DOI] |
| 15. | Rosen CB, Heimbach JK, Gores GJ. Liver transplantation for cholangiocarcinoma. Transpl Int. 2010;23:692-697. [PubMed] [DOI] |