修回日期: 2015-05-14
接受日期: 2015-05-15
在线出版日期: 2015-06-28
目的: 研究肝硬化非肿瘤性门静脉血栓(portal vein thrombosis, PVT)形成患者的临床特点, 分析PVT形成的相关危险因素.
方法: 回顾性分析昆明医科大学第二附属医院肝病中心2013-09/2014-12资料完整的肝硬化住院患者171例, 其中34例肝硬化合并PVT患者作为门静脉血栓组(PVT组), 137例肝硬化无血栓患者作为对照组. 记录患者临床指标, 进行单因素分析和Logistic回归筛选出PVT的独立危险因素. 绘制受试者工作曲线(receiver operating characteristic, ROC), 计算曲线下面积(area under the curve, AUC), 以判断各指标的诊断效能.
结果: Logistic回归模型分析显示D-二聚体(D-dimer, DD)(OR = 12.021, P = 0.001)、门静脉宽度(OR = 28.574, P = 0.001)、门静脉血流速度(OR = 19.568, P = 0.002)差异有统计学意义, 绘制ROC, 门静脉血流速度AUC<0.5, 不能用于预测. DD、门静脉宽度AUV分别为0.669、0.742, P<0.05.
结论: 门静脉宽度、DD是肝硬化PVT形成的危险因素, 门静脉直径越大, DD值越高, PVT形成的风险越高. 门静脉宽度>1.3 cm或DD>25 μg/mL时, 预测发生PVT的敏感性及特异度综合较好. 肝硬化患者应注意监测门静脉宽度、DD水平.
核心提示: 本文收集肝硬化合并门静脉血栓形成(portal vein thrombosis, PVT)及未合并PVT患者的实验室数据及影像学指标, 进行单因素及多因素统计学分析, 绘制受试者工作曲线评价指标的诊断效能.
引文著录: 周佳, 杨晋辉. 肝硬化非肿瘤性门静脉血栓形成的危险因素. 世界华人消化杂志 2015; 23(18): 2886-2893
Revised: May 14, 2015
Accepted: May 15, 2015
Published online: June 28, 2015
AIM: To identify the risk factors for nontumoral portal vein thrombosis (PVT) in patients with liver cirrhosis, and analyze the risk factors influencing the origin of PVT.
METHODS: We performed a retrospective study of 171 cirrhotic patients who were diagnosed with the disease at our hospital between September 2013 and December 2014. CT and color Doppler ultrasound were used to diagnose PVT. Of the patients included, 34 had PVT (experiment group), and 137 had not (control group). We collected the clinical features and laboratory indexes of the two groups. Logistic regression model (Wald test) was used to screen independent risk factors. The diagnostic performance of each risk factor was determined by plotting the ROC curve and determining the optimal threshold.
RESULTS: D-dimer (DD) (OR = 12.021, P = 0.001), width of main portal vein (OR = 28.574, P = 0.001), and portal vein velocity flow (OR = 19.568, P = 0.002) differed statistically between the two groups. Unconditional Logistic regression analysis indicated that DD and width of main portal vein were independent risk factors for PVT in cirrhosis patients, and their area under the curve was 0.669 and 0.742, respectively.
CONCLUSION: Width of main portal vein and DD are independent risk factors for PVT in cirrhosis patients. Wider diameter of main portal vein and higher DD are associated with a higher incidence of PVT.
- Citation: Zhou J, Yang JH. Risk factors for nontumoral portal vein thrombosis in patients with liver cirrhosis. Shijie Huaren Xiaohua Zazhi 2015; 23(18): 2886-2893
- URL: https://www.wjgnet.com/1009-3079/full/v23/i18/2886.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i18.2886
门静脉血栓形成(portal vein thrombosis, PVT)是发生在门静脉系统, 包括门静脉主干及分支、肠系膜上下静脉和脾静脉的深部血管阻塞性疾病. PVT是肝硬化常见的并发症, 尤其在肝硬化失代偿阶段[1-4]. PVT的发病率随肝硬化的进展而增高[5,6], 在肝硬化代偿期患者, 发病率约为1%, 在等待肝移植的患者中上升至8%-25%[7]. PVT起病隐匿, 临床上可造成门静脉阻塞, 引起门静脉压力增高、肠管淤血, 是导致肝前性门脉高压的一个重要病因. 由于目前对于肝硬化PVT的治疗没有指南或共识意见, 而PVT影响肝硬化患者的预后[8-10]. 如何早期预测PVT尤为重要, 因此, 本文对肝硬化患者非肿瘤性PVT形成的危险因素进行分析, 希望筛选出可能预测PVT的因素, 进而能早期进行干预.
回顾性分析昆明医科大学第二附属医院肝病中心2013-09/2014-12资料完整的肝硬化住院患者171例, 依据彩色多普勒超声及多排螺旋计算机断层扫描(computed tomography, CT)门脉血管成像诊断PVT. 其中34例肝硬化合并PVT患者作为血栓组(PVT组), 137例肝硬化无血栓患者作为对照组. 所有患者均根据临床、生化、影像学检查或组织学检查结果诊断为肝硬化. 诊断标准均符合2000年病毒性肝炎诊断标准和2006年酒精性肝病诊断标准[11,12].
排除标准: 肝硬化合并肝癌、胃癌、胰腺癌等其他恶性肿瘤; 肝硬化合并系统性红斑狼疮、克罗恩病、溃疡性结肠炎等炎性疾病; 肝硬化合并血液系统疾病; 既往长期服用避孕药、抗凝药、抗血小板聚集药物史; 非肝脏疾病继发的PVT形成; 布-加氏综合征、门静脉畸形等导致门静脉血流速度减慢的疾病等.
记录患者性别、年龄、肝硬化病因、彩色多普勒超声检查门静脉宽度、门静脉血流速度, 并进行实验室检查, 包括血常规、生化、凝血功能、血浆D-二聚体(D-dimer, DD)、抗凝血酶原-Ⅲ(antithrombin-Ⅲ, AT-Ⅲ), 计算终末期肝病模型(Model for End-stage Liver disease, MELD)评分.
统计学处理 采用SPSS20.0软件处理数据, 正态分布计量资料采用mean±SD表示, 偏态分布计量资料以范围表示, 组间资料比较服从正态分布者采用t检验, 不服从正态分布的资料采用秩和检验; 计数资料采用χ2检验(P<0.05为差异有统计学意义). 采用多因素非条件Logistic回归模型筛选出相应的危险因素(OR值>1, 说明该危险因素暴露时增加疾病发生分风险, 危险因素每增加1个单位其形成PVT的危险性增加OR倍), 并进行Wald检验(P<0.05为差异有统计学意义). 绘制受试者工作曲线(receiver operating characteristic, ROC), 计算曲线下面积(area under the curve, AUC), 以判断各指标的诊断效能, 显示各因素诊断价值. ROC曲线下面积取值范围在0.5-1.0, 一般来说, ROC曲线下面积在0.5-0.7表示诊断价值较低, 在0.7-0.9表示诊断价值中等, 0.9以上表示诊断价值较高[13].
血栓组男25例, 女9例, 平均年龄56.12岁±11.89岁; 对照组男90例, 女47例, 平均年龄52.77岁±12.62岁, 经SPSS统计分析(χ2, 两独立样本t检验), 两组样本性别比例、年龄差异均无统计学意义(P>0.05)(表1).
| 指标 | 分组 | χ2/t 值 | P值 | |
| PTV组 | 对照组 | |||
| 性别 | χ2 = 0.759 | 0.384 | ||
| 男 | 25 | 90 | ||
| 女 | 9 | 47 | ||
| 年龄(岁) | 56.12±11.89 | 52.77±12.62 | t = -1.398 | 0.164 |
血栓组病因: 病毒性15例(其中乙型肝炎12例, 丙型肝炎3例); 酒精性5例; 自身免疫性1例, 原因未明13例. 对照组病因: 病毒性69例(其中乙型肝炎58例, 丙型肝炎11例), 酒精性17例, 自身免疫性22例, 原因未明28例, 肝豆状核变性1例. 经SPSS统计分析(Fisher确切概率法), 两组样本病因差异无统计学意义(P = 0.131).
2.3 两组样本MELD、门静脉宽度、门静脉血流速度比较 经SPSS统计分析(正态性检验), 样本MELD、门静脉宽度、门静脉血流速度均为非正态分布, 故采用秩和检验进行统计分析. 经SPSS统计分析(秩和检验), 两组样本MELD差异无统计学意义(P>0.05); 两组样本门静脉宽度、门静脉血流速度差异有统计学意义(P<0.05)(表2).
| 指标 | 分组M(P75-P25) | Z值 | P值 | |
| PTV组 | 对照组 | |||
| MELD | 9.74(7.84) | 10.04(7.63) | -0.364 | 0.716 |
| 门静脉宽度 | 1.33(0.30) | 1.40(0.27) | -3.469 | 0.001 |
| 门静脉血流速度 | 14.96(2.60) | 14.96(2.40) | -3.469 | 0.001 |
经SPSS统计分析(正态性检验), 样本白蛋白(albumin, ALB)、总胆红素(total bilirubin, TBIL)、直接胆红素(direct bilirubin, DBIL)、间接胆红素(indirect bilirubin, IBIL)、甘油三酯(triglyceride, TG)、总胆固醇(total cholesterol, TCHOL)、肌酐(serum creatinie, Scr)、钠(natrium, NA)、凝血酶原时间(prothrombin time, PT)、国际标准化比值(international normalized ratio, INR)、活化部分凝血活酶时间(activatied partial prothrombin time, APTT)、纤维蛋白原(fibrinogen, FIB)、DD、AT-Ⅲ、血小板(platelet, PLT)、红细胞(red blood cell, RBC)、白细胞(white blood cell, WBC)均为非正态分布, 故采用秩和检验进行统计分析. 经SPSS统计分析(秩和检验), 两组样本APTT、DD差异有统计学意义(P<0.05); 其余指标差异均无统计学意义(P>0.05)(表3).
| 项目 | PTV组 | 对照组 | P值 |
| ALB | 27.90(7.63) | 28.20(11.05) | 0.333 |
| TBIL | 25.35(23.52) | 30.70(44.15) | 0.096 |
| DBIL | 12.05(10.37) | 13.80(28.70) | 0.369 |
| IBIL | 11.00(9.15) | 16.10(15.10) | 0.068 |
| TG | 0.86(0.54) | 0.88(0.61) | 0.393 |
| TCHOL | 2.58(1.57) | 3.30(1.55) | 0.084 |
| Scr | 71.00(36.00) | 67.00(27.50) | 0.315 |
| NA | 136.50(5.85) | 138.20(4.75) | 0.215 |
| PT | 19.15(4.48) | 18.80(5.20) | 0.818 |
| INR | 1.55(0.42) | 1.52(0.47) | 0.836 |
| APTT | 30.35(6.68) | 32.40(6.00) | 0.006 |
| FIB | 2.09(0.89) | 2.34(1.21) | 0.656 |
| DD | 5.05(8.53) | 4.50(4.17) | 0.043 |
| AT-Ⅲ | 65.12(21.97) | 66.63(25.95) | 0.774 |
| PLT | 65.00(77.75) | 75.00(64.00) | 0.443 |
| RBC | 3.23(1.26) | 3.64(1.35) | 0.079 |
| WBC | 3.52(5.45) | 4.15(2.87) | 0.286 |
经SPSS统计分析(二分类多因素非条件Logistics回归), 对可能影响PVT的一些相关因素进行自变量的筛选(Backward Stepwise): 最终只有INR、FIB、DD、门静脉宽度、门静脉血流速度被留在模型中; 经二分类多因素非条件Logistics分析, DD、门静脉宽度、门静脉血流速度回归分析, 差异有统计学意义(P<0.05), 说明回归模型成立, DD、门静脉宽度、门静脉血流速度为PVT发生的危险因素(P<0.05, OR>1), 即DD每增加一个单位, 患PVT的可能性就增加12.021倍; 门静脉宽度每增加一个单位, 患PVT的可能性就增加28.574倍; 门静脉血流速度每增加一个单位, 患PVT的可能性就增加19.568倍(表4).
| 变量 | B值 | Wald值 | P值 | OR值 | 95%CI | |
| Lower | Upper | |||||
| INR | -1.666 | 3.651 | 0.056 | 0.189 | 0.034 | 1.044 |
| FIB | 0.414 | 2.909 | 0.088 | 1.513 | 0.940 | 2.435 |
| DD | 3.112 | 6.884 | 0.001 | 12.021 | 1.568 | 19.995 |
| 门静脉宽度 | 3.352 | 11.664 | 0.001 | 28.574 | 4.173 | 195.665 |
| 门静脉血流速度 | 2.116 | 9.778 | 0.002 | 19.568 | 8.632 | 26.785 |
| Constant | -1.100 | 0.205 | 0.651 | 0.333 | ||
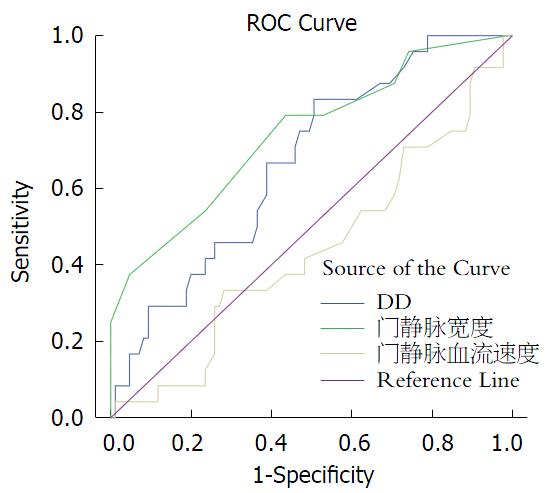
经SPSS结果显示: 门静脉血流速度AUV = 0.438, 不能用其预测. 诊断价值: 门静脉宽度>DD, AUV = 0.742, 0.669, P<0.05(表5, 图1). 通过曲线坐标表(表6)计算, 我们可以得出门静脉宽度为1.3 cm, DD为25 μg/mL, 预测发生PTV的敏感性及特异度综合较好.
| Test Result Variable(s) | Positive if Greater Thanor Equal To1 | Sensitivity | 1-Specificity | Specificity | Youden index |
| DD | 35 | 1.000 | 1.000 | 0.000 | 0.000 |
| 34 | 1.000 | 1.000 | 0.000 | 0.000 | |
| 32 | 0.981 | 0.789 | 0.211 | 0.192 | |
| 30 | 0.974 | 0.744 | 0.256 | 0.230 | |
| 8 | 0.815 | 0.539 | 0.461 | 0.276 | |
| 25 | 0.859 | 0.541 | 0.459 | 0.318 | |
| 20 | 0.642 | 0.391 | 0.609 | 0.251 | |
| 15 | 0.378 | 0.242 | 0.758 | 0.136 | |
| 10 | 0.268 | 0.097 | 0.903 | 0.171 | |
| 8 | 0.205 | 0.012 | 0.988 | 0.193 | |
| 6 | 0.138 | 0.003 | 0.997 | 0.135 | |
| 4 | 0.116 | 0.006 | 0.994 | 0.110 | |
| 2 | 0.048 | 0.002 | 0.998 | 0.046 | |
| 1 | 0.021 | 0.000 | 1.000 | 0.021 | |
| 0.5 | 0.000 | 0.000 | 1.000 | 0.000 | |
| 门静脉宽度 | 0.85 | 1.000 | 1.000 | 0.000 | 0.000 |
| 0.95 | 1.000 | 0.985 | 0.015 | 0.015 | |
| 1.05 | 0.971 | 0.796 | 0.204 | 0.175 | |
| 1.15 | 0.912 | 0.745 | 0.255 | 0.167 | |
| 1.25 | 0.853 | 0.618 | 0.382 | 0.235 | |
| 1.30 | 0.853 | 0.538 | 0.462 | 0.315 | |
| 1.35 | 0.647 | 0.394 | 0.606 | 0.253 | |
| 1.45 | 0.382 | 0.219 | 0.781 | 0.163 | |
| 1.55 | 0.265 | 0.066 | 0.934 | 0.199 | |
| 1.65 | 0.176 | 0.015 | 0.985 | 0.161 | |
| 1.75 | 0.147 | 0.015 | 0.985 | 0.132 | |
| 1.95 | 0.118 | 0.004 | 0.996 | 0.114 | |
| 2.15 | 0.059 | 0.003 | 0.997 | 0.056 | |
| 2.35 | 0.029 | 0.002 | 0.998 | 0.027 | |
| 3.45 | 0.000 | 0.000 | 1.000 | 0.000 |
肝硬化PVT形成是肝硬化的一种严重并发症. 1868年Balfour和Stewart报道了首例肝硬化PVT形成, 患者表现为脾大、腹水和食道静脉曲张等严重并发症. PVT形成后进一步提高门静脉压力, 并增加上消化道出血及肠梗死的风险, 对患者的预后及生存质量有明显的影响[14-17].
PVT常常没有临床症状, 因此其发病率被低估. 当肝硬化出现顽固性腹水及上消化道出血等失代偿期症状时, 应考虑是否合并PVT形成, 并进行进一步检查[18,19]. 近年来随着临床医师对肝硬化PVT的认识逐渐加深, 以及影像学技术的发展, PVT的检出率也在升高. 然而, 对本病的病因及治疗没有大规模的前瞻性研究或共识意见. 因此寻找肝硬化PVT形成的危险因素, 有助于引起临床医师及患者的重视, 早期发现, 早期干预, 从而提高患者的生活质量及延长患者的生存期.
本次研究中发现在单因素分析中, 肝硬化合并PVT组与对照组比较, 门静脉宽度、门静脉血流速度、APTT、DD差异有统计学意义. 对可能影响PVT的一些相关因素进行自变量的筛选(Backward Stepwise): 最终只有INR、FIB、DD、门静脉宽度、门静脉血流速度被留在模型中; 经二分类多因素非条件Logistics分析, DD、门静脉宽度回归分析, 差异有统计学意义(P<0.05).
Zocco等[20]的研究中, 门静脉血流速度<15 cm/s的肝硬化患者PVT发生率比对照组高(OR = 44.9, 95%CI: 5.3-382.7;P<0.001), 结论是门静脉血流速度减少是PVT形成的重要预测变量. Maruyama等[21]的研究也指出, 对于病毒性肝硬化, 侧支血管的发展减少了门静脉主干的血流速度, 是PVT发生的重要预测因素. 本研究中门静脉血流速度两组差异有统计学意义(P值为0.001), 并进入Logistic回归方程, 但绘制ROC曲线, 计算AUV = 0.438, 不能用其预测. 考虑可能与血栓组样本量较小有关.
多因素非条件Logistic回归分析显示门静脉宽度回归分析差异有统计学意义(P<0.05), 说明回归模型成立, 门静脉宽度为PVT发生的危险因素(P值为0.001, OR值为28.574), 即门静脉宽度每增加一个单位, 患PVT的可能性就增加28.574倍.
肝硬化患者失代偿期存在门脉高压, 门静脉系统向肝血流受阻, 血管直径变宽, 变化的先后次序为门静脉、脾静脉和肠系膜上静脉. 刘元水等[22]的研究表明, 肝硬化导致的门静脉高压与门静脉直径正相关, 朱为群等[23]的研究也表明门静脉直径与门静脉压有良好正相关, 门静脉直径是评价门脉高压的敏感指标. 门静脉直径增宽后, 门静脉血流迟缓、瘀滞、涡流形成, 血流缓慢后易形成血栓. 随着病情的进展, 门静脉阻力和侧支循环的增加, 门静脉血流速度较前降低, 有可能出现逆向血流. 门静脉高压导致门静脉血流动力学变化, 血流量有一个增多、瘀滞、减少到逆向的变化过程[24]. 血流动力学的变化使门静脉内膜受损, 胶原暴露, 启动凝血机制, 促进血栓形成. PVT形成后, 特别是血栓位于门静脉主干, 门静脉相对狭窄, 血流瘀滞导致门静脉压力进一步升高, 门静脉主干直径相应增宽, PVT易形成, 而PVT形成后又加重门静脉压力, 并形成恶性循环.
血浆DD是纤维蛋白的特异性降解产物, 在正常人血液监测中水平很低. 在凝血过程中, 纤维蛋白原被凝血酶水解后, 逐步释放出纤维蛋白肽A和纤维蛋白肽B, 剩余部分为可溶性纤维蛋白单体. 在转酰胺酶的作用下, 可溶的纤维蛋白单体转为纤维蛋白, 从而引起血液凝固. 形成的纤维蛋白能够被纤溶酶降解, 生成多种多聚体, DD为其中的一种产物. 其水平升高表明体内纤维蛋白血栓形成和继发纤溶发生. 目前DD主要用于弥散性血管内凝血的诊断及静脉血栓性疾病的排除诊断, 包括深静脉血栓及肺栓塞[25-27]. 近年来很多学者[28-31]发现肝硬化PVT患者血浆DD水平升高, DD是PVT形成的危险因素. 本研究中血浆DD与对照组比较差异有统计学意义, 二分类多因素非条件Logistics分析, DD每增加一个单位, 患PVT的可能性就增加12.021倍. 通过计算, DD为25 μg/mL, 预测发生PTV的敏感性及特异度综合较好.
总之, 门静脉宽度是肝硬化PVT形成的危险因素, 门静脉直径越大, DD越高, PVT形成的风险越高, 门静脉宽度每增加一个单位, 患PVT的可能性就增加28.574倍. 门静脉宽度为1.3 cm时, 预测发生PTV的敏感性及特异度综合较好. DD每增加一个单位, 患PVT的可能性就增加12.021倍. DD为25 μg/mL, 预测发生PTV的敏感性及特异度综合较好. 临床工作中, 当发现肝硬化患者门静脉宽度>1.3 cm或DD>25 μg/mL时, 应告知患者定期随访的必要性, 腹部彩超显示近端肝内门静脉消失, 门脉血流为持续性而不随呼吸变化时, 可行腹部CT门脉血管成像或血管造影, 早期发现PTV形成, 并进行早期治疗, 改善患者的预后.
门静脉血栓形成(portal vein thrombosis, PVT)是发生在门静脉系统, 包括门静脉主干及分支、肠系膜上下静脉和脾静脉的深部血管阻塞性疾病. PVT是肝硬化常见的并发症, 尤其在肝硬化失代偿阶段. PVT影响肝硬化患者的预后. 因此, 早期诊断具有重要意义.
黄颖秋, 教授, 本溪钢铁(集团)总医院消化内科
血栓性疾病的发病机制分3个方面: 血流动力学改变、血管壁破坏、抗凝与促凝作用失衡-倾向于促凝方面, 导致血液呈高凝状态. 国外学者Saugel与Amitrano研究了血栓形成倾向中的遗传性危险因素, 国内很多学者研究临床可测到的指标与血栓形成的关系.
国内外多名学者均为收集实验室及影像学数据进行统计学分析. Zocco等研究后指出门静脉血流速度是肝硬化PVT形成的重要预测变量, 国内学者Chen等报道脾脏肿大是肝硬化PVT形成的危险因素. 张冬磊等学者研究报道血浆D-二聚体升高是肝硬化PVT形成的危险因素. 由于数据收集方法等的不同, 得出的结论没有一致意见.
本文对昆明医科大学第二附属医院肝胆胰内科对于肝硬化患者常检测的指标进行统计学分析, 初步探讨了肝硬化非肿瘤性PVT形成的危险因素, 对临床工作有一定参考价值.
本文初步探讨了肝硬化非肿瘤性PVT形成的危险因素, 对临床工作有一定参考价值.
编辑: 韦元涛 电编:闫晋利
| 1. | Ponziani FR, Zocco MA, Garcovich M, D'Aversa F, Roccarina D, Gasbarrini A. What we should know about portal vein thrombosis in cirrhotic patients: a changing perspective. World J Gastroenterol. 2012;18:5014-5020. [PubMed] [DOI] |
| 2. | Mangia A, Villani MR, Cappucci G, Santoro R, Ricciardi R, Facciorusso D, Leandro G, Caruso N, Andriulli A. Causes of portal venous thrombosis in cirrhotic patients: the role of genetic and acquired factors. Eur J Gastroenterol Hepatol. 2005;17:745-751. [PubMed] |
| 3. | Ogren M, Bergqvist D, Björck M, Acosta S, Eriksson H, Sternby NH. Portal vein thrombosis: prevalence, patient characteristics and lifetime risk: a population study based on 23,796 consecutive autopsies. World J Gastroenterol. 2006;12:2115-2119. [PubMed] |
| 4. | Fimognari FL, Violi F. Portal vein thrombosis in liver cirrhosis. Intern Emerg Med. 2008;3:213-218. [PubMed] [DOI] |
| 5. | Nery F, Chevret S, Condat B, de Raucourt E, Boudaoud L, Rautou PE, Plessier A, Roulot D, Chaffaut C, Bourcier V. Causes and consequences of portal vein thrombosis in 1,243 patients with cirrhosis: results of a longitudinal study. Hepatology. 2015;61:660-667. [PubMed] [DOI] |
| 6. | John BV, Konjeti R, Aggarwal A, Lopez R, Atreja A, Miller C, Zein NN, Carey WD. Impact of untreated portal vein thrombosis on pre and post liver transplant outcomes in cirrhosis. Ann Hepatol. 2013;12:952-958. [PubMed] |
| 7. | Francoz C, Belghiti J, Vilgrain V, Sommacale D, Paradis V, Condat B, Denninger MH, Sauvanet A, Valla D, Durand F. Splanchnic vein thrombosis in candidates for liver transplantation: usefulness of screening and anticoagulation. Gut. 2005;54:691-697. [PubMed] [DOI] |
| 8. | Amitrano L, Guardascione MA, Scaglione M, Menchise A, Martino R, Manguso F, Lanza AG, Lampasi F. Splanchnic vein thrombosis and variceal rebleeding in patients with cirrhosis. Eur J Gastroenterol Hepatol. 2012;24:1381-1385. [PubMed] [DOI] |
| 9. | Rodríguez-Castro KI, Porte RJ, Nadal E, Germani G, Burra P, Senzolo M. Management of nonneoplastic portal vein thrombosis in the setting of liver transplantation: a systematic review. Transplantation. 2012;94:1145-1153. [PubMed] [DOI] |
| 10. | Senzolo M. Liver: PVT in cirrhosis, not always an innocent bystander. Nat Rev Gastroenterol Hepatol. 2015;12:11-13. [PubMed] [DOI] |
| 13. | Amitrano L, Brancaccio V, Guardascione MA, Margaglione M, Iannaccone L, D'Andrea G, Marmo R, Ames PR, Balzano A. Inherited coagulation disorders in cirrhotic patients with portal vein thrombosis. Hepatology. 2000;31:345-348. [PubMed] [DOI] |
| 14. | D'Amico G, De Franchis R. Upper digestive bleeding in cirrhosis. Post-therapeutic outcome and prognostic indicators. Hepatology. 2003;38:599-612. [PubMed] [DOI] |
| 15. | Girleanu I, Stanciu C, Cojocariu C, Boiculese L, Singeap AM, Trifan A. Natural course of nonmalignant partial portal vein thrombosis in cirrhotic patients. Saudi J Gastroenterol. 2014;20:288-292. [PubMed] [DOI] |
| 16. | Tsochatzis EA, Senzolo M, Germani G, Gatt A, Burroughs AK. Systematic review: portal vein thrombosis in cirrhosis. Aliment Pharmacol Ther. 2010;31:366-374. [PubMed] [DOI] |
| 17. | Qi X, Dai J, Yang M, Ren W, Jia J, Guo X. Association between Portal Vein Thrombosis and Survival in Non-Liver-Transplant Patients with Liver Cirrhosis: A Systematic Review of the Literature. Gastroenterol Res Pract. 2015;2015:480842. [PubMed] [DOI] |
| 18. | Bayraktar Y, Harmanci O. Etiology and consequences of thrombosis in abdominal vessels. World J Gastroenterol. 2006;12:1165-1174. [PubMed] |
| 19. | Berry K, Taylor J, Liou IW, Ioannou GN. Portal vein thrombosis is not associated with increased mortality among patients with cirrhosis. Clin Gastroenterol Hepatol. 2015;13:585-593. [PubMed] [DOI] |
| 20. | Zocco MA, Di Stasio E, De Cristofaro R, Novi M, Ainora ME, Ponziani F, Riccardi L, Lancellotti S, Santoliquido A, Flore R. Thrombotic risk factors in patients with liver cirrhosis: correlation with MELD scoring system and portal vein thrombosis development. J Hepatol. 2009;51:682-689. [PubMed] [DOI] |
| 21. | Maruyama H, Okugawa H, Takahashi M, Yokosuka O. De novo portal vein thrombosis in virus-related cirrhosis: predictive factors and long-term outcomes. Am J Gastroenterol. 2013;108:568-574. [PubMed] [DOI] |
| 23. | 朱 为群, 张 辉, 尹 炽标, 冼 建中, 李 玉娥, 邝 伟明, 张 舒眉. 肝硬化门静脉高压症患者门静脉最大血流速度、平均血流速度和门静脉直径与自由门静脉压力相关性的研究. 中华普通外科杂志. 2003;18:54-55. |
| 24. | Kawasaki T, Moriyasu F, Nishida O, Ban N, Nakamura T, Tamada T, Kimura T, Yamashita Y, Ono S, Uchino H. Analysis of hepatofugal flow in portal venous system using ultrasonic Doppler duplex system. Am J Gastroenterol. 1989;84:937-941. [PubMed] |
| 25. | Anderson DR, Wells PS, Stiell I, MacLeod B, Simms M, Gray L, Robinson KS, Bormanis J, Mitchell M, Lewandowski B. Management of patients with suspected deep vein thrombosis in the emergency department: combining use of a clinical diagnosis model with D-dimer testing. J Emerg Med. 2000;19:225-230. [PubMed] |
| 26. | Wells PS, Anderson DR, Rodger M, Forgie M, Kearon C, Dreyer J, Kovacs G, Mitchell M, Lewandowski B, Kovacs MJ. Evaluation of D-dimer in the diagnosis of suspected deep-vein thrombosis. N Engl J Med. 2003;349:1227-1235. [PubMed] [DOI] |
| 27. | Anderson DR, Kovacs MJ, Kovacs G, Stiell I, Mitchell M, Khoury V, Dryer J, Ward J, Wells PS. Combined use of clinical assessment and d-dimer to improve the management of patients presenting to the emergency department with suspected deep vein thrombosis (the EDITED Study). J Thromb Haemost. 2003;1:645-651. [PubMed] |
| 29. | Zhang DL, Hao JY, Yang N. Value of D-dimer and protein S for diagnosis of portal vein thrombosis in patients with liver cirrhosis. J Int Med Res. 2013;41:664-672. [PubMed] [DOI] |