修回日期: 2015-03-06
接受日期: 2015-03-18
在线出版日期: 2015-05-18
目的: 采用循证医学的方法评估糖链抗原242(carbohydrate antigen 242, CA242)在诊断胰腺癌(pancreatic cancer, PC)诊断价值和诊断效能.
方法: 计算机检索2014-12-31之前在PubMed、Embase、Web of science、Cochrane协作网数据库、中国知网、谷歌学术搜索、万方及维普数据库公开发表的文献, 并手工检索国内相关医学杂志. 按照已定的纳入排除标准结果收集CA242诊断PC的研究文献, 采用QUADAS量表进行严格的文献质量评价, 利用Meta-Disc 1.4统计软件进行异质性分析和定量合成, 并绘制SROC曲线, 计算相应验后合并灵敏度和特异度.
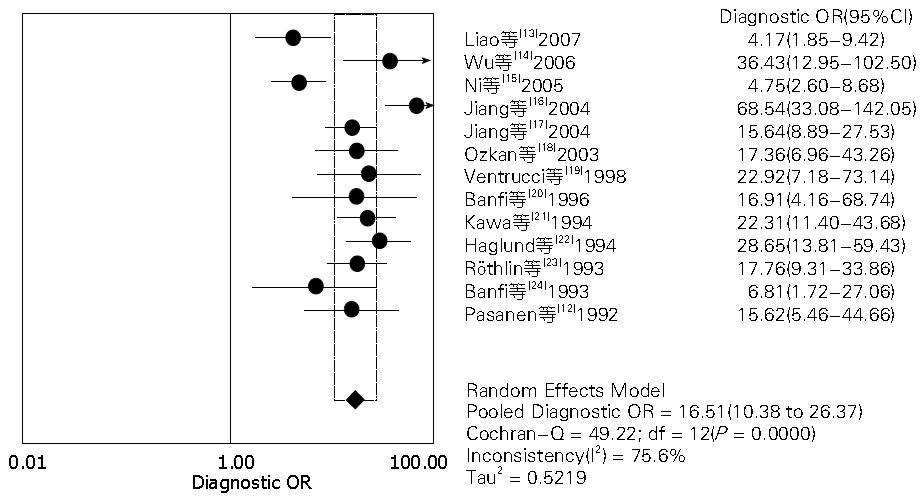
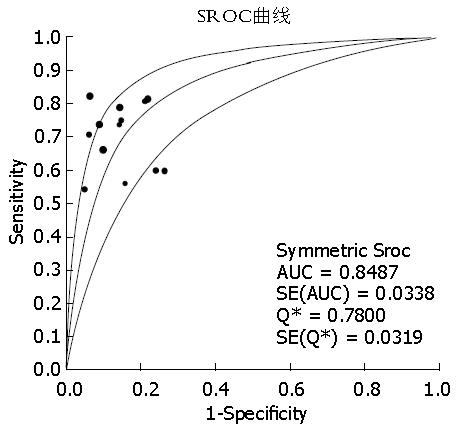
结果: 共纳入13篇英文文献, Meta分析表明: CA242诊断PC的合并灵敏度为71%(95%CI: 69%-74%)、合并特异度为87%(95%CI: 85%-88%)、合并诊断比值比(diagnostic odds ratio, DOR)为16.51(95%CI: 10.38-26.37)、阳性似然比(+LR)为5.26(95%CI: 3.87-7.14)、阴性似然比(-LR)为0.34(95%CI: 0.28-0.42)、SROC曲线下面积为0.8487.
结论: CA242在诊断PC诊断效能较CA19-9高, 漏诊率和误诊率较低, 可以作为筛选、诊断PC和评估预后的实验室指标, 值得临床推广.
核心提示: 糖链抗原242(carbohydrate antigen 242, CA242)可以作为常见的胰腺癌(pancreatic cancer, PC)的临床肿瘤标志物, 与CA19-9互为补充, 增加PC的诊断率, 提高预后.
引文著录: 张建忠, 谢生智, 陈海英. 血清糖链抗原242诊断胰腺癌价值的系统评价. 世界华人消化杂志 2015; 23(14): 2310-2317
Revised: March 6, 2015
Accepted: March 18, 2015
Published online: May 18, 2015
AIM: To assess the value of carbohydrate antigen (CA) 242 in the diagnosis of pancreatic cancer (PC) to provide the best evidence to clinical decision-making.
METHODS: Medline, EMBASE, Science Direct, Springer link, CBM, CNKI, Wan fang and VIP database were searched by computer before December 31, 2014 to collect the articles assessing the diagnostic value of CA242 in pancreatic cancer. Quality assessment was performed using the QUADAS scale. Meta-Disc 1.4 software was used to analyze the heterogeneity of the included articles, plot the SROC curve, and calculate the pooled sensitivity and specificity.
RESULTS: A total of 13 English articles were included. The summary sensitivity of CA242 in diagnosing pancreatic cancer was 71% (95%CI: 69%-74%), the summary specificity was 87% (95%CI: 85%-88%), the diagnostic odds ratio (DOR) was 16.51 (95%CI: 10.38-26.37), the positive likelihood ratio was 5.26 (95%CI: 3.87-7.14), the negative likelihood ratio was 0.34 (95%CI: 0.28-0.42), and the area under the SROC curve was 0.8487.
CONCLUSION: Serum CA242 has higher value in diagnosing pancreatic cancer than CA19-9, and it can be used as an diagnostic marker for pancreatic cancer.
- Citation: Zhang JZ, Xie SZ, Chen HY. Value of carbohydrate antigen 242 in diagnosis of pancreatic cancer: A systemic review and meta-analysis. Shijie Huaren Xiaohua Zazhi 2015; 23(14): 2310-2317
- URL: https://www.wjgnet.com/1009-3079/full/v23/i14/2310.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i14.2310
胰腺癌(pancreatic cancer, PC)是临床上常见的恶性肿瘤之一, 其发病率较低, 预后较差, 因此相关文献显示在发达国家中PC患者的病死率为居常见消化系肿瘤(肝癌、胃癌等)的第4-5位[1], 全世界每年新发PC患者约有250000例, 统计显示PC的年发病率与病死率相当(发病率0.039‰, 病死率0.037‰)[2]. PC高死亡率的主要原因是: 早期难以诊断、治疗方法比较局限、术后易复发等, PC被诊断时多已发生转移或局部已转变为进展期, 此时无法行外科手术治疗[3,4]. 因此, 提高PC早期诊断率, 及早干预PC的病程, 对降低PC的病死率、提高预后至关重要.
血清肿瘤标志物由于其具有简便、快捷等特点, 因为被广泛应用于PC的早期诊断[5]. 已有研究[6-8]表明: 糖链抗原19-9(carbohydrate antigen 19-9, CA19-9)、CA50、肿瘤特异性生长因子(tumor supplied group of factors, TSGF)、癌胚抗原(carcinoembryonic antigen, CEA)等相关血清学肿瘤标志物在PC的诊断中有着重要意义. 但是由于这些肿瘤指标的特异性和灵敏度较低, 诊断价值有限[9]. 理想的肿瘤标志物应具有灵敏度和特异性高, 并且能诊断和预测预后. 目前尚未发现理想的肿瘤标志物. CA242是由Lindholm等[10]在1985年第1次从人类腺癌COLO 205细胞免疫的小鼠融合SP2/0鼠骨髓瘤细胞分离出的一种新型肿瘤标志物. CA242是一种黏蛋白类糖抗原, 在正常人体中表达甚微, 在恶性肿瘤患者体内血清中含量明显升高[7]. 因此可作为辅助诊断恶性肿瘤特别是PC的早期血清学指标, 但是目前国内关于CA242诊断PC的诊断价值的研究较多, 相互之间有较大的争议, 目前尚无文献系统性的探讨CA242诊断PC的诊断价值, 为了进一步明确CA242在诊断PC的诊断价值, 本文拟采用循征医学方法对CA242和CA19-9在诊断PC的诊断价值进行系统评价.
检索策略的制定根据Cochrane协作网诊断试验协作组的Cochrane手册, 检索式为: ("CA242 OR carbohydrate antigen 242")、("pancreatic carcinoma OR pancreatic cancer OR carcinoma of pancreas OR pancreatic tumor"), 中文检索式为: "糖链抗原242"、"CA242"、"胰腺癌"、"诊断价值". 检索PubMed、Embase、Web of Science、Cochrane协作网数据库、中国知网、谷歌学术搜索、万方及维普数据库公开发表的文献. 所检索文献的最终截止时间为2014-12-31. 所检索的语言限制仅限于英文文献.
1.2.1 纳入标准: (1)文献检索截止时间: 2014-12-31之前公开发表的英文文献; (2)随机或者非随机研究, 其中包括前瞻性及回顾性诊断试验, 样本量需>15例; (3)所有纳入的研究中应交代血清CA242的检测方法和/或CA242诊断PC的最佳的cut-off值; (4)纳入研究对象: 包括金标准(病理学检查)诊断为PC的有病组和金标准诊断为无PC的无病组, 无病组可为胰腺炎、良性胰腺疾病、其他恶性疾病或健康者, 各组均需有完整的数据; (5)文献中的原始数据应该完整, 交代病例的纳入及排除标准, 能进行统计学处理, 得出诊断价值或者可以计算出的所有指标(真阳性、假阳性、假阴性、真阴性).
1.2.2 排除标准: (1)文献的全文为非英文, 但摘要为英文不予以纳入; (2)文献中对于设计方法学不明确或未交代的研究不予以纳入; (3)对于重复发表或者不同研究重复利用相同数据的研究取其中之一; (4)无法获得相关诊断试验数据的研究不予以纳入.
1.2.3 文献筛选以及资料提取: 两位研究者(张、谢)独立阅读文献标题及摘要, 严格按照既定的纳入排除标准进行文献的筛选和取舍, 筛选过程中采用盲法, 当对于阅读文献的选择有争议时, 经讨论或者第三研究者决定. 制定文献资料筛选表, 其中包括: 纳入研究第一作者及发表时间、国家、CA242检测方法、纳入研究病例数、诊断试验诊断指标. 所有数据至少复核3次.
1.2.4 文献质量评估: 根据Whiting等[11]制订的诊断性试验准确性质量评价工具(quality assessment of diagnostic accuracy studies, QUADAS)质量标准对已纳入文献进行质量评价, 该量表从文献偏倚、病例的选择、诊断试验的实施、变异和质量报告等14个方面进行文献的质量评价, 每个条目分为"是(满足标准)"、"否(不满足量表的标准)"、"不清楚(部分满足或者无法得出更多信息)"三个等级, 按照评分计算, 其中"是"记1分, 其他为0分.
统计学处理 文献资料筛选后, 采用Meta-Disc 1.4(Barcelona, Spain)软件对于CA242诊断PC的诊断效能进行Meta分析. 统计学异质性采用χ2检验, 显著性水平设定为α = 0.05, I2评估异质性大小, 对于异质性较大的研究(P<0.05且I2>75%), 采用随机效应模型进行合并数据分析, 无明显异质性(P>0.05且I2<75%)的采用固定效应模型进行数据分析, 并对敏感性(sensitivity, Sen)、灵敏度(specificity, Spe)、阳性似然比(+LR)、阴性似然比(-LR)、阳性预测值、阴性预测值、诊断OR值进行合并分析, 并绘制SROC曲线且计算曲线下面积(area under curve, AUC), 计算约登指数(Youden index) = Sen+Spe-1. 所有的结果均用95%CI表示.
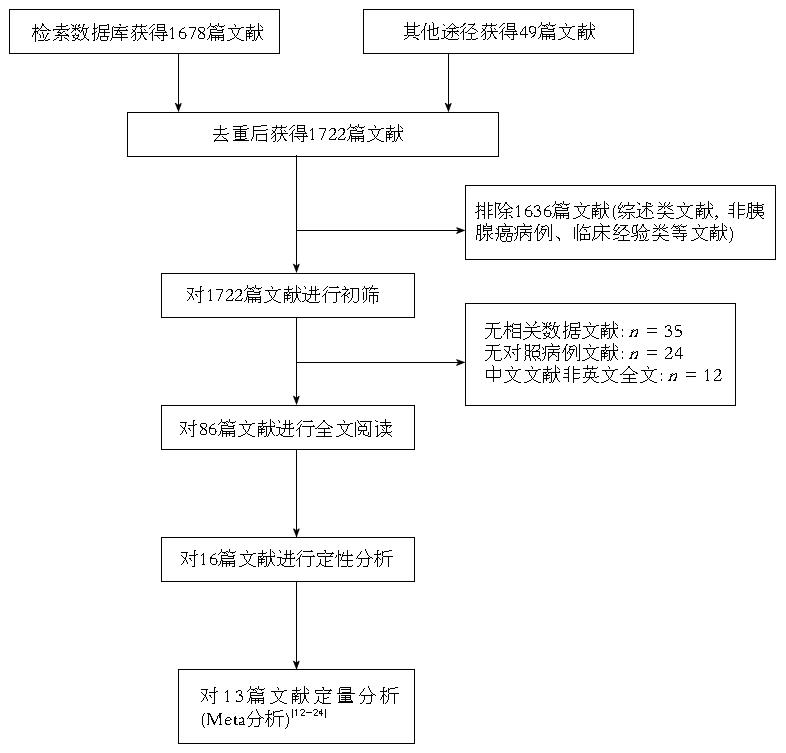
经过两位研究者独立进行筛选文献后, 共检索相关文献1722篇, 首先经阅读摘要和全文, 排除非PC病例或者综述类文献1636篇, 最后剩余86篇. 严格按照文献的纳入与排除标准对于所纳入全文阅读文献进行筛选和剔除, 最终纳入英文文献13篇[12-24]. 文献筛选的PRISMA流程图如图1, 纳入文献基本情况(发表时间, 国家, 病例数, 诊断价值等情况)如表1.
| 研究 | 国家 | 总人数(n) | CA242 | 评分 | |||
| PC数 | 非PC数 | Cut-off(U/mL) | Sen(%) | Spe(%) | |||
| Pasanen等[12]1992 | Finland | 26 | 151 | 20 | 80.7 | 79.0 | 11 |
| Liao等[13]2007 | China | 112 | 38 | 20 | 59.42 | 72.72 | 10 |
| Wu等[14]2006 | China | 48 | 96 | 25 | 71.1 | 93.5 | 9 |
| Ni等[15]2005 | China | 105 | 100 | 20 | 60.0 | 76.0 | 13 |
| Jiang等[16]2004 | China | 96 | 252 | 20 | 82.3 | 93.5 | 10 |
| Jiang等[17]2004 | China | 129 | 183 | 20 | 81.7 | 78.4 | 9 |
| Ozkan等[18]2003 | Turkey | 40 | 95 | 20 | 75.0 | 85.5 | 8 |
| Ventrucci等[19]1998 | Italy | 46 | 81 | 46 | 54.3 | 95.0 | 11 |
| Banfi等[20]1996 | Italy | 42 | 21 | 20 | 73.8 | 85.0 | 12 |
| Kawa等[21]1994 | Japan | 151 | 105 | 30 | 79.0 | 86.0 | 11 |
| Haglund等[22]1994 | Finland | 179 | 112 | 20 | 74.0 | 91.0 | 9 |
| Röthlin等[23]1993 | Switzerland | 68 | 262 | 20 | 66.2 | 90.0 | 7 |
| Banfi等[24]1993 | Italy | 41 | 19 | 34 | 57.0 | 84.2 | 9 |
| 合计 | 1083 | 1515 | |||||
纳入文献方法学设计: 所有纳入的研究均为CA242诊断PC的前瞻性或回顾性诊断试验, 均交代病例资料和病例纳入排除标准. 纳入研究观察对象: 13个纳入研究共有2598例研究对象被纳入本文, 其中经过病理组织学确认的PC患者有1083例, 非PC患者共1515例, 另外部分文献设置正常健康人作为对照.
我们质量严格逐条按QUADAS量表对所纳入的13篇文献进行质量评价, 其中文献的QUADAS质量评分如表1, 由表1可知: 纳入文献的质量评分为7-13分, 平均9.9分, 其中>10分的文献7篇, <10分的文献6篇, 文献的整体质量较高. 其中低分文献主要是未交代PC病理学取样方法、病例退出试验的原因和影响试验结果的混合偏倚.
2.3 CA242诊断PC的诊断价值
2.3.1 CA242诊断PC的异质性分析: 在文献筛选和质量评价后, 我们采用Meta-Disc 1.4软件分别提取13篇纳入研究CA242在诊断PC的四格表数据进行Meta分析, CA242诊断PC的异质性分析如图2. 异质性分析表明: CA242的合并的诊断比值比(diagnostic odds ratio, DOR)为16.51(95%CI: 10.38-26.37), 各项纳入研究之间存在中度异质性(P = 0.0000, I2 = 75.6%), 同时我们对纳入的文献中CA19-9在诊断PC的诊断价值进行系统评价, 结果表明: CA19-9的合并DOR为14.81(95%CI: 8.82-24.86), 存在着明显的异质性(P = 0.0000, I2 = 80.9%). 由上述数据可知: CA242诊断PC的DOR较高, 诊断效能高.
2.3.2 CA242诊断PC的性能及诊断价值: Meta-disc 1.4软件合并分析CA242在诊断PC的诊断价值如表2, 并绘制其合并的SROC曲线以及曲线下面积AUC如图3. Meta-disc软件分析结果显示: CA242诊断PC的合并的灵敏度(pooled Sen)为71%(95%CI: 69%-74%)、合并特异度(pooled Spe)为87%(95%CI: 85%-88%)、+LR为5.26(95%CI: 3.87-7.14)、-LR为0.34(95%CI: 0.28-0.42)、约登指数为0.58, SROC曲线下面积为0.8487; 同时各纳入文献均给出了CA19-9诊断PC的诊断价值, Meta-disc软件分析结果显示: CA19-9诊断PC时合并的灵敏度为69%(95%CI: 67%-82%)、特异度为81%(95%CI: 78%-83%)、+LR为4.01(95%CI: 2.63-6.12)、-LR为0.28(95%CI: 0.23-0.34)、约登指数为0.50, SROC曲线下面积为0.8319. 由以上数据可以得出: CA242诊断PC的诊断价值较高, 误诊率和漏诊率较CA19-9低.
| 项目 | 合并灵敏度 | 合并特异度 | 阳性似然比 | 阴性似然比 |
| CA242 | 71%(95%CI: 69%-74%) | 87%(95%CI: 85%-88%) | 5.26(95%CI: 3.87-7.14) | 0.34(95%CI: 0.28-0.42) |
| CA19-9 | 69%(95%CI: 67%-82%) | 81%(95%CI: 78%-83%) | 4.01(95%CI: 2.63-6.12) | 0.28(95%CI: 0.23-0.34) |
近年来, 随着外科手术技术及影像学技术的进步, PC的预后得以轻度提高, 但总体预后较差, 对于早期可切除的PC患者, 5年生存率不到20%[25,26], 但多数情况下PC的发现即处于晚期, 无法行外科手术切除, 生存率较差, 因此早期预测和发现PC对于提高预后尤为重要. 其中早期的血清学指标在预测PC的研究较多, 目前已发现超过2516个血清学指标可能是PC的早期预测指标[27]. 但是对于繁杂的预测指标目前存在较多争议, 其中CA19-9在诊断早期PC中的作用已成为共识[28-30], 但CA19-9容易受肝功能和胆汁淤积的影响, 在良性梗阻性黄疸中如慢性胰腺炎患者及肝实质受损害时, CA19-9易出现升高而出现假阳性. 因此有必要寻找标志物特异性更高的肿瘤标志物, CA242被认为是PC相关肿瘤指标的新型标志物, CA242与CA19-9在来源上一样, 都是Lewis a血型上的相关抗原决定簇, 但对于CA242的抗原决定簇的结构目前研究不明确, 并且在不同的良性疾病时, CA242与CA19-9的抗原决定簇出现的机会和表达高低程度并不相同[5,12,31,32], 目前的研究[12-24]表明: 在恶性肿瘤时, 两者的血清中含量均较正常明显增高, 而在良性疾病中, 尤其是在肝胆胰的良性疾病(胆总管结石、急性胆管炎、急慢性胰腺炎等)时, 血清中CA19-9常会升高, 而CA242不升高, 因此在PC时检测CA242更具有特异性, 已有相关研究证明可以对PC进行预测, 本文即采用系统评价的方法, 根据已发表的关于CA242诊断PC诊断价值的文献, 对CA242诊断PC的诊断价值进行系统评价.
本研究采用循证医学方法对相关纳入文献进行评价, 并用专用Meta分析软件对各已发表的实验结果进行定量合成, 通过增大统计量方法加大统计学效能, 研究结果显示: CA242诊断PC的合并的灵敏度为71%、特异度87%、合并DOR为16.51、+LR为5.26、-LR为0.34、约登指数为0.58, SROC曲线下面积为0.8487. 与此同时, 我们对纳入文献中所报到的CA19-9诊断价值进行Meta分析, 结果显示: CA19-9诊断PC的合并灵敏度为69%、特异度81%、合并DOR为14.81、+LR为4.01、-LR为0.28、约登指数为0.50, SROC曲线下面积为0.8319. 由以上数据可以表明: CA242的诊断的灵敏度、特异度、阳性似然比和阴性似然比较CA19-9高, 其SROC曲线下面积较CA19-9高, 诊断效能较高, 误诊率和漏诊率较低, 因此可以作为临床上常见的肿瘤标志物用于PC的早期诊断和病情的检测, 但是由于临床医师特别是肿瘤科及消化科医师对于CA19-9的诊断地位的关注较多, 建议在临床上进行PC或相关疾病(慢性胰腺炎、梗阻性黄疸)等进行筛选的同时, 可将CA242作为常规的诊断血清学指标, 这样结合CA19-9与CA242进行综合评价, 可以减少漏诊率和误诊率, 从而对于早期的诊断PC提供帮助, 提高PC患者的预后, 值得临床推广.
本文是基于近年来在国内外所发表的CA242在诊断PC的诊断价值的相关研究文献, 通过提取文献中的数据, 通过增大样本量的方法, 对CA242诊断PC的诊断价值进行系统评价. 文献的纳入均为全文英文的文献, 诊断试验的质量也是影响结果的可靠性的重要因素, 异质性检验可知: 本文存在中等程度的异质性, 异质性可导致Meta分析的结果的偏倚, 这是本文的局限性. 因此本文的局限性或异质性: (1)纳入文献的方法学设计不同, 多数文献为前瞻性诊断试验, 但是国内病例的相关文献采用回顾性诊断试验, 且纳入研究中在对照组(无病组)的匹配和病例的选择存在着不足, 这可能导致异质性的产生, 且存在选择偏倚(selection bias), 影响着试验的结果; (2)由于纳入文献的地理位置(人群分布)存在着差异, 因此不同人群中PC的发病率病理学诊断标准有所不同, 从而产生异质性; (3)另外本文的文献检索的语言仅为中英文, 这可能存在语种的偏倚, 无法检索出或其他语言的类似研究, 产生异质性, 影响Meta分析的最终结果; (4)各纳入研究中多数均未详细交代诊断试验的实施细节(如试验解读偏倚和金标准解读偏倚等); (5)各纳入文献的CA242的检测方法的不同和试剂盒的生产制造商的不同也是本文的局限性.
总之, 本文是国内首次采用Meta分析的方法对血清学肿瘤指标CA242诊断PC的诊断价值进行系统评价, 通过Meta分析, 我们得出结果: CA242在诊断PC的诊断效能较传统肿瘤标志物CA19-9高, 漏诊率和误诊率较低, 可以作为常见的诊断PC的肿瘤标志物, 但是未来仍需要大样本、多中心、前瞻性的高质量诊断研究来验证CA242在作为肿瘤指标早期诊断PC的诊断价值和评估PC的预后.
胰腺癌(pancreatic cancer, PC)是临床上常见的恶性肿瘤之一, 其发病率较低, 预后较差, 众所周知, 糖链抗原19-9(carbohydrate antigen 19-9, CA19-9)、CA50、癌胚抗原(carcinoembryonic antigen, CEA)等相关血清学肿瘤标志物在PC的诊断中的特异性和灵敏度较低, 诊断价值有限. 理想的肿瘤标志物应具有灵敏度和特异性高, 并且能诊断和预测预后.
戴朝六, 教授, 中国医科大学第二临床学院(盛京医院)肝胆外科
目前尚无文献系统性的探讨CA242诊断PC的诊断价值, 为了进一步明确CA242在诊断PC的诊断价值, 本文拟采用循征医学方法对CA242和CA19-9在诊断PC的诊断价值进行系统评价.
以往认为, PC的诊断的主要的肿瘤指标是CA19-9, 但是由于其诊断的局限性和有一定的漏诊率, 近年来CA242作为肿瘤指标为人们所认知, 因此本文即是针对CA242诊断PC的诊断进行系统的评价.
本文采用系统评价的方法将CA242与CA19-9诊断PC的诊断价值进行对比, 从而提供了一个新的肿瘤标志物, 为临床的治疗方法的选择提供建议.
本研究提示, CA242可以作为常见的PC的肿瘤标志物, 在临床上推广, 这样会提高PC的诊断率.
灵敏度: 被诊断为阳性的概率, 也称为真阳性率, 反映了诊断试验检出病例的能力; 特异度: 未患病且被诊断为阴性的概率, 也称为真阴性率, 反映了诊断试验排除某疾病的能力.
本文研究认为CA242在PC的诊断效能较传统肿瘤标志物CA19-9高, 漏诊率和误诊率较低, 可以作为常见的诊断PC的肿瘤标志物, 对临床有一定的参考意义.
编辑: 郭鹏 电编: 闫晋利
| 1. | Maisonneuve P, Lowenfels AB. Epidemiology of pancreatic cancer: an update. Dig Dis. 2010;28:645-656. [PubMed] [DOI] |
| 2. | Bednar F, Simeone DM. Pancreatic cancer stem cell biology and its therapeutic implications. J Gastroenterol. 2011;46:1345-1352. [PubMed] [DOI] |
| 3. | Jelski W, Kutylowska E, Laniewska-Dunaj M, Szmitkowski M. Alcohol dehydrogenase (ADH) and aldehyde dehydrogenase (ALDH) as candidates for tumor markers in patients with pancreatic cancer. J Gastrointestin Liver Dis. 2011;20:255-259. [PubMed] |
| 4. | Gui JC, Yan WL, Liu XD. CA19-9 and CA242 as tumor markers for the diagnosis of pancreatic cancer: a meta-analysis. Clin Exp Med. 2014;14:225-233. [PubMed] [DOI] |
| 5. | Chakraborty S, Baine MJ, Sasson AR, Batra SK. Current status of molecular markers for early detection of sporadic pancreatic cancer. Biochim Biophys Acta. 2011;1815:44-64. [PubMed] [DOI] |
| 6. | Wang Z, Tian YP. Clinical value of serum tumor markers CA19-9, CA125 and CA72-4 in the diagnosis of pancreatic carcinoma. Mol Clin Oncol. 2014;2:265-268. [PubMed] |
| 7. | Huang Z, Liu F. Diagnostic value of serum carbohydrate antigen 19-9 in pancreatic cancer: a meta-analysis. Tumour Biol. 2014;35:7459-7465. [PubMed] [DOI] |
| 8. | Bao B, Ali S, Ahmad A, Li Y, Banerjee S, Kong D, Aboukameel A, Mohammad R, Van Buren E, Azmi AS. Differentially expressed miRNAs in cancer-stem-like cells: markers for tumor cell aggressiveness of pancreatic cancer. Stem Cells Dev. 2014;23:1947-1958. [PubMed] [DOI] |
| 9. | Tanase CP, Neagu M, Albulescu R, Hinescu ME. Advances in pancreatic cancer detection. Adv Clin Chem. 2010;51:145-180. [PubMed] [DOI] |
| 10. | Lindholm L, Johansson C, Jaiisson EL, Hallberg C, Nilsson O. An immunoradiometric assay (IRMA) for the CA 50 antigen. Tumour marker antigen. Lund: Student literature 1985; 123-133. |
| 11. | Whiting P, Rutjes AW, Reitsma JB, Bossuyt PM, Kleijnen J. The development of QUADAS: a tool for the quality assessment of studies of diagnostic accuracy included in systematic reviews. BMC Med Res Methodol. 2003;3:25. [PubMed] [DOI] |
| 12. | Pasanen PA, Eskelinen M, Partanen K, Pikkarainen P, Penttilä I, Alhava E. Clinical evaluation of a new serum tumour marker CA 242 in pancreatic carcinoma. Br J Cancer. 1992;65:731-734. [PubMed] [DOI] |
| 13. | Liao Q, Zhao YP, Yang YC, Li LJ, Long X, Han SM. Combined detection of serum tumor markers for differential diagnosis of solid lesions located at the pancreatic head. Hepatobiliary Pancreat Dis Int. 2007;6:641-645. [PubMed] |
| 14. | Wu X, Lu XH, Xu T, Qian JM, Zhao P, Guo XZ, Yang XO, Jiang WJ. Evaluation of the diagnostic value of serum tumor markers, and fecal k-ras and p53 gene mutations for pancreatic cancer. Chin J Dig Dis. 2006;7:170-174. [PubMed] [DOI] |
| 15. | Ni XG, Bai XF, Mao YL, Shao YF, Wu JX, Shan Y, Wang CF, Wang J, Tian YT, Liu Q. The clinical value of serum CEA, CA19-9, and CA242 in the diagnosis and prognosis of pancreatic cancer. Eur J Surg Oncol. 2005;31:164-169. [PubMed] [DOI] |
| 16. | Jiang JT, Wu CP, Deng HF, Lu MY, Wu J, Zhang HY, Sun WH, Ji M. Serum level of TSGF, CA242 and CA19-9 in pancreatic cancer. World J Gastroenterol. 2004;10:1675-1677. [PubMed] |
| 17. | Jiang XT, Tao HQ, Zou SC. Detection of serum tumor markers in the diagnosis and treatment of patients with pancreatic cancer. Hepatobiliary Pancreat Dis Int. 2004;3:464-468. [PubMed] |
| 18. | Ozkan H, Kaya M, Cengiz A. Comparison of tumor marker CA 242 with CA 19-9 and carcinoembryonic antigen (CEA) in pancreatic cancer. Hepatogastroenterology. 2003;50:1669-1674. [PubMed] |
| 19. | Ventrucci M, Ubalducci GM, Cipolla A, Panella MA, Ligabue A. Serum CA 242: the search for a valid marker of pancreatic cancer. Clin Chem Lab Med. 1998;36:179-184. [PubMed] [DOI] |
| 20. | Banfi G, Bravi S, Ardemagni A, Zerbi A. CA 19.9, CA 242 and CEA in the diagnosis and follow-up of pancreatic cancer. Int J Biol Markers. 1996;11:77-81. [PubMed] |
| 21. | Kawa S, Tokoo M, Hasebe O, Hayashi K, Imai H, Oguchi H, Kiyosawa K, Furuta S, Homma T. Comparative study of CA242 and CA19-9 for the diagnosis of pancreatic cancer. Br J Cancer. 1994;70:481-486. [PubMed] [DOI] |
| 22. | Haglund C, Lundin J, Kuusela P, Roberts PJ. CA 242, a new tumour marker for pancreatic cancer: a comparison with CA 19-9, CA 50 and CEA. Br J Cancer. 1994;70:487-492. [PubMed] [DOI] |
| 23. | Röthlin MA, Joller H, Largiadèr F. CA 242 is a new tumor marker for pancreatic cancer. Cancer. 1993;71:701-707. [PubMed] [DOI] |
| 24. | Banfi G, Zerbi A, Pastori S, Parolini D, Di Carlo V, Bonini P. Behavior of tumor markers CA19.9, CA195, CAM43, CA242, and TPS in the diagnosis and follow-up of pancreatic cancer. Clin Chem. 1993;39:420-423. [PubMed] |
| 25. | Lewis R, Drebin JA, Callery MP, Fraker D, Kent TS, Gates J, Vollmer CM. A contemporary analysis of survival for resected pancreatic ductal adenocarcinoma. HPB (Oxford). 2013;15:49-60. [PubMed] |
| 26. | Harsha HC, Kandasamy K, Ranganathan P, Rani S, Ramabadran S, Gollapudi S, Balakrishnan L, Dwivedi SB, Telikicherla D, Selvan LD. A compendium of potential biomarkers of pancreatic cancer. PLoS Med. 2009;6:e1000046. [PubMed] [DOI] |
| 27. | Datta J, Vollmer CM. Investigational biomarkers for pancreatic adenocarcinoma: where do we stand? South Med J. 2014;107:256-263. [PubMed] [DOI] |
| 28. | Ballehaninna UK, Chamberlain RS. The clinical utility of serum CA 19-9 in the diagnosis, prognosis and management of pancreatic adenocarcinoma: An evidence based appraisal. J Gastrointest Oncol. 2012;3:105-119. [PubMed] |
| 29. | Locker GY, Hamilton S, Harris J, Jessup JM, Kemeny N, Macdonald JS, Somerfield MR, Hayes DF, Bast RC. ASCO 2006 update of recommendations for the use of tumor markers in gastrointestinal cancer. J Clin Oncol. 2006;24:5313-5327. [PubMed] [DOI] |
| 30. | Berger AC, Garcia M, Hoffman JP, Regine WF, Abrams RA, Safran H, Konski A, Benson AB, MacDonald J, Willett CG. Postresection CA 19-9 predicts overall survival in patients with pancreatic cancer treated with adjuvant chemoradiation: a prospective validation by RTOG 9704. J Clin Oncol. 2008;26:5918-5922. [PubMed] [DOI] |
| 31. | Mendieta Zerón H, García Flores JR, Romero Prieto ML. Limitations in improving detection of pancreatic adenocarcinoma. Future Oncol. 2009;5:657-668. [PubMed] [DOI] |
| 32. | Bünger S, Laubert T, Roblick UJ, Habermann JK. Serum biomarkers for improved diagnostic of pancreatic cancer: a current overview. J Cancer Res Clin Oncol. 2011;137:375-389. [PubMed] [DOI] |