修回日期: 2015-02-16
接受日期: 2015-03-09
在线出版日期: 2015-04-18
目的: 探讨上消化道不同部位黏膜下肿瘤的临床特征及治疗方法.
方法: 收集159例上消化道不同部位黏膜下肿瘤患者, 行内镜下黏膜剥离术(endoscopic submucosal dissection, ESD)切除病灶, 切除后病灶均送病理, 比较不同部位性别及年龄组成比, 病灶最大直径, 手术时间及并发症发生率, 所有患者2 mo及6 mo后复查胃镜.
结果: 159例患者中, 病灶位于食道28例, 贲门12例, 胃底44例, 胃体48例(其中2例为残胃), 胃窦22例, 十二指肠5例. 病灶完全切除155例(155/159, 97.5%), 术中病灶行整块切除154例(154/159, 96.9%), 食道者16例以隧道法切除, 胃底者16例行全层切除. 病灶位于食道者, 隧道法及普通ESD术手术时间相比差异无统计学意义. 病灶位于胃底者, 普通ESD术及全层切除法手术时间相比差异无统计学意义. 术后病理主要包括平滑肌瘤、间质瘤及异位胰腺. 本研究中共发生术中穿孔19例, 后均行全层切除术, 成功闭合创面; 所有术中出血均以电凝止血钳及钛夹成功止血, 术后迟发性出血发生2例, 均经急诊内镜下钛夹成功止血. 所有患者术后2 mo及6 mo复查胃镜, 所有患者创面愈合良好, 未见复发.
结论: 上消化道黏膜下肿瘤根据其不同生长部位, 有其不同临床及病理特征, 可采用不同ESD手术方式.
核心提示: 对于不同部位的黏膜下病灶, 可采取不同的手术方式, 如食道者可选用隧道法, 而胃底病灶可采用全层切除术. 不同部位黏膜下病灶病理类型有一定倾向性, 对于间质瘤及神经内分泌肿瘤高发部位, 需密切随访, 防止病灶恶变.
引文著录: 陆芬英, 施新岗, 王伟, 李兆申, 陆志平, 成翠娥, 吴钢. 不同部位上消化道黏膜下肿瘤临床特征及治疗方法. 世界华人消化杂志 2015; 23(11): 1805-1811
Revised: February 16, 2015
Accepted: March 9, 2015
Published online: April 18, 2015
AIM: To investigate the clinical characteristics and treatment methods for upper gastrointestinal submucosal tumors located in different sites.
METHODS: One hundred and fifty-nine patients with upper gastrointestinal tract submucosal tumors were included. Endoscopic submucosal dissection (ESD) was performed, and the resected lesions were subjected to pathological examination. Gender and age composition ratio, maximum diameter of lesions, operation time and the rate of complications were compared among tumors located in different sites. All patients underwent gastroscopy two and six months after operation.
RESULTS: There were 28 lesions in the esophagus, 12 in the cardia, 44 in the gastric fundus, 48 in the gastric body (including 2 cases of residual stomach), 22 in the gastric sinus, and 5 in the duodenum. Complete resection was performed in 155 (155/159, 97.5%) cases, and 154 cases were resected as a whole piece (154/159, 96.9%). In the esophagus, 16 cases were resected by submucosal tunneling endoscopic resection; in the gastric fundus, 16 cases were resected by endoscopic filtering resection. There was no significant difference in operation time between submucosal tunneling endoscopic resection and ordinary ESD for tumors in the esophagus. There was also no significant difference in operation time between endoscopic filtering resection and ordinary ESD for tumors in the gastric fundus. The pathologic diagnoses mainly included leiomyoma, stromal tumors and ectopic pancreas. The major complications were perforation, intraoperative bleeding and postoperative delayed bleeding. A total of 19 cases developed perforation and underwent endoscopic filtering resection to close the wound successfully. Intraoperative bleeding was managed successfully with electric coagulation forceps and titanium clip in all patients. The two cases with postoperative delayed bleeding were managed successfully by emergency endoscopic titanium clipping. All patients underwent gastroscopy after two and six months, which revealed that the wound healed well, and no recurrence occurred.
CONCLUSION: Upper gastrointestinal submucosal tumors located in different sites show different clinical and pathological features, and different ESD operation methods should be selected.
- Citation: Lu FY, Shi XG, Wang W, Li ZS, Lu ZP, Cheng CE, Wu G. Clinical characteristics and treatments for upper gastrointestinal submucosal tumors located in different sites. Shijie Huaren Xiaohua Zazhi 2015; 23(11): 1805-1811
- URL: https://www.wjgnet.com/1009-3079/full/v23/i11/1805.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i11.1805
胃肠道黏膜下肿瘤是一类来自胃壁非上皮性间叶组织的肿瘤, 主要包括间质瘤、平滑肌瘤、脂肪瘤、神经源性肿瘤、纤维瘤等, 这类患者通常无明显症状, 于常规体检时发现病灶[1]. 内镜下黏膜剥离术(endoscopic submucosal dissection, ESD)是治疗消化系黏膜下病变的一种新技术, 能够完整切除黏膜下病灶, 以得到病理学诊断, 该项技术已经在日本等国家广泛开展. 目前已经有多项研究[2-4]证实: 不管在上消化道还是下消化道病变中, ESD技术能够完整切除黏膜下肿瘤, 即使病灶来源于固有肌层. 本文收集2012-10/2013-09入住长海医院消化科159例不同部位黏膜下肿瘤患者的病历资料, 总结不同部位病灶的临床特征及病理结果, 以及手术方式及并发症发生情况.
收集2012-10/2013-09入住长海医院消化科患者159例, 所有患者均在常规胃镜检查时发现病灶, 并经超声胃镜检查证实, 病灶来源于黏膜层以下, 病灶直径0.5-9.0 cm, 且超声内镜下无腔外生长征象. 159例患者中, 男性73例, 女性86例, 年龄16-78岁, 平均年龄51岁±12.4岁. OLYMPUS XQ-260J胃镜, 内镜注射针, dual刀, IT-2刀, 止血钳, 透明帽, ERBE高频电发生器, OLYMPUS止血夹, 尼龙圈, 圈套器及1:10000肾上腺素甘油果糖注射溶液等.
1.2.1 术前准备: 所有患者收住入院前均行超声胃镜检查, 提示病灶起源于黏膜层以下, 无腔外生长表现, 术前完善血常规, 凝血功能, 评估心肺功能, 签署知情同意书.
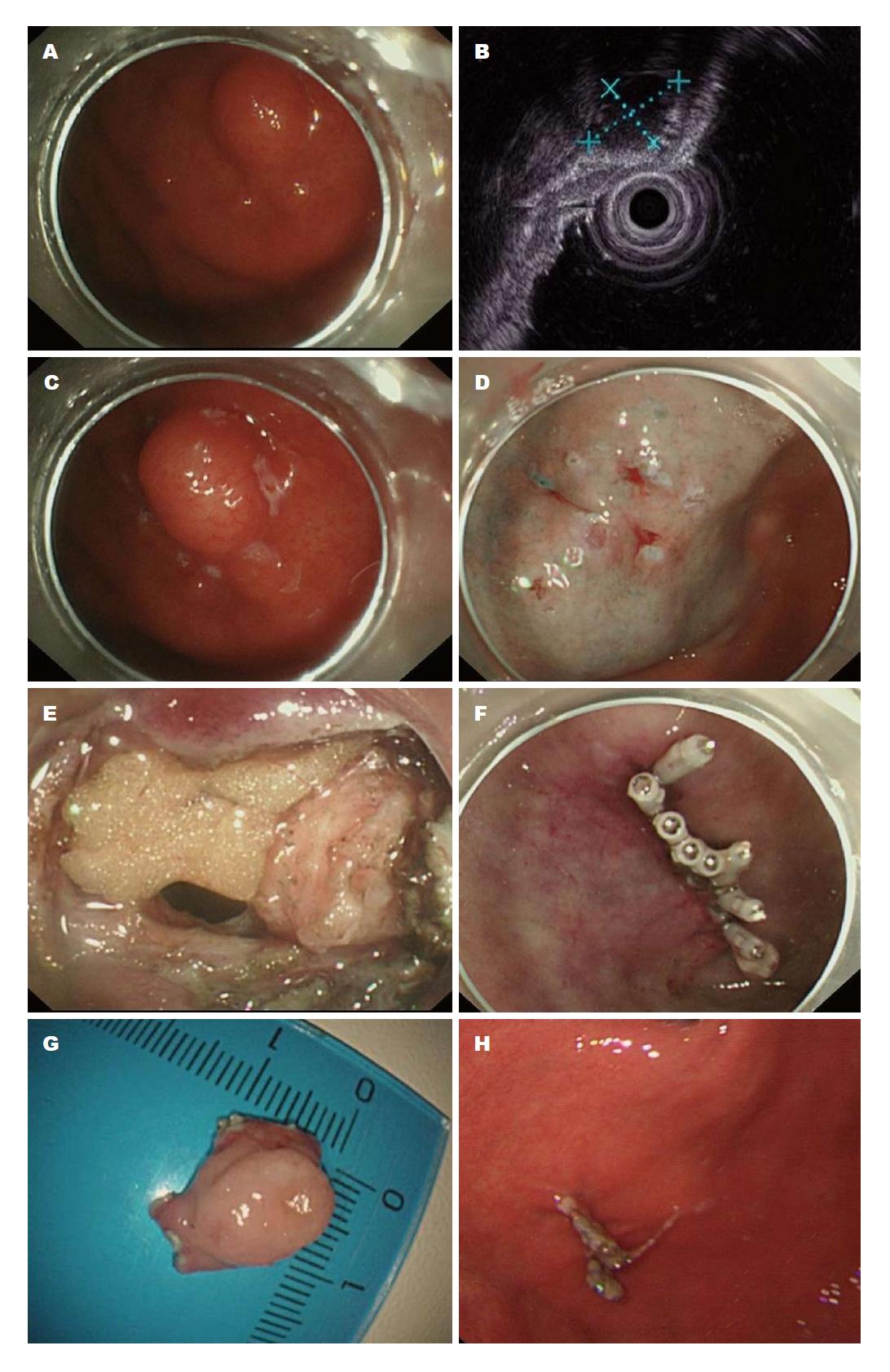
1.2.2 操作步骤: 所有患者均在静脉麻醉下完成ESD术, 病变位于食管及贲门者实施气管插管. 具体步骤如下: (1)标记: 以dual刀于病灶边缘外0.5 cm以ERBE20指数标记; (2)注射: 于标记处用注射针将1:10000肾上腺素甘油果糖注射液注射于黏膜下层; (3)预切开: 以dual刀以ERBE50指数进行病灶预切开; (4)剥离瘤体, 以IT-2刀剥离瘤体, 术中出血以止血钳电凝止血, 术后予止血夹夹闭显露血管或者创面, 术中穿孔患者行全层切除术(图1).
1.2.3 术后处理: 所有患者术后禁食, 常规静滴抑酸药物及抗生素2 d, 口服胃黏膜保护剂, 监测生命体征, 无明显并发症者术后24 h进食流质, 如无不适, 3-5 d后改为半流质, 约2 wk后进食普食, 术后3-5 d出院. 行全层切除者胃肠减压3 d, 每日冲洗胃管保持通畅, 72 h后进食流质, 3-5 d后改为半流质.
1.2.4 标本处理: 病灶均送病理科, 部分患者行免疫组织化学检测CD34、CD117、Desmin、SMA等.
1.2.5 随访: 所有患者出院后口服质子泵抑制剂(proton pump inhibitors, PPI)2 mo, 停药后复查胃镜, 至术后6 mo及1年再次复查胃镜, 观察手术部位愈合情况及有无复发.
统计学处理 采用SPSS19.0软件进行统计学分析, 计数资料均以mean±SD表示, 两两比较采用t检验, P<0.05认为差异有统计学意义.
159例患者中, 病灶位于食道28例、贲门12例、胃底44例、胃体48例(2例为残胃)、胃窦22例、十二指肠5例. 食道中男性17例, 女性11例; 贲门中男性7例, 女性5例; 胃底中男性11例, 女性33例; 胃体中男性21例, 女性27例; 胃窦中男性15例, 女性7例, 十二指肠中男性2例, 女性3例. 本研究统计了不同部位黏膜下肿瘤病理构成比(表1).
| 部位 | n | 间质瘤 | 平滑肌瘤 | 异位胰腺 | 脂肪瘤 | 其他1 |
| 食道 | 28 | 3(10.7) | 21(75.0) | 0(0.0) | 0(0.0) | 4(14.3) |
| 贲门 | 12 | 0(0.0) | 11(91.7) | 0(0.0) | 0(0.0) | 1(8.3) |
| 胃底 | 44 | 33(75.0) | 9(20.5) | 0(0.0) | 0(0.0) | 2(4.5) |
| 胃体 | 48 | 18(37.5) | 19(39.6) | 3(6.3) | 1(2.1) | 7(14.5) |
| 胃窦 | 22 | 0(0.0) | 2(9.1) | 7(31.8) | 2(9.1) | 11(50.0) |
| 十二指肠 | 5 | 0(0.0) | 1(20.0) | 2(40.0) | 0(0.0) | 2(40.0) |
2.2.1 一般情况: 159例患者中, 病灶完全切除155例(155/159, 97.5%), 有4例患者因病灶体积大, 最大直径>5 cm, 起源于固有肌层深层, 后行部分切除, 术后病理证实为异位胰腺及平滑肌瘤, 剩余病灶未予特殊处理. 术中病灶行整块切除154例(154/159, 96.9%), 5例患者因病灶起源深, 体积大, 或是瘤体呈不规则形, 术中将圈套器切碎瘤体, 予分块切除. 食道者16例以隧道法切除, 胃底者16例行全层切除. 不同部位手术时间如表2, 其中食道隧道法及普通ESD术手术时间相比差异无统计学意义(t = 1.096, P>0.05), 胃底者普通ESD术及全层切除法手术时间相比差异无统计学意义(t = 0.768, P>0.05).
| 部位 | 手术时间 | 最大值 | 最小值 |
| 食道(普通法) | 41.5±23.8 | 75.0 | 16.0 |
| 食道(隧道法) | 50.5±19.7 | 100.0 | 28.0 |
| 贲门 | 53.6±29.6 | 106.0 | 10.0 |
| 胃底(普通法) | 45.1±34.8 | 150.0 | 15.0 |
| 胃底(全层切除) | 38.1±13.8 | 67.0 | 20.0 |
| 胃体 | 44.2±29.5 | 138.0 | 11.0 |
| 胃窦 | 43.1±21.8 | 113.0 | 14.0 |
| 十二指肠 | 30.6±16.3 | 49.0 | 14.0 |
2.2.2 并发症: 本研究中发生术中穿孔19例, 其中16例位于胃底, 3例位于胃体, 未有术后迟发性穿孔. 术中穿孔首先均以腹腔抽气减压, 18例以钛夹夹闭浆膜层缺损面, 1例以钛夹及尼龙圈修补创面. 所有患者术后均加强抗感染治疗, 留置胃肠减压及禁食3 d, 所有患者恢复可, 均未出现延迟性穿孔及腹腔感染. 术中出血均以热止血钳电凝止血或钛夹夹闭血管, 其中1例位于胃体及1例位于胃窦患者均于术后4-5 h发生呕血, 2例均经急诊内镜下钛夹夹闭出血血管, 其中1例输红悬液400 mL, 后均未再发生出血.
2.2.3 复查及随访: 所有患者术后2 mo及6 mo后复查胃镜, 创面愈合好, 无1例复发, 随访至今均无狭窄发生.
胃黏膜下病变包括胃黏膜下肿瘤和其他非肿瘤性病变, 肿瘤性病变包括间质瘤、平滑肌瘤、脂肪瘤、血管瘤及类癌等, 而非肿瘤性病变包括异位胰腺、囊肿、血肿及曲张静脉. 在常规胃镜下, 胃黏膜下病变表层完整, 普通活检不能做出定性诊断. 超声内镜能够根据病灶回声及均匀度等大概判断病变的起源及性质, 分辨出血流性及非血流性病变, 但不能对病变做出定性诊断. 有文献[5]报道, 即使是超声内镜下细针穿刺技术(endoscopic ultrasonography-fine needle aspiration EUS-FNA), 其病理结果与外科手术结果仍有一定的差异, 而ESD能够完整切下病变, 并做出病理诊断乃至免疫组织化学, 用以指导临床治疗.
本研究将上消化道分为食管、贲门、胃底、胃体、胃窦及十二指肠6组, 分别总结了这些不同部位病灶的手术时间及病理结果. 发现术后病理以平滑肌瘤及间质瘤为主, 其次为异位胰腺及脂肪瘤. 不同部位黏膜下病灶病理结果有明显差异, 食管及贲门以平滑肌瘤为主, 胃底者以间质瘤为主, 胃体者则间质瘤及平滑肌瘤所占比例相近, 胃窦则以异位胰腺居多, 其他少见的包括神经内分泌肿瘤及错构瘤等. 因间质瘤及神经内分泌肿瘤有恶变倾向[6], 且间质瘤如直径>5 cm, 易发生消化系出血及远处转移[7], 故如常规胃镜检查于间质瘤高发部位如胃底, 胃体发现黏膜下病灶, 需密切随访, 尽早切除明确诊断.
Bialek等[8]报道, 起源于黏膜肌层及黏膜下层病灶手术速度明显高于起源于固有肌层患者, 手术时间不同一方面考虑与病灶部位有关, 另外考虑与病灶起源, 体积大小及病灶形状等均有关联. 本研究中发现隧道法切除食道黏膜下病灶平均手术时间与普通ESD术相比, 两者差异无统计学意义, 但由于隧道法可在隧道内将瘤体完整切除, 可保持瘤体表面黏膜的完整性, 故大大减少了穿孔、感染、气胸及纵膈气肿等的发生率, 且在建立隧道过程中, 隧道内血管清晰可见, 如发生出血, 处理容易, 可为手术提供清晰的视野[9], 故对于食道黏膜下肿瘤, 如无明显禁忌, 可首选隧道法切除. 另外, 本研究中44例胃底患者中, 18例因术中穿孔, 后转为全层切除术, 但统计发现两者手术时间相比差异无统计学意义, 全层切除没有因为手术的复杂性而增加手术时间.
异位胰腺是一种先天性疾病, 是正常胰腺以外的孤立胰腺组织, 有其独立的血供及神经内分泌系统. 患者通常表现为腹部不适或者腹痛等症状, 也有患者表现为黑便, 呕吐等, 有少部分患者无明显临床表现, 病灶可位于消化系各部位, 但以胃窦部最多见[10]. 超声内镜下可表现为低回声、等回声、高回声及混合回声等, 部分病例内部可见管状结构, 大部分病灶边界不清, 无包膜[11], 诊断无特异性, 故容易被误诊为平滑肌瘤及间质瘤等. 彭浒萍等[12]通过研究证实, 异位胰腺组织大部分呈团块状, 而有少部分呈散在分布, 且散在分布者易浸润至固有肌层, 导致不能完整剥离, 创面大, 易发生出血, 穿孔等并发症. 本研究中1例患者因胃窦病灶浸润至固有肌层, 且与周围组织分界不清, 后未完全切除, 终止操作, 术后病理证实为异位胰腺, 未予特殊处理. 若术中强行将病灶完全剥离, 极易发生大的穿孔, 出血及腹膜炎等并发症, 严重者需外科手术治疗. 而另一异位胰腺患者术后发生迟发性出血, 该病灶体积大, 最大直径5.5 cm, 位于胃体上部前壁, 超声胃镜提示起源于固有肌层, 剥离后创面较大较深, 4 h后发生出血, 考虑原因为异位胰腺血供丰富, 术后未能以止血夹完全夹闭血管残端所致. 故对于术中高度怀疑异位胰腺患者, 术中需谨慎操作, 尽量夹闭手术残端血管, 防止术中及术后大出血.
ESD术常见并发症为出血及穿孔, 本研究发生迟发性出血2例(2/159, 1.3%), 穿孔19例(19/159, 11.9%), 其中16例穿孔(16/19, 84.2%)发生于胃底, 与多项研究[8,13-15]结果一致, 研究发现术中穿孔与病灶大小及患者性别、年龄等无明显相关性, 考虑胃底易发生穿孔与以下因素有关: (1)胃底黏膜下肿瘤以间质瘤为主, 经超声胃镜证实大部分起源于固有肌层, 外层仅有浆膜层; (2)胃底部胃壁厚度较其他部位薄; (3)胃底部病灶通常于反转胃镜下操作, 手术难度大, 考虑也为造成穿孔原因之一. 鉴于该部位的特殊性, 考虑对于胃底黏膜下肿瘤, 如术中发生穿孔, 可采用全层切除, 以止血夹及尼龙圈闭合创面.
总结经验如下: (1)对于不同部位的黏膜下病灶, 可采取不同的手术方式, 如食道者可选用隧道法, 而胃底病灶可采用全层切除术; (2)如病灶体积大, 起源深, 与固有肌层紧密相连, 考虑到ESD术极有可能发生穿孔及出血, 内镜下无法处理, 需及时终止手术, 可转外科手术或者待已经部分切除病灶病理结果决定下一步治疗方案; (3)ESD术中发生穿孔后, 不必急于外科手术, 可内镜下以止血夹夹闭创面或采用尼龙圈及止血夹联合使用夹闭创面; (4)不同部位黏膜下病灶病理类型有一定倾向性, 对于间质瘤及神经内分泌肿瘤高发部位, 需密切随访, 防止病灶恶变; (5)位于胃窦及胃体部位病灶, 如高度怀疑异位胰腺, 且病灶体积大, 起源深, 形状不规则, 剥离后创面大, 术后需仔细观察创面底部及切缘血管, 以电凝止血钳或者止血夹充分止血.
总之, 不同部位上消化道黏膜下病灶, 有其不同临床及病理特征, 可采用不同ESD手术方式以达到最佳治疗效果. ESD作为一种内镜下治疗手段, 具有高效及低并发症的特点, 其并发症如出血及穿孔均可在内镜下成功处理.
内镜下黏膜剥离术(endoscopic submucosal dissection, ESD)是治疗消化系黏膜下病变的一种新技术, 本文总结了不同部位病灶的临床特征及病理结果, 以及手术方式及并发症发生情况.
冯志杰, 主任医师, 河北医科大学第二医院消化内科
ESD作为一种内镜下治疗手段, 具有较高的有效性及安全性, 如何提高手术成功率, 减少其并发症如出血及穿孔等发生率尚待进一步研究.
Bialek等报道, 起源于黏膜肌层及黏膜下层病灶手术速度明显高于起源于固有肌层患者.
本文主要总结了消化系不同部位病灶的临床特征及病理结果, 以及手术方式及并发症发生情况, 病灶位于食道者采取了普通ESD术及隧道法, 病灶位于胃底者采用了普通ESD术及全层切除法.
对于不同部位的黏膜下病灶, 可采取不同的手术方式, 如食道者可选用隧道法, 而胃底病灶可采用全层切除术. ESD术中发生穿孔后, 不必急于外科手术, 可内镜下以止血夹夹闭创面或采用尼龙圈及止血夹联合使用夹闭创面.
内镜下黏膜剥离术(ESD): 是治疗消化系黏膜下病变的一种新技术, 方法是在内镜黏膜下注射基础上利用dual刀及IT刀等将病变所在黏膜剥离, 能够完整切除黏膜下病灶.
ESD作为一种内镜下治疗手段, 具有高效及低并发症的特点, 其并发症如出血及穿孔均可在内镜下成功处理. 本文病例数较多, 资料齐全, 图片清晰, 有随访结果, 对上消化道黏膜下肿瘤的内镜诊断与治疗具有较好的指导意义.
编辑: 韦元涛 电编: 都珍珍
| 1. | Connolly EM, Gaffney E, Reynolds JV. Gastrointestinal stromal tumours. Br J Surg. 2003;90:1178-1186. [PubMed] [DOI] |
| 2. | Białek A, Wiechowska-Kozłowska A, Pertkiewicz J, Polkowski M, Milkiewicz P, Karpińska K, Ławniczak M, Starzyńska T. Endoscopic submucosal dissection for treatment of gastric subepithelial tumors (with video). Gastrointest Endosc. 2012;75:276-286. [PubMed] [DOI] |
| 3. | Park YS, Park SW, Kim TI, Song SY, Choi EH, Chung JB, Kang JK. Endoscopic enucleation of upper-GI submucosal tumors by using an insulated-tip electrosurgical knife. Gastrointest Endosc. 2004;59:409-415. [PubMed] |
| 4. | Chu YY, Lien JM, Tsai MH, Chiu CT, Chen TC, Yang KC, Ng SC. Modified endoscopic submucosal dissection with enucleation for treatment of gastric subepithelial tumors originating from the muscularis propria layer. BMC Gastroenterol. 2012;12:124. [PubMed] [DOI] |
| 5. | Ando N, Goto H, Niwa Y, Hirooka Y, Ohmiya N, Nagasaka T, Hayakawa T. The diagnosis of GI stromal tumors with EUS-guided fine needle aspiration with immunohistochemical analysis. Gastrointest Endosc. 2002;55:37-43. [PubMed] [DOI] |
| 6. | Miettinen M, Lasota J. Gastrointestinal stromal tumors: pathology and prognosis at different sites. Semin Diagn Pathol. 2006;23:70-83. [PubMed] [DOI] |
| 7. | DeMatteo RP, Lewis JJ, Leung D, Mudan SS, Woodruff JM, Brennan MF. Two hundred gastrointestinal stromal tumors: recurrence patterns and prognostic factors for survival. Ann Surg. 2000;231:51-58. [PubMed] [DOI] |
| 8. | Białek A, Wiechowska-Kozłowska A, Pertkiewicz J, Karpińska K, Marlicz W, Milkiewicz P, Starzyńska T. Endoscopic submucosal dissection for the treatment of neoplastic lesions in the gastrointestinal tract. World J Gastroenterol. 2013;19:1953-1961. [PubMed] [DOI] |
| 9. | von Delius S, Gillen S, Doundoulakis E, Schneider A, Wilhelm D, Fiolka A, Wagenpfeil S, Schmid RM, Feussner H, Meining A. Comparison of transgastric access techniques for natural orifice transluminal endoscopic surgery. Gastrointest Endosc. 2008;68:940-947. [PubMed] [DOI] |
| 10. | Ormarsson OT, Gudmundsdottir I, Mårvik R. Diagnosis and treatment of gastric heterotopic pancreas. World J Surg. 2006;30:1682-1689. [PubMed] |
| 11. | Kim JH, Lim JS, Lee YC, Hyung WJ, Lee JH, Kim MJ, Chung JB. Endosonographic features of gastric ectopic pancreases distinguishable from mesenchymal tumors. J Gastroenterol Hepatol. 2008;23:e301-e307. [PubMed] [DOI] |
| 12. | 彭 浒萍, 岳 辉, 何 锋坚, 邵 兰, 刘 素英, 王 伟飞, 魏 清柱, 彭 芊芊, 李 清峰. 内镜下粘膜剥离术和内镜隧道技术对胃异位胰腺的诊断值. 中华消化内镜杂志. 2013;30:376-379. |
| 13. | Lee IL, Lin PY, Tung SY, Shen CH, Wei KL, Wu CS. Endoscopic submucosal dissection for the treatment of intraluminal gastric subepithelial tumors originating from the muscularis propria layer. Endoscopy. 2006;38:1024-1028. [PubMed] [DOI] |
| 14. | Bai J, Wang Y, Guo H, Zhang P, Ling X, Zhao X. Endoscopic resection of small gastrointestinal stromal tumors. Dig Dis Sci. 2010;55:1950-1954. [PubMed] [DOI] |
| 15. | Zhang S, Chao GQ, Li M, Ni GB, Lv B. Endoscopic submucosal dissection for treatment of gastric submucosal tumors originating from the muscularis propria layer. Dig Dis Sci. 2013;58:1710-1716. [PubMed] [DOI] |