修回日期: 2015-02-17
接受日期: 2015-03-06
在线出版日期: 2015-04-18
目的: 探讨外周血中单核吞噬细胞的磷脂酰丝氨酸(phosphatidylserine, PS)外翻与其血清依赖的调理作用之间的关系, 为探索生理微环境对于吞噬细胞功能的影响奠定基础.
方法: 基于Ficoll-paque密度梯度离心法分离外周血单核细胞(peripheral blood mononuclear cells, PBMC), 经过PBS充分洗涤之后利用含有和不含血清的RPMI 1640培养基处理细胞, 一定时间之后利用Annexin V染色检测血清处理前后PS外翻的情况; 通过比色法检测胞膜丙二醛(malondialdehyde, MDA)的含量, 以考察脂质过氧化产物对Annexin V检测结果的影响; 通过anti-CD3、anti-CD56、anti-HLA-DR等不同的表面分子抗体染色, 利用流式分析PBMC中不同细胞群的PS外翻情况; 利用表达绿色荧光蛋白的细菌与PBMC共孵育, 通过流式细胞术检测细胞的吞噬能力.
结果: 流式分析表明PBMC经血清处理后PS+细胞比例明显升高, 并且这种升高发生在血清短暂的处理之后; 血清处理对于细胞膜MDA的含量没有显著影响, 排除了脂质过氧化对PS检测的影响; 针对PBMC的细胞表型分析表明HLA-DR+单核吞噬细胞是PBMC中对血清处理敏感的主要细胞亚群, 其在血清处理后Annexin V+细胞中的比例有显著的增加(P<0.05); 细菌吞噬实验表明外翻的PS参与了血清诱导的调理作用.
结论: 吞噬细胞PS外翻是血清依赖的, 并且这种外翻的PS参与了对细菌的调理作用.
核心提示: 本文对单核吞噬细胞血清依赖的调理作用与其组成型的胞膜磷脂酰丝氨酸(phosphatidylserine, PS)外翻之间的联系进行了研究, 表明吞噬细胞胞膜的PS外翻是血清依赖的, 并且这种能够被血清孵育促进的外翻PS参与了对细菌的调理作用.
引文著录: 陈辉, 邵红伟, 陆晓敏, 何免, 沈晗, 吴凤麟, 王辉, 黄树林. 吞噬细胞的磷脂酰丝氨酸外翻与其血清依赖的调理作用的关系. 世界华人消化杂志 2015; 23(11): 1728-1735
Revised: February 17, 2015
Accepted: March 6, 2015
Published online: April 18, 2015
AIM: To investigate the relationship between the exposure of phosphatidylserine (PS) and serum-dependent opsonization in peripheral blood mononuclear cells (PBMCs), to lay a foundation for exploring the influence of physiological microenvironment on the function of phagocytes.
METHODS: PBMCs were isolated from the peripheral blood of healthy individuals using Ficoll-paque and treated by RPMI 1640 medium with or without serum after washing with PBS. The phosphatidylserine (PS) exposure was detected by annexin V staining before and after in vitro serum incubation. Malondialdehyde (MDA) in treated PBMCs was examined by spectrophotometry to evaluate the interference of lipid peroxidation. The PS exposure in different subsets of PBMCs was analyzed by flow cytometry with anti-CD3, anti-CD56 and anti-HLA-DR staining. Phagocytosis was detected by FCM after incubation with bacteria expressing green fluorescent protein (GFP).
RESULTS: PS+ cells significantly increased in PBMCs after serum incubation, and short-term serum incubation immediately induced the increase of PS+ cells. Serum incubation had no influence on the membrane MDA content, which excluded the interference by the products of lipid peroxidation. Cell subset analysis showed that HLA-DR+ mononuclear phagocytes were the main cells exposing PS in PBMCs and significantly increased in Annexin V+ cells. Bacterial phagocytosis showed that the exposed PS was involved in the serum-dependent opsonization.
CONCLUSION: The exposure of PS is serum-dependent and is involved in the opsonization of bacteria by PBMCs.
- Citation: Chen H, Shao HW, Lu XM, He M, Shen H, Wu FL, Wang H, Huang SL. Relationship between phosphatidylserine exposure and serum-dependent opsonization in phagocytes. Shijie Huaren Xiaohua Zazhi 2015; 23(11): 1728-1735
- URL: https://www.wjgnet.com/1009-3079/full/v23/i11/1728.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i11.1728
作为天然免疫的重要组成部分, 血清调理素(serum opsonin)-包括补体和抗体-能够有效地促进吞噬细胞的吞噬作用, 此即调理作用(opsonization)[1-5]. 有研究[6,7]表明, 一些吞噬细胞只有在血清存在的情况下, 才能发挥吞噬作用, 这种现象称之为血清依赖的调理作用. 一般来说, 调理作用的目的是清除一些被调理(opsonized)的颗粒性抗原, 这一过程通常是由吞噬细胞膜表面的特异性受体介导的, 如FcR、CR1等[8-12]. 目前发现血清中能够发挥调理作用的分子还有很多, 如血小板反应蛋白Ⅰ、β2糖蛋白Ⅰ、C反应蛋白、DNA酶Ⅰ等等[13-17], 而这些分子是否借助特定的膜受体发挥调理作用、通过哪些受体发挥作用、是否还有其他影响调理作用的机制等很多问题目前还不清楚, 因此有必要对血清依赖的调理作用的机制进行进一步的研究.
磷脂酰丝氨酸(phosphatidylserine, PS)是细胞膜的一种成分, 通常位于细胞膜的内层, 在细胞发生凋亡的时候, 细胞膜的这种不对称性发生了破坏[18,19], 导致PS的外翻(inside-to-outside movement or flop). 然而, PS外翻并不总是意味着细胞的凋亡[20], 如单核细胞来源的吞噬细胞表面就组成型的表达PS, 并且有研究表明这种PS外翻与其特定的吞噬功能密切相关[21,22]. 如果封闭其表面的PS, 单核吞噬细胞吞噬凋亡胸腺细胞的活性显著下降, 但是对其他受体介导的吞噬活性并无抑制作用[21], 因此表面外翻的PS是单核吞噬细胞特定清除凋亡细胞所必需的. 然而, 目前对于单核吞噬细胞表面PS外翻的机制有不同的看法, 有人认为由凋亡细胞上脱落下来的囊泡被吞噬细胞摄取后将外翻的PS传递给了后者[22,23]. 还有人认为是PS转运蛋白将PS从胞膜内侧转运到了外侧, 或者是膜的不对称性在单核吞噬细胞中与其他细胞有所不同[22]. 因此导致单核细胞表面PS外翻的机制仍然是不清楚的.
众所周知, 细胞所处的微环境对于细胞发挥生理功能具有重要的影响, 单核吞噬细胞在体内通常处于血清所组成的微环境中, 因此我们考虑吞噬细胞的PS外翻与血清依赖的调理作用之间是否存在某种联系呢? 在本文中我们对这一问题进行了研究.
在本研究中, 我们通过Annexin V染色来示踪PS. 结果显示外周血单核细胞(peripheral blood mononuclear cells, PBMC)在体外刚分离出来时, PS外翻的细胞比例很低, 但是在经过一段时间培养后再进行检测时, 这群细胞的比例显著升高, 这种PS外翻的现象在接触血清后的很短时间内(1 h内)就能检测到. 通过流式表型分析, 这群细胞大多是MHC-Ⅱ+的, 证明其确是PBMC中的单核吞噬细胞. 我们对细胞的吞噬能力进行了检测, 结果表明在血清诱导的PS外翻的前提下, 加入能与PS特异性结合的Annexin V, 能够显著地增加细胞吞噬细菌的能力, 因此我们的研究表明, 血清能够诱导PBMC的胞膜PS外翻, 并且外翻的PS参与了对细菌的调理作用.
人外周血来自于实验室志愿者, 经肝素钠抗凝管采集. 表达绿色荧光蛋白的大肠杆菌(Escherichia coli, E. coli)由华南理工大学蓝东明副教授惠赠. Annexin V-FITC Apoptosis Detection Kit Ⅰ购自美国BD公司; 细胞脂质丙二醛(malondialdehyde, MDA)活性TBARS光度法定量检测试剂盒购自上海杰美基因医药科技有限公司; anti-CD3, anti-CD56和anti-HLA-DR单克隆抗体购自美国Beckman Coulter公司; Ficoll-paque分离液购自美国GE公司; RPMI 1640培养基和胎牛血清均购自美国Life公司.
1.2.1 PBMC的分离: 健康人外周血经抗凝管采集后, 用等量的生理盐水进行稀释, 稀释后的外周血小心铺加于含适量Ficoll-paque淋巴细胞分离液的液面上, 随后按要求进行离心、吸取和洗涤, 洗涤后的PBMC或进行流式检测或重悬于相应的培养基中进行后续实验.
1.2.2 PBMC的体外处理: 长时间培养: 新鲜分离的PBMC或者立即上机检测, 或者重悬于含10%胎牛血清的RPMI 1640培养基中, 同时加入终浓度为1000 IU/mL的IL-2, 以及100 IU/mL的氨苄青霉素和50 μg/mL的链霉素, 每3 d进行半量换液, 在培养的3 d和7 d分别进行相应的检测.
短期处理: 新鲜分离的PBMC重悬于含有或者不含胎牛血清的RPMI 1640培养基中, 于37 ℃ 50 mL/L CO2条件下培养1 h, 然后收集细胞进行相应的检测.
1.2.3 Annexin V-FITC/PI双标记检测: 取1×106个细胞, 收集于1.5 mL离心管中, 400 g离心8 min, 弃上清液, 用预冷的PBS洗涤2次, 重悬于100 μL binding buffer中. 避光加入2.5 μL Annexin V-FITC和5 μL PI于细胞悬液中, 轻轻混匀. 常温避光染色15 min. 再加入400 μL binding buffer混悬细胞, 转移至流式管, 1 h内进行流式分析.
1.2.4 TBARS光度法脂质过氧化检测: 取2×107个细胞, 参照Genmed公司脂质过氧化检测试剂盒的检测方法, 提取总蛋白, BCA法测定总蛋白浓度, 并调节蛋白浓度一致(在20-50 mg/mL范围内), 酶标仪检测MDA的吸光值.
1.2.5 流式抗体与Annexin V-FITC共染: 取1×106个细胞, PBS洗涤、重悬后加入相应荧光标记的单克隆抗体, 避光染色20 min后用预冷的PBS洗涤2次, 重悬于100 μL binding buffer中, 按上述方法加入Annexin V-FITC进行染色, 1 h内进行流式分析.
1.2.6 PBMC的吞噬效率检测: 利用4%甲醛对绿色荧光蛋白细菌进行固定, 经PBS洗涤后, 取100 μL菌液加入各组PBMC细胞, 于37 ℃ 50 mL/L CO2条件下培养30 min后, 利用流式细胞仪检测细胞的吞噬效率, 将FS阈值设为100, 以去除游离细菌的干扰.
统计学处理 本实验相关数据利用Excel进行统计分析, 相关数据以mean±SD表示, 采用单因素方差分析比较各组差异. 当P<0.05为差异具有统计学意义.
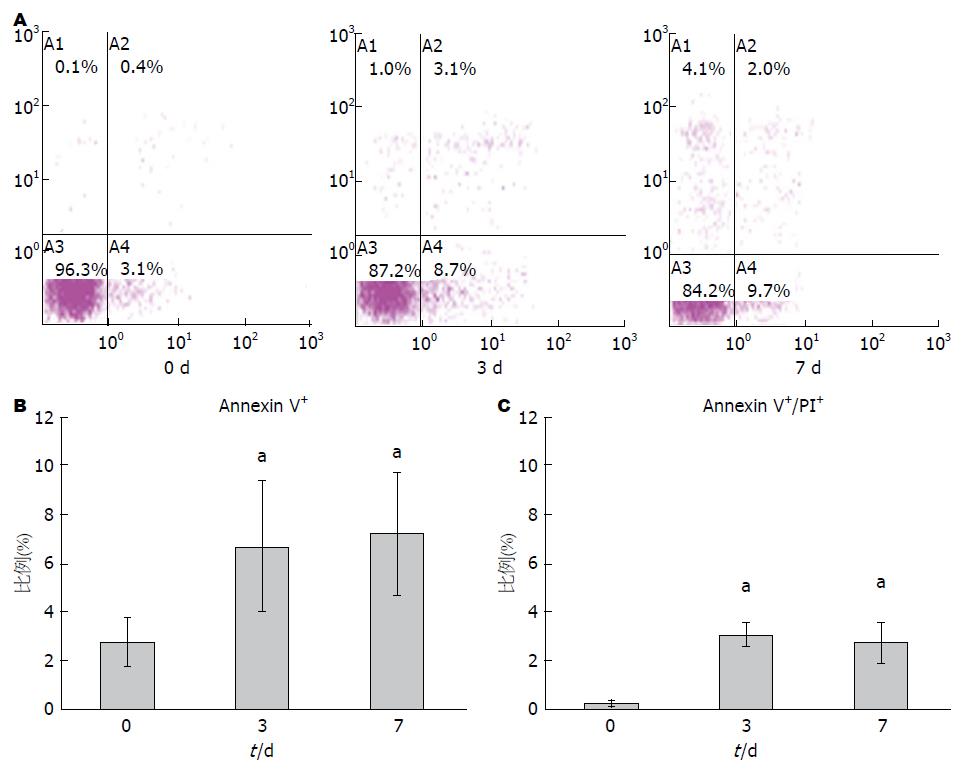
利用Ficoll-paque从外周血中分离PBMC, 经生理盐水洗涤后, 一部分进行Annexin V/PI染色, 并进行流式检测. 其余部分重悬于含10%FBS的RPMI 1640培养基中, 于37 ℃, 50 mL/L CO2条件下培养, 分别在培养的3 d和7 d收集细胞, 利用流式检测Annexin V/PI的染色情况. 结果显示, 培养后的PBMC其Annexin V染色阳性比例有显著的增加(图1A, B), 刚分离时PBMC中Annexin V+细胞比例为2%左右, 在培养至第3天时, 这一比例超过了6%, 第7天时仍略有上升. 但是增加的Annexin V单阳性的这部分细胞并没有随着时间的增加而进入Annexin V/PI双阳性象限(图1C), 第7天和第3天时Annexin V+/PI+差异没有统计学意义(P<0.05), 从而证明Annexin V单阳性的这部分细胞并不是处于早期凋亡状态的细胞, 而只是发生了PS外翻.
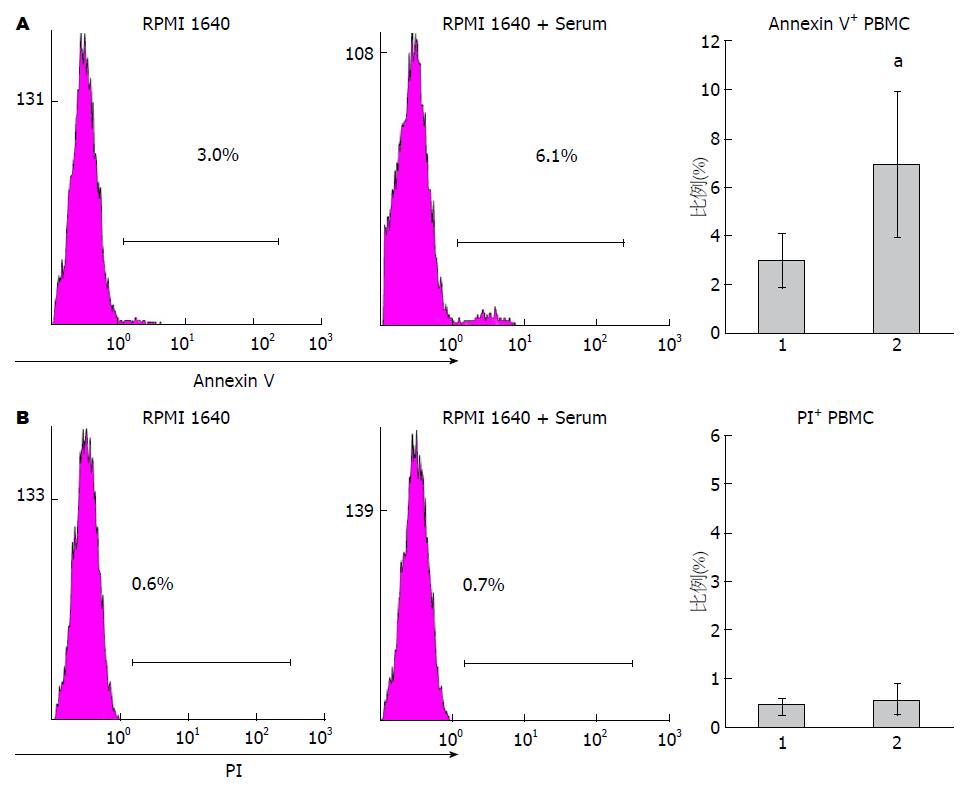
取新鲜分离的PBMC样本, 经生理盐水洗涤后, 分别用含有或者不含胎牛血清的RPMI 1640培养基重悬, 于37 ℃、50 mL/L CO2条件下培养1 h后, 收集细胞进行Annexin V-FITC/PI双标记流式检测. 结果显示, 含血清培养基处理的PBMC其Annexin V+细胞比例显著高于不含血清培养基处理组, 且具有显著性差异(P<0.05), 而PI染色阳性细胞在处理前后并没有显著差异(图2). 这表明血清处理能够显著促使PBMC胞膜的PS外翻.
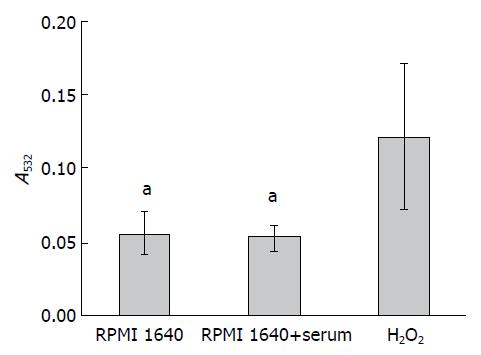
有研究指出, Annexin V除了能与PS结合外, 还能够与细胞膜中的一些脂质过氧化产物, 如MDA结合[20]. 因此为了排除Annexin V染色是由于PBMC胞膜中的MDA增加造成的, 我们对各组PBMC中的MDA含量进行了检测, 以H2O2处理组作为阳性对照. 结果表明(图3), 含血清培养基处理的PBMC胞膜MDA含量与不含血清培养基处理的PBMC组没有显著差异, 但是两者均与H2O2处理组差异具有统计学意义(P<0.05), 这表明PBMC中Annexin V染色阳性确实是由于PS外翻造成的.
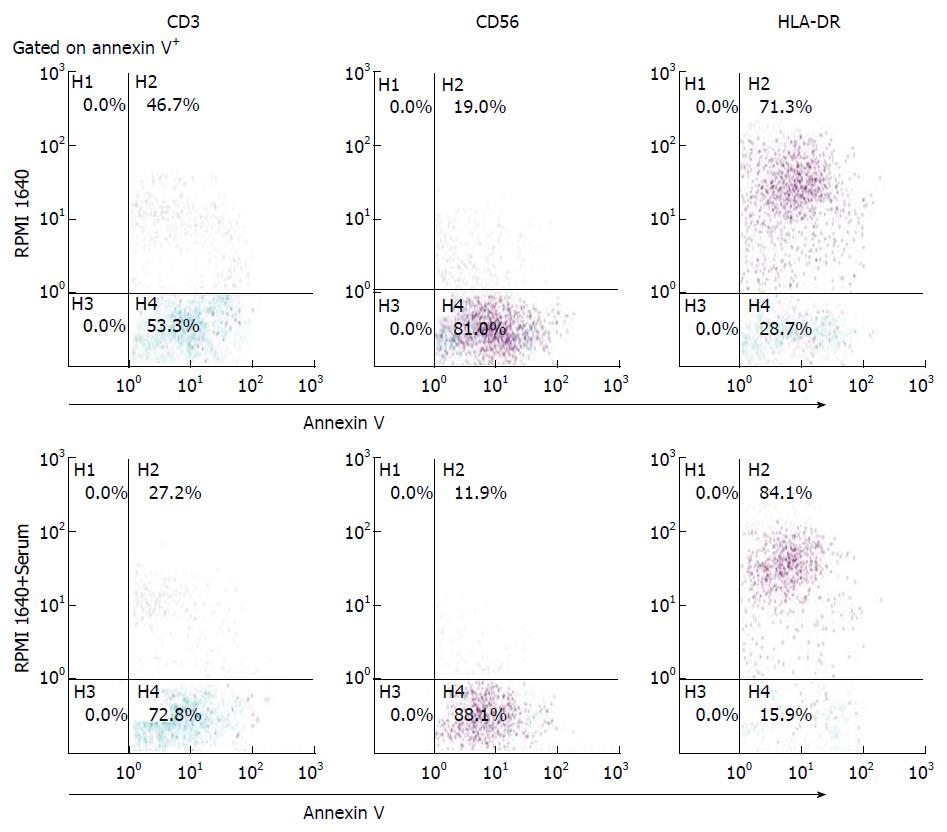
由于PBMC中含有不同类型的细胞, 我们又对不同类型细胞表面PS外翻的情况进行了检测. 结果显示(图4), 在检测的几种PBMC细胞中, 血清处理后annexin V+细胞中只有HLA-DR+细胞的PS外翻显著增加, 其他几种细胞的比例都是下降的, 且差异均具有统计学意义(P<0.05). 这表明PBMC中的单核吞噬细胞是对血清处理敏感的主要细胞亚群, 血清接触是促使其PS外翻的重要条件.
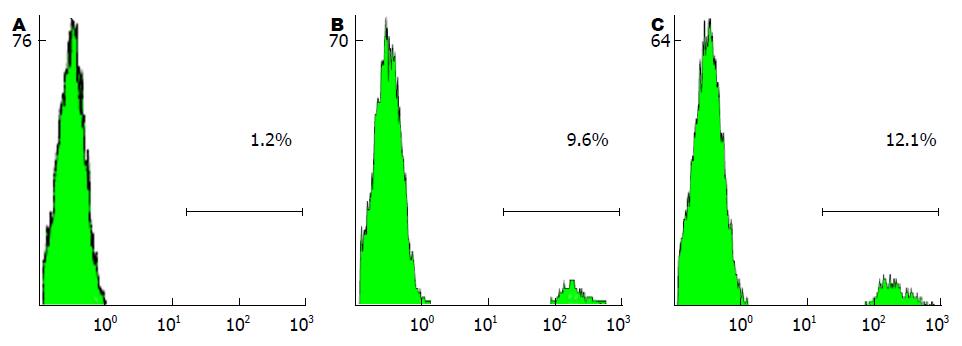
为了阐明外翻的PS是否能够影响细胞的吞噬作用, 我们对血清处理前后PBMC吞噬绿色荧光蛋白细菌的能力进行了检测(图5). 结果表明, 未经血清处理的PBMC其吞噬能力非常低, 只有1%左右的细胞具有吞噬能力; 经过血清处理后, 吞噬细胞的比例超过了9%; 而利用PS特异性的配体Annexin V与血清一起处理PBMC, 则吞噬细胞的比例增加到了12%左右, 并且未经血清处理组与其他两组间差异具有统计学意义(P<0.01), 其他两组之间差异也具有统计学意义(P<0.05). 这一结果表明, 外翻的PS参与了吞噬细胞对细菌的吞噬作用.
大部分的细胞其氨基磷脂都是分布在细胞膜的内侧, 这是一个耗能的过程[24-27], 表明这种分布对于正常的细胞功能至关重要. 然而部分类型的细胞如巨噬细胞、血小板、B淋巴细胞、成肌细胞等, 在正常生理状态下, 其PS组成型的位于胞膜外侧[28-30], 表明暴露的PS对于这些细胞的功能和分化非常重要.
有研究[21]表明, PS外翻对于吞噬细胞发挥吞噬凋亡细胞的功能具有促进作用, 但是对于Fc受体介导的对红细胞的吞噬作用没有影响. 然而如前所述, 对于吞噬细胞PS外翻的机制, 目前还没有统一的看法. 而吞噬细胞血清依赖的调理作用这一现象, 使得我们认识到有必要对血清处理和PS外翻之间的联系进行研究.
我们的结果显示, 体外新鲜分离的PBMC在接触血清之前, 其PS+细胞比例很低, 一旦接触血清, PS+细胞的比例很快有显著性的升高(图2). 结合细胞表型分析, 升高的PS+细胞主要是HLA-DR+的(图3), 表明血清接触主要促进PBMC中单核吞噬细胞的PS外翻. 短暂的接触就能诱导显著的PS外翻, 并且发生在没有外来凋亡细胞存在的情况下, 这一结果排除了吞噬细胞摄取凋亡细胞脱落的囊泡从而导致其PS显露在胞外的可能性. 同时由于这种PS外翻发生的时间较短(可以发生在1 h甚至更短的时间内), 不太可能依赖于某些基因表达的变化, 因此这也表明, 是血清中的某种特定成分直接诱导或者通过细胞膜上的PS转运蛋白导致单核吞噬细胞发生了PS的外翻. 此外, 针对细菌的吞噬能力检测显示, 血清诱导的PS外翻参与了吞噬细胞对细菌的调理作用, 这表明血清调理作用, 不仅可以通过FcR和补体受体等分子发挥作用, 也可以通过PS发挥作用.
至于血清中的何种成分诱导了单核吞噬细胞的PS外翻, 血清诱导的PS外翻是否需要细胞膜中PS转运蛋白的参与以及何种转运蛋白的参与, 这种表型变化对其功能有何意义, 这些问题都有待进一步的深入研究.
总之, 本研究表明吞噬细胞PS外翻是血清依赖的, 并且这种外翻的PS参与了对细菌的调理作用, 这一结果为揭示吞噬细胞PS外翻的机制提供了思路.
单核吞噬细胞表现出血清依赖的调理作用, 表明血清微环境对其正常生理功能的重要作用, 但具体机制仍待进一步研究. 组成型的磷脂酰丝氨酸(phosphatidylserine, PS)外翻是单核吞噬细胞的特征, 且与其特定的吞噬功能密切相关. 两者之间是否存在某种联系值得进行研究.
陆斌, 副教授, 中国人民解放军第二军医大学
单核吞噬细胞具有血清依赖的调理作用, 血清中发挥调理作用的分子种类众多, 但具体机制还不清楚. PS外翻促进单核吞噬细胞吞噬凋亡的细胞, 但对Fc受体介导的吞噬作用没有影响, 且导致单核吞噬细胞表面PS外翻的机制仍有争议, 因此有必要对此开展研究.
Callahan等发现吞噬细胞表面PS对于细胞的吞噬功能必不可少, 表明PS参与了吞噬作用. Liu等发现肝脏吞噬含有PS的脂质体具有血清依赖的现象, 表明血清处理对于PS参与的吞噬具有密切关系. Mapes等的报道表明导致单核细胞表面PS外翻的机制尚不清楚.
本研究结果表明外周血单核吞噬细胞的胞膜PS外翻是血清依赖的, 并且这种血清诱导的PS外翻参与了对细菌的调理作用, 本研究结果将血清依赖的调理作用这一现象与吞噬细胞PS外翻的表型特征联系在了一起, 为揭示吞噬细胞的吞噬机制开拓了思路.
本研究表明血清处理可以通过增加单核吞噬细胞PS外翻而促进其吞噬能力, 从而为阐明吞噬细胞的作用机制奠定了基础, 本研究结果还可为利用这一机制增加或抑制吞噬细胞对颗粒性抗原, 如病毒、携药脂质体、外泌体等的吞噬能力提供了思路.
血清依赖的调理作用: 是指一些吞噬细胞只有在血清存在的情况下, 才能发挥吞噬作用的现象;
PS外翻: PS是细胞膜的一种成分, 通常位于细胞膜的内层, 在某些特定的细胞类型或者凋亡的细胞中, 这种膜的不对称性发生了改变, 从内层翻转到外层的现象即为PS外翻.
通过检测血清处理后PBMC的PS外翻情况及不同细胞亚群的占比, 发现HLA-DR+单核吞噬细胞作为PBMC中对血清处理敏感的主要细胞亚群, 依赖血清刺激参与了对细菌的调理作用. 研究内容及课题设计合理, 具有一定的研究意义.
编辑: 郭鹏 电编: 都珍珍
| 1. | Zarafonetis C, Harmon DR, Clark PF. The Influence of Temperature upon Opsonization and Phagocytosis. J Bacteriol. 1947;53:343-349. [PubMed] |
| 2. | Victor J, Beall FA. Mechanisms of citrate inhibition of phagocytosis and opsonization. J Infect Dis. 1954;95:285-290. [PubMed] [DOI] |
| 3. | Martin WJ. Assay for the immunosuppressive capacity of antilymphocyte serum. I. Evidence for opsonization. J Immunol. 1969;103:979-989. [PubMed] |
| 4. | Mulye M, Bechill MP, Grose W, Ferreira VP, Lafontaine ER, Wooten RM. Delineating the importance of serum opsonins and the bacterial capsule in affecting the uptake and killing of Burkholderia pseudomallei by murine neutrophils and macrophages. PLoS Negl Trop Dis. 2014;8:e2988. [PubMed] [DOI] |
| 5. | Bidula S, Sexton DW, Abdolrasouli A, Shah A, Reed A, Armstrong-James D, Schelenz S. The serum opsonin L-ficolin is detected in lungs of human transplant recipients following fungal infections and modulates inflammation and killing of Aspergillus fumigatus. J Infect Dis. 2015; Jan 22. [Epub ahead of print]. [PubMed] [DOI] |
| 6. | Liu D, Liu F, Song YK. Recognition and clearance of liposomes containing phosphatidylserine are mediated by serum opsonin. Biochim Biophys Acta. 1995;1235:140-146. [PubMed] |
| 7. | Leijh PC, van den Barselaar MT, van Zwet TL, Dubbeldeman-Rempt I, van Furth R. Kinetics of phagocytosis of Staphylococcus aureus and Escherichia coli by human granulocytes. Immunology. 1979;37:453-465. [PubMed] |
| 8. | Ali F, Lee ME, Iannelli F, Pozzi G, Mitchell TJ, Read RC, Dockrell DH. Streptococcus pneumoniae-associated human macrophage apoptosis after bacterial internalization via complement and Fcgamma receptors correlates with intracellular bacterial load. J Infect Dis. 2003;188:1119-1131. [PubMed] [DOI] |
| 9. | Berger M, Norvell TM, Tosi MF, Emancipator SN, Konstan MW, Schreiber JR. Tissue-specific Fc gamma and complement receptor expression by alveolar macrophages determines relative importance of IgG and complement in promoting phagocytosis of Pseudomonas aeruginosa. Pediatr Res. 1994;35:68-77. [PubMed] [DOI] |
| 10. | Nardin A, Lindorfer MA, Taylor RP. How are immune complexes bound to the primate erythrocyte complement receptor transferred to acceptor phagocytic cells? Mol Immunol. 1999;36:827-835. [PubMed] |
| 11. | Thomas-Rudolph D, Du Clos TW, Snapper CM, Mold C. C-reactive protein enhances immunity to Streptococcus pneumoniae by targeting uptake to Fc gamma R on dendritic cells. J Immunol. 2007;178:7283-7291. [PubMed] [DOI] |
| 12. | Polando R, Dixit UG, Carter CR, Jones B, Whitcomb JP, Ballhorn W, Harintho M, Jerde CL, Wilson ME, McDowell MA. The roles of complement receptor 3 and Fcγ receptors during Leishmania phagosome maturation. J Leukoc Biol. 2013;93:921-932. [PubMed] [DOI] |
| 13. | Mevorach D. Opsonization of apoptotic cells. Implications for uptake and autoimmunity. Ann N Y Acad Sci. 2000;926:226-235. [PubMed] [DOI] |
| 14. | Gaipl US, Kuhn A, Sheriff A, Munoz LE, Franz S, Voll RE, Kalden JR, Herrmann M. Clearance of apoptotic cells in human SLE. Curr Dir Autoimmun. 2006;9:173-187. [PubMed] [DOI] |
| 15. | Reed JH, Clancy RM, Purcell AW, Kim MY, Gordon TP, Buyon JP. β2-glycoprotein I and protection from anti-SSA/Ro60-associated cardiac manifestations of neonatal lupus. J Immunol. 2011;187:520-526. [PubMed] [DOI] |
| 16. | Goundis D, Reid KB. Properdin, the terminal complement components, thrombospondin and the circumsporozoite protein of malaria parasites contain similar sequence motifs. Nature. 1988;335:82-85. [PubMed] [DOI] |
| 17. | Manfredi AA, Rovere P, Heltai S, Galati G, Nebbia G, Tincani A, Balestrieri G, Sabbadini MG. Apoptotic cell clearance in systemic lupus erythematosus. II. Role of beta2-glycoprotein I. Arthritis Rheum. 1998;41:215-223. [PubMed] |
| 18. | Tanaka Y, Schroit AJ. Insertion of fluorescent phosphatidylserine into the plasma membrane of red blood cells. Recognition by autologous macrophages. J Biol Chem. 1983;258:11335-11343. [PubMed] |
| 19. | Biermann M, Maueröder C, Brauner JM, Chaurio R, Janko C, Herrmann M, Muñoz LE. Surface code--biophysical signals for apoptotic cell clearance. Phys Biol. 2013;10:065007. [PubMed] [DOI] |
| 20. | Balasubramanian K, Schroit AJ. Aminophospholipid asymmetry: A matter of life and death. Annu Rev Physiol. 2003;65:701-734. [PubMed] [DOI] |
| 21. | Callahan MK, Williamson P, Schlegel RA. Surface expression of phosphatidylserine on macrophages is required for phagocytosis of apoptotic thymocytes. Cell Death Differ. 2000;7:645-653. [PubMed] |
| 22. | Mapes J, Chen YZ, Kim A, Mitani S, Kang BH, Xue D. CED-1, CED-7, and TTR-52 regulate surface phosphatidylserine expression on apoptotic and phagocytic cells. Curr Biol. 2012;22:1267-1275. [PubMed] [DOI] |
| 23. | Zhang Y, Wang H, Kage-Nakadai E, Mitani S, Wang X. C. elegans secreted lipid-binding protein NRF-5 mediates PS appearance on phagocytes for cell corpse engulfment. Curr Biol. 2012;22:1276-1284. [PubMed] [DOI] |
| 24. | Pomorski T, Hrafnsdóttir S, Devaux PF, van Meer G. Lipid distribution and transport across cellular membranes. Semin Cell Dev Biol. 2001;12:139-148. [PubMed] [DOI] |
| 25. | Kim JE, Han M, Hanl KS, Kim HK. Vitamin E inhibition on platelet procoagulant activity: involvement of aminophospholipid translocase activity. Thromb Res. 2011;127:435-442. [PubMed] [DOI] |
| 26. | Mioka T, Fujimura-Kamada K, Tanaka K. Asymmetric distribution of phosphatidylserine is generated in the absence of phospholipid flippases in Saccharomyces cerevisiae. Microbiologyopen. 2014;3:803-821. [PubMed] [DOI] |
| 27. | Son M, London E. The dependence of lipid asymmetry upon polar headgroup structure. J Lipid Res. 2013;54:3385-3393. [PubMed] [DOI] |
| 28. | Bevers EM, Comfurius P, Zwaal RF. Changes in membrane phospholipid distribution during platelet activation. Biochim Biophys Acta. 1983;736:57-66. [PubMed] [DOI] |
| 29. | Dillon SR, Constantinescu A, Schlissel MS. Annexin V binds to positively selected B cells. J Immunol. 2001;166:58-71. [PubMed] [DOI] |
| 30. | Sessions A, Horwitz AF. Differentiation-related differences in the plasma membrane phospholipid asymmetry of myogenic and fibrogenic cells. Biochim Biophys Acta. 1983;728:103-111. [PubMed] [DOI] |