修回日期: 2015-02-14
接受日期: 2015-03-06
在线出版日期: 2015-04-08
目的: 炎症因子在重症急性胰腺炎(sever acute pancreatitis, SAP)继发急性肾损伤(acute kidney injury, AKI)中起重要作用, 探讨趋化因子受体CX3CR1在大鼠SAP继发AKI的表达及其作用.
方法: 30只♂SD大鼠, 随机分为SAP组、轻型急性胰腺炎(mild acute pancreatitis, MAP)组及假手术(sham operation, SO)组, 每组10只, 以3.5%牛磺胆酸钠建立SAP模型, 以20% L-精氨酸建立MAP模型. 光镜下观察胰腺及肾脏组织病理学表现; 检测血清淀粉酶、肌酐及尿素氮水平; 蛋白质印迹法及免疫组织化学法检测肾脏组织CX3CR1的表达及定位.
结果: SAP组胰腺及肾脏组织病理学评分、血清淀粉酶、肌酐、尿素氮及肾脏组织CX3CR1蛋白表达水平均较MAP组及SO组显著升高(P<0.05). Spearman等级相关系数及Peason相关系数分析示, 肾脏组织CX3CR1表达水平与肾脏组织病理学评分、血清肌酐及尿素氮水平呈正相关(r1 = 0.878, P<0.01; r2 = 0.829, P<0.01; r3 = 0.78, P<0.01).
结论: 趋化因子受体CX3CR1参与SAP继发AKI过程, 其水平可反映AKI严重程度.
核心提示: 目前对趋化因子受体CX3CR1在重症急性胰腺炎(severe acute pancreatitis, SAP)继发急性肾损伤(acute kidney injury, AKI)的作用研究报道较少. 本课题组前期研究已证实趋化因子受体CX3CR1在SAP体外细胞中高表达, 本研究表明CX3CR1在体内SAP继发AKI动物模型中高表达, 且可作为SAP继发AKI严重程度的预测指标.
引文著录: 付春萍, 黄李雅, 杨力. CX3CR1在大鼠重症急性胰腺炎继发急性肾损伤中的表达及作用. 世界华人消化杂志 2015; 23(10): 1553-1559
Revised: February 14, 2015
Accepted: March 6, 2015
Published online: April 8, 2015
AIM: To investigate the expression of chemokine receptor CX3CR1 in acute kidney injury (AKI) associated with severe acute pancreatitis (SAP) in rats.
METHODS: Thirty male Sprague-Dawley rats were randomly divided into an SAP group, a mild acute pancreatitis (MAP) group and a sham operation (SO) group, with 10 rats in each group. SAP was induced in rats with 3.5% sodium taurocholate, while MAP was induced with 20% L-arginine. Histopathological changes in the pancreas and kidney tissues were examined under a light microscope. Serum amylase, creatinine and urea nitrogen levels were detected. Localization and expression of CX3CR1 in the kidney were determined by Western blot and immunohistochemical staining.
RESULTS: Compared with the MAP and SO groups, kidney histopathological score, levels of serum amylase, creatinine and urea nitrogen, as well as expression level of CX3CR1 in kidney tissue in the SAP group increased significantly (P < 0.05). Spearman's rank correlation analysis showed that expression of CX3CR1 was positively correlated with kidney histopathological score (r1 = 0.878, P < 0.01). Pearson's correlation analysis showed that expression of CX3CR1 was positively correlated with serum creatinine and urea nitrogen levels (r2 = 0.829, P < 0.01; r3 = 0.78, P < 0.01).
CONCLUSION: Chemokine receptor CX3CR1 is involved in the process of SAP associated AKI, and its level can reflect the severity of AKI.
- Citation: Fu CP, Huang LY, Yang L. Expression of CX3CR1 in acute kidney injury associated with acute pancreatitis in rats. Shijie Huaren Xiaohua Zazhi 2015; 23(10): 1553-1559
- URL: https://www.wjgnet.com/1009-3079/full/v23/i10/1553.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i10.1553
重症急性胰腺炎(severe acute pancreatitis, SAP)是临床常见的急危重症疾病, 常并发多器官损伤的全身性并发症. 肾脏是较常见的胰腺外受损器官. SAP患者一旦出现急性肾损伤(acute kidney injury, AKI), 其死亡率明显升高[1]. 已有多项研究[2-6]表明, 炎症因子参与SAP继发AKI发病过程. 本课题组前期研究[7]发现, 在SAP体外细胞模型中, 趋化因子受体CX3CR1高表达, 但其在SAP体内动物模型中的表达情况尚不清楚. 因此, 本研究拟通过大鼠SAP合并AKI模型, 观察趋化因子受体CX3CR1的表达情况, 希望寻找出早期预测SAP合并AKI的指标.
健康♂成年SD大鼠30只, 清洁级, 体质量200-250 g, 由宁夏医科大学实验动物中心提供. 牛磺胆酸钠及L-精氨酸(美国Sigma公司); 兔抗大鼠多克隆抗体(美国Abcam公司); 辣根过氧化物酶(horseradish peroxidase, HRP)标记二抗(北京中杉金桥生物技术有限公司); 全蛋白提取试剂盒及BCA蛋白含量检测试剂盒(南京凯基生物科技发展有限公司).
1.2.1 动物分组与大鼠动物模型制备: 30只♂SD大鼠随机分为SAP组、轻型急性胰腺炎(mild acute pancreatitis, MAP)组和假手术(sham operation, SO)组, 每组10只. 大鼠适应性饲养1 wk, 术前24 h禁食, 不禁水. SAP组大鼠以1%戊巴比妥钠(0.6 mL/100 g)腹腔注射麻醉, 正中切口入腹, 血管夹夹闭胆总管, 24号套管针自十二指肠前壁穿刺进入胰管, 逆行性经微量注射泵缓慢匀速(0.1 mL/min)注入5%牛磺胆酸钠(0.1 mL/100 g), 1 min后见胰腺出现出血、坏死样改变后, 去除血管夹, 逐层关腹[8]. MAP组大鼠分3次腹腔内注射20%L-精氨酸溶液(1000 mg/100 g), 每次间隔1 h[9]. SO组仅行开关腹手术.
1.2.2 标本采集: 3组大鼠均于制模后24 h处死. 1%戊巴比妥钠腹腔麻醉后, 原正中切口开腹, 经腹主动脉穿刺取血, 离心后取上清置-80 ℃冰箱保存待检. 留取大鼠胰腺、肾脏组织标本, 一部分置于40 g/L多聚甲醛固定用于HE染色和免疫组织化学检测, 余置于-80 ℃冰箱待检.
1.2.3 胰腺、肾脏组织病理学观察: 取胰腺及肾脏组织HE染色, 光镜下阅片, 每张切片随机选取5个视野并对组织损伤进行评分. 胰腺组织病理学评分采用改良Grewal等[10]评分标准; 肾脏组织病理学损伤评分采用Smith等[11]的评分标准.
1.2.4 血清肌酐、尿素氮、淀粉酶水平检测: 将血清标本送宁夏医科大学总医院检验科, 采用Beckman X7型全自动生化分析仪检测血清肌酐、尿素氮、淀粉酶水平.
1.2.5 蛋白质印迹法检测大鼠肾脏组织CX3CR1表达: 取适量肾脏组织, 抽提总蛋白, BCA蛋白定量试剂盒定量. 取50 μg蛋白样品, SDS-PAGE蛋白电泳分离并转移至PVDF膜, 分别加入兔抗大鼠CX3CR1多克隆抗体(1:1000)、GAPDH抗体(1:1000), 一抗4 ℃孵育过夜, TBST(Tris-HCL缓冲液+Tween)洗膜3次, 每次10 min, 加入HRP标记的IgG二抗(CX3CR1 1:3000, GAPDH 1:2000), 室温孵育2 h, ECL显影. Bio-Rad数码成像系统扫描图片, 应用Quantity One软件, 以GAPDH为内参定量分析CX3CR1灰度值.
1.2.6 免疫组织化学法测定大鼠肾脏组织CX3CR1表达: 应用S-P法将石蜡切片常规脱蜡至水, 修复抗原, 加入兔抗大鼠多克隆抗体(CX3CR1工作液1:400), 阴性对照加入PBS液替代一抗, 4 ℃冰箱过夜, 加入HRP标记的通用型二抗室温孵育30 min, DAB显色, 苏木素复染, 切片脱水、透明. 以胞浆或胞膜呈棕黄色染色为阳性细胞.
统计学处理 应用统计软件SPSS17.0对数据进行统计学分析, 所有数据采用mean±SD表示, 多样本均数比较采用单因素方差分析, 两两比较采用LSD法. 相关性分析采用Spearman等级相关系数及Peason相关系数. P<0.05为差异有统计学意义.
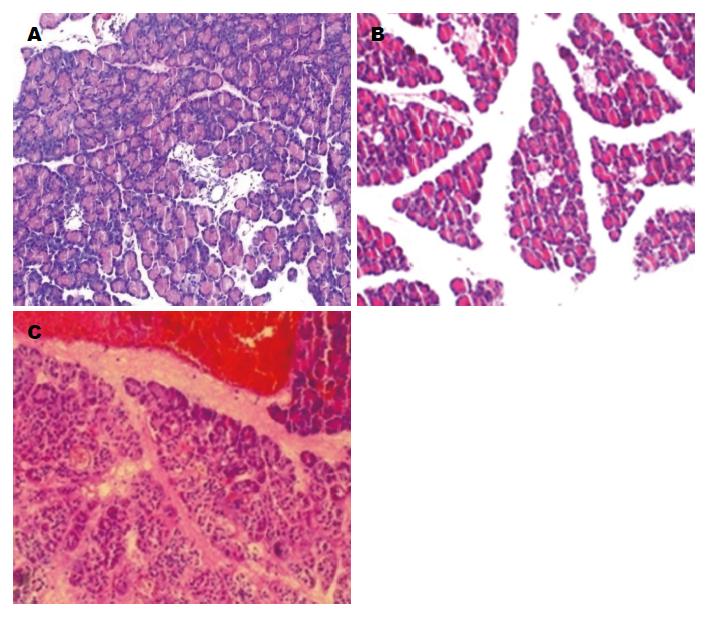
SO组胰腺腺泡结构完整, 间质未见水肿, 未见炎症细胞浸润或腺泡细胞坏死(图1A). MAP组胰腺间质明显水肿, 少量炎症细胞浸润及极少量腺泡细胞坏死(图1B). SAP组胰腺腺泡细胞大片坏死, 间质出血, 大量炎症细胞浸润(图1C). SAP组胰腺组织病理学评分较MAP组和SO组显著升高(P<0.05)(表1), MAP组胰腺组织病理学评分较SO组明显升高(P<0.05)(表1).
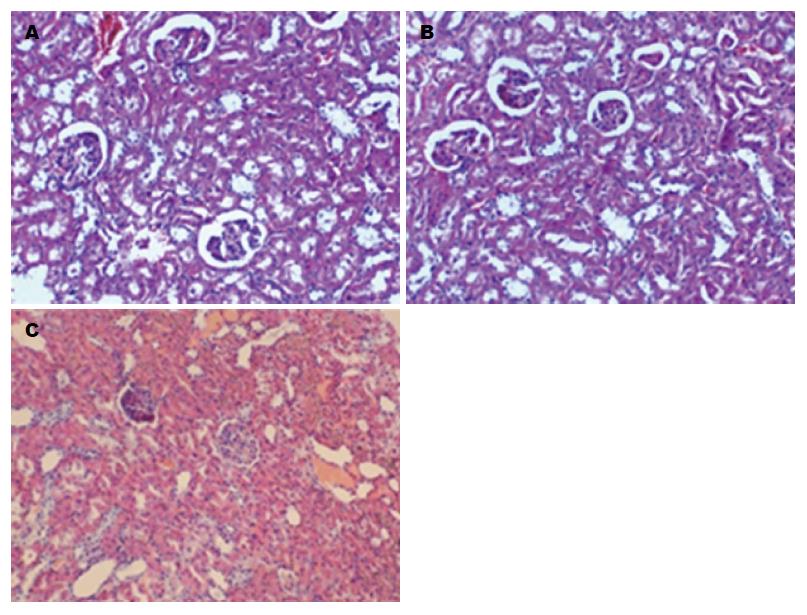
SO组未见明显病理学改变(图2A). MAP组肾小管上皮轻度水肿, 少量炎症细胞浸润(图2B). SAP组可见肾小球退行性变, 肾小管上皮水肿、坏死, 管腔明显狭窄, 肾间质淤血, 炎症细胞浸润(图2C). SAP组肾脏组织病理学评分较MAP组及SO组显著升高(P<0.05)(表1).
SAP组血清淀粉酶较MAP组及SO组显著升高(P<0.05)(表1), MAP组较SO组明显升高(P<0.05)(表1). SAP组血清肌酐较MAP组及SO组显著升高(P<0.05)(表1). SAP组血清尿素氮较MAP组及SO组显著升高(P<0.05)(表1).
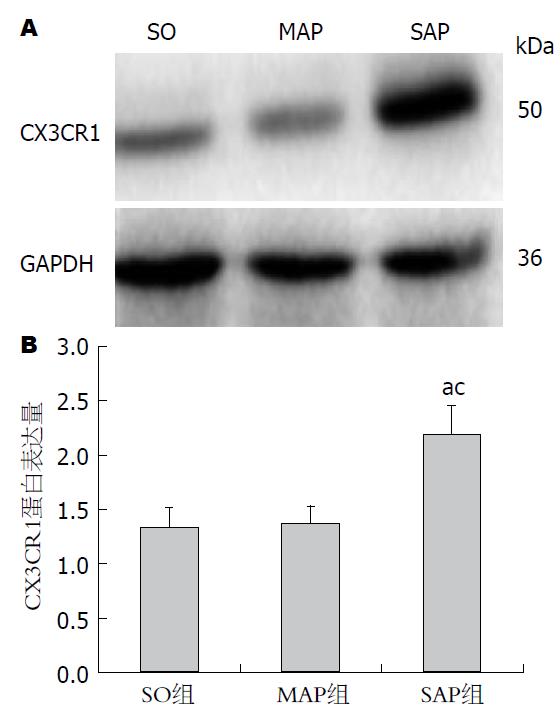
蛋白质印迹法检测结果: SAP组肾脏组织CX3CR1蛋白表达水平(2.19±0.26)较MAP组(1.36±0.17)及SO组(1.33±0.18)显著升高(P<0.05)(图3B).
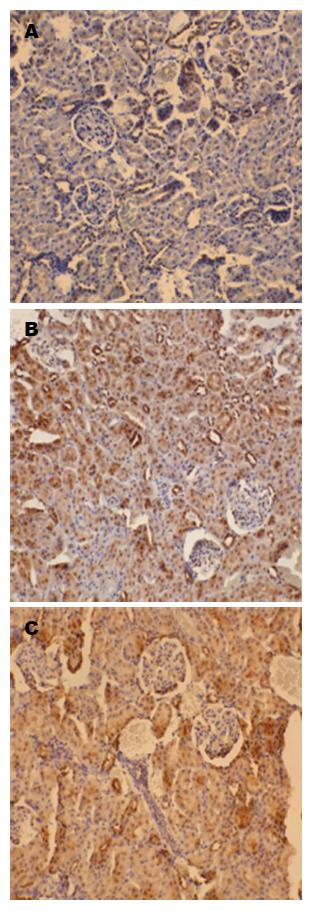
免疫组织化学法检测结果: 在SO组肾脏组织中呈低表达或不表达(图4A), 在MAP组肾脏组织中呈中度表达(图4B), CX3CR1蛋白在SAP组肾脏组织中呈高表达(图4C).
Spearman等级相关系数分析表明, 肾脏组织中CX3CR1蛋白表达水平与肾脏组织病理评分呈正相关(r1 = 0.737, P<0.01). Peason相关系数分析表明, 肾脏组织中CX3CR1蛋白表达水平与血清肌酐及尿素氮水平均呈正相关(r2 = 0.793, P<0.01; r3 = 0.627, P<0.01; r2及r3为肾脏组织CX3CR3蛋白水平分别与血清肌酐及尿素氮水平之间的相关系数).
SAP合并AKI, 不仅加重胰腺损伤, 同时可能引起急性肾衰竭并增加死亡率, 相关数据表明, SAP并发急性肾衰竭时死亡率高达45%-50%[12]. 趋化因子通过与其特异性受体结合介导白细胞的趋化运动从而参与SAP炎症反应过程, 因而近年来趋化因子及其受体在SAP中的作用越来越受到研究者的关注[13-17]. CX3CR1是趋化因子CX3C亚家族的唯一成员Fractalkine(FKN)的特异性受体, 属于趋化因子受体超家族, 是具有7次跨膜结构的G-蛋白偶联受体, 主要表达在CD16+ NK细胞、CD14+单核细胞和CD3+、CD8+ T淋巴细胞上[18], 其特异性配体FKN同时具有黏附和趋化两种功能, 因此二者结合不依赖整合素作用, 可以直接介导CX3CR1阳性细胞的黏附和趋化, 从而参与多种炎症性疾病[19-22]. 但CX3CR1及其配体FKN在SAP中的表达及作用近两年才见相关报道[7,23-25]. 本研究免疫组织化学结果显示CX3CR1在SAP组肾脏组织中高表达, 在MAP组及SO组肾脏组织中呈中低表达或不表达, Western blot结果显示CX3CR1在SAP组肾脏组织中的表达较MAP组及SO组显著升高(P<0.05)(图3), 同时胰腺及肾脏HE染色观察到, SAP组胰腺及肾脏组织中有大量炎症细胞浸润, 伴有组织出血、坏死表现, 同时组织病理损伤评分较MAP组及SO组显著升高(P<0.05)(表1). 由此推测, SAP发生后, 表达CX3CR1的NK细胞、T淋巴细胞及单核细胞被大量激活, 与其配体FKN特异性结合, 诱导趋化大量炎症细胞进入胰腺组织, 促进炎症级联反应发生、发展, 从而导致大量胰腺腺泡细胞坏死及胰腺外器官肾脏受累, 引起肾小球、肾小管等继发性病变.
目前血清肌酐和尿素氮仍是临床上最常用来检测肾功能的指标[26]. 但血清肌酐浓度多在肾功能减退50%以上时才升高, 且其水平受年龄、性别、肌肉组织量及药物等因素影响,所以依赖血清肌酐及尿素氮水平评价肾功能可能因肾损伤和肾功能异常之间的时间差而导致失去治疗的最佳时机并导致AKI的高死亡率[27]. 因此需要寻找其他更好地反映AKI发生及其严重程度的生物学标志物. Huang等[3]的研究表明, 降钙素原水平在SAP继发AKI患者血清中明显升高. Dent等[28]报道, 血清中性粒细胞明胶酶相关脂质运载蛋白(NGAL)在早期诊断AKI的敏感性及特异性均较血清肌酐高. Cho等[29]报道, 尿肝脏型脂肪酸结合蛋白(L-FABP)在AKI患者中明显升高. Wu等[30]发现与野生型缺血再灌注损伤小鼠相比, IL-18(-/-)的缺血再灌注损伤小鼠的肾损伤程度更轻, 说明IL-18参与缺血再灌注肾损伤. 本研究中相关性分析结果显示, 大鼠肾脏组织CX3CR1蛋白表达水平与肾脏病理学评分、血清肌酐及尿素氮等肾脏损伤严重程度的指标呈正相关, 因此我们认为CX3CR1可以反映AKI严重程度.
总之,在SAP病程中, 趋化因子受体CX3CR1可能参与介导AKI的发生, 并可以反映SAP继发AKI的严重程度. 但其具体作用机制仍有待进一步深入研究.
重症急性胰腺炎(severe acute pancreatitis, SAP)是临床常见的急危重症, 当继发急性肾损伤(acute kidney injury, AKI)时死亡率明显升高. 已有多项研究表明, 炎症因子参与SAP继发AKI发病过程.
江建新, 教授, 主任医师, 湖北省肿瘤医院肝胆胰腺外科
目前趋化因子及其受体在SAP继发AKI中的作用越来越引起研究者的关注, 但趋化因子受体CX3CR1在SAP继发AKI中的作用鲜有报道.
编辑: 郭鹏 电编:闫晋利
| 1. | Kes P, Vucicević Z, Ratković-Gusić I, Fotivec A. Acute renal failure complicating severe acute pancreatitis. Ren Fail. 1996;18:621-628. [PubMed] |
| 2. | Petejova N, Martinek A. Acute kidney injury following acute pancreatitis: A review. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub. 2013;157:105-113. [PubMed] |
| 3. | Huang HL, Nie X, Cai B, Tang JT, He Y, Miao Q, Song HL, Luo TX, Gao BX, Wang LL. Procalcitonin levels predict acute kidney injury and prognosis in acute pancreatitis: a prospective study. PLoS One. 2013;8:e82250. [PubMed] [DOI] |
| 4. | Liu HS, Pan CE, Xue HZ, Li DY, Wang LC, Qin XL, Yu HB. Effect of p38 MAPK inhibitor on adhesion molecule expression and microvascular permeability of renal injury in a rat model of acute necrotizing pancreatitis. J Anim Vet Adv. 2011;10:1292-1298. [DOI] |
| 5. | Lee DW, Faubel S, Edelstein CL. Cytokines in acute kidney injury (AKI). Clin Nephrol. 2011;76:165-173. [PubMed] |
| 6. | Zhu HH, Jiang LL. Serum inter-cellular adhesion molecule 1 is an early marker of diagnosis and prediction of severe acute pancreatitis. World J Gastroenterol. 2012;18:2554-2560. [PubMed] [DOI] |
| 7. | Huang LY, Chen P, Xu LX, Zhou YF, Zhang YP, Yuan YZ. Fractalkine upregulates inflammation through CX3CR1 and the Jak-Stat pathway in severe acute pancreatitis rat model. Inflammation. 2012;35:1023-1030. [PubMed] [DOI] |
| 8. | Aho HJ, Koskensalo SM, Nevalainen TJ. Experimental pancreatitis in the rat. Sodium taurocholate-induced acute haemorrhagic pancreatitis. Scand J Gastroenterol. 1980;15:411-416. [PubMed] |
| 10. | Grewal HP, Mohey el Din A, Gaber L, Kotb M, Gaber AO. Amelioration of the physiologic and biochemical changes of acute pancreatitis using an anti-TNF-alpha polyclonal antibody. Am J Surg. 1994;167:214-218; discussion 218-219;. [PubMed] |
| 11. | Smith RG, Van der Ploeg LH, Howard AD, Feighner SD, Cheng K, Hickey GJ, Wyvratt MJ, Fisher MH, Nargund RP, Patchett AA. Peptidomimetic regulation of growth hormone secretion. Endocr Rev. 1997;18:621-645. [PubMed] |
| 12. | Zhang XP, Wang L, Zhou YF. The pathogenic mechanism of severe acute pancreatitis complicated with renal injury: a review of current knowledge. Dig Dis Sci. 2008;53:297-306. [PubMed] |
| 13. | Zhou GX, Zhu XJ, Ding XL, Zhang H, Chen JP, Qiang H, Zhang HF, Wei Q. Protective effects of MCP-1 inhibitor on a rat model of severe acute pancreatitis. Hepatobiliary Pancreat Dis Int. 2010;9:201-207. [PubMed] |
| 14. | Frossard JL, Lenglet S, Montecucco F, Steffens S, Galan K, Pelli G, Spahr L, Mach F, Hadengue A. Role of CCL-2, CCR-2 and CCR-4 in cerulein-induced acute pancreatitis and pancreatitis-associated lung injury. J Clin Pathol. 2011;64:387-393. [PubMed] |
| 15. | Gong J, Meng HB, Hua J, Song ZS, He ZG, Zhou B, Qian MP. The SDF-1/CXCR4 axis regulates migration of transplanted bone marrow mesenchymal stem cells towards the pancreas in rats with acute pancreatitis. Mol Med Rep. 2014;9:1575-1582. [PubMed] [DOI] |
| 16. | Moreno C, Nicaise C, Gustot T, Quertinmont E, Nagy N, Parmentier M, Louis H, Devière J. Chemokine receptor CCR5 deficiency exacerbates cerulein-induced acute pancreatitis in mice. Am J Physiol Gastrointest Liver Physiol. 2006;291:G1089-G1099. [PubMed] [DOI] |
| 17. | Bhatia M, Hegde A. Treatment with antileukinate, a CXCR2 chemokine receptor antagonist, protects mice against acute pancreatitis and associated lung injury. Regul Pept. 2007;138:40-48. [PubMed] |
| 18. | Imai T, Hieshima K, Haskell C, Baba M, Nagira M, Nishimura M, Kakizaki M, Takagi S, Nomiyama H, Schall TJ. Identification and molecular characterization of fractalkine receptor CX3CR1, which mediates both leukocyte migration and adhesion. Cell. 1997;91:521-530. [PubMed] |
| 19. | Shimizu K, Furuichi K, Sakai N, Kitagawa K, Matsushima K, Mukaida N, Kaneko S, Wada T. Fractalkine and its receptor, CX3CR1, promote hypertensive interstitial fibrosis in the kidney. Hypertens Res. 2011;34:747-752. [PubMed] [DOI] |
| 20. | Cybulsky MI, Hegele RA. The fractalkine receptor CX3CR1 is a key mediator of atherogenesis. J Clin Invest. 2003;111:1118-1120. [PubMed] |
| 22. | Grizenkova J, Akhtar S, Brandner S, Collinge J, Lloyd SE. Microglial Cx3cr1 knockout reduces prion disease incubation time in mice. BMC Neurosci. 2014;15:44. [PubMed] [DOI] |
| 23. | Huang LY, Chen P, Xu LX, Zhou YF, Li WG, Yuan YZ. Fractalkine as a marker for assessment of severe acute pancreatitis. J Dig Dis. 2012;13:225-231. [PubMed] [DOI] |
| 24. | DHaese J, DHaese TD, SezginH , Kehl T, Demir IE, Bergmann F, Friess H, Ceyham GO. Disruption of fractalkine/CX3CR1 signaling attenuates acute pancreatitis and pancreatic pain. Pancreatology. 2014;14:S17. [DOI] |
| 25. | Li F, Zhang H, Xu KY, Wei Q, Zhou GX. Role of the chemokine fractalkine in a rat model of acute necrotizing pancreatitis and the interventional effect of ulinastatin. Arch Iran Med. 2013;16:83-87. [PubMed] |
| 27. | Bonventre JV. Diagnosis of acute kidney injury: from classic parameters to new biomarkers. Contrib Nephrol. 2007;156:213-219. [PubMed] |
| 28. | Dent CL, Ma Q, Dastrala S, Bennett M, Mitsnefes MM, Barasch J, Devarajan P. Plasma neutrophil gelatinase-associated lipocalin predicts acute kidney injury, morbidity and mortality after pediatric cardiac surgery: a prospective uncontrolled cohort study. Crit Care. 2007;11:R127. [PubMed] |
| 29. | Cho E, Yang HN, Jo SK, Cho WY, Kim HK. The role of urinary liver-type fatty acid-binding protein in critically ill patients. J Korean Med Sci. 2013;28:100-105. [PubMed] [DOI] |
| 30. | Wu H, Craft ML, Wang P, Wyburn KR, Chen G, Ma J, Hambly B, Chadban SJ. IL-18 contributes to renal damage after ischemia-reperfusion. J Am Soc Nephrol. 2008;19:2331-2341. [PubMed] [DOI] |