修回日期: 2014-10-21
接受日期: 2014-11-05
在线出版日期: 2015-01-08
目的: 研究多巴胺D2受体(dopamine D2 receptor, Drd2)在慢传输型便秘(slow transit constipation, STC)大鼠消化系组织表达情况, 探讨引发STC大鼠便秘发病的可能机制.
方法: 选取24只健康Wistar大鼠随机分成2组, 实验组和对照组. 实验组每天予以复方苯乙哌啶混悬液(8 mg/kg)灌胃制造慢传输便秘大鼠模型, 对照组给予相等剂量的生理盐水灌胃. 每5 d记录1次大便粒数、大便干质量及大鼠体质量. 饲养90 d后停药1 wk, 判断造模成功与否. 大鼠解剖后分别选取胃窦、小肠及结肠组织, 采用实时荧光聚合酶链反应法(real-time polymerase chain reaction, RT-PCR)检测组织中Drd2的表达情况.
结果: 通过测定比较实验组与对照组大鼠的日均粪便粒数、日均粪便质量及首粒黑便排出时间, 差异均有统计学意义, 判断STC大鼠造模成功. RT-PCR能特异性扩增Drd2, Drd2在STC大鼠胃、小肠组织中的表达与对照组的表达差异无统计学意义(3.97±1.21, P>0.05; 3.12±1.14, P>0.05), 而在结肠组织中的表达明显高于对照组(1.93±0.78, P<0.05), 差异有统计学意义.
结论: STC大鼠Drd2在胃、小肠组织表达与正常大鼠的表达差异无统计学意义, 在结肠组织表达显著上调, 提示Drd2可能参与STC大鼠的发病机制.
核心提示: 本实验通过成功建立慢传输便秘大鼠模型, 采用RT-PCR技术方法从基因水平发现多巴胺D2受体(dopamine D2 receptor, Drd2)在大鼠消化系表达情况, 提示Drd2高表达可致结肠动力障碍, 可能为慢传输型便秘(slow transit constipation)的病理生理机制之一.
引文著录: 张晓媛, 徐华, 郑倩, 张旭. 慢传输型便秘大鼠胃肠道多巴胺D2受体表达. 世界华人消化杂志 2015; 23(1): 93-98
Revised: October 21, 2014
Accepted: November 5, 2014
Published online: January 8, 2015
AIM: To investigate the expression of dopamine D2 receptor (Drd2) in the gastrointestinal mucosa of rats with slow transit constipation (STC) to explore the possible pathogenesis of STC.
METHODS: Twenty-four healthy Wistar rats were randomly into two groups: an experiment group and a control group. Rats of the experiment group were daily administered diphenoxylate (8 mg/kg) for 90 d to induce STC, while the control rats were fed normal saline. The number and weight of fecal granules and the body weight of rats were recorded every 5 d. After successful induction of STC, the rats were killed to take tissues of the gastric antrum, small intestine, and colon. Real-time polymerase chain reaction (RT-PCR) was used to detect the expression of Drd2 in the above tissues.
RESULTS: The daily number and mean weight of fecal granules and the time to discharge of the first black granule differed significantly between the two groups, suggesting that STC was successfully induced. Drd2 was specifically amplified by RT-PCR. Compared with the control group, the expression of Drd2 in the stomach and small intestine was not significantly different in the experiment group (P > 0.05 for both). However, the expression of Drd2 in colon tissues of STC rats was significantly higher than that in control rats (1.93 ± 0.78, P < 0.05).
CONCLUSION: The expression of Drd2 in the stomach and small intestine does not change significantly in STC rats, but Drd2 expression is up-regulated in colon tissues of STC rats, which may contribute to the pathogenesis of STC.
- Citation: Zhang XY, Xu H, Zheng Q, Zhang X. Expression of dopamine D2 receptor in the gastrointestinal mucosa of rats with slow transit constipation. Shijie Huaren Xiaohua Zazhi 2015; 23(1): 93-98
- URL: https://www.wjgnet.com/1009-3079/full/v23/i1/93.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i1.93
近年来, 通过流行病调查发现, 儿童便秘在世界范围内均具有较高的发病率[1], 不同国家、地域发病率不尽相同, 给医疗卫生系统带来的负担呈上升趋势[2], 目前国内报道发病率约3%-8%, 且90%以上属于功能性便秘(functional constipation, FC), 其中以慢传输型便秘(slow transit constipation, STC)最为常见. STC主要是指结肠动力减慢、结肠传输时间延长等为特点一种较顽固的便秘[3], 是近年来国内外研究的热点之一, 但其具体的病因及发病机制尚未得到统一的结论. 目前研究主要集中在胃肠动力、胃肠道神经递质、肠神经系统(enteric nervous system, ENS)、Cajal间质细胞(interstitial cells of Cajal, ICC)及精神、心理因素等方面. 许多学者认为STC的发生和一些胃肠神经递质的异常表达有很大的关系[4]. 研究发现多巴胺(dopamine, DA)作为重要的胃肠神经递质之一, 其中多巴胺D2受体(dopamine D2 receptor, Drd2)在消化系不同部位均有表达, 参与调解胃肠道功能, 与多种疾病导致结肠动力异常有关, 致结肠传输时间延长, 久之, 形成慢传输便秘[5,6]. 目前有关从基因方面论证大鼠消化系不同部位Drd2与STC关系鲜有报道. 本研究应用实时荧光聚合酶链反应法(real-time polymerase chain reaction, RT-PCR)观察Drd2在STC消化系不同部位的表达情况, 以期为STC病理生理机制提供理论依据.
实验动物: 清洁级健康8周龄Wistar♂大鼠24只, 体质量120 g±10 g, 是由中国人民解放军军事医学科学院实验动物中心提供, 生产许可证号: SCXK-(军)2007-004. 随机分为实验组和对照组, n = 12. 两组大鼠均分笼饲养于中国人民解放军304医院动物实验室, 大鼠在室温条件20 ℃-22 ℃; 相对湿度50%-70%, 清洁安静, 正常更替光照, 24 h食水供应, 常规饲养1 wk以适应环境. 两组均以普通干饲料喂养(由北京华阜康生物科技股份有限公司提供).
实验试剂: 生理盐水(湖南康源制药有限公司); 复方地芬诺酯(合肥久联制药有限公司); 活性炭(国药集团化学试剂有限公司); TRIzol-A+试剂、RNase-free ddH2O、FastQuant RT Kit (with gDNase)、SuperReal PreMix Plus(SYBR Green)均购自北京TIANGEN公司; 引物及内参合成由上海生工公司完成. 离心机(德国Heraeus公司); 紫外分光光度仪(UV-2201日本岛津公司); PCR扩增仪(中国SLAN公司).
1.2.1 STC大鼠模型建立: 参照包云光等[7]和刘兴等[8]的方法建立STC大鼠模型. 在适宜环境下, 大鼠分笼饲养, 饲养7 d后开始建立模型, 给实验组Wistar大鼠喂养复方苯乙哌啶混悬液[剂量8 mg/(kg•d)], 对照组给予等量生理盐水, 隔5 d记录1次大鼠粪便粒数、大便干质量及大鼠体质量. 饲养90 d之后, 大鼠解剖后分别取大鼠胃窦、小肠、结肠组织各5 mm. 取后组织用生理盐水冲洗、滤纸吸干多余水分, 放入液氮保存.
1.2.2 测定肠道传输功能: 应用活性炭灌胃的方法测定首粒黑便排出时间. 待大鼠停药1 wk后(禁食、不禁水24 h), 从口灌入100 g/L活性炭悬液2 mL. 活性炭灌胃完毕后开始计时, 记录从灌胃至首粒黑便排出的时间.
1.2.3 RT-PCR: (1)总RNA的提取: 参照TRIzol-A+试剂(公司)说明书提取总RNA. 应用紫外分光光度仪检测提取完后的RNA的纯度. 测量A260和A280的数值, 且每个样本重复测3次, 取其平均值. A260/280的比值在1.8-2.0范围内, 说明提取RNA的纯度比较好; (2)反转录合成cDNA: 将模板RNA在冰上解冻, 其余试剂(每种溶液使用前涡旋振荡混匀)在常温解冻, 待解冻后迅速置于冰上. 按照试剂盒上操作, 配置gDNA去除反应体系混合液(5×gDNA Buffer, 2 μL; total RNA, 计算出; RNase-Free ddH2O, 补足到10 μL), 短暂离心后, 置于42 ℃, 孵育3 min, 然后置于冰上放置. 配制反转录体系Mix(10×Fast RT Buffer, 2 μL; RT Enzyme Mix, 1 μL; FQ-RT Primer Mix, 2 μL; RNase-Free ddH2O, 补足到10 μL), 然后加到gDNA去除反应体系混合液中, 充分混匀, 置于42 ℃水浴, 孵育15 min. 取出后再置于95 ℃水浴孵育3 min, 迅速放于冰上, 得到cDNA置于-20 ℃冰箱保存, 用于后续实验; (3)设计和合成引物: 通过查找PubMed相关文献, 得出引物序列, 用Primer5.0软件处理得出最合适的引物序列(表1), 并由上海生工公司合成; (4)PCR扩增: 参照SuperReal PreMix Plus试剂盒说明书的操作步骤, 冰上进行RT-PCR反应液的配置, 建立20 μL反应体系(2×SuperReal PreMix Plus, 10 μL; 正向引物、反向引物各1 μL; cDNA模板1.5 μL; 50×ROX Reference Dye 0.4 μL; RNase-Free ddH2O补足至20 μL), 置于PCR扩增仪上进行扩增, 每个样品均重复3次. 三步法反应程序: 95 ℃预变性15 min, 95 ℃变性10 s, 59 ℃退火30 s, 72 ℃延伸32 s, 总共40个循环. 将电脑测得的Ct值及融解曲线记录下来, 通过相对定量法检测不同组间Drd2的表达情况. 并将得到的PCR产物置于2.5%的琼脂糖凝胶上, 在150 V电压下电泳35 min后, 放于紫外灯下观察、取样.
| 目的基因 | 引物序列 | 片段大小(bp) |
| Drd2 | 上游: 5'-AACCCTGCCTTTGTGGTCTA-3' | 174 |
| 下游: 5'-GTTGCCCTTGAGTGGTGTCT-3' | ||
| β-actin | 上游: 5'-CCCATCTATGAGGGTTACGC-3' | 150 |
| 下游: 5'-TTTAATGTCACGCACGATTTC-3' |
统计学处理 采用SPSS16.0统计软件进行数据分析, 实验数据用mean±SD表示, 采用独立样本t检验和方差分析进行显著性检验, P<0.05为差异有统计学意义.
实验组大鼠粪便粒数(粒/d)少于对照组(P<0.01), 日均粪便质量大于对照组(P<0.05), 首粒黑便排出时间明显长于对照组(P<0.01), 差异均有统计学意义, 因此, 说明慢传输便秘大鼠造模成功(表2).
| 分组 | 粪便粒数(粒/d) | 粪便质量(mg/粒) | 首粒黑便排出时间(min) |
| 实验组 | 24.83±2.12 | 157.49±9.78 | 980.00±30.23 |
| 对照组 | 34.25±3.36 | 139.43±14.71 | 387.50±34.54 |
| P值 | <0.01 | <0.05 | <0.01 |
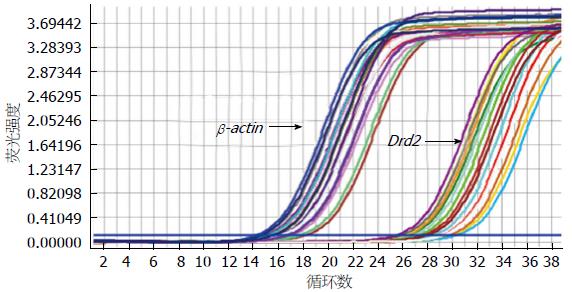
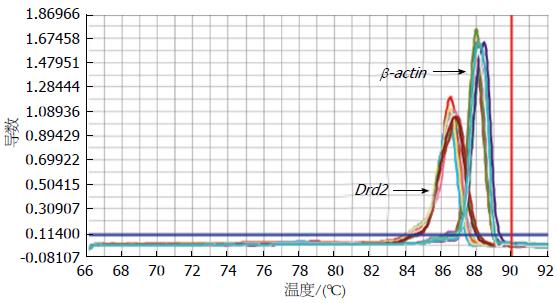
实验组与对照组大鼠胃窦、小肠组织Drd2表达差异无统计学意义(P>0.05), 但在结肠组织中Drd2的相对定量(2-△△Ct)结果明显高于对照组, 差异有显著统计学意义(P<0.05)(表3). Drd2和内参的PCR产物的融解曲线均为单一峰, 并且没有非特异性扩增及引物二聚体的产生, 其目的基因扩增曲线良好(图1, 2).
| 分组 | Drd2受体相对表达量(2-△△Ct) | t值 | P值 |
| 实验组 | |||
| 胃 | 3.97±1.21 | 2.45 | >0.05 |
| 小肠 | 3.12±1.14 | 1.84 | >0.05 |
| 结肠 | 1.93±0.78 | 2.46 | <0.05 |
| 对照组 | |||
| 胃 | 1.00±0.00 | ||
| 小肠 | 1.00±0.00 | ||
| 结肠 | 1.00±0.00 |
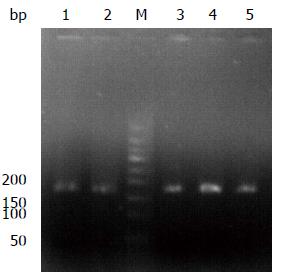
Drd2和β-actin的扩增产物经过2.5%琼脂糖凝胶电泳后, 在紫外灯下观测, 可见到特异性条带, 为单一条带(图3), 且扩增的片段大小与设计的大小相一致, 表明RT-PCR可以特异性扩增Drd2, 且结果可靠.
STC是目前临床上常见的一种较为顽固的疾病, 关于其具体病因及发病机制尚不明确. 目前研究主要集中在以下几个方面: 胃肠道动力、胃肠神经递质、ENS、ICC等. 因此, 建立STC模型, 从不同层面寻找致病因素, 并探索不同因素之间的相互作用机制, 是下一步针对STC病因和发病机制新的突破口. 目前有关STC大鼠模型研究方法主要有泻剂造模法、复方苯乙哌啶及吗啡法等[9]. 本实验参照包云光等[7]和刘兴等[8]研究方法, 予复方苯乙哌啶法, 通过比较大鼠粪便粒数、粪便质量及肠道传输时间, 成功建立STC模型. 复方苯乙哌啶系度冷丁衍生物, 通过提高肠张力和抑制肠蠕动, 使结肠动力减弱及肠道内容物通过延迟, 进而导致便秘. 研究报道[7,10], 该方法模型大鼠结肠黏膜未造成组织病理损害, 对ENS递质的产生未造成远期影响, 如: 一氧化氮(nitric oxide, NO)、P物质(substance P, SP)、血管活性肠肽(vasoactive intestinal peptide, VIP). 同时, 该模型可重复性较强, 与患者有着较为相似临床症状.
DA属儿茶酚胺类神经递质, 在中枢神经及外周均有不同程度的分布, DA通过相应的膜受体发挥作用. 多巴胺受体(dopamine receptor, DAR)为七个跨膜区域组成的G蛋白偶联受体家族, 根据受体生物化学及药理学性质, 将DAR分为D1类受体(包括D1、D5亚型)和D2类受体(D2、D3、D4亚型). D1类受体激活后升高细胞内cAMP水平, 总体上起兴奋作用, D2类受体与之相反.
DA为脑肠肽重要神经递质, 在促胃肠动力方面发挥着重要作用[11]. 本实验采用RT-PCR方法, 从基因层面, 证实大鼠胃窦、小肠及结肠组织均有Drd2的表达, 这与既往研究相一致. 有学者研究报道[12], 多巴胺受体在消化系不同部位有不同程度分布, 其中在胃组织内Drd2表达量最高. 本实验STC大鼠的胃窦、小肠Drd2基因表达结果与正常大鼠的差异不显著, 但在结肠组织表达上调, 表明动力的改变可能主要是继发于结肠. 正常胃黏膜内Drd2表达量很高, 通过抑制胃酸和胃蛋白酶的分泌和促进黏液及碳酸氢盐的分泌发挥着重要的胃黏膜保护及胃排空的作用, 而小肠的主要功能是负责消化吸收和分泌. 实验研究发现[13,14], DA与ENS存在相关性, 大鼠结肠纵行肌与环形肌之间分布大量肌间神经丛, 其内含有丰富的胆碱能神经元, 通过释放乙酰胆碱(acetyl choline, ACH)可以引起肌肉的收缩, 促进肠道排空和蠕动以及腺体分泌. Mozaffari等[15]最新研究表明Drd2阻滞剂可同5-HT4激动剂、胃动素、胃促生长素等将作为治疗便秘的二期临床研究性药物. 如: 多潘立酮通过作用于外周Drd2发挥促胃动力作用, 加速胃排空及胃窦和十二指肠协调运动. 新一代新型Drd2阻滞剂依托必利[16,17]具有高选择性, 同时也是抑制乙酰胆碱酯酶活性的第三代促胃肠动力药物, 不但刺激内源性ACH的释放, 且抑制ACH的水解, 加强胃和十二指肠运动及促进胃排空, 并能促进结肠蠕动. 有实验研究证明[18], 患有便秘的帕金森病(Parkinson's disease, PD)模型大鼠胃肠DA含量表达增加. 大鼠排便时结肠运动的主要类型为巨大移行性收缩运动(giant migration contractions, GMCs), 而DA可抑制大鼠结肠的这种运动. 朱红灿等[19]发现, 6-羟基多巴胺(6-hydroxy dopamine, 6-OHDA)诱导的PD大鼠ENS DA含量增多, 可导致便秘的发生.
本研究采用RT-PCR技术从基因水平研究Drd2在大鼠STC中胃窦、小肠、结肠三个部位的表达, 发现实验组与对照组在胃窦与小肠表达差异不显著, 但在结肠组织中实验组表达明显高于对照组, 提示Drd2高表达可致结肠运动障碍, 可能为STC的病理生理机制之一.
儿童便秘发病率呈升高趋势, 且以慢传输型便秘(slow transit constipation, STC)类型为主, 严重影响了儿童的身心健康. 目前, 临床治疗尚未取得满意的效果. 因此, 研究STC的生理病理机制至关重要.
文彬, 研究员, 广州中医药大学脾胃研究所
从基因水平研究多巴胺D2受体(dopamine D2 receptor, Drd2)在消化系不同部位表达情况, 阐明Drd2在STC发病机制中的作用, 为进一步的临床治疗提供理论基础.
国外Doi等研究报道, 多巴胺与肠神经系统存在相关性, 通过释放乙酰胆碱引起平滑肌收缩, 进而促进肠道排空、蠕动及分泌. 国内朱红灿等学者发现, 患有帕金森病大鼠肠神经系统多巴胺含量增多, 可导致便秘的发生.
本实验首次从基因层面探讨Drd2在STC大鼠消化系不同部位的表达情况, 并发现其在STC大鼠结肠组织中表达上调, 提示Drd2可能参与了STC的发生.
本文通过研究STC大鼠Drd2的表达情况, 为STC发生的病理生理机制以及为临床选择性用药提供理论基础.
STC: 指结肠传输功能障碍致肠内容物传输缓慢引起的便秘, 又称结肠无力, 多伴有排便困难、粪质坚硬、结肠通过延缓、腹胀、腹痛等胃肠表现; 神经递质: 神经末梢分泌的化学组分, 可使神经脉冲越过突触而传导, 在化学突触传递中担任信使的特定化学物质. 在中枢神经系统中, 神经递质由突触前膜释放后立即与相应的突触后膜受体结合, 产生突触去极化电位或超极化电位, 导致突触后神经兴奋性升高或降低.
本研究设计合理, 方法科学, 数据可靠, 值得进一步研究.
编辑: 韦元涛 电编:都珍珍
| 1. | Liem O, Benninga MA, Mousa HM, Di Lorenzo C. Novel and alternative therapies for childhood constipation. Curr Gastroenterol Rep. 2007;9:214-218. [PubMed] |
| 2. | Sethi S, Mikami S, Leclair J, Park R, Jones M, Wadhwa V, Sethi N, Cheng V, Friedlander E, Bollom A. Inpatient burden of constipation in the United States: an analysis of national trends in the United States from 1997 to 2010. Am J Gastroenterol. 2014;109:250-256. [PubMed] |
| 3. | Dinning PG, Di Lorenzo C. Colonic dysmotility in constipation. Best Pract Res Clin Gastroenterol. 2011;25:89-101. [PubMed] [DOI] |
| 5. | Greene JG, Noorian AR, Srinivasan S. Delayed gastric emptying and enteric nervous system dysfunction in the rotenone model of Parkinson's disease. Exp Neurol. 2009;218:154-161. [PubMed] [DOI] |
| 6. | Zhu HC, Zhao J, Luo CY, Li QQ. Gastrointestinal dysfunction in a Parkinson's disease rat model and the changes of dopaminergic, nitric oxidergic, and cholinergic neurotransmitters in myenteric plexus. J Mol Neurosci. 2012;47:15-25. [PubMed] [DOI] |
| 8. | 刘 兴, 王 文革. 慢传输型便秘动物模型研究进展. 中国中西医结合消化杂志. 2013;21:548-551. |
| 11. | Zheng LF, Wang ZY, Li XF, Song J, Hong F, Lian H, Wang Q, Feng XY, Tang YY, Zhang Y. Reduced expression of choline acetyltransferase in vagal motoneurons and gastric motor dysfunction in a 6-OHDA rat model of Parkinson's disease. Brain Res. 2011;1420:59-67. [PubMed] [DOI] |
| 12. | Wang Q, Ji T, Zheng LF, Feng XY, Wang ZY, Lian H, Song J, Li XF, Zhang Y, Zhu JX. Cellular localization of dopamine receptors in the gastric mucosa of rats. Biochem Biophys Res Commun. 2012;417:197-203. [PubMed] [DOI] |
| 13. | Doi H, Sakakibara R, Kishi M, Tsuyuzaki Y, Tateno F, Hirai S. [Gastrointestinal dysfunction has important implications for plasma L-dopa concentrations in Parkinson's disease]. Rinsho Shinkeigaku. 2013;53:1382-1385. [PubMed] [DOI] |
| 14. | Li ZS, Schmauss C, Cuenca A, Ratcliffe E, Gershon MD. Physiological modulation of intestinal motility by enteric dopaminergic neurons and the D2 receptor: analysis of dopamine receptor expression, location, development, and function in wild-type and knock-out mice. J Neurosci. 2006;26:2798-2807. [PubMed] [DOI] |
| 15. | Mozaffari S, Didari T, Nikfar S, Abdollahi M. Phase II drugs under clinical investigation for the treatment of chronic constipation. Expert Opin Investig Drugs. 2014;23:1485-1497. [PubMed] |
| 16. | Amarapurkar DN, Rane P. Randomised, double-blind, comparative study to evaluate the efficacy and safety of ganaton (itopride hydrochloride) and mosapride citrate in the management of functional dyspepsia. J Indian Med Assoc. 2004;102:735-77, 760. [PubMed] |
| 17. | Lim HC, Kim YG, Lim JH, Kim HS, Park H. Effect of itopride hydrochloride on the ileal and colonic motility in guinea pig in vitro. Yonsei Med J. 2008;49:472-478. [PubMed] [DOI] |
| 18. | Tian YM, Chen X, Luo DZ, Zhang XH, Xue H, Zheng LF, Yang N, Wang XM, Zhu JX. Alteration of dopaminergic markers in gastrointestinal tract of different rodent models of Parkinson's disease. Neuroscience. 2008;153:634-644. [PubMed] [DOI] |