修回日期: 2014-10-15
接受日期: 2014-11-12
在线出版日期: 2015-01-08
目的: 探讨聚乙二醇(polyethylene glycol, Peg)修饰重组人干扰素α 2b[Peg-(interferon α, IFNα) 2b]联合伊马替尼对耐伊马替尼胃肠道间质瘤(gastrointestinal stromal tumors, GISTs)细胞株的增殖和凋亡的影响及其可能机制.
方法: 培养C-kit二次突变所致继发性耐药的GISTs患者的原代细胞株GIST-R和对伊马替尼敏感GIST-T1细胞株模拟临床胃肠间质瘤获得性耐药过程; Peg-IFNα 2b和伊马替尼单独或联合组处理细胞; MTT法检测细胞的增殖并计算耐药指数、联合指数, FCM法检测细胞凋亡率, Western blot检测p-mTOR和Bcl-2蛋白表达水平.
结果: GIST-R细胞株对伊马替尼高度耐药, 其耐药指数(RI = 46.14), Peg-IFNα 2b单独用药对GISTs细胞株均无明显增殖抑制作用; INF-α与伊马替尼联合用药组对GIST-R抑制率明显高于伊马替尼单独用药, 耐药指数下降(RI = 14.79), 表现明显的协同增敏效应(CI = 0.79). FCM检测结果表明, Peg-IFNα 2b与伊马替尼联合用药具有明显的促细胞凋亡的作用. 与单药组比较, Peg-IFNα 2b与伊马替尼联合用药可明显下调耐伊马替尼细胞p-mTOR和Bcl-2蛋白表达水平(P<0.01).
结论: Peg-IFNα 2b可以提高GISTs耐药细胞株细胞对伊马替尼的敏感性, 这一协同增敏效应可能与下调p-mTOR蛋白表达水平以及诱导细胞凋亡有关.
核心提示: 探讨聚乙二醇-干扰素α 2b(polyethylene glycol-interferon α 2b)和伊马替尼联合用药对耐伊马替尼获得性耐药的胃肠间质瘤细胞株的抗肿瘤效应及其可能机制.
引文著录: 张磊屹, 黄江生, 皮执民, 喻梅英, 王群伟, 段伦喜, 刘威. Peg-IFNα 2b联合伊马替尼对耐伊马替尼胃肠间质瘤细胞株的抑制作用. 世界华人消化杂志 2015; 23(1): 85-92
Revised: October 15, 2014
Accepted: November 12, 2014
Published online: January 8, 2015
AIM: To investigate the inhibition effects of polyethylene glycol interferon α 2b (Peg-IFNα 2b) and imatinib, alone or in combination, on imatinib-resistant gastrointestinal stromal tumor (GIST) cell line (GIST-R), and to explore the possible mechanism.
METHODS: GIST-R cells were exposed to Peg-IFNα 2b and imatinib, alone or in combination. The rate of reduced proliferation and the combination index (CI) in different treatment groups were detected by MTT assay. The apoptotic rate was detected by flow cytometry. The expression of phosphorylated mammalian target of rapamycin (p-mTOR) and Bcl-2 was analyzed by Western blot.
RESULTS: GIST-R cells presented remarkable resistance to imatinib, and the resistance index (RI) was 46.14. The rate of reduced proliferation in the combination group was significantly higher than those in the Peg-IFNα 2b or imatinib alone groups (P < 0.05). The calculated CI values in the combination group suggested a synergistic effect. Compared with non-treated GIST-R cells, the expression levels of p-mTOR and Bcl-2 proteins in GIST-R cells treated with Peg-IFNα 2b and imatinib significantly decreased (P < 0.01).
CONCLUSION: The combination of Peg-IFNα 2b and imatinib generates a synergistic effect in GIST-R cells. This effect may be related with apoptosis and the down-regulation of the expression of p-mTOR.
- Citation: Zhang LY, Huang JS, Pi ZM, Yu MY, Wang QW, Duan LX, Liu W. Inhibitory effects of Peg-IFNα 2b and imatinib, alone or in combination, on imatinib-resistant gastrointestinal stromal tumor cell line PC9/GR. Shijie Huaren Xiaohua Zazhi 2015; 23(1): 85-92
- URL: https://www.wjgnet.com/1009-3079/full/v23/i1/85.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i1.85
胃肠道间质瘤(gastrointestinal stromal tumors, GISTs)是胃肠道最常见的间叶组织源性的肿瘤. 他占消化系恶性肿瘤的2.2%, 在他们中有80%-90%通过干细胞生长因子受体基因KIT, 5%-10%通过血小板源性生长受体α(platelet derived growth factor receptor alpha, PDGFRα)另外有5%-10%通过野生型的KIT和PDGFRα进行突变[1]. 伊马替尼甲磺酸盐(imatinib, IM)是现今推荐治疗GIST的首选药物. Gleevec是小分子酪氨酸激酶抑制剂, 他能选择性地抑制KIT、BCR-ABL和PDGFR. IM结合于胞质内酪氨酸激酶功能区的ATP结合位点, 阻断磷酸基团由ATP向蛋白质底物信号传导, 抑制细胞增殖, 恢复正常细胞凋亡. 但几乎所有初始治疗有效的患者都会在少于20 mo后出现病情进展, 产生获得性耐药[2]. KIT或PDGFRα基因发生二次突变, 从而导致蛋白构象发生改变, 与IM结合受阻是胃肠道间质肿瘤伊马替尼获得性耐药的最主要机制[3,4]. Peg-IFNα 2b是重组人干扰素α-2b与单甲氧基聚乙二醇的一种共价结合物, 比IFNα-2b有更长的血浆半衰期和低毒性与抗耐受作用, 主要用于慢性肝炎的治疗. 目前GIST对IM的耐药问题没有明确的治疗指南, 是当前GIST临床治疗亟待解决的难题. 随着免疫治疗的日益重视, 加强自身抗肿瘤免疫力帮助根除耐药的衍生型克隆和有自我更新能力的干细胞成为新的关注模式. 因此, 本研究通过探讨Peg-IFNα 2b和伊马替尼联合用药对耐伊马替尼获得性耐药的胃肠间质瘤细胞株的抗肿瘤效应及其可能机制, 以期寻找一种能克服伊马替尼获得性耐药的治疗方案, 为胃肠间质瘤的临床治疗提供实验依据.
收集2013-12/2014-02在中南大学湘雅二医院进行活检的5例GIST患者新鲜标本. 其中, 男性3例、女性2例; 年龄45-60岁, 平均年龄53岁; 患者既往口服伊马替尼甲磺酸盐进行分子靶向治疗, 平均治疗时间为13 mo. 病例纳入标准: 患者既往行c-kit基因检测提示有外显子11药物敏感性突变, 口服IM治疗后病灶进展或局部复发, 再次行c-kit基因检测提示发生二次突变, 突变区域集中在外显子13、14和17. 所有患者均签署治疗知情同意书, 此研究得到湘雅二医院药物临床实验伦理委员会批准. 人GISTs细胞系GIST-T1购自深圳百恩维(Biowit)生物科技公司. IM为瑞士诺华公司产品. RPMI-1640培养液、胎牛血清、胰蛋白酶购自美国GIBCO公司; 四甲基偶氮唑蓝(MTT)、二甲基亚砜(DMSO)等购自美国sigma公司; AnnexinⅤ-FITC细胞凋亡检测试剂盒购自南京凯基生物科技有限公司; 人体癌细胞原代培养试剂盒购自武汉原生原代生物医药科技有限公司; 兔抗人p-mTOR和β-actin多克隆抗体以及辣根过氧化物酶标记的山羊抗兔IgG购自美国Cell Signal Technology公司; 鼠抗人Bcl-2购自北京中杉金桥生物技术有限公司.
1.2.1 GIST原代获得性耐药细胞的提取和培养: 应用人体癌细胞原代培养试剂盒进行GIST原代细胞的培养. 将穿刺获得的5例GIST患者的组织标本剪碎并制备成糊状, 加入Hank's液; 离心; 加入Hank's液和10倍稀释的细胞分散素反应2 h, 在光学显微镜下观察细胞团块的分散情况; 细胞分散后加入含胎牛血清的RPMI-1640细胞培养液, 终止反应; 弃去悬液中的脂肪及纤维组织, 离心; 加入等量的Hank's液和RPMI-1640培养液, 滤网过滤, 收集细胞悬液, 离心获取细胞沉淀; 将回收的细胞重悬在预培养液PCM-1中, 移入Ⅰ型胶原凝胶涂布的细胞培养瓶中, 置于细胞培养箱中培养24 h后, 弃去血细胞及死细胞, 获得单细胞悬液. 细胞传代3次后为进行后续实验, 耐药细胞株命名为GIST-R.
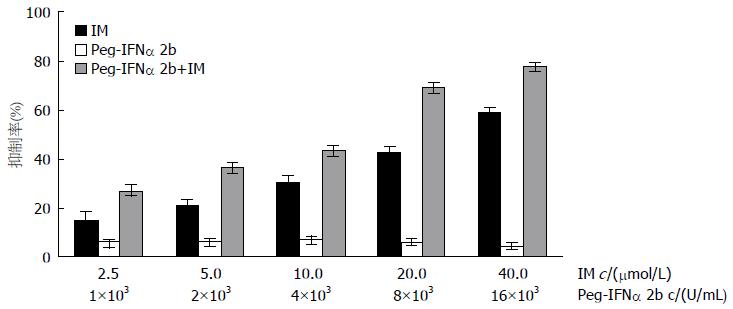
1.2.2 四甲基偶氮唑盐(MTT)法测定细胞活性及药物半数抑制浓度(half maximal inhibitory concentration of a substance, IC50): 取处于对数生长期的GIST-T1和GIST-R细胞株, 消化制成3×104个/mL的细胞悬液, 每孔150 mL接种于96孔培养板中, 每列的第一孔不加细胞, 为调零孔. 待细胞贴壁后, 单药组加入不同浓度的伊马替尼(0.0、2.5、5.0、10.0、20.0、40.0 μmol/L)和Peg-IFNα 2b(0.0、1×103、2×103、4×103、8×103、16×103 U/mL), 为与各单药组的药物浓度一致, 联合组以相应终浓度1:1的比例联合给药, 每组设置6个平行复孔. 置37 ℃、5%CO2的培养箱中培养48 h后, 避光条件下每孔加MTT 20 mL(5 mg/mL), 混匀, 37 ℃孵育; 去除上清后, 每孔加150 mL的DMSO, 振摇10 min, 酶标仪检测波长492 nm的每孔吸光度(A)值求其平均值. 据吸光度值计算细胞抑制率. 抑制率(E): E = (对照组A值-实验组平均A值/对照组A值)×100%, 以药物浓度为横坐标, 抑制率为纵坐标, 绘制细胞生长抑制曲线. 应用SPSS16.0软件计算各药物的IC50值; 计算耐药指数(resistance index, RI) = 耐药细胞株药物IC50/亲代细胞株药物IC50. 以CompuSyn软件计算联合用药组的联合指数(combination index, CI), CI>1表示2种药物有拮抗效应, CI = 1表示2种药物有相加效应, CI<1表示2种药物有协同效应. 实验重复3次.
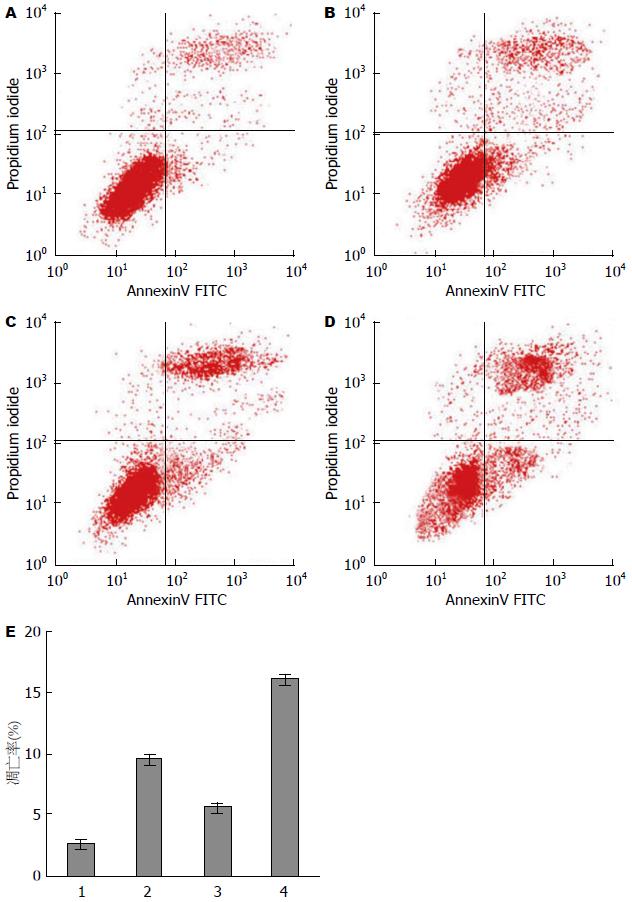
1.2.3 流式细胞术检测细胞的凋亡率: 取处于对数生长期的GIST-R细胞, 实验分组和药物处理: 实验分为对照组(仅含细胞和培养液, 不含药物)、IM组(终浓度为10 μmol/L)、Peg-IFNα 2b组(终浓度为4×103 U/mL)和联合组. 24 h后用胰酶消化并收集细胞, 用冷PBS洗涤2次, 加入结合缓冲液重悬细胞, 制成细胞悬液, 调整细胞密度为1×106个/mL. 吸取100 μL细胞悬液, 加入AnnexinⅤ-FITC 5 μL和碘化丙锭(propidium iodide, PI)5 μL, 混匀后避光并室温下孵育15 min, 加入结合缓冲液400 μL, 立即上流式细胞仪分析. 以未染色细胞调零, 以AnnexinⅤ-FITC单染管和PI单染管作为基准对照, 测定每个上样管数据, 测定凋亡细胞百分比. 实验重复3次.
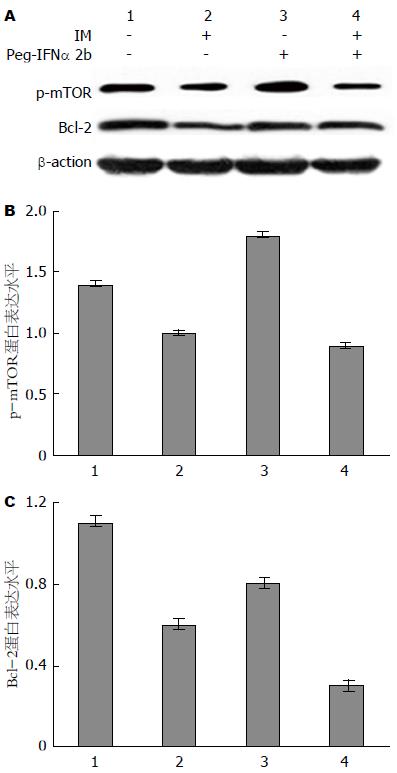
1.2.4 Western印迹法检测p-mTOR和Bcl-2蛋白表达水平: 取处于对数生长期的GIST-R细胞, 实验分组和药物处理方法与1.2.3节相同, 24 h后收集各组细胞, 提取细胞总蛋白. 用Western印迹法分别检测p-mTOR和Bcl-2蛋白的表达: 细胞总蛋白经8%SDS-PAGE电泳分离后, 转移至聚偏二氟乙烯(polyvinylidene difluoride, PVDF)膜上, 用含0.5%脱脂奶粉的TBST溶液封闭1 h, 加入1:2000稀释的抗磷酸化mTOR抗体以及1:1000稀释的抗Bcl-2和β-actin(内参照)抗体, 4 ℃孵育过夜, TBST漂洗3次后加入相应的辣根过氧化物酶标记的二抗(1:5000), 室温摇床孵育1 h, TBST漂洗3次后DAB显色, 曝光, 显影. 实验重复3次. 应用Image J软件分析目的蛋白质条带的灰度值, 以目的蛋白质条带的灰度值与内参照β-actin蛋白质条带灰度值的比值表示目的蛋白质的相对表达水平.
统计学处理 数值以mean±SD来表示, 采用SPSS11.5软件进行统计学分析. 以配对t检验进行统计学比较, P<0.05为差异有统计学意义.
MTT法检测结果显示: Peg-IFNα 2b单独用药对GIST-T1及GIST-R细胞株均无明显增殖抑制作用; 伊马替尼对GIST-R细胞株高度耐药, 其增殖抑制作用明显低于敏感株GIST-T1, 其RI为46.14(表1). Peg-IFNα 2b和伊马替尼联合应用对GIST-R细胞的增殖抑制作用明显强于各单药组(图1). 且耐药指数(RI = 14.79)明显低于伊马替尼组(表1). 通过计算各药物浓度组的CI值发现, 不同浓度的药物联合组CI值的均值为0.79, 表现出明显的协同效应(表2).
| 药物 | GIST-T1 IC50(μmol/L) | GIST-R IC50(μmol/L) | RI |
| IM | 0.75 | 34.65 | 46.14 |
| Peg-IFNα 2b | - | - | - |
| Peg-IFNα 2b+IM | 0.68 | 10.06 | 14.79 |
| Peg-IFNα 2b+IM (U/mL+μmol/L) | CI |
| 1×103+2.5 | 1.23 |
| 2×103+5.0 | 0.95 |
| 4×103+10.0 | 0.73 |
| 8×103+20.0 | 0.42 |
| 16×103+40.0 | 0.64 |
FCM法检测结果(图2)显示, 对照组GIST-R细胞的凋亡率为2.70%±0.62%, 伊马替尼和Peg-IFNα 2b对GIST-R细胞的凋亡率分别为9.5%±1.57%和5.66%±0.76%, 联合用药组GIST-R细胞的凋亡率为16.06%±3.24%. 联合用药组的细胞凋亡率高于单独用药组, 差异有统计学意义(P<0.05). 以上结果表明, Peg-IFNα 2b和伊马替尼具有明显促进GIST-R细胞凋亡的作用.
蛋白质印迹法检测结果(图3)显示, 与对照组比较, 伊马替尼处理组GIST-R细胞中p-mTOR蛋白表达水平均下调, 差异有统计学意义(P<0.05), Peg-IFNα 2b处理组GIST-R细胞中p-mTOR蛋白表达水平均明显上调, 差异有统计学意义(P<0.05); 联合处理组PC9/GR细胞中GIST-R蛋白表达水平显著下调低于伊马替尼单药组, 差异有统计学意义(P<0.05). 同时, 与对照组和Peg-IFNα 2b和伊马替尼单药组比较, Peg-IFNα 2b联合伊马替尼处理组GIST-R细胞中Bcl-2蛋白的表达水平明显下调, 差异均有统计学意义(P<0.01). 这一结果说明, Peg-IFNα 2b和伊马替尼联合用药可显著降低耐伊马替尼GIST-R细胞株p-mTOR蛋白以及Bcl-2蛋白的表达水平.
在伊马替尼耐药后的两项国际著名临床试验USS0033和EORTC62005研究中指出, 如果疾病进展, 400 mg/d剂量组的患者将被分配到800 mg/d高剂量组[5,6]. 但在临床实践中发现, 国人在伊马替尼800 mg/d治疗组的耐受性极差. 为了解决GIST对IM的耐药问题, 目前已陆续开发了多种治疗GIST的新型分子靶向药物, 如索拉替尼(sunitinib)[7]、达沙替尼(dasatinib)[8]、尼罗替尼(nilotinib)[9]和索拉非尼(sorafnib)[10]等, 由于突变的多样性和药物对不同突变敏感性不同, 新型分子靶向药物联合IM可能扩大靶向治疗的范围, 但对其临床的安全性和可行性的评估目前还处于早期的临床试验阶段.
随着免疫治疗的日益重视, 加强自身抗肿瘤免疫力帮助根除耐药的衍生型克隆和有自我更新能力的干细胞成为新的关注模式. IFNα可以通过促进DC的成熟、抗原的提呈、刺激Th1生成和聚集以及提高T淋巴细胞的克隆扩增、分化和存活率从而有效的结合固有自体免疫和适应性获得免疫. IFNα具有广泛的抗病毒、抗肿瘤、调节免疫作用, 能够有效的治疗B型和C型肝炎, 慢性粒细胞白血病、多毛细胞白血病、滤泡性淋巴瘤、肾细胞癌、黑色素瘤和Kaposis肉瘤[11]. Peg-IFNα 2b比IFNα 2b有更长的血浆半衰期和低毒性与抗耐受作用[12]. 用Gleevec 600 mg/d联合Peg-IFNα 2b治疗慢性髓性白血病慢性期的患者, 结果显示疗效是两者单独治疗效果的叠加[13]. Chen等[14]报道了6例Peg-IFNα 2b联合IM治疗Ⅲ/Ⅳ期GISTs的患者发现, 与经典的单独使用IM治疗GIST试验(B2222)相比, 联合治疗的临床有效期更长, 并且在因IM耐药引起的疾病进展期再次使用Peg-IFNα 2b, 逆转耐药, 诱发了第2次PR的现象. 更有报道称, IM可以作用于树突状细胞而产生NK细胞依赖性的抗癌效应[15]. NK细胞的IFNγ水平可以预示着用IM治疗GIST患者的生存时间[16]. 如果外周血里IFNγ的水平很高, 那么GIST的治疗会十分的有效[17].
本实验培养c-kit二次突变所致继发性耐药的GISTs患者的原代细胞和对伊马替尼敏感GIST-T1细胞株模拟临床胃肠间质瘤获得性耐药过程, 采用Peg-IFNα 2b和伊马替尼单独或联合干预. 实验结果显示, 伊马替尼对GIST-R细胞株高度耐药, 验证了GIST-R细胞株的耐药性; Peg-IFNα 2b单独用药对GIST-T1及GIST-R细胞株均无明显增殖抑制作用; 而Peg-IFNα 2b与伊马替尼联合用药对GIST-R抑制率明显高于伊马替尼单独用药, 耐药指数下降, 表现明显的协同增敏效应(CI = 0.79). 而且FCM检测结果表明, Peg-IFNα 2b与伊马替尼联合用药具有明显的促细胞凋亡的作用. 由此在细胞水平说明, Peg-IFNα 2b可以增强伊马替尼对耐药细胞株的抑制作用, 促进其凋亡.
GISTs继发性耐药主要与c-kit/PDGFRA二次突变有关, 而下游信号转导通路PI3K/Akt/mTOR是其主要激活途径[18]. 磷酸化mTOR在调控癌细胞的增殖、生存及凋亡中有中心调控点作用. 本研究结果显示, 与对照组比较, Peg-IFNα 2b处理组GIST-R细胞中p-mTOR蛋白表达水平均明显上调, 伊马替尼处理组GIST-R细胞中p-mTOR蛋白表达水平均下调. 同时, 联合处理组PC9/GR细胞中GIST-R蛋白表达水平显著下调低于伊马替尼单药组. Peg-IFNα 2b和伊马替尼影响的下游信号通路不尽相同, 我们推测Peg-IFNα 2b联合伊马替尼时, Peg-IFNα 2b通过激活下游信号通路, 诱导肿瘤细胞下游信号蛋白的过量表达, 信号转导增强, 使伊马替尼治疗的靶向性更强, 导致单独应用Peg-IFNα 2b时GIST-R细胞中p-mTOR的表达水平上调, 联合用药时GIST-R细胞中p-mTOR的表达水平下调. 这些均提示Peg-IFNα 2b可能通过影响PI3K/Akt/mTOR通路的活性, 增强细胞对伊马替尼的敏感性, 从而逆转耐药.
Bcl-2家族是与细胞凋亡相关的原癌基因, 其表达产物Bcl-2蛋白是一种抗凋亡蛋白, 具有抑制细胞凋亡的作用, 其表达下调能增强肿瘤细胞对凋亡的敏感性[19]. 本研究结果显示, Peg-IFNα 2b和伊马替均能不同程度地下调Bcl-2蛋白的表达水平, 且Peg-IFNα 2b联合伊马替尼能使GIST-R细胞中Bcl-2蛋白的表达水平明显下调. 这一结果提示, Peg-IFNα 2b联合伊马替尼联合用药增强GIST-R细胞的凋亡可能与下调Bcl-2蛋白的表达有关.
本研究结果表明, Peg-IFNα 2b和伊马替尼联合用药对GISTs伊马替尼继发性耐药细胞株具有较好的抑制作用, Peg-IFNα 2b对伊马替尼具有明显的协同增敏效应, 并逆转耐药, 而且这一效应可能与影响PI3K/Akt/mTOR通路的活性, 下调p-mTOR蛋白表达水平以及诱导细胞凋亡有关. Peg-IFNα 2b和伊马替尼联合用药可以考虑作为治疗GISTs伊马替尼耐药的药物选择, 为临床上GISTs患者的伊马替尼耐药治疗提供了一定的实验依据. 而其临床应用有待进一步大样本循证医学验证.
随着免疫治疗的日益重视, 加强自身抗肿瘤免疫力帮助根除耐药的衍生型克隆和有自我更新能力的干细胞成为新的关注模式, 聚乙二醇-干扰素α 2b(polyethylene glycol-interferon α 2b, Peg-IFNα 2b)具有广泛的抗病毒、抗肿瘤、调节免疫作用, 比IFNα-2b有更长的血浆半衰期和低毒性与抗耐受作用. 几乎所有初始治疗有效的胃肠道间质瘤患者都会在少于20 mo伊马替尼肿瘤后出现病情进展, 产生获得性耐药.
赵春玲, 副教授, 潍坊医学院细胞生物学教研室
此文重点研究免疫治疗联合靶向治疗, 是肿瘤耐药治疗的新模式.
Chen报道了6例Peg-IFNα 2b联合IM治疗Ⅲ/Ⅳ期GISTs的患者发现, 与经典的单独使用IM治疗GIST试验(B2222)相比, 联合治疗的临床有效期更长, 并且在因IM耐药引起的疾病进展期再次使用Peg-IFNα 2b, 逆转耐药, 诱发了第2次PR的现象.
免疫调教药物联合靶向药物治疗胃肠道间质瘤伊马替尼耐药, 是一种全新的关注模式.
本研究通过探讨Peg-IFNα 2b和伊马替尼联合用药对耐伊马替尼获得性耐药的胃肠间质瘤细胞株的抗肿瘤效应及其可能机制, 为胃肠间质瘤的临床治疗提供实验依据.
研究选题具有科学性、新颖性, 并具有一定的临床研究价值.
编辑: 郭鹏 电编:都珍珍
| 1. | Agaimy A, Wünsch PH, Hofstaedter F, Blaszyk H, Rümmele P, Gaumann A, Dietmaier W, Hartmann A. Minute gastric sclerosing stromal tumors (GIST tumorlets) are common in adults and frequently show c-KIT mutations. Am J Surg Pathol. 2007;31:113-120. [PubMed] [DOI] |
| 2. | Heinrich MC, Corless CL, Demetri GD, Blanke CD, von Mehren M, Joensuu H, McGreevey LS, Chen CJ, Van den Abbeele AD, Druker BJ. Kinase mutations and imatinib response in patients with metastatic gastrointestinal stromal tumor. J Clin Oncol. 2003;21:4342-4349. [PubMed] [DOI] |
| 3. | Antonescu CR, Besmer P, Guo T, Arkun K, Hom G, Koryotowski B, Leversha MA, Jeffrey PD, Desantis D, Singer S. Acquired resistance to imatinib in gastrointestinal stromal tumor occurs through secondary gene mutation. Clin Cancer Res. 2005;11:4182-4190. [PubMed] [DOI] |
| 4. | McLean SR, Gana-Weisz M, Hartzoulakis B, Frow R, Whelan J, Selwood D, Boshoff C. Imatinib binding and cKIT inhibition is abrogated by the cKIT kinase domain I missense mutation Val654Ala. Mol Cancer Ther. 2005;4:2008-2015. [PubMed] [DOI] |
| 5. | Blanke CD, Rankin C, Demetri GD, Ryan CW, von Mehren M, Benjamin RS, Raymond AK, Bramwell VH, Baker LH, Maki RG. Phase III randomized, intergroup trial assessing imatinib mesylate at two dose levels in patients with unresectable or metastatic gastrointestinal stromal tumors expressing the kit receptor tyrosine kinase: S0033. J Clin Oncol. 2008;26:626-632. [PubMed] [DOI] |
| 6. | Zalcberg JR, Verweij J, Casali PG, Le Cesne A, Reichardt P, Blay JY, Schlemmer M, Van Glabbeke M, Brown M, Judson IR. Outcome of patients with advanced gastro-intestinal stromal tumours crossing over to a daily imatinib dose of 800 mg after progression on 400 mg. Eur J Cancer. 2005;41:1751-1757. [PubMed] [DOI] |
| 7. | Potapova O, Laird AD, Nannini MA, Barone A, Li G, Moss KG, Cherrington JM, Mendel DB. Contribution of individual targets to the antitumor efficacy of the multitargeted receptor tyrosine kinase inhibitor SU11248. Mol Cancer Ther. 2006;5:1280-1289. [PubMed] [DOI] |
| 8. | Schittenhelm MM, Shiraga S, Schroeder A, Corbin AS, Griffith D, Lee FY, Bokemeyer C, Deininger MW, Druker BJ, Heinrich MC. Dasatinib (BMS-354825), a dual SRC/ABL kinase inhibitor, inhibits the kinase activity of wild-type, juxtamembrane, and activation loop mutant KIT isoforms associated with human malignancies. Cancer Res. 2006;66:473-481. [PubMed] [DOI] |
| 9. | Braconi C, Bracci R, Cellerino R. Molecular targets in Gastrointestinal Stromal Tumors (GIST) therapy. Curr Cancer Drug Targets. 2008;8:359-366. [PubMed] [DOI] |
| 10. | Wilhelm S, Chien DS. BAY 43-9006: preclinical data. Curr Pharm Des. 2002;8:2255-2257. [PubMed] [DOI] |
| 11. | Jonasch E, Haluska FG. Interferon in oncological practice: review of interferon biology, clinical applications, and toxicities. Oncologist. 2001;6:34-55. [PubMed] [DOI] |
| 12. | Bukowski RM, Tendler C, Cutler D, Rose E, Laughlin MM, Statkevich P. Treating cancer with PEG Intron: pharmacokinetic profile and dosing guidelines for an improved interferon-alpha-2b formulation. Cancer. 2002;95:389-396. [PubMed] |
| 13. | Nicolini FE, Hayette S, Legros L, Rousselot P, Maloisel F, Tulliez M, Guerci A, Charbonnier A, Prébet T, Rigal-Huguet F. Pegylated IFN-α2a combined to imatinib mesylate 600mg daily can induce complete cytogenetic and molecular responses in a subset of chronic phase CML patients refractory to IFN alone or to imatinib 600mg daily alone. Leuk Res. 2011;35:80-86. [PubMed] [DOI] |
| 14. | Chen LL, Chen X, Choi H, Sang H, Chen LC, Zhang H, Gouw L, Andtbacka RH, Chan BK, Rodesch CK. Exploiting antitumor immunity to overcome relapse and improve remission duration. Cancer Immunol Immunother. 2012;61:1113-1124. [PubMed] [DOI] |
| 15. | Borg C, Terme M, Taïeb J, Ménard C, Flament C, Robert C, Maruyama K, Wakasugi H, Angevin E, Thielemans K. Novel mode of action of c-kit tyrosine kinase inhibitors leading to NK cell-dependent antitumor effects. J Clin Invest. 2004;114:379-388. [PubMed] |
| 16. | Ménard C, Blay JY, Borg C, Michiels S, Ghiringhelli F, Robert C, Nonn C, Chaput N, Taïeb J, Delahaye NF. Natural killer cell IFN-gamma levels predict long-term survival with imatinib mesylate therapy in gastrointestinal stromal tumor-bearing patients. Cancer Res. 2009;69:3563-3569. [PubMed] [DOI] |
| 17. | Dunn GP, Koebel CM, Schreiber RD. Interferons, immunity and cancer immunoediting. Nat Rev Immunol. 2006;6:836-848. [PubMed] |
| 18. | Reichardt P. Novel approaches to imatinib- and sunitinib-resistant GIST. Curr Oncol Rep. 2008;10:344-349. [PubMed] |