修回日期: 2014-11-07
接受日期: 2014-11-18
在线出版日期: 2015-01-08
目的: 探讨泮托拉唑对二乙基亚硝胺(diethylnitrosamine, DEN)联合四氯化碳(carbon tetrachloride, CCl4)诱导C57BL/6J小鼠肝癌模型肝癌细胞增殖的影响.
方法: 将78只C57小鼠采用DEN联合CCl4共同诱导C57BL/6J小鼠肝癌, 第9周将制模小鼠随机分为模型组、泮托拉唑低剂量组(40 mg/kg)、高剂量组(80 mg/kg), 并开始腹腔注射泮托拉唑, 同时取12只正常小鼠为对照. 第25周处死小鼠, 取正常肝组织、肝癌组织和癌旁组织, 肉眼观察拍片, 并作HE染色光镜检查. 采用生化法检查小鼠血清谷丙转氨酶(alanine transaminase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)、尿素(urea)、肌酐(creatinine, Cr)水平; 采用Real-time PCR方法来检测正常肝、肝癌及癌旁组织甲胎蛋白(α-fetoprotein, AFP)、细胞增殖核抗原Ki67、增殖细胞核抗原(proliferating cell nuclear antigen, PCNA) mRNA的表达, 采用Western blot法检测Ki67、PCNA蛋白的表达.
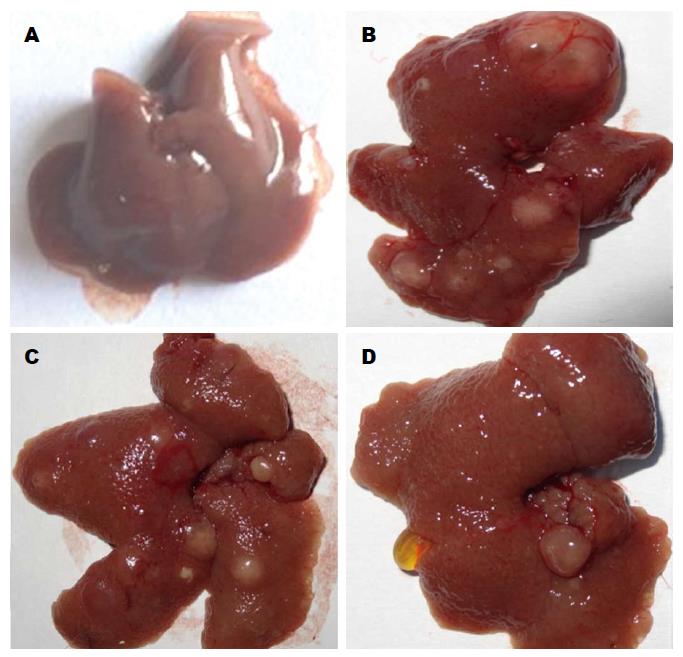
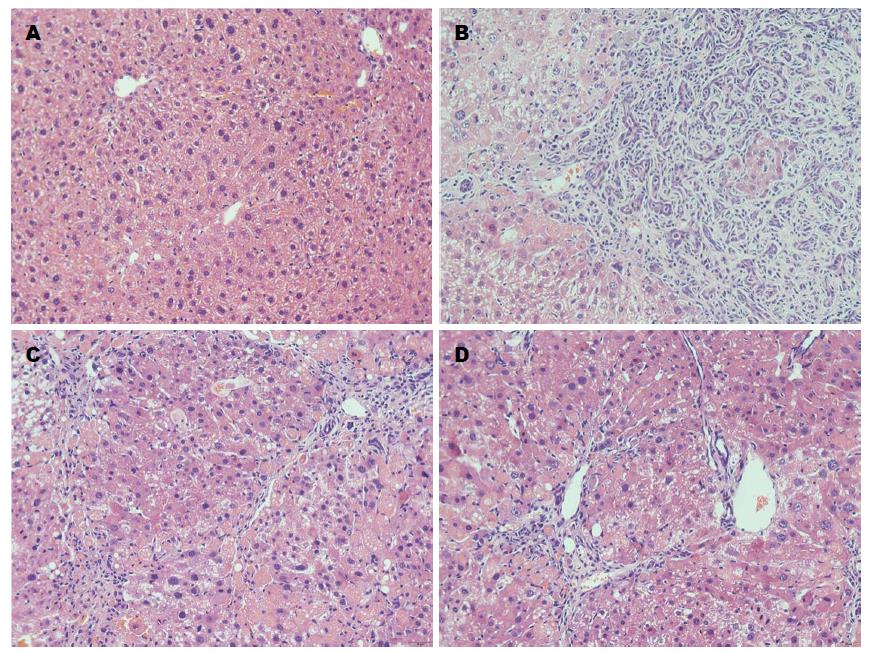
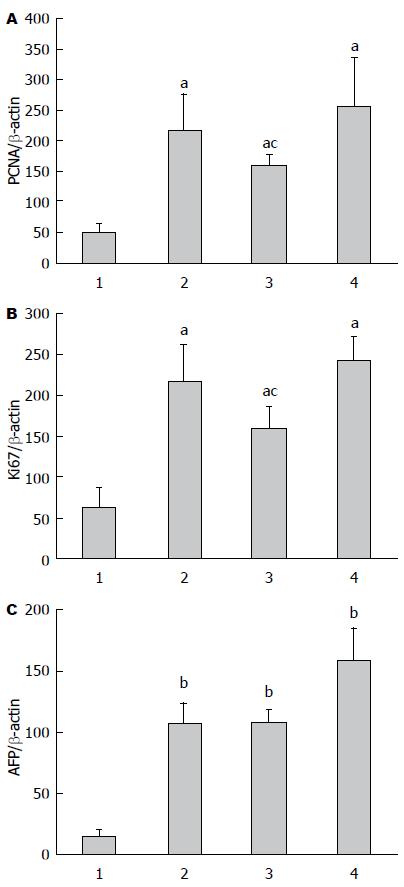
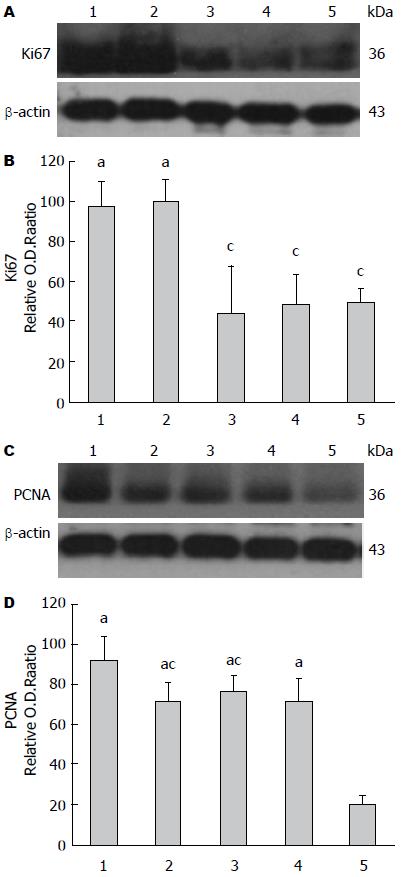
结果: 小鼠死亡率为21%, 成瘤率为100%. 肝脏组织巨检: 模型组与高低剂量组肝体积增大, 表面有大小不等的结节, 与模型组比较, 高、低剂量组结节个数明显减少. HE染色显示: 与模型组比较, 高、低剂量组异型增生明显减少. 血清生化检测显示: 模型组、高、低剂量组血清ALT、AST水平明显高于正常组(P<0.05), 高剂量组ALT、AST水平明显低于模型组(P<0.05). RT-PCR结果提示, 与正常组相比较, 模型组和高、低剂量组AFP、Ki67和PCNA mRNA表达明显增高(P<0.05, F = 7.94; P<0.05, F = 15.62; P<0.01, F = 45.58). 与模型组比较, 高剂量组Ki67和PCNA mRNA表达降低(P<0.05, F = 5.89; P<0.05, F = 10.34). Western blot结果显示, 与正常肝组织比较, 模型组和高剂量组的肝癌及癌旁组织Ki67和PCNA蛋白表达明显增高(P<0.05, F = 20.41; P<0.05, F = 20.31). 与模型组比较, 高剂量组肝癌及癌旁组织Ki67和PCNA蛋白表达明显减少(P<0.05, F = 16.47; P<0.05, F = 12.38).
结论: 泮托拉唑DEN联合CCl4诱导C57BL/6J小鼠肝癌模型肝细胞增殖有抑制作用.
核心提示: 通过二乙基亚硝胺(diethylnitro -samine)联合四氯化碳(carbon tetrachloride)诱导C57BL/6J小鼠肝癌模型, 采用RT-PCR和Western blot法来检测肝癌模型中肝癌及癌旁组织细胞增殖核抗原Ki67、增殖细胞核抗原(proliferating cell nuclear antigen) mRNA和蛋白的表达, 明确泮托拉唑对肝癌模型细胞增殖的影响.
引文著录: 黎元, 金海, 文国容, 庹必光. 泮托拉唑对二乙基亚硝胺联合四氯化碳诱导C57BL/6J小鼠肝癌模型肝细胞增殖的影响. 世界华人消化杂志 2015; 23(1): 22-29
Revised: November 7, 2014
Accepted: November 18, 2014
Published online: January 8, 2015
AIM: To investigate the effect of pantoprazole on the proliferation of cancer cells of mice with hepatoma induced by diethylnitrosamine (DEN) plus carbon tetrachloride.
METHODS: Seventy-eight C57 mice were treated with DEN and carbon tetrachloride (CCl4) for 9 wk and then randomly divided into three groups: a model group, low- (40 mg/kg) and high-dose (80 mg/kg) pantoprazole groups. Twelve normal C57 mice were used as controls. The two pantoprazole groups were administrated pantoprazole for 25 wk by intraperitoneal injection, and the mice were then sacrificed for collecting normal liver tissues, hepatoma tissues and hepatoma-adjacent tissues. All these tissues were prepared for pathological observation by HE staining. Blood levels of alanine transaminase (ALT), aspartate aminotransferase (AST), urea, and creatinine (Cr) were assayed. The mRNA levels of α-fetoprotein (AFP), Ki67, and proliferating cell nuclear antigen (PCNA) were quantified by real-time PCR, and the protein levels of Ki67 and PCNA were tested by Western blot.
RESULTS: Hepatoma was successfully induced in all mice treated with DEN and carbon tetrachloride, and 21% of the mice were dead. Gross examination of liver tissues showed that the livers in the model group were larger and had more heterogeneous nodules than those in the pantoprazole groups. Pathological analysis showed a lower incidence of dysplasia after administration of pantoprazole. Compared with normal controls, the levels of ALT and AST were increased in the model and pantoprazole groups, and these biological indexes in the pantoprazole groups were significantly lower than those in the model group (P < 0.05). The mRNA levels of AFP, Ki67 and PCNA in the model group and pantoprazole groups were significantly higher than those in normal controls (P < 0.05, F = 7.94; P < 0.05, F = 15.62; P < 0.01, F = 45.58), and pantoprazole decreased Ki67 and PCNA mRNA levels significantly compared with the model group (P < 0.05, F = 5.89, P < 0.05, F = 10.34). The expression of Ki67 and PCNA proteins was increased by treatment with DEN and carbon tetrachloride (P < 0.05, F = 20.41; P < 0.05, F = 20.31) but was decreased by pantoprazole treatment (P < 0.05, F = 16.47; P < 0.05, F = 12.38).
CONCLUSION: Pantoprazole can inhibit the growth of murine hepatoma by inhibiting cancer cell proliferation.
- Citation: Li Y, Jin H, Wen GR, Tuo BG. Pantoprazole inhibits cancer cell proliferation in mice with diethylnitrosamine and carbon tetrachloride-induced hepatoma. Shijie Huaren Xiaohua Zazhi 2015; 23(1): 22-29
- URL: https://www.wjgnet.com/1009-3079/full/v23/i1/22.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i1.22
肝细胞癌(hepatocellular carcinoma, HCC)是最常见的原发恶性肝癌, 全球每年发病人数在60万以上, 其死亡率占全部恶性肿瘤的18.8%, 是位居第三的最主要癌症死因[1-5]. 我国肝癌的死亡率在所有恶性肿瘤中居第2位, 每年死于肝癌的人数占全世界肝癌年死亡总数的53%, 仍居世界首位[6-8]. 泮托拉唑(pantoprazole)是第3代质子泵抑制剂(proton pump inhibitors, PPIs), 研究[9,10]发现PPIs对多种人恶性肿瘤细胞株具有化疗增敏作用, 并能选择性地诱导癌细胞凋亡, 对正常细胞则无明显影响. 但目前国内外尚未就PPIs对肝癌的作用进行深入研究. PPIs有望成为一种新型的肿瘤化学治疗的佐剂, 但目前的研究尚处于细胞和动物水平, 还缺乏大量的临床试验研究.
肝癌动物模型是进行肝癌实验研究的重要材料和手段. 在多种动物模型中, 二乙基亚硝胺(diethylnitrosamine, DEN)诱发大鼠肝癌前病变的阶段性类似人类病程[11]. 本文亦通过DEN联合四氯化碳(carbon tetrachloride, CCl4)诱导建立肝癌模型来检测正常组织、癌组织、癌旁组织中Ki67、增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)的表达, 进一步探讨泮托拉唑对DEN诱导C57小鼠肝癌模型细胞增殖的影响, 以期为肝癌治疗提供新的思路和策略.
DEN(Sigma公司)、CCl4(天津市协和吴鹏色谱科技有限公司)、橄榄油(阿拉丁试剂公司)、泮托拉唑(杭州中美华东制药有限公司)、TRIzol(TakaRa公司)、Ki67单克隆抗体(Abcam公司), PCNA多克隆抗体(Santa Cruz公司), 内参β-actin抗体(BBI公司)、TRIzol、引物、全蛋白提取试剂盒[生工生物工程(上海)股份有限公司], cDNA逆转录试剂盒及RNA扩增试剂盒(北京全式金生物技术有限公司)、实时荧光定量PCR仪(美国BIO-RAD公司)、全波段酶标仪(美国Thermo公司).
1.2.1 动物及分组: 90只健康♂C57BL/6J小鼠, 体质量18-22 g, 购自重庆第三军医大大坪医院实验动物中心. 动物许可证号: SCXK(渝)2012-0001. 饲养于光照-黑暗12 h交替(光照期6:00-18:00)的SPF程控环境, 自由饮水进食, 动物房室温维持在23 ℃左右. 适应性喂养1 wk后全部随机取12只为空白组、其余78只制模8 wk后随机分为模型组、泮托拉唑低(40 mg/kg)、高剂量组(80 mg/kg).
1.2.2 造模及取材: 模型制备参考文献[12]. 取80只制模小鼠一次性腹腔注射DEN(100 mg/kg), 3 wk后以CCl4和橄榄油(20:80)灌胃, 0.05 mL/10 g, 2次/wk; 第14周再次腹腔注射DEN 1次(50 mg/kg), 同时开始每天给予含有90 mL/L乙醇的饮用水, 第4周加大CCl4剂量至0.08 mL/10 g, 正常组仅自由饮用灭菌普通水, 直至实验结束. 同时, 第9周将制模小鼠随机分为模型组、泮托拉唑低(40 mg/kg)、高剂量组(80 mg/kg), 每组18只(小鼠死亡率约为18%), 并开始腹腔注射泮托拉唑. 第25周处死小鼠. 取各组小鼠血、正常肝、肝癌组织和癌旁组织备用.
1.2.3 肝组织巨检、HE染色及肝功能测定: 取小鼠血清检测谷丙转氨酶(alanine transaminase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)、尿素(urea)、肌酐(creatinine, Cr)水平, 分别对各组肝组织拍照观察, 然后用40 g/L甲醛固定组织, 切取2 mm×4 mm×6 mm组织块; 常规石蜡包埋, 6 μm切片; 同步烤片、脱蜡、梯度乙醇水化, HE染色.
1.2.4 Real-time PCR检测甲胎蛋白(α-feto-protein, AFP)、Ki67、PCNA mRNA的表达: 取50-100 mg的正常肝组织、癌旁组织、癌组织分别置于1 mL TRIzol中匀浆, 加入200 μL的氯仿, 震荡混匀, 12000 r/min, 4 ℃离心15 min. 吸取上清300 μL转入另外去酶EP管中, 加等量异丙醇混匀后, 12000 r/min, 4 ℃离心10 min, 弃去上清, 在沉淀加入无RNA酶的750 mL/L乙醇洗涤2次, 每次12000 r/min, 4 ℃离心2 min, 去上清液, 待其干燥后加入50 μL DEPC水溶解RNA, 用全波段酶标仪检测其纯度和浓度. 取200 ng RNA按试剂盒说明配成20 μL体系逆转录, 然后按照扩增试剂盒说明配制20 μL扩增体系, PCR应条件为: 第1步: 95 ℃×3 min, 第2步: 95 ℃×30 s, 60 ℃×1 min, 循环40次, 第3步: 65 ℃×30 s, 循环61次. 目的基因的相对表达量以"目的基因/内参基因"表示. 引物序列如表1.
| 基因 | 基因号 | 上游引物 | 下游引物 |
| AFP | NM_007423.4 | 5'-AGCAGGACTGCTCGAAACAT-3' | 5'-AGCGAAATGTAGCAGGAGA-3' |
| Ki67 | NM_001081117.2 | 5'-CCTTGCTGAGAACACCACAG-3' | 5'-TCTGCTTCCTGGCACTTGAT-3' |
| PCNA | NM_011045.2 | 5'-AGCCAGACCTCGTTCCTCTT-3' | 5'-AGCCTCCAGCACCTTCTTC-3' |
1.2.5 Western blot检测Ki67、PCNA的表达: 用组织蛋白质抽提试剂盒提取各组蛋白质, 用BCA蛋白浓度测定试剂盒测定蛋白浓度. 取40 g蛋白质样品加上样缓冲液煮沸变性后, 8%SDS-PAGE分离蛋白, 转移至硝酸纤维素膜, 用含5%脱脂奶粉的TBST封闭1 h, 分别加入Ki67单克隆抗体、PCNA多克隆抗体, 摇匀后, 4 ℃冰箱过夜; TBST洗膜3次, 每次10 min, 分别加入二抗室温下反应1 h, TBST洗膜3次, 每次10 min, 以化学发光法特异性检测膜上Ki67、PCNA的表达.
统计学处理 采用SPSS17.0软件进行分析, 实验结果用mean±SD表示, 组间比较采用单因素方差分析, P<0.05为差异有统计学意义.
肝脏组织巨检: 正常组小鼠肝脏色鲜红, 有光泽, 质软, 表面光滑细腻, 边缘锐利. 模型组与高、低剂量组肝体积增大, 表面有大小不等的结节, 切面灰白、实性质中, 中央可见坏死. 与模型组比较, 高低剂量组结节个数明显减少, 高剂量组尤为明显(图1).
HE染色显示: 正常组小鼠肝小叶结构完整, 界限清晰. 中央静脉清楚, 细胞大小均匀, 形态一致; 模型组与高、低剂量组正常组织结构消失, 细胞大小不等, 形态多样, 核大深染, 核分裂像多见, 并见病理性核分裂肝小叶结构破坏或消失, 中央静脉周围及汇管区纤维沉积增多, 纤维隔内有大量炎性细胞及成纤维细胞浸润. 与模型组比较, 高低剂量组异型增生减少, 高剂量组尤为显著(图2).
高、低剂量组和模型组分别与正常组比较, ALT、AST水平明显高于正常组, 两者差异均有统计学意义(P<0.05), 与模型组相比较, 高剂量组ALT、AST水平明显降低, 两者差异均有统计学意义(P<0.05). 各组尿素、Cr 水平差异无统计学意义(P>0.05)(表2).
结果提示AFP、Ki67、PCNA mRNA(图3)在正常组、模型组和高低剂量组肝组织中均有表达. 与正常组相比较, 高、低剂量和模型组AFP、Ki67、PCNA mRNA表达明显增高, 差异具有统计学意义(P<0.05, F = 7.94; P<0.05, F = 15.62; P<0.01, F = 45.58). 与模型组比较, 高剂量组Ki67、PCNA mRNA表达较低, 差异具有统计学意义(P<0.05, F = 5.89; P<0.05, F = 10.34).
Western blot结果显示在模型组、高剂量组肝癌和癌旁组织及正常肝组织均有Ki67、PCNA的表达, 如图示Ki67、PCNA及其内参在36、43 kDa处有条带表达(图4). 与正常肝组织比较, 高剂量和模型组的肝癌及癌旁组织表达明显增高, 差别具有统计学意义(P<0.05, F = 20.41; P<0.05, F = 20.31). 与模型组比较, 高剂量组肝癌及癌旁组织表达明显减少, 差别具有统计学意义(P<0.05, F = 16.47, P<0.05, F = 12.38). 各组癌组织与癌旁组织间无统计学意义(P>0.05).
诱发性肝癌模型中, DEN诱癌成功率较高, 对肝脏致癌有较好的专一性, 且大部分癌变为肝细胞癌, 所以本实验应用DEN联合CCl4对C57BL/6J小鼠进行肝癌诱发. 肝功能ALT和AST异常升高说明小鼠肝组织细胞在受到DEN刺激后, 发生了严重的肝脏损伤, 进而导致肝衰竭和肝脏合成功能下降. 肝脏组织巨检提示模型组表面有大小不等的结节, HE染色显示模型组异型增生表现, RT-PCR结果提示模型组AFP mRNA表达明显增高, 以上结果均提示模型组小鼠已被成功诱发肝癌, 模型成功率为100%.
已有研究表明, PPI可抑制肿瘤局部酸的分泌, 诱导多种肿瘤细胞的凋亡, 如胃癌[13]、胰腺癌[14]、结肠癌[15]、B细胞瘤[16]等, 但泮托拉唑对肝癌的作用尚不清楚. 近年来肿瘤细胞所处的酸性微环境可能参与了肿瘤细胞多药耐药性的产生, 并成为国外的研究热点. 空泡型质子泵(vacuolar H+-ATPases, V-ATPase)主要分布在肿瘤细胞的细胞膜和胞内酸性囊泡膜上, 且在肿瘤细胞中高度表达, 而正常组织细胞的胞膜上不表达V-ATPase, 只在其胞内酸性囊泡中少量表达[17-19], 其主要功能就是将肿瘤细胞胞浆中糖酵解代谢的H+泵出细胞外或泵入胞内的酸性囊泡, 维持胞浆内的弱碱性环境, 参与肿瘤的浸润和远处转移, 且与肿瘤化疗的多药耐药密切相关[20]. 质子泵抑制剂可通过抑制空泡型质子泵的表达, 逆转肿瘤细胞内外pH梯度, 促使肿瘤细胞内酸化, 改变肿瘤细胞微环境, 同时抑制缺氧诱导因子低氧诱导因子-1α (hypoxia inducible factor-1α, HIF-1α)、P-糖蛋白(P-glycoprotein, P-gp)及多药耐药相关蛋白1(multidrug resistanec-associated protein 1, MRP1)的表达, 促进肿瘤细胞的凋亡, 提高肿瘤细胞对化疗药物的敏感性, 逆转肿瘤多药耐药[21]. 肿瘤微环境形成的细胞内外pH值梯度可激活胞内PI3K/Akt信号通路, 为我们研究逆转肿瘤多药耐药提供了新思路[22,23]. 本实验室前期研究发现人肝癌细胞中Y-ATPase明显上调, 而且大量存在于癌细胞的细胞膜, 促进了癌细胞内H+排出, V-ATPase的抑制可延缓肝癌细胞的生长. 研究[24,25]表明, 鉴于V-ATPase在调节肿瘤微环境的酸度和持续清除毒性分子, 如H+和活性氧簇(reactive oxygen species, ROS)所起的关键性作用, V-ATPase可能是PPI抗肿瘤作用最重要的机制. 我们研究[26]还发现, 泮托拉唑能抑制肝癌HepG2细胞迁移和侵袭, 其机制可能与下调MMP9 mRNA的表达有关.
肿瘤细胞的增殖状态及增殖能力是评判肿瘤生物学行为的重要指标. 我们检测AFP、Ki67和PCNA在各组中的相对表达水平, 比较各组肝组织的增殖能力. 近期研究发现, AFP具有激活PI3K/AKT信号的功能, 通过该信号途径诱导癌基因Ras、Src等的表达, 促进肝癌细胞增殖[27,28]. 细胞增殖核抗原Ki67和PCNA均被视为评估肿瘤细胞增殖活性的重要标志物, 其表达随细胞周期的变化而变化, 在肿瘤的诊治与预后监测等方面均显示出重要的临床价值[29,30]. Ki67是目前应用最广泛的增殖细胞标志之一, 用于检测与增殖相关的核抗原的出现, 进而辨认处于细胞循环G1、S、G2、M期细胞. 其表达量的高低对评价细胞的增殖状态, 研究肿瘤的生物学行为、判断其危害性具有重要意义. 有研究[31-33]认为Ki-67在HCC中的表达情况还与预后有关, 表达越高, 预后越差. PCNA又称周期抗原, 是评价细胞增殖状态的常用指标. 其表达在细胞增殖周期G1后期开始升高, G1/S期时达高峰, S期持续高水平, 能与DNA多聚酶辅助蛋白结合, 参与细胞DNA的复制[34,35]. 本实验中用Real-time PCR(图3)分别检测各组AFP、Ki67和PCNA mRNA相对表达水平, Western blot(图4)分别检测Ki67和PCNA蛋白相对表达量, 结果显示, 与正常组相比较, 其余组表达明显上调(P<0.05). 与模型组比较, 高剂量组表达显著下调(P<0.05). 以上共同表明了高剂量的泮托拉唑可以显著抑制肝癌细胞的增殖.
总之, 泮托拉唑能够下调肝癌组织的AFP、Ki67、PCNA的表达, 且高剂量干预后表达下调更显著. 同时泮托拉唑可以降低肝癌细胞增殖速率, 抑制肿瘤生长. 故泮托拉唑有望成为一种新型的肝癌化学治疗的佐剂, 但目前的研究尚处于细胞和动物水平, 还缺乏大量的临床试验研究. 相信泮托拉唑对肝癌细胞增殖影响的进一步研究, 能有助于我们对肝癌更深层的认识, 为肝癌的治疗提供更多手段.
肝细胞癌(hepato cellular carcinoma, HCC)是最常见的原发恶性肝癌, 是全球位居第三的最主要癌症死因. 诱发性肝癌模型中, 二乙基亚硝胺(diethylnitrosa mine, DEN)诱癌成功率较高, 对肝脏致癌有较好的专一性, 且大部分癌变为肝细胞癌, 所以本实验应用DEN联合四氯化碳(carbon tetrachloride)对C57BL/6J小鼠进行肝癌诱发.
秦建民, 主任医师, 上海中医药大学附属普陀医院普外科
泮托拉唑(pantoprazole)是3代质子泵抑制剂(proton pump in hibitors, PPIs), 研究发现PPIs对多种人恶性肿瘤细胞株具有化疗增敏作用, 并能选择性地诱导癌细胞凋亡, 对正常细胞则无明显影响. 但目前国内外尚未就PPIs对肝癌的作用进行深入研究. 质子泵抑制剂有望成为一种新型的肿瘤化学治疗的佐剂.
本实验室前期研究发现人肝癌细胞中空泡型质子泵(vacuolar H+-ATPases, V-ATPase)明显上调, 而且大量存在于癌细胞的细胞膜, 促进了癌细胞内H+排出, V-ATPase的抑制可延缓肝癌细胞的生长. 我们研究还发现, 泮托拉唑能抑制肝癌HepG2细胞迁移和侵袭, 其机制可能与下调MMP9 mRNA的表达有关.
本文采用Real-time PCR和Western blot法来检测肝癌模型中各组肝癌及癌旁组织Ki67、PCNA mRNA和蛋白的表达, 进一步说明泮托拉唑对肝癌模型细胞增殖的影响.
泮托拉唑能够下调肝癌组织的AFP、Ki67、PCNA的表达, 且高剂量干预后表达下调更显著. 故泮托拉唑有望成为一种新型的肝癌化学治疗的佐剂. 他对肝癌细胞增殖影响的进一步研究, 能有助于我们对肝癌更深层的认识, 为肝癌的治疗提供更多手段.
V-ATPase: 位于小泡的膜上(动物细胞溶酶体膜、动物细胞的内吞体、高尔基体的囊泡膜、植物液泡膜), 水解ATP产生能量, 转运H+但不发生自磷酸化, 保持细胞质基质内中性pH和细胞器内的酸性pH.
本文探讨PPI泮托拉唑在肝癌发生过程中对细胞增殖的影响, 为肝细胞癌的治疗提供新的思路, 具有一定的应用研究价值.
编辑: 郭鹏 电编:都珍珍
| 1. | Martí-Bonmatí L, Sanz-Requena R, de Gracia BP, Carot-Sierra JM. Magnetic resonance pharmacokinetic imaging clusterization of hepatocellular carcinomas as a means to grade tumor aggressiveness. Expert Rev Gastroenterol Hepatol. 2012;6:711-716. [PubMed] [DOI] |
| 2. | 董 志珍, 姚 登福, 吴 玮, 邱 历伟, 姚 宁华, 严 晓娣, 蔚 丹丹, 陈 洁. 肝癌胰岛素样生长因子-Ⅱ表观遗传改变与其基因转录、表达的相关性分析. 中华肝脏病杂志. 2012;20:593-597. |
| 3. | Xiong JJ, Altaf K, Javed MA, Huang W, Mukherjee R, Mai G, Sutton R, Liu XB, Hu WM. Meta-analysis of laparoscopic vs open liver resection for hepatocellular carcinoma. World J Gastroenterol. 2012;18:6657-6668. [PubMed] [DOI] |
| 4. | Yoon AJ, Kuo WH, Lin CW, Yang SF. Role of ERCC5 polymorphism in risk of hepatocellular carcinoma. Oncol Lett. 2011;2:911-914. [PubMed] |
| 5. | Cotoi CG, Khorsandi SE, Pleşea IE, Quaglia A. Histological aspects of post-TACE hepatocellular carcinoma. Rom J Morphol Embryol. 2012;53:677-682. [PubMed] |
| 6. | Chen JG, Zhang SW. Liver cancer epidemic in China: past, present and future. Semin Cancer Biol. 2011;21:59-69. [PubMed] [DOI] |
| 7. | Jang KY, Noh SJ, Lehwald N, Tao GZ, Bellovin DI, Park HS, Moon WS, Felsher DW, Sylvester KG. SIRT1 and c-Myc promote liver tumor cell survival and predict poor survival of human hepatocellular carcinomas. PLoS One. 2012;7:e45119. [PubMed] |
| 8. | 李 玉英, 贾 海燕, 郭 慧, 王 转花. rBTI蛋白对人肝癌HepG2细胞增殖、迁移及ROS产生的影响. 细胞与分子免疫学杂志. 2012;28:358-360. |
| 9. | Luciani F, Spada M, De Milito A, Molinari A, Rivoltini L, Montinaro A, Marra M, Lugini L, Logozzi M, Lozupone F. Effect of proton pump inhibitor pretreatment on resistance of solid tumors to cytotoxic drugs. J Natl Cancer Inst. 2004;96:1702-1713. [PubMed] |
| 10. | Yeo M, Kim DK, Kim YB, Oh TY, Lee JE, Cho SW, Kim HC, Hahm KB. Selective induction of apoptosis with proton pump inhibitor in gastric cancer cells. Clin Cancer Res. 2004;10:8687-8696. [PubMed] |
| 11. | Ogawa K. Molecular pathology of early stage chemically induced hepatocarcinogenesis. Pathol Int. 2009;59:605-622. [PubMed] [DOI] |
| 13. | Xu J, Xie R, Liu X, Wen G, Jin H, Yu Z, Jiang Y, Zhao Z, Yang Y, Ji B. Expression and functional role of vacuolar H(+)-ATPase in human hepatocellular carcinoma. Carcinogenesis. 2012;33:2432-2440. [PubMed] [DOI] |
| 14. | Yeo M, Kim DK, Park HJ, Cho SW, Cheong JY, Lee KJ. Retraction: Blockage of intracellular proton extrusion with proton pump inhibitor induces apoptosis in gastric cancer. Cancer Sci. 2008;99:185. [PubMed] |
| 15. | Udelnow A, Kreyes A, Ellinger S, Landfester K, Walther P, Klapperstueck T, Wohlrab J, Henne-Bruns D, Knippschild U, Würl P. Omeprazole inhibits proliferation and modulates autophagy in pancreatic cancer cells. PLoS One. 2011;6:e20143. [PubMed] [DOI] |
| 16. | Marino ML, Fais S, Djavaheri-Mergny M, Villa A, Meschini S, Lozupone F, Venturi G, Della Mina P, Pattingre S, Rivoltini L. Proton pump inhibition induces autophagy as a survival mechanism following oxidative stress in human melanoma cells. Cell Death Dis. 2010;1:e87. [PubMed] [DOI] |
| 17. | Sennoune SR, Luo D, Martínez-Zaguilán R. Plasmalemmal vacuolar-type H+-ATPase in cancer biology. Cell Biochem Biophys. 2004;40:185-206. [PubMed] |
| 18. | Sun-Wada GH, Wada Y. Vacuolar-type proton pump ATPases: roles of subunit isoforms in physiology and pathology. Histol Histopathol. 2010;25:1611-1620. [PubMed] |
| 19. | Toei M, Saum R, Forgac M. Regulation and isoform function of the V-ATPases. Biochemistry. 2010;49:4715-4723. [PubMed] [DOI] |
| 20. | You H, Jin J, Shu H, Yu B, De Milito A, Lozupone F, Deng Y, Tang N, Yao G, Fais S. Small interfering RNA targeting the subunit ATP6L of proton pump V-ATPase overcomes chemoresistance of breast cancer cells. Cancer Lett. 2009;280:110-119. [PubMed] [DOI] |
| 22. | Emerling BM, Akcakanat A. Targeting PI3K/mTOR signaling in cancer. Cancer Res. 2011;71:7351-7359. [PubMed] [DOI] |
| 23. | Zhou Q, Lui VW, Yeo W. Targeting the PI3K/Akt/mTOR pathway in hepatocellular carcinoma. Future Oncol. 2011;7:1149-1167. [PubMed] [DOI] |
| 24. | De Milito A, Iessi E, Logozzi M, Lozupone F, Spada M, Marino ML, Federici C, Perdicchio M, Matarrese P, Lugini L. Proton pump inhibitors induce apoptosis of human B-cell tumors through a caspase-independent mechanism involving reactive oxygen species. Cancer Res. 2007;67:5408-5417. [PubMed] |
| 25. | Fais S. Proton pump inhibitor-induced tumour cell death by inhibition of a detoxification mechanism. J Intern Med. 2010;267:515-525. [PubMed] [DOI] |
| 27. | Yang X, Zhang Y, Zhang L, Zhang L, Mao J. Silencing alpha-fetoprotein expression induces growth arrest and apoptosis in human hepatocellular cancer cell. Cancer Lett. 2008;271:281-293. [PubMed] [DOI] |
| 28. | Li M, Li H, Li C, Wang S, Jiang W, Liu Z, Zhou S, Liu X, McNutt MA, Li G. Alpha-fetoprotein: a new member of intracellular signal molecules in regulation of the PI3K/AKT signaling in human hepatoma cell lines. Int J Cancer. 2011;128:524-532. [PubMed] [DOI] |
| 29. | Masuda H, Masuda N, Kodama Y, Ogawa M, Karita M, Yamamura J, Tsukuda K, Doihara H, Miyoshi S, Mano M. Predictive factors for the effectiveness of neoadjuvant chemotherapy and prognosis in triple-negative breast cancer patients. Cancer Chemother Pharmacol. 2011;67:911-917. [PubMed] [DOI] |
| 30. | Zhao H, Ho PC, Lo YH, Espejo A, Bedford MT, Hung MC, Wang SC. Interaction of proliferation cell nuclear antigen (PCNA) with c-Abl in cell proliferation and response to DNA damages in breast cancer. PLoS One. 2012;7:e29416. [PubMed] [DOI] |
| 31. | Jakobsen JN, Sørensen JB. Clinical impact of ki-67 labeling index in non-small cell lung cancer. Lung Cancer. 2013;79:1-7. [PubMed] [DOI] |
| 32. | Buchynska LG, Nesina IP, Yurchenko NP, Bilyk OO, Grinkevych VN, Svintitsky VS. Expression of p53, p21WAF1/CIP1, p16INK4A and Ki-67 proteins in serous ovarian tumors. Exp Oncol. 2007;29:49-53. [PubMed] |
| 33. | Zheng Y, Wang L, Zhang JP, Yang JY, Zhao ZM, Zhang XY. Expression of p53, c-erbB-2 and Ki67 in intestinal metaplasia and gastric carcinoma. World J Gastroenterol. 2010;16:339-344. [PubMed] |
| 34. | Mailand N, Gibbs-Seymour I, Bekker-Jensen S. Regulation of PCNA-protein interactions for genome stability. Nat Rev Mol Cell Biol. 2013;14:269-282. [PubMed] [DOI] |
| 35. | Wang K, Shi Z, Zhang M, Cheng D. Structure of PCNA from Drosophila melanogaster. Acta Crystallogr Sect F Struct Biol Cryst Commun. 2013;69:387-392. [PubMed] [DOI] |