修回日期: 2014-10-11
接受日期: 2014-11-12
在线出版日期: 2015-01-08
目的: 探讨胰高血糖素样肽-1(glucagon-like peptide-1, GLP-1)对棕榈酸(palmitic acid, PA)诱导的肝L02细胞脂性凋亡的影响及可能机制.
方法: 不同浓度PA(0.125、0.250、0.500 mmol/L)分别干预肝L02细胞; 使用Cell Counting Kit-8(CCK-8)试剂盒检测其在12、24和48 h时的细胞增殖活性; 将肝L02细胞随机分为对照组(NC组)、PA干预组(PA组)、PA+SP 600125组(PASP组)及PA+GLP-1组(PAGLP组), 运用末端脱氧核苷酸转移酶介导的dUTP缺口末端标记测定法(TUNEL法)检测细胞凋亡; 免疫印迹(Western blot)法检测c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK)、c-Jun、p-JNK及p-c-Jun蛋白表达.
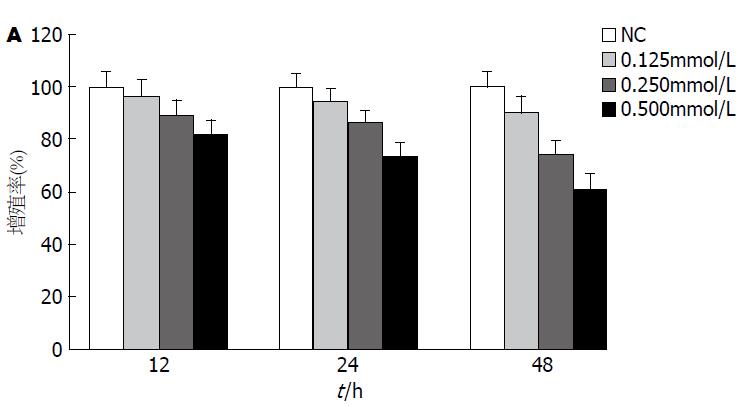
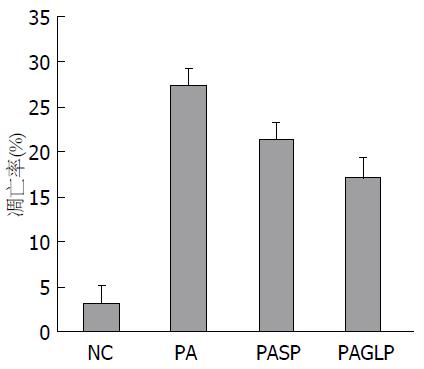
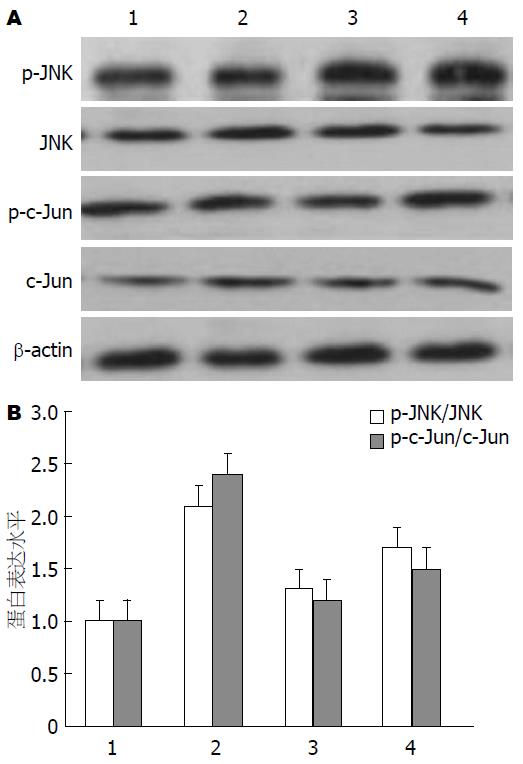
结果: 和对照组相比较, 经PA处理的肝L02细胞增殖活性降低(P<0.05), 而且呈剂量依懒性; 0.5 mmol/L PA干预24 h后, 肝L02细胞凋亡率增加28.4%±2.6%, Western blot结果显示: JNK、c-Jun磷酸化增多; 加用SP 600125或GLP-1后, 细胞凋亡率分别减少21.7%±2.9%和19.4%±2.7%, 差异具有统计学意义(P<0.05), PAGLP组p-JNK与p-c-Jun蛋白表达有所下降, 差异具有统计学意义(P<0.05).
结论: PA可诱导肝L02细胞脂性凋亡; 此过程可能和JNK通路相关; GLP-1可能是通过抑制JNK信号通路来抑制肝L02细胞的脂性凋亡.
核心提示: 我们发现, 棕榈酸(palmitic acid, PA)诱导L02细胞发生凋亡的过程中出现c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK)活化, 当应用JNK抑制剂SP 600125抑制JNK通路后, L02凋亡率下降, 用胰高血糖素样肽-1(glucagon-like peptide-1, GLP-1)可明显降低经PA诱导的肝L02细胞凋亡率, 抑制了p-JNK和下游底物p-c-Jun表达水平, 提示GLP-1可拮抗PA诱导的肝L02细胞的脂性凋亡, 其过程可能是通过JNK信号通路实现. 为非酒精性脂肪性肝炎(non-alcoholic steatohepatitis)防治药物的研制提供一定的实验基础.
引文著录: 王珣, 王明林, 鲁新耀, 张鹏, 于红刚, 胡义奎. GLP-1通过抑制肝L02细胞脂性凋亡的可能机制. 世界华人消化杂志 2015; 23(1): 16-21
Revised: October 11, 2014
Accepted: November 12, 2014
Published online: January 8, 2015
AIM: To investigate the potential effects of glucagon-like peptide-1 (GLP-1) on palmitic acid (PA) induced apoptosis of hepatic L02 cells and the underlying mechanism.
METHODS: L02 cells were stimulated with different levels (0.125, 0.250 and 0.500 mmol/L) of PA for different durations (12, 24 and 48 h) in the presence or absence of GLP-1. Cell Counting Kit-8 (CCK-8) assay was used to analyze the inhibitory effects on growth of L02 cells, and terminal-deoxynucleoitidyl transferase mediated nick end labeling (TUNEL) assay was used to observe the apoptotic rate of the cells. The expression of c-Jun N-terminal kinase (JNK), c-Jun, p-JNK and p-c-Jun proteins was detected by Western blot assay.
RESULTS: The growth of the L02 cells was significantly inhibited by PA in vitro, and PA induced the expression of p-JNK and p-c-Jun. GLP-1 suppressed the activation of JNK and c-Jun induced by PA.
CONCLUSION: PA can inhibit the proliferation of L02 cells and induce cell apoptosis. The JNK signaling pathway is probably involved in the mechanism of PA induced apoptosis.
- Citation: Wang X, Wang ML, Lu XY, Zhang P, Yu HG, Hu YK. Glucagon-like peptide-1 suppresses palmitic acid induced L02 cell apoptosis through JNK pathway. Shijie Huaren Xiaohua Zazhi 2015; 23(1): 16-21
- URL: https://www.wjgnet.com/1009-3079/full/v23/i1/16.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i1.16
游离脂肪酸(free fatty acid, FFA)是体内的脂质代谢物质, 研究显示: FFA是诱导非酒精性脂肪性肝炎(non-alcoholic steatohepatitis, NASH)的发生最主要外在因子[1,2], 机制可能是FFA诱导了肝细胞的脂性凋亡. 我们先前的研究显示c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK)通路参与此过程[3]. 目前临床上NASH的防治主要是针对发病机制进行的, 但尚无公认有效的治疗药物. 胰高血糖素样肽-1(glucagon-like peptide-1, GLP-1)为胰岛素促泌剂, 有增加胰岛素敏感性及减轻体质量等作用[4]. 本文意在探索GLP-1对FFA诱导的肝L02细胞脂性凋亡的影响及可能机制, 为新药研究奠定基础.
L02细胞系购自武汉大学细胞收藏中心. 培养细胞所用试剂、试剂盒购自北京中杉生物科技有限公司. 棕榈酸(palmitic acid, PA)、JNK抑制剂SP 600125及实验用GLP-1、Cell Counting Kit-8(CCK-8)试剂盒、Western blot试剂盒及TUNEL试剂盒均购自瑞士Roche公司. JNK及β肌动蛋白(β-actin)多克隆一抗以及单克隆二抗均购自美国Santa Cruz公司.
1.2.1 L02细胞培养: 用含20%的胎牛血清的DMEM(dulbecco's modified eagle medium)完全培养基稀释细胞悬液, 并留取少量的L02细胞进行纯度及活力鉴定. 以1×105-1×106 mL的密度接种到50 mL塑料培养瓶中, 在温度为37 ℃、体积分数为5%的CO2, 95%潮湿空气的CO2恒温培养箱中进行细胞培养. 培养瓶内L02细胞24 h后第一次换新鲜的DMEM培养液, 以后每隔3 d换液1次, 将培养液换为含10%胎牛血清的DMEM完全培养基, 经3-4 d的消化传代. 选择生长状态良好的L02细胞用于实验.
1.2.2 实验分组与处理: 分组: 将传代的L02细胞随机分为4组: 对照组(NC组)、PA干预组(PA组)、PA+SP 600125组(PASP组)及PA+GLP-1组(PAGLP组).
处理: NC组为空白对照; PA组(0.5 mmol/L的PA干预24 h); PASP组(25 μmol/L的SP 600125预孵育1 h, 再予0.5 mmol/L的PA+25 μmol/L的SP 600125干预24 h); PAGLP组(50 nmol/L的GLP-1预孵育24 h, 再予0.5 mmol/L的PA及50 nmol/L的GLP-1共孵育24 h).
1.2.3 CCK-8法检测L02细胞的增殖活性: 参照我们先前的研究方法[5]对L02细胞进行培养. NC组加入20 μL的完全培养基, 而非对照组加入20 μL不同浓度PA(浓度分别为0.125、0.250、0.500 mmol/L)干预12、24和48 h. 然后每组加入10 μL的CCK-8溶液, 继续孵育3 h.
1.2.4 TUNEL法检测L02细胞凋亡: 严格按照试剂盒操作说明对L02进行细胞凋亡的检测; 随机选取5个视野, 计数100个细胞核. 凋亡率(%) = 凋亡细胞数/细胞总数×100%.
1.2.5 Western blot半定量测定p-JNK、p-c-Jun蛋白水平: 方法参照文献[5]. 使用GEl-pro 4.0软件进行灰度值定量.
统计学处理 正态计量资料以mean±SD表示; 细胞增殖抑制率的比较采用重复测量数据的方差分析(ANOVA); 组间比较采用单因素方差分析(One-way ANOVA); 两两比较采用SNK-q法; P<0.05为差异有统计学意义.
假定NC组增殖活性100%. 与NC组比较, 随着PA干预浓度的升高及干预时间延长, 细胞增殖活性降低, 差异具有统计学意义(P<0.05)(图1).
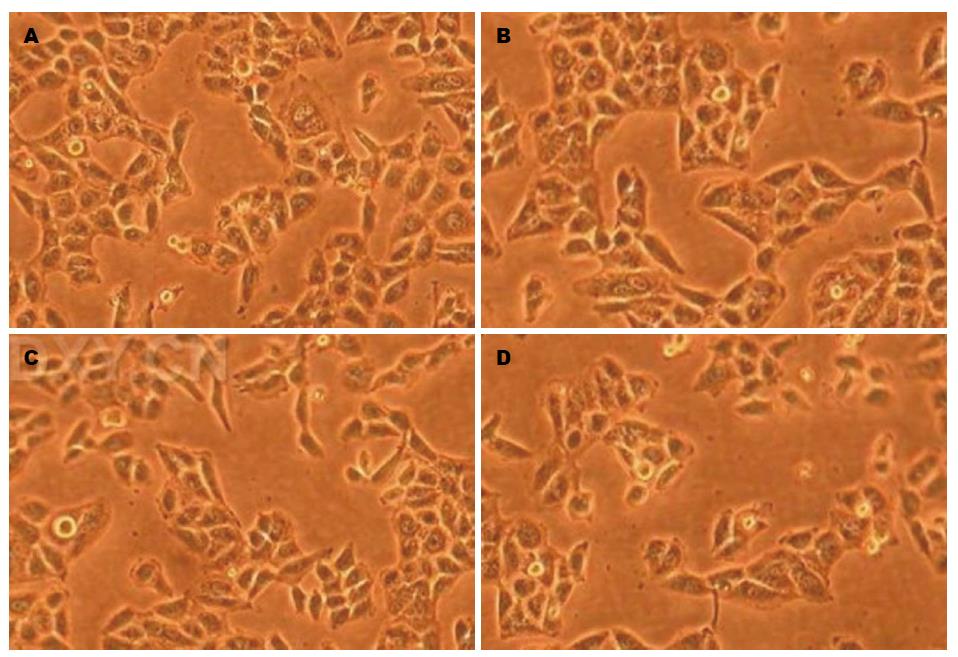
正常的L02细胞之间相互连接并见融合, 出现抱团. 然而经过PA干预24 h后, 可见细胞间连接减少, 并可见崩解现象. 当加入SP 600125或GLP-1后, 上述情况有所改善(图2).
棕色为凋亡细胞. PA组凋亡率为27.2%±2.1%, NC组为3.2%±0.4%, 差异有统计学意义(P<0.05). 加入SP 600125或GLP-1的干预组, L02细胞凋亡率分别为21.3%±2.6%及17.3%±2.8%, 较PA组减少, 差异有统计学意义(图3, 4).
各组JNK、c-Jun蛋白表达差异无统计学意义. 与对照组比较, PA干预后p-JNK与p-c-Jun表达均上升, 而应用SP 600125或GLP-1预处理后, 两蛋白表达下降, 差异有统计学意义(图5).
非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)是一组临床病理综合征, 包括NASH和单纯性脂肪肝(nonalcoholic fatty liver, NAFL)[6-10]. NASH可进一步发展为终末期肝病甚至肝恶性病变[11-13]. 然而目前临床上有效的防治NASH的药物较少, 针对发病机制的药物研制显得尤其重要, 然而NASH的发病机制尚不明确. NASH发生发展过程中肝细胞凋亡越来越受到研究者的关注, 逐渐成为目前NASH发病机制研究的热点[14]. 本实验采用不同浓度的PA成功诱导了肝L02细胞的凋亡, 表明高游离脂肪酸水平是促进肝L02细胞发生凋亡的重要机制之一.
JNK是位于细胞质内的丝氨酸/苏氨酸蛋白激酶. 研究发现, JNK参与某些神经退行性疾病(如帕金森病)、糖尿病、脂质代谢紊乱等疾病的发生[15-17]. 作用机制可能是JNK在一些外源性因子刺激作用下(如游离脂肪酸等), 通过使其第63、73位丝氨酸残基发生磷酸化而活化. 活化的JNK与c-Jun等蛋白的氨基末端区域结合, 使转录因子活性区域发生磷酸化, 从而对细胞凋亡、分化起到调控作用[18]. 我们发现, PA诱导L02细胞发生凋亡的过程中出现JNK活化, 当应用JNK抑制剂SP 600125抑制JNK通路后, L02凋亡率下降. 这一现象可能提示JNK通路参与了FFA诱导的肝细胞脂性凋亡, 和我们先前的研究[5]结论一致.
GLP-1是一种肠道分泌的、促胰岛素分泌激素, 其包含30个氨基酸. GLP-1及其类似物药物的应用使得2型糖尿病的治疗获得突破性进展. 他和其他降糖药物治疗糖尿病的本质区别在于不导致胰岛B细胞凋亡. NASH和糖尿病同属代谢综合征范畴, 他是代谢综合征的肝脏的一种表现形式. 目前临床有使用口服降糖药来治疗NASH[19], 作用机制多为降低胰岛素抵抗及调节脂质代谢, 但均无法解决NASH发展过程中肝细胞脂性凋亡这一难题.
本研究还发现加用GLP-1可明显降低经PA诱导的肝L02细胞凋亡率, 抑制了p-JNK和下游底物p-c-Jun表达水平, 提示GLP-1可拮抗PA诱导的肝L02细胞的脂性凋亡, 其过程可能是通过JNK信号通路实现. 为NASH防治药物的研制提供一定的实验基础.
目前临床上非酒精性脂肪性肝炎(non-alcoholic steatohepatitis, NASH)的防治主要是针对发病机制进行的, 但尚无公认有效的治疗药物. 胰高血糖素样肽-1(glucagon-like peptide-1, GLP-1)为胰岛素促泌剂, 增加胰岛素敏感性及减轻体质量等作用, 目前主要用于糖尿病等代谢性疾病; 而NASH和糖尿病同属代谢综合征, GLP-1是否对NASH有治疗作用值得研究, 而且该机制的阐明为该药运用于临床提供实验基础.
许戈良, 教授, 安徽省立医院
NASH可进一步发展为终末期肝病甚至肝恶性病变, 然而NASH的发病机制尚不明确. NASH发生发展过程中肝细胞凋亡越来越受到研究者的关注, 逐渐成为目前NASH发病机制研究的热点. 本实验采用不同浓度的棕榈酸(palmitic acid, PA)诱导肝L02细胞的凋亡, 探寻可能机制.
目前临床有使用口服降糖药来治疗NASH, 作用机制多为降低胰岛素抵抗及调节脂质代谢, 但均无法解决NASH发展过程中肝细胞脂性凋亡这一难题. 本研究发现GLP-1可明显降低经PA诱导的肝L02细胞凋亡率, 其过程可能是通过JNK信号通路实现.
本文的科学性、创新性及可读性能较好地反映我国胃肠病学临床和基础研究的先进水平.
编辑: 韦元涛 电编:都珍珍
| 1. | Nascimento AF, Ip BC, Luvizotto RA, Seitz HK, Wang XD. Aggravation of nonalcoholic steatohepatitis by moderate alcohol consumption is associated with decreased SIRT1 activity in rats. Hepatobiliary Surg Nutr. 2013;2:252-259. [PubMed] [DOI] |
| 2. | Attar BM, Van Thiel DH. Current concepts and management approaches in nonalcoholic fatty liver disease. ScientificWorldJournal. 2013;2013:481893. [PubMed] [DOI] |
| 3. | Wu D, Cederbaum AI. Inhibition of autophagy promotes CYP2E1-dependent toxicity in HepG2 cells via elevated oxidative stress, mitochondria dysfunction and activation of p38 and JNK MAPK. Redox Biol. 2013;1:552-565. [PubMed] [DOI] |
| 4. | Olaywi M, Bhatia T, Anand S, Singhal S. Novel anti-diabetic agents in non-alcoholic fatty liver disease: a mini-review. Hepatobiliary Pancreat Dis Int. 2013;12:584-588. [PubMed] [DOI] |
| 6. | Chang E, Park CY, Park SW. Role of thiazolidinediones, insulin sensitizers, in non-alcoholic fatty liver disease. J Diabetes Investig. 2013;4:517-524. [PubMed] [DOI] |
| 7. | Ozturk ZA, Kadayifci A. Insulin sensitizers for the treatment of non-alcoholic fatty liver disease. World J Hepatol. 2014;6:199-206. [PubMed] [DOI] |
| 8. | Takaki A, Kawai D, Yamamoto K. Molecular mechanisms and new treatment strategies for non-alcoholic steatohepatitis (NASH). Int J Mol Sci. 2014;15:7352-7379. [PubMed] [DOI] |
| 9. | Mishra S, Yadav D, Gupta M, Mishra H, Sharma P. A Study of Carotid Atherosclerosis in Patients with Non-alcoholic Fatty Liver Disease. Indian J Clin Biochem. 2013;28:79-83. [PubMed] [DOI] |
| 10. | Zarrinpar A, Loomba R. Review article: the emerging interplay among the gastrointestinal tract, bile acids and incretins in the pathogenesis of diabetes and non-alcoholic fatty liver disease. Aliment Pharmacol Ther. 2012;36:909-921. [PubMed] [DOI] |
| 11. | Xiang Z, Chen YP, Ma KF, Ye YF, Zheng L, Yang YD, Li YM, Jin X. The role of ursodeoxycholic acid in non-alcoholic steatohepatitis: a systematic review. BMC Gastroenterol. 2013;13:140. [PubMed] [DOI] |
| 12. | Walenbergh SM, Koek GH, Bieghs V, Shiri-Sverdlov R. Non-alcoholic steatohepatitis: the role of oxidized low-density lipoproteins. J Hepatol. 2013;58:801-810. [PubMed] [DOI] |
| 13. | Takahashi Y, Soejima Y, Fukusato T. Animal models of nonalcoholic fatty liver disease/nonalcoholic steatohepatitis. World J Gastroenterol. 2012;18:2300-2308. [PubMed] [DOI] |
| 14. | Mells JE, Anania FA. The role of gastrointestinal hormones in hepatic lipid metabolism. Semin Liver Dis. 2013;33:343-357. [PubMed] [DOI] |
| 15. | Inamdar AA, Chaudhuri A, O'Donnell J. The Protective Effect of Minocycline in a Paraquat-Induced Parkinson's Disease Model in Drosophila is Modified in Altered Genetic Backgrounds. Parkinsons Dis. 2012;2012:938528. [PubMed] [DOI] |
| 16. | Bogoyevitch MA, Ngoei KR, Zhao TT, Yeap YY, Ng DC. c-Jun N-terminal kinase (JNK) signaling: recent advances and challenges. Biochim Biophys Acta. 2010;1804:463-475. [PubMed] [DOI] |
| 17. | Yang C, Aye CC, Li X, Diaz Ramos A, Zorzano A, Mora S. Mitochondrial dysfunction in insulin resistance: differential contributions of chronic insulin and saturated fatty acid exposure in muscle cells. Biosci Rep. 2012;32:465-478. [PubMed] [DOI] |
| 18. | Huntwork-Rodriguez S, Wang B, Watkins T, Ghosh AS, Pozniak CD, Bustos D, Newton K, Kirkpatrick DS, Lewcock JW. JNK-mediated phosphorylation of DLK suppresses its ubiquitination to promote neuronal apoptosis. J Cell Biol. 2013;202:747-763. [PubMed] [DOI] |
| 19. | Poon MK, Chiu PY, Mak DH, Ko KM. Metformin protects against carbon tetrachloride hepatotoxicity in mice. J Pharmacol Sci. 2003;93:501-504. [PubMed] [DOI] |